化学人教版(2019)必修第二册8.1.2海水的开发利用(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.2海水的开发利用(共17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-29 09:19:08 | ||
图片预览



文档简介
(共17张PPT)
第八章 化学与可持续发展
第一节 自然资源的开发利用
第2课时 海水资源的开发利用
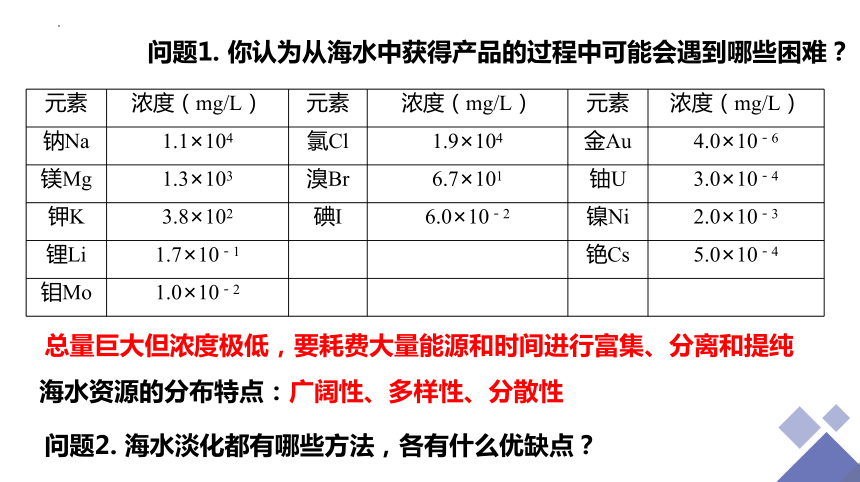
元素 浓度(mg/L) 元素 浓度(mg/L) 元素 浓度(mg/L)
钠Na 1.1×104 氯Cl 1.9×104 金Au 4.0×10-6
镁Mg 1.3×103 溴Br 6.7×101 铀U 3.0×10-4
钾K 3.8×102 碘I 6.0×10-2 镍Ni 2.0×10-3
锂Li 1.7×10-1 铯Cs 5.0×10-4
钼Mo 1.0×10-2
问题1. 你认为从海水中获得产品的过程中可能会遇到哪些困难?
总量巨大但浓度极低,要耗费大量能源和时间进行富集、分离和提纯
海水资源的分布特点:广阔性、多样性、分散性
问题2. 海水淡化都有哪些方法,各有什么优缺点?
二、海水资源的开发利用
海水资源
水资源
化学资源
矿产资源
生物资源
能源
空间资源
海水资源的特点:
分散性
广阔性
多样性
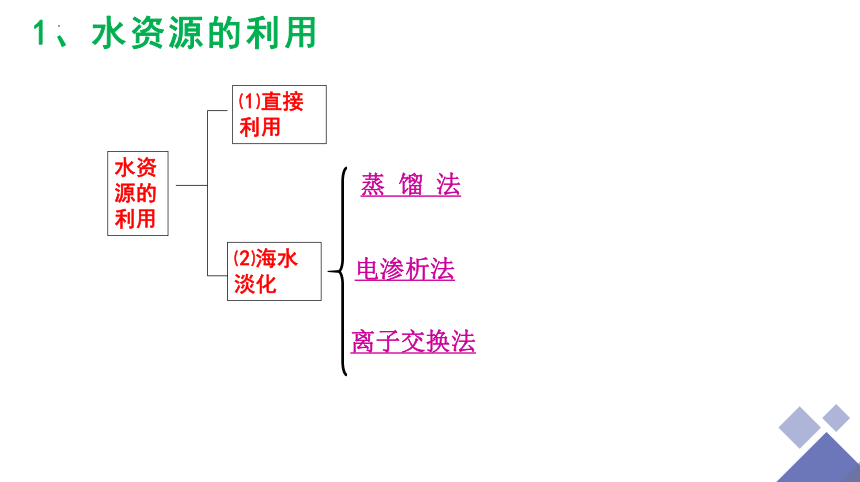
水资源的利用
⑴直接利用
⑵海水淡化
蒸 馏 法
电渗析法
离子交换法
1、水资源的利用
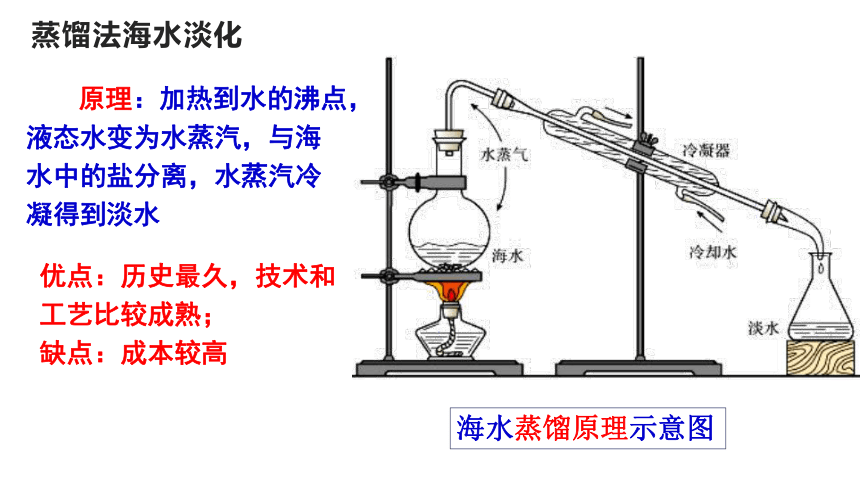
蒸馏法海水淡化
海水蒸馏原理示意图
原理:加热到水的沸点,液态水变为水蒸汽,与海水中的盐分离,水蒸汽冷凝得到淡水
优点:历史最久,技术和工艺比较成熟;
缺点:成本较高
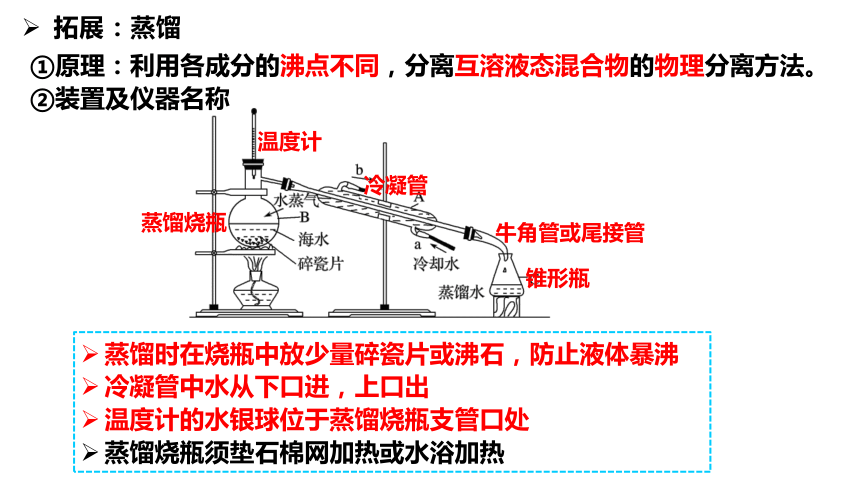
①原理:利用各成分的沸点不同,分离互溶液态混合物的物理分离方法。②装置及仪器名称
拓展:蒸馏
蒸馏烧瓶
温度计
冷凝管
牛角管或尾接管
锥形瓶
蒸馏时在烧瓶中放少量碎瓷片或沸石,防止液体暴沸
冷凝管中水从下口进,上口出
温度计的水银球位于蒸馏烧瓶支管口处
蒸馏烧瓶须垫石棉网加热或水浴加热
直形冷凝管瓶
球形冷凝管瓶
蛇形冷凝管瓶
冷凝管的种类
溴及其化合物在医药、农药、染料和阻燃剂等的生产中有广泛应用。
溴是海洋元素,地球上99%的溴元素分布在海洋中,以Br-的形式存在。海水中的溴元素含量约为67mg/L。
CF2ClBr
二氟一氯一溴甲烷
从海水中提取溴——吹出法
教材101
【思考与讨论1】该流程中是Br-如何转化成Br2?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
【思考与讨论2】用热空气吹出的物质是什么?利用该物质的什么性质呢?
溴,有挥发性
【思考与讨论3】根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
海水提溴
①海水提溴的方法(吹出法)
工艺流程 基本操作 浓缩
氧化
吹出
吸收
蒸馏
海水晒盐和海水淡化的过程中副产物Br-得到浓缩
向浓缩的海水中通入Cl2,将Br-氧化成Br2
2Br -+Cl2=Br2+2Cl-
利用溴的挥发性,通入热空气和水蒸气,吹出溴蒸气
吹出的溴蒸气用SO2吸收。SO2+Br2+2H2O=4H++SO42-+2Br-
再用Cl2将HBr氧化得到产品溴后蒸馏分离
从海水中获取氯化钠还可以用于哪些工业生产?你能写出相应的化学方程式吗?
思考交流:下图为从海水中提取镁的工业设备图,请结合你所掌握的知识画出海水提镁的工业流程图,并写出相应的化学反应方程式。
主要的化学反应原理
CaCO3 CaO+CO2↑
CaO+H2O==Ca(OH)2
Ca(OH)2+MgCl2==Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl===MgCl2+2H2O
MgCl2(熔融) Mg+Cl2↑
思考交流:请结合视频讲解画出海带提碘的工业流程图,并写出相应的化学反应方程式。
(1)海带中提碘
①工艺流程:海带→浸泡→氧化→过滤→提纯→碘单质。
②主要的化学反应原理:2H++2I-+H2O2===I2+2H2O。
或Cl2+2I-=I2+2Cl-
稀硫酸的作用:
增强H2O2的氧化性;
抑制I2与水反应
拓展:萃取分液
①萃取:物质在两种互不相溶的溶剂中溶解度不同,将物质从一种溶剂转移到另一种溶剂中,从而实现分离的方法。
仪器:分液漏斗
萃取剂:苯、四氯化碳等(不能用酒精)
萃取剂的选择条件:
与原溶剂不互溶
与被萃取的物质不反应
被萃取的物质在萃取剂中的溶解度比原溶剂大
②分液:将两种互不相溶的液体分离的操作
注意:分液可单独进行,但萃取之后一般要进行分液。
建立方法模型
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
三、新能源的开发
(1)从海水中提取铀和重水,铀和重水是核能开发的重要原料。
(2)潮汐能、波浪能是待开发的新型能源。
(3)开发海洋药物。
第八章 化学与可持续发展
第一节 自然资源的开发利用
第2课时 海水资源的开发利用
元素 浓度(mg/L) 元素 浓度(mg/L) 元素 浓度(mg/L)
钠Na 1.1×104 氯Cl 1.9×104 金Au 4.0×10-6
镁Mg 1.3×103 溴Br 6.7×101 铀U 3.0×10-4
钾K 3.8×102 碘I 6.0×10-2 镍Ni 2.0×10-3
锂Li 1.7×10-1 铯Cs 5.0×10-4
钼Mo 1.0×10-2
问题1. 你认为从海水中获得产品的过程中可能会遇到哪些困难?
总量巨大但浓度极低,要耗费大量能源和时间进行富集、分离和提纯
海水资源的分布特点:广阔性、多样性、分散性
问题2. 海水淡化都有哪些方法,各有什么优缺点?
二、海水资源的开发利用
海水资源
水资源
化学资源
矿产资源
生物资源
能源
空间资源
海水资源的特点:
分散性
广阔性
多样性
水资源的利用
⑴直接利用
⑵海水淡化
蒸 馏 法
电渗析法
离子交换法
1、水资源的利用
蒸馏法海水淡化
海水蒸馏原理示意图
原理:加热到水的沸点,液态水变为水蒸汽,与海水中的盐分离,水蒸汽冷凝得到淡水
优点:历史最久,技术和工艺比较成熟;
缺点:成本较高
①原理:利用各成分的沸点不同,分离互溶液态混合物的物理分离方法。②装置及仪器名称
拓展:蒸馏
蒸馏烧瓶
温度计
冷凝管
牛角管或尾接管
锥形瓶
蒸馏时在烧瓶中放少量碎瓷片或沸石,防止液体暴沸
冷凝管中水从下口进,上口出
温度计的水银球位于蒸馏烧瓶支管口处
蒸馏烧瓶须垫石棉网加热或水浴加热
直形冷凝管瓶
球形冷凝管瓶
蛇形冷凝管瓶
冷凝管的种类
溴及其化合物在医药、农药、染料和阻燃剂等的生产中有广泛应用。
溴是海洋元素,地球上99%的溴元素分布在海洋中,以Br-的形式存在。海水中的溴元素含量约为67mg/L。
CF2ClBr
二氟一氯一溴甲烷
从海水中提取溴——吹出法
教材101
【思考与讨论1】该流程中是Br-如何转化成Br2?
溴元素由化合物变为单质,化合价升高,发生了氧化反应,所以用氧化剂把Br-氧化为Br2
【思考与讨论2】用热空气吹出的物质是什么?利用该物质的什么性质呢?
溴,有挥发性
【思考与讨论3】根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
海水提溴
①海水提溴的方法(吹出法)
工艺流程 基本操作 浓缩
氧化
吹出
吸收
蒸馏
海水晒盐和海水淡化的过程中副产物Br-得到浓缩
向浓缩的海水中通入Cl2,将Br-氧化成Br2
2Br -+Cl2=Br2+2Cl-
利用溴的挥发性,通入热空气和水蒸气,吹出溴蒸气
吹出的溴蒸气用SO2吸收。SO2+Br2+2H2O=4H++SO42-+2Br-
再用Cl2将HBr氧化得到产品溴后蒸馏分离
从海水中获取氯化钠还可以用于哪些工业生产?你能写出相应的化学方程式吗?
思考交流:下图为从海水中提取镁的工业设备图,请结合你所掌握的知识画出海水提镁的工业流程图,并写出相应的化学反应方程式。
主要的化学反应原理
CaCO3 CaO+CO2↑
CaO+H2O==Ca(OH)2
Ca(OH)2+MgCl2==Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl===MgCl2+2H2O
MgCl2(熔融) Mg+Cl2↑
思考交流:请结合视频讲解画出海带提碘的工业流程图,并写出相应的化学反应方程式。
(1)海带中提碘
①工艺流程:海带→浸泡→氧化→过滤→提纯→碘单质。
②主要的化学反应原理:2H++2I-+H2O2===I2+2H2O。
或Cl2+2I-=I2+2Cl-
稀硫酸的作用:
增强H2O2的氧化性;
抑制I2与水反应
拓展:萃取分液
①萃取:物质在两种互不相溶的溶剂中溶解度不同,将物质从一种溶剂转移到另一种溶剂中,从而实现分离的方法。
仪器:分液漏斗
萃取剂:苯、四氯化碳等(不能用酒精)
萃取剂的选择条件:
与原溶剂不互溶
与被萃取的物质不反应
被萃取的物质在萃取剂中的溶解度比原溶剂大
②分液:将两种互不相溶的液体分离的操作
注意:分液可单独进行,但萃取之后一般要进行分液。
建立方法模型
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
三、新能源的开发
(1)从海水中提取铀和重水,铀和重水是核能开发的重要原料。
(2)潮汐能、波浪能是待开发的新型能源。
(3)开发海洋药物。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
