重庆市巴蜀中学2023-2024学年高一下学期5月期中考试 化学(含答案)
文档属性
| 名称 | 重庆市巴蜀中学2023-2024学年高一下学期5月期中考试 化学(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 916.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-29 11:47:44 | ||
图片预览


文档简介
高2026届高一(下)半期考试
化学试卷
注意事项:
1.答题前,考生务必将自己的姓名、准考证号、班级、学校在答题卡上填写清楚.
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号.在试卷上作答无效.
3.考试结束后,请将答题卡交回,试卷自行保存.满分100分,考试用时75分钟.
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Fe-56 Co-59 Cu-64
一、单项选择题(共14个小题,每小题3分,共42分.每小题只有一个选项符合题目要求.)
1.化学与生活、科技、医药、传统文化密切相关.以下说法错误的是( )
A.含钠、钾、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色,发生的是物理变化
B.组成Ti-Ni形状记忆合金的两种金属都属于过渡金属元素
C.二氧化硫有毒,严禁将其添加到任何食品、饮料中
D.可用于制作抗胃酸药品“胃舒平”
2.关于下列物质的性质及用途说法错误的是( )
A.硫酸钡难溶于胃酸,在医疗上可被用作消化系统X射线检查的内服药剂.
B.单质硅具有半导体性能,被用于制造芯片、太阳能电池等.
C.溶于雨水均能形成酸雨,pH小于5.6.
D.超导陶瓷属于新型无机非金属材料,具有超导性.
3.下列化学用语表示不正确的是( )
A.联氨的分子模型为:
B.氯原子的结构示意图:
C.HClO的电子式:
D.溴化铵的电子式:
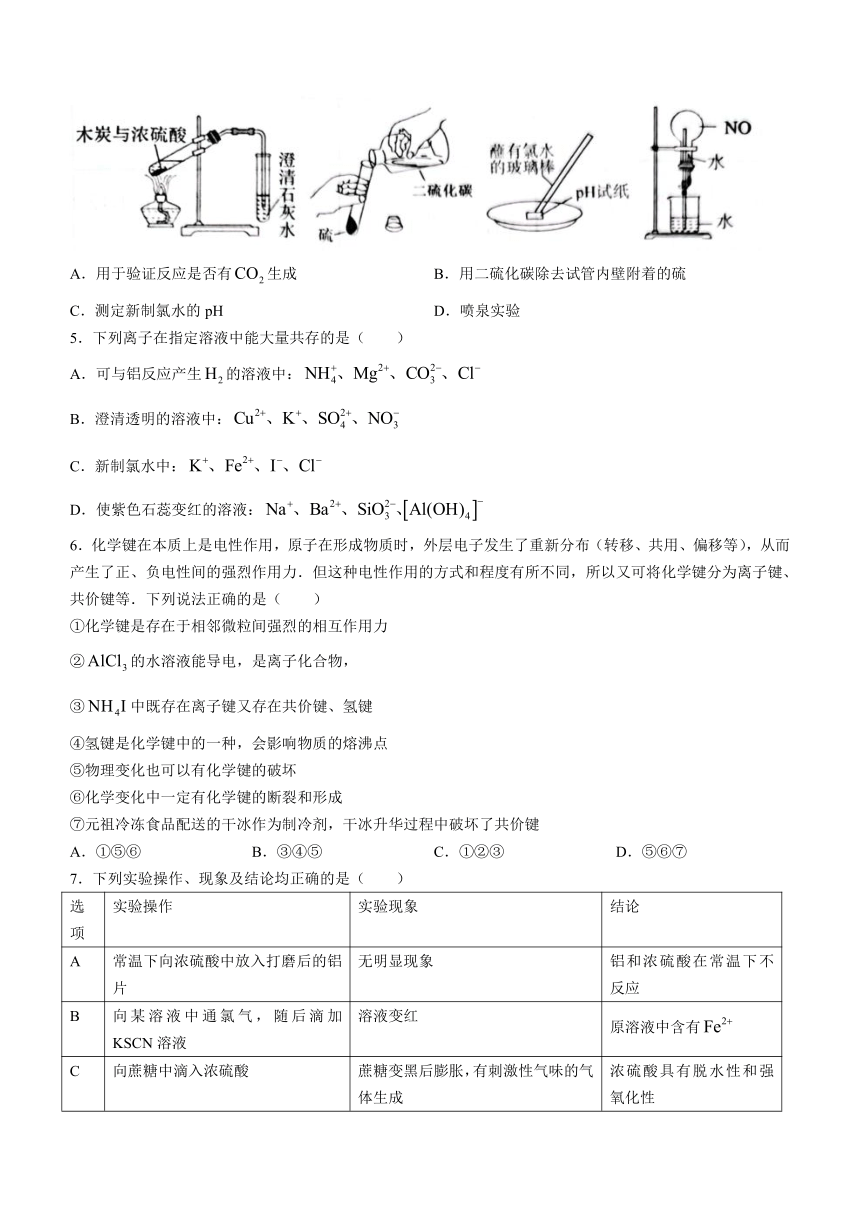
4.利用下列实验装置能达到实验目的的是( )
A.用于验证反应是否有生成 B.用二硫化碳除去试管内壁附着的硫
C.测定新制氯水的pH D.喷泉实验
5.下列离子在指定溶液中能大量共存的是( )
A.可与铝反应产生的溶液中:
B.澄清透明的溶液中:
C.新制氯水中:
D.使紫色石蕊变红的溶液:
6.化学键在本质上是电性作用,原子在形成物质时,外层电子发生了重新分布(转移、共用、偏移等),从而产生了正、负电性间的强烈作用力.但这种电性作用的方式和程度有所不同,所以又可将化学键分为离子键、共价键等.下列说法正确的是( )
①化学键是存在于相邻微粒间强烈的相互作用力
②的水溶液能导电,是离子化合物,
③中既存在离子键又存在共价键、氢键
④氢键是化学键中的一种,会影响物质的熔沸点
⑤物理变化也可以有化学键的破坏
⑥化学变化中一定有化学键的断裂和形成
⑦元祖冷冻食品配送的干冰作为制冷剂,干冰升华过程中破坏了共价键
A.①⑤⑥ B.③④⑤ C.①②③ D.⑤⑥⑦
7.下列实验操作、现象及结论均正确的是( )
选项 实验操作 实验现象 结论
A 常温下向浓硫酸中放入打磨后的铝片 无明显现象 铝和浓硫酸在常温下不反应
B 向某溶液中通氯气,随后滴加KSCN溶液 溶液变红 原溶液中含有
C 向蔗糖中滴入浓硫酸 蔗糖变黑后膨胀,有刺激性气味的气体生成 浓硫酸具有脱水性和强氧化性
D 向某溶液中滴加溶液 有白色沉淀产生 原溶液中含有
A.A B.B C.C D.D
8.金属铯是一种碱金属元素,由于其独特的金属性质已被人们广泛应用于材料制造、航空航天等领域.下列对铯及其化合物性质的推断正确的是( )
①铯的熔点比钾的高 ②碳酸铯的水溶液呈碱性
③铯在氧气中燃烧主要生成氧化铯 ④氢氧化铯的碱性比氢氧化钠强
⑤铯不能从硫酸铜溶液中置换出金属铜
A.①②③⑤ B.②③④⑤ C.①②③④ ⑤D.②④⑤
9.下列离子方程式书写正确的是( )
A.向氯化钙溶液中通入少量
B.向氯化铜溶液中通入
C.向次氯酸钠溶液中通入少量
D.稀硝酸中加入过量铁粉:
10.下列结论正确的是( )
①微粒半径: ②氢化物的稳定性:
③离子的还原性: ④还原性:
⑤酸性: ⑥非金属性:
A.①②③④ B.②③⑤⑥ C.①②④⑥ D.②③⑤⑥
11.使用下列装置及试剂,可以实现元素不同价态之间的转化的是( )
选项 转化 试剂a 试剂b 试剂c
A 浓硫酸 Cu 溶液
B 稀硫酸 FeS 溶液
C 浓盐酸 水
D 浓硝酸 Cu 水
A.A B.B C.C D.D
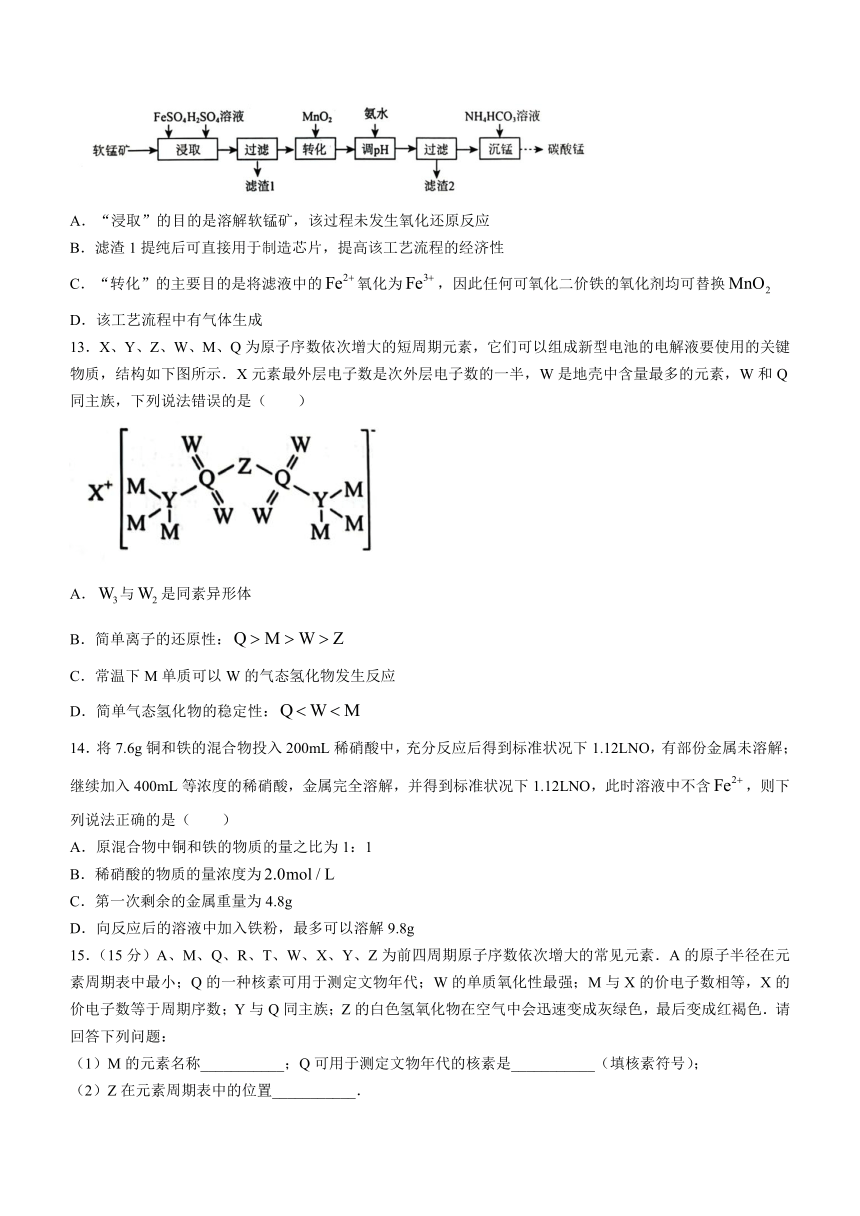
12.利用软锰矿(主要成分是,含有少量的等)制备碳酸锰的工艺流程如下.下列说法正确的是( )
A.“浸取”的目的是溶解软锰矿,该过程未发生氧化还原反应
B.滤渣1提纯后可直接用于制造芯片,提高该工艺流程的经济性
C.“转化”的主要目的是将滤液中的氧化为,因此任何可氧化二价铁的氧化剂均可替换
D.该工艺流程中有气体生成
13.X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,它们可以组成新型电池的电解液要使用的关键物质,结构如下图所示.X元素最外层电子数是次外层电子数的一半,W是地壳中含量最多的元素,W和Q同主族,下列说法错误的是( )
A.与是同素异形体
B.简单离子的还原性:
C.常温下M单质可以W的气态氢化物发生反应
D.简单气态氢化物的稳定性:
14.将7.6g铜和铁的混合物投入200mL稀硝酸中,充分反应后得到标准状况下1.12LNO,有部份金属未溶解;继续加入400mL等浓度的稀硝酸,金属完全溶解,并得到标准状况下1.12LNO,此时溶液中不含,则下列说法正确的是( )
A.原混合物中铜和铁的物质的量之比为1:1
B.稀硝酸的物质的量浓度为
C.第一次剩余的金属重量为4.8g
D.向反应后的溶液中加入铁粉,最多可以溶解9.8g
15.(15分)A、M、Q、R、T、W、X、Y、Z为前四周期原子序数依次增大的常见元素.A的原子半径在元素周期表中最小;Q的一种核素可用于测定文物年代;W的单质氧化性最强;M与X的价电子数相等,X的价电子数等于周期序数;Y与Q同主族;Z的白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色.请回答下列问题:
(1)M的元素名称___________;Q可用于测定文物年代的核素是___________(填核素符号);
(2)Z在元素周期表中的位置___________.
(3)T、W、X的简单离子半径从大到小的顺序为___________.(用离子符号表示)
(4)Y的氧化物与AW反应的化学方程式___________.
(5)工业上通过还原Y的氧化物制备Y单质的粗品,其化学方程式为:___________.
(6)离子化合物常用于合成有机物,其阴离子的电子式为___________.
(7)铝热法还原Z的红棕色氧化物制备Z单质的化学方程式为:___________.
(8)一定条件下,Z单质与一定量硝酸恰好完全反应,同时生成两种气体,且两种气体的量相同.向反应后的溶液中加入铜片,铜片不溶解.写出该反应的离子方程式:___________.
16.(14分)白合金是铜钴矿冶炼过程的中间产物,主要含和少量.一种从白合金中分离回收各类金属的具体流程及操作如图所示:
已知溶液中金属阳离子的氢氧化物沉淀完全的pH如表所示:
金属离子
完全沉淀时的pH 9.0 3.2 9.0
(1)中铁元素的化合价为___________.
(2)向溶液1中加入的作用是___________.
(3)焙烧1中发生反应的化学方程式为___________.
(4)固体3的成分为___________(填化学式).
(5)焙烧2中发生反应的化学方程式为___________.
(6)对18.3g沉钴所得的固体在空气中进行高温灼烧,最终可以得到一种钴的氧化物.灼烧过程中,固体质量随温度的变化曲线如图:
①B点对应物质为___________(填化学式).
②该过程中CD段发生反应的化学方程式为___________.
17.(14分)中学教材对Cu与的反应进行了讲解,但深入研究时用到了控制变量法(即有多个变量时,应该控制其他变量不变,只允许一个变量发生变化的研究方法),设计了如下的实验装置,并探讨了一些值得思考的问题.
Ⅰ.利用如图装置完成Cu与制取氮氧化物的反应.实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体.
(1)实验开始时应先打开弹簧夹,通入氮气,排尽整套装置内的空气,一段时间后关闭弹簧夹.该操作目的是___________.
(2)用化学方程式解释C中液面上方为红棕色气体的原理___________.
(3)将分液漏斗中液体换为稀硫酸和硝酸钠混合液也出现了溶解现象.此时烧瓶中发生反应的离子方程式为___________.
Ⅱ.深入研究时,有同学观察到了以下现象:实验1中蓝色溶液A遇铜片立即产生气泡;而相同条件下实验2中3mol/L硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生.实验操作如下:
实验1
实验2
分析蓝色溶液A的成分后,学习小组探究蓝色溶液A与铜片能够立即发生反应的原因.
实验验证:(1)将少量硫酸铜固体加入到硝酸中,溶液呈蓝色,放入铜片,无明显变化.该同学这样做是为了验证___________(填化学式)对该反应是否有催化作用.该同学这样做不能得出该物质不是催化剂的正确结论,还应该考虑___________和___________的影响.
(2)某同学又提出可能是对该反应有催化作用.为了得出该结论,应该补充的实验为___________(写实验操作及现象).
18.(15分)某同学完成了如下系列实验,探究元素周期表中元素性质的递变规律.
Ⅰ.(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:___________与硫酸反应速率最慢,___________与硫酸反应产生的气体最多.(填元素符号)
(2)向溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为___________.
Ⅱ.验证主族元素非金属性的变化规律设计了如图装置.
(3)某研究小组想用该装置一次性验证的非金属性的变化规律,则装置A、C中所装药品分别为___________、___________.该实验采用的理论依据为___________.
Ⅲ.完成下列问题.
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:___________.
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂.
(5)由工业流程图可以判断为___________(填“一”、“二”或“三”)元酸.
(6)不考虑产物的损失,标准状况下若有参加反应,则整个工业流程中共生成___________升气体.
高2026届高一(下)期中考试
化学参考答案
1.C 2.C 3.D 4.B 5.B 6.A 7.C 8.D 9.D 10.C 11.D 12.D 13.B 14.D
15.(1)硼 ( (2)第四周期VⅢ族
(3) (4)
(5)
(6)
(7)
(8)
16.(1)
(2)将二价铁氧化为三价铁
(3)
(4)
(5)
(6)① ②
17.Ⅰ:(1)排尽装置内的氧气,避免干扰实验.
(2)
(3)
Ⅱ:(1)或 离子浓度 阴离子种类(二者顺序可以交换)
(2)向中鼓入数分钟得溶液,相同条件下,铜片与溶液的反应速率:大于.
18.(1) (2)
(3) 最高价含氧酸酸性越强,该元素的非金属性越强
(4)
(5)一 (6)28
化学试卷
注意事项:
1.答题前,考生务必将自己的姓名、准考证号、班级、学校在答题卡上填写清楚.
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号.在试卷上作答无效.
3.考试结束后,请将答题卡交回,试卷自行保存.满分100分,考试用时75分钟.
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Fe-56 Co-59 Cu-64
一、单项选择题(共14个小题,每小题3分,共42分.每小题只有一个选项符合题目要求.)
1.化学与生活、科技、医药、传统文化密切相关.以下说法错误的是( )
A.含钠、钾、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色,发生的是物理变化
B.组成Ti-Ni形状记忆合金的两种金属都属于过渡金属元素
C.二氧化硫有毒,严禁将其添加到任何食品、饮料中
D.可用于制作抗胃酸药品“胃舒平”
2.关于下列物质的性质及用途说法错误的是( )
A.硫酸钡难溶于胃酸,在医疗上可被用作消化系统X射线检查的内服药剂.
B.单质硅具有半导体性能,被用于制造芯片、太阳能电池等.
C.溶于雨水均能形成酸雨,pH小于5.6.
D.超导陶瓷属于新型无机非金属材料,具有超导性.
3.下列化学用语表示不正确的是( )
A.联氨的分子模型为:
B.氯原子的结构示意图:
C.HClO的电子式:
D.溴化铵的电子式:
4.利用下列实验装置能达到实验目的的是( )
A.用于验证反应是否有生成 B.用二硫化碳除去试管内壁附着的硫
C.测定新制氯水的pH D.喷泉实验
5.下列离子在指定溶液中能大量共存的是( )
A.可与铝反应产生的溶液中:
B.澄清透明的溶液中:
C.新制氯水中:
D.使紫色石蕊变红的溶液:
6.化学键在本质上是电性作用,原子在形成物质时,外层电子发生了重新分布(转移、共用、偏移等),从而产生了正、负电性间的强烈作用力.但这种电性作用的方式和程度有所不同,所以又可将化学键分为离子键、共价键等.下列说法正确的是( )
①化学键是存在于相邻微粒间强烈的相互作用力
②的水溶液能导电,是离子化合物,
③中既存在离子键又存在共价键、氢键
④氢键是化学键中的一种,会影响物质的熔沸点
⑤物理变化也可以有化学键的破坏
⑥化学变化中一定有化学键的断裂和形成
⑦元祖冷冻食品配送的干冰作为制冷剂,干冰升华过程中破坏了共价键
A.①⑤⑥ B.③④⑤ C.①②③ D.⑤⑥⑦
7.下列实验操作、现象及结论均正确的是( )
选项 实验操作 实验现象 结论
A 常温下向浓硫酸中放入打磨后的铝片 无明显现象 铝和浓硫酸在常温下不反应
B 向某溶液中通氯气,随后滴加KSCN溶液 溶液变红 原溶液中含有
C 向蔗糖中滴入浓硫酸 蔗糖变黑后膨胀,有刺激性气味的气体生成 浓硫酸具有脱水性和强氧化性
D 向某溶液中滴加溶液 有白色沉淀产生 原溶液中含有
A.A B.B C.C D.D
8.金属铯是一种碱金属元素,由于其独特的金属性质已被人们广泛应用于材料制造、航空航天等领域.下列对铯及其化合物性质的推断正确的是( )
①铯的熔点比钾的高 ②碳酸铯的水溶液呈碱性
③铯在氧气中燃烧主要生成氧化铯 ④氢氧化铯的碱性比氢氧化钠强
⑤铯不能从硫酸铜溶液中置换出金属铜
A.①②③⑤ B.②③④⑤ C.①②③④ ⑤D.②④⑤
9.下列离子方程式书写正确的是( )
A.向氯化钙溶液中通入少量
B.向氯化铜溶液中通入
C.向次氯酸钠溶液中通入少量
D.稀硝酸中加入过量铁粉:
10.下列结论正确的是( )
①微粒半径: ②氢化物的稳定性:
③离子的还原性: ④还原性:
⑤酸性: ⑥非金属性:
A.①②③④ B.②③⑤⑥ C.①②④⑥ D.②③⑤⑥
11.使用下列装置及试剂,可以实现元素不同价态之间的转化的是( )
选项 转化 试剂a 试剂b 试剂c
A 浓硫酸 Cu 溶液
B 稀硫酸 FeS 溶液
C 浓盐酸 水
D 浓硝酸 Cu 水
A.A B.B C.C D.D
12.利用软锰矿(主要成分是,含有少量的等)制备碳酸锰的工艺流程如下.下列说法正确的是( )
A.“浸取”的目的是溶解软锰矿,该过程未发生氧化还原反应
B.滤渣1提纯后可直接用于制造芯片,提高该工艺流程的经济性
C.“转化”的主要目的是将滤液中的氧化为,因此任何可氧化二价铁的氧化剂均可替换
D.该工艺流程中有气体生成
13.X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,它们可以组成新型电池的电解液要使用的关键物质,结构如下图所示.X元素最外层电子数是次外层电子数的一半,W是地壳中含量最多的元素,W和Q同主族,下列说法错误的是( )
A.与是同素异形体
B.简单离子的还原性:
C.常温下M单质可以W的气态氢化物发生反应
D.简单气态氢化物的稳定性:
14.将7.6g铜和铁的混合物投入200mL稀硝酸中,充分反应后得到标准状况下1.12LNO,有部份金属未溶解;继续加入400mL等浓度的稀硝酸,金属完全溶解,并得到标准状况下1.12LNO,此时溶液中不含,则下列说法正确的是( )
A.原混合物中铜和铁的物质的量之比为1:1
B.稀硝酸的物质的量浓度为
C.第一次剩余的金属重量为4.8g
D.向反应后的溶液中加入铁粉,最多可以溶解9.8g
15.(15分)A、M、Q、R、T、W、X、Y、Z为前四周期原子序数依次增大的常见元素.A的原子半径在元素周期表中最小;Q的一种核素可用于测定文物年代;W的单质氧化性最强;M与X的价电子数相等,X的价电子数等于周期序数;Y与Q同主族;Z的白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色.请回答下列问题:
(1)M的元素名称___________;Q可用于测定文物年代的核素是___________(填核素符号);
(2)Z在元素周期表中的位置___________.
(3)T、W、X的简单离子半径从大到小的顺序为___________.(用离子符号表示)
(4)Y的氧化物与AW反应的化学方程式___________.
(5)工业上通过还原Y的氧化物制备Y单质的粗品,其化学方程式为:___________.
(6)离子化合物常用于合成有机物,其阴离子的电子式为___________.
(7)铝热法还原Z的红棕色氧化物制备Z单质的化学方程式为:___________.
(8)一定条件下,Z单质与一定量硝酸恰好完全反应,同时生成两种气体,且两种气体的量相同.向反应后的溶液中加入铜片,铜片不溶解.写出该反应的离子方程式:___________.
16.(14分)白合金是铜钴矿冶炼过程的中间产物,主要含和少量.一种从白合金中分离回收各类金属的具体流程及操作如图所示:
已知溶液中金属阳离子的氢氧化物沉淀完全的pH如表所示:
金属离子
完全沉淀时的pH 9.0 3.2 9.0
(1)中铁元素的化合价为___________.
(2)向溶液1中加入的作用是___________.
(3)焙烧1中发生反应的化学方程式为___________.
(4)固体3的成分为___________(填化学式).
(5)焙烧2中发生反应的化学方程式为___________.
(6)对18.3g沉钴所得的固体在空气中进行高温灼烧,最终可以得到一种钴的氧化物.灼烧过程中,固体质量随温度的变化曲线如图:
①B点对应物质为___________(填化学式).
②该过程中CD段发生反应的化学方程式为___________.
17.(14分)中学教材对Cu与的反应进行了讲解,但深入研究时用到了控制变量法(即有多个变量时,应该控制其他变量不变,只允许一个变量发生变化的研究方法),设计了如下的实验装置,并探讨了一些值得思考的问题.
Ⅰ.利用如图装置完成Cu与制取氮氧化物的反应.实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体.
(1)实验开始时应先打开弹簧夹,通入氮气,排尽整套装置内的空气,一段时间后关闭弹簧夹.该操作目的是___________.
(2)用化学方程式解释C中液面上方为红棕色气体的原理___________.
(3)将分液漏斗中液体换为稀硫酸和硝酸钠混合液也出现了溶解现象.此时烧瓶中发生反应的离子方程式为___________.
Ⅱ.深入研究时,有同学观察到了以下现象:实验1中蓝色溶液A遇铜片立即产生气泡;而相同条件下实验2中3mol/L硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生.实验操作如下:
实验1
实验2
分析蓝色溶液A的成分后,学习小组探究蓝色溶液A与铜片能够立即发生反应的原因.
实验验证:(1)将少量硫酸铜固体加入到硝酸中,溶液呈蓝色,放入铜片,无明显变化.该同学这样做是为了验证___________(填化学式)对该反应是否有催化作用.该同学这样做不能得出该物质不是催化剂的正确结论,还应该考虑___________和___________的影响.
(2)某同学又提出可能是对该反应有催化作用.为了得出该结论,应该补充的实验为___________(写实验操作及现象).
18.(15分)某同学完成了如下系列实验,探究元素周期表中元素性质的递变规律.
Ⅰ.(1)为验证金属与稀酸的反应速率,将Na、Lⅰ、Fe、Al各0.28mol分别投入到足量的2.2mol/L的硫酸中,实验结果为:___________与硫酸反应速率最慢,___________与硫酸反应产生的气体最多.(填元素符号)
(2)向溶液中通入适量氯气出现黄色浑浊,可证明Cl的非金属性比S强,但是氯气过量后会发现黄色浑浊减少甚至消失,在此溶液中检测到有两种强酸,黄色浑浊减少甚至消失反应的离子方程式为___________.
Ⅱ.验证主族元素非金属性的变化规律设计了如图装置.
(3)某研究小组想用该装置一次性验证的非金属性的变化规律,则装置A、C中所装药品分别为___________、___________.该实验采用的理论依据为___________.
Ⅲ.完成下列问题.
(4)铝用途广泛,可与强碱溶液反应,请书写铝与氢氧化钠溶液反应的化学方程式:___________.
Ⅳ.粮食安全问题很重要,储存环节要避免虫蛀.工业上可用以下方法制备粮食储备的强效熏虫剂.
(5)由工业流程图可以判断为___________(填“一”、“二”或“三”)元酸.
(6)不考虑产物的损失,标准状况下若有参加反应,则整个工业流程中共生成___________升气体.
高2026届高一(下)期中考试
化学参考答案
1.C 2.C 3.D 4.B 5.B 6.A 7.C 8.D 9.D 10.C 11.D 12.D 13.B 14.D
15.(1)硼 ( (2)第四周期VⅢ族
(3) (4)
(5)
(6)
(7)
(8)
16.(1)
(2)将二价铁氧化为三价铁
(3)
(4)
(5)
(6)① ②
17.Ⅰ:(1)排尽装置内的氧气,避免干扰实验.
(2)
(3)
Ⅱ:(1)或 离子浓度 阴离子种类(二者顺序可以交换)
(2)向中鼓入数分钟得溶液,相同条件下,铜片与溶液的反应速率:大于.
18.(1) (2)
(3) 最高价含氧酸酸性越强,该元素的非金属性越强
(4)
(5)一 (6)28
同课章节目录
