2024北京首都师大附中高三考前热身化学(PDF版,含答案)
文档属性
| 名称 | 2024北京首都师大附中高三考前热身化学(PDF版,含答案) |  | |
| 格式 | |||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-05-29 16:44:16 | ||
图片预览

文档简介
首都师大附中2023—2024学年第二学期考前练习
高三化学 2024.05.28
本试卷共 8 页,100 分。考试时长 90 分钟。考生务必将答案答在答题纸上,在试卷上作答无
效。考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:S 32
第一部分
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 北京 2022 年冬奥会中使用了大量新材料,下列属于无机非金属材料的是
A B C D
“飞扬”火炬中的聚 颁奖礼服中的石墨烯 可降解餐具中的聚乳
速滑冰刀中的钛合金
硅氮烷树脂 发热材料 酸材料
2. 下列图示或化学用语表示不.正.确.的是
A B C D
乙炔的空间结构模型 SO2的 VSEPR 模型 反-2-丁烯的结构简式 乙醇的核磁共振氢谱
3. 下列物质的性质不.能.用化学键解释的是
A.金属铜具有导电性 B.氮气化学性质稳定
C.金刚石硬度大 D.碘单质常温为固体
4. 下列说法不.正.确.的是 O H
A.疫苗等生物制剂需要在低温下保存 B.蛋白质、氨基酸中均含有 C N
C.在伤口处涂抹医用酒精可消毒、杀菌 D.蛋白质水解可以得到氨基酸
1
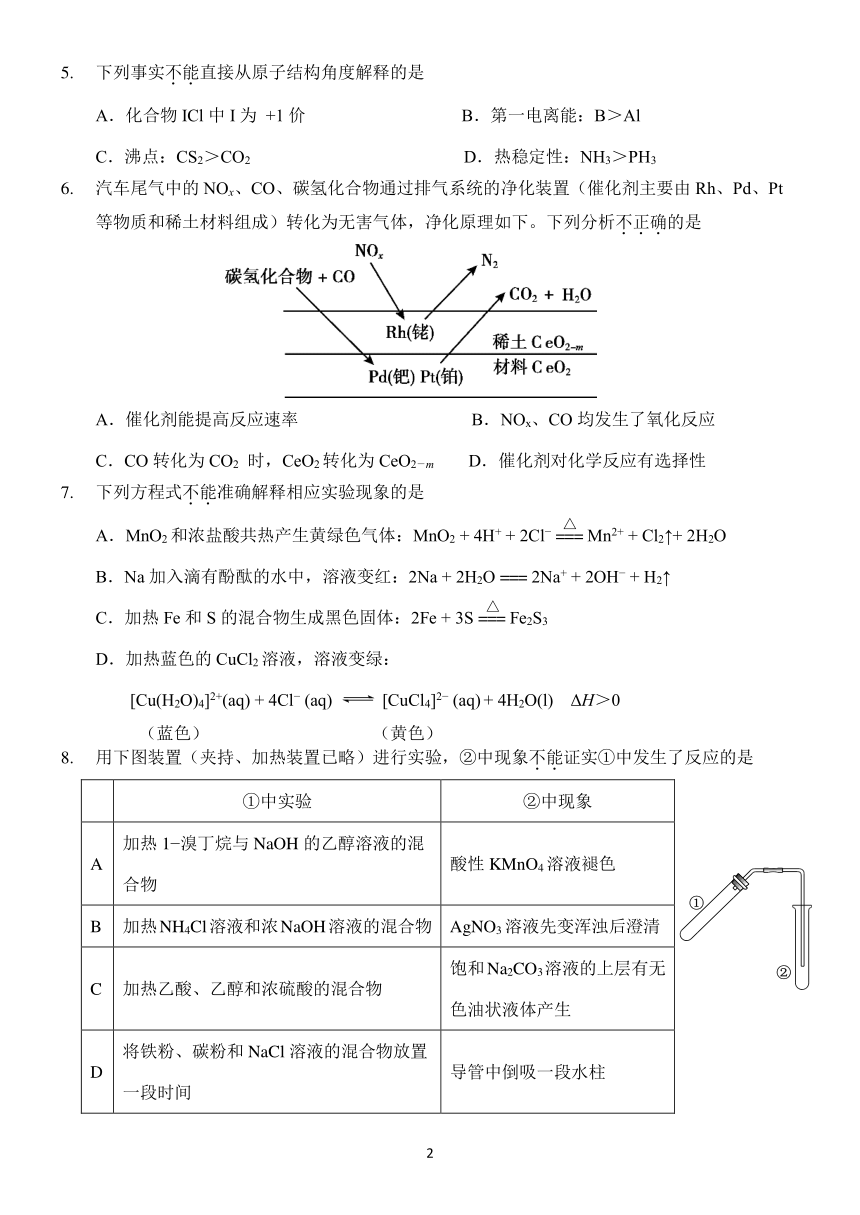
5. 下列事实不.能.直接从原子结构角度解释的是
A.化合物 ICl 中 I 为 +1 价 B.第一电离能:B>Al
C.沸点:CS2>CO2 D.热稳定性:NH3>PH3
6. 汽车尾气中的 NOx、CO、碳氢化合物通过排气系统的净化装置(催化剂主要由 Rh、Pd、Pt
等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析不.正.确.的是
A.催化剂能提高反应速率 B.NOx、CO 均发生了氧化反应
C.CO 转化为 CO2 时,CeO2转化为 CeO2-m D.催化剂对化学反应有选择性
7. 下列方程式不.能.准确解释相应实验现象的是
△
A.MnO2 和浓盐酸共热产生黄绿色气体:MnO2 + 4H+ + 2Cl === Mn2+ + Cl2↑+ 2H2O
B.Na 加入滴有酚酞的水中,溶液变红:2Na + 2H + 2O === 2Na + 2OH + H2↑
△
C.加热 Fe 和 S 的混合物生成黑色固体:2Fe + 3S === Fe2S3
D.加热蓝色的 CuCl2溶液,溶液变绿:
[Cu(H O) ]2+(aq) + 4Cl 2 4 (aq) [CuCl 2 4] (aq) + 4H2O(l) ΔH>0
(蓝色) (黄色)
8. 用下图装置(夹持、加热装置已略)进行实验,②中现象不.能.证实①中发生了反应的是
①中实验 ②中现象
加热 1 溴丁烷与 NaOH 的乙醇溶液的混
A 酸性 KMnO4溶液褪色
合物
B 加热NH4Cl溶液和浓NaOH溶液的混合物 AgNO3 溶液先变浑浊后澄清
饱和Na2CO3溶液的上层有无
C 加热乙酸、乙醇和浓硫酸的混合物
色油状液体产生
将铁粉、碳粉和 NaCl 溶液的混合物放置
D 导管中倒吸一段水柱
一段时间
2
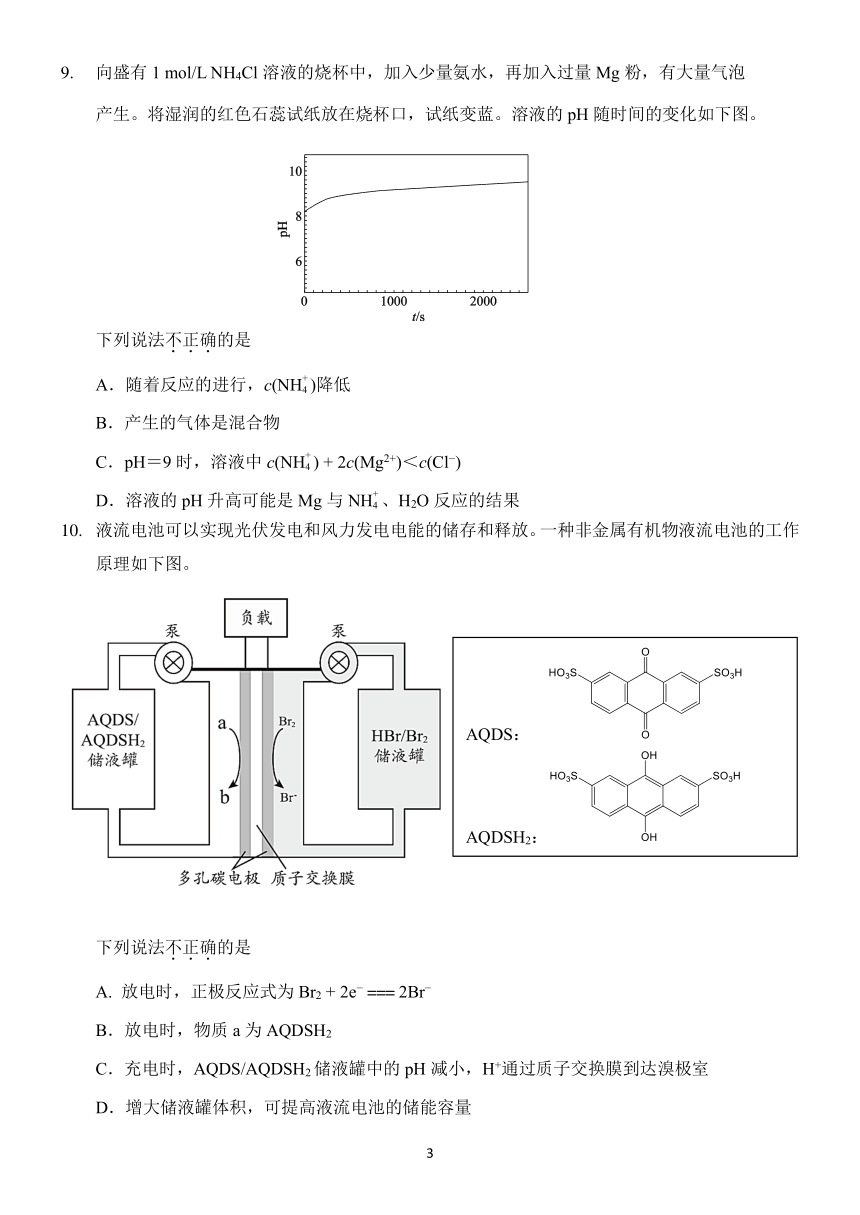
9. 向盛有 1 mol/L NH4Cl 溶液的烧杯中,加入少量氨水,再加入过量 Mg 粉,有大量气泡
产生。将湿润的红色石蕊试纸放在烧杯口,试纸变蓝。溶液的 pH 随时间的变化如下图。
下列说法不.正.确.的是
+
A.随着反应的进行,c(NH4 )降低
B.产生的气体是混合物
+
C.pH=9 时,溶液中 c(NH4 ) + 2c(Mg2+)<c(Cl )
+
D.溶液的 pH 升高可能是 Mg 与 NH4 、H2O 反应的结果
10. 液流电池可以实现光伏发电和风力发电电能的储存和释放。一种非金属有机物液流电池的工作
原理如下图。
AQDS:
AQDSH2:
下列说法不.正.确.的是
A. 放电时,正极反应式为 Br + 2e 2 === 2Br
B.放电时,物质 a 为 AQDSH2
C.充电时,AQDS/AQDSH2储液罐中的 pH 减小,H+通过质子交换膜到达溴极室
D.增大储液罐体积,可提高液流电池的储能容量
3
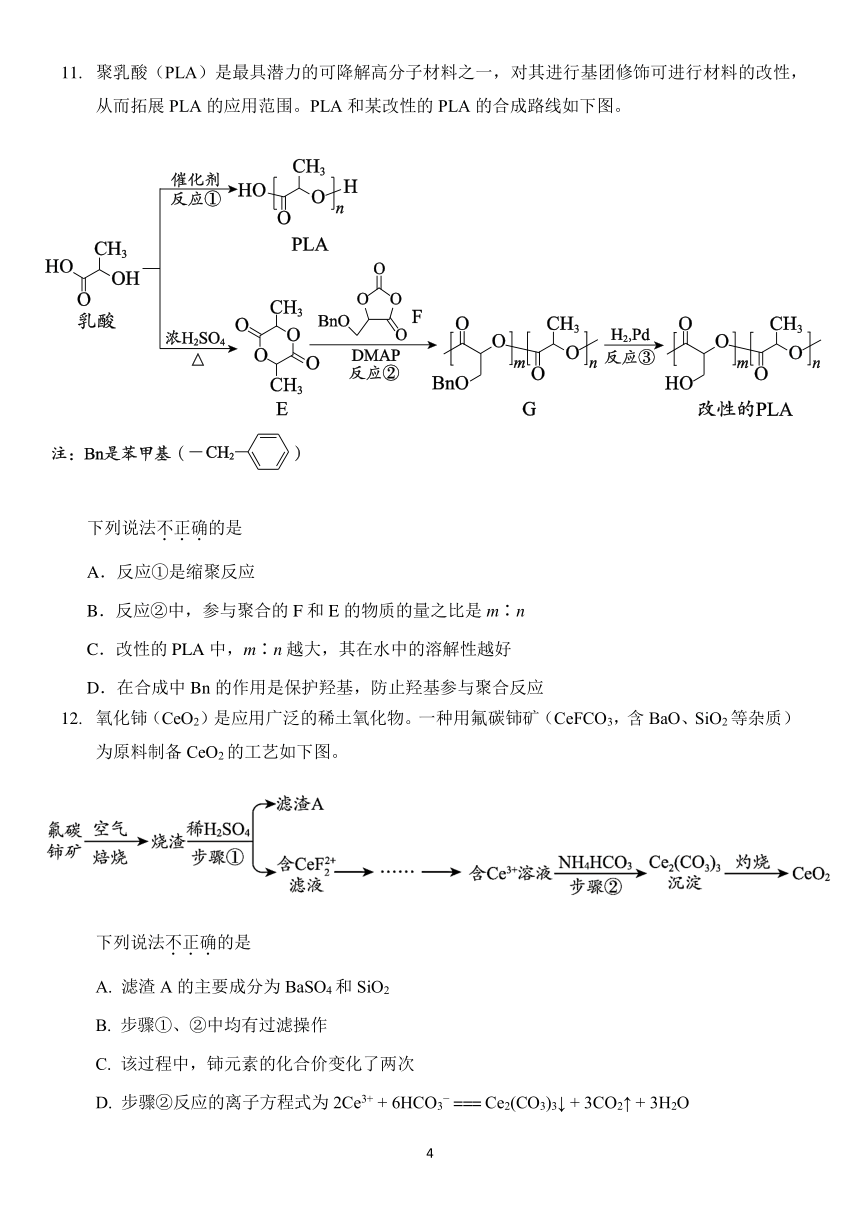
11. 聚乳酸(PLA)是最具潜力的可降解高分子材料之一,对其进行基团修饰可进行材料的改性,
从而拓展 PLA 的应用范围。PLA 和某改性的 PLA 的合成路线如下图。
下列说法不.正.确.的是
A.反应①是缩聚反应
B.反应②中,参与聚合的 F 和 E 的物质的量之比是 m∶n
C.改性的 PLA 中,m∶n 越大,其在水中的溶解性越好
D.在合成中 Bn 的作用是保护羟基,防止羟基参与聚合反应
12. 氧化铈(CeO2)是应用广泛的稀土氧化物。一种用氟碳铈矿(CeFCO3,含 BaO、SiO2等杂质)
为原料制备 CeO2的工艺如下图。
下列说法不.正.确.的是
A. 滤渣 A 的主要成分为 BaSO4 和 SiO2
B. 步骤①、②中均有过滤操作
C. 该过程中,铈元素的化合价变化了两次
D. 步骤②反应的离子方程式为 2Ce3+ + 6HCO 3 === Ce2(CO3)3↓ + 3CO2↑ + 3H2O
4
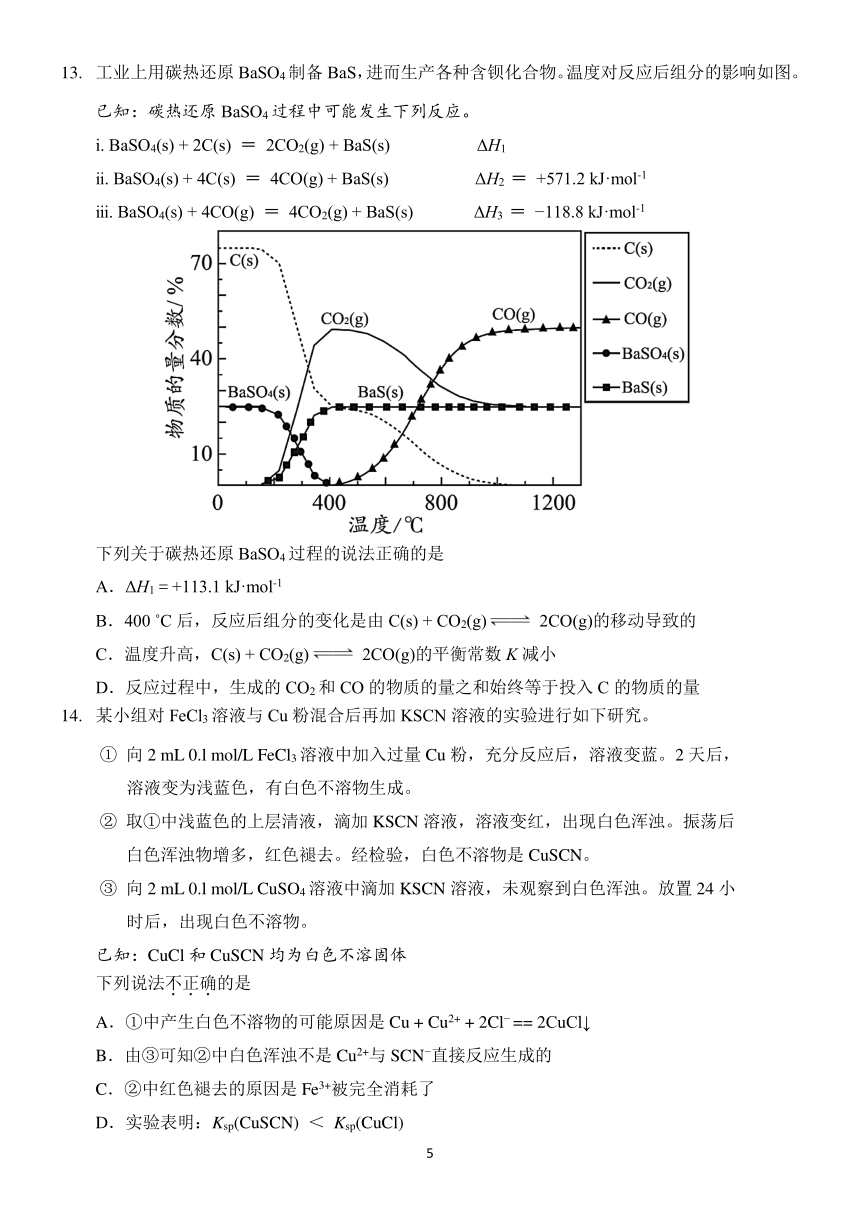
13. 工业上用碳热还原 BaSO4制备 BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
已知:碳热还原 BaSO4 过程中可能发生下列反应。
ⅰ. BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) ΔH 1
ⅱ. BaSO4(s) + 4C(s) = 4CO(g) + BaS(s) ΔH2 = +571.2 kJ·mol-1
ⅲ. BaSO4(s) + 4CO(g) = 4CO2(g) + BaS(s) ΔH3 = 118.8 kJ·mol-1
下列关于碳热还原 BaSO4过程的说法正确的是
A.ΔH1=+113.1 kJ·mol-1
B.400 C 后,反应后组分的变化是由 C(s) + CO2(g) 2CO(g)的移动导致的
C.温度升高,C(s) + CO2(g) 2CO(g)的平衡常数 K减小
D.反应过程中,生成的 CO2和 CO 的物质的量之和始终等于投入 C 的物质的量
14. 某小组对 FeCl3 溶液与 Cu 粉混合后再加 KSCN 溶液的实验进行如下研究。
① 向 2 mL 0.l mol/L FeCl3 溶液中加入过量 Cu 粉,充分反应后,溶液变蓝。2 天后,
溶液变为浅蓝色,有白色不溶物生成。
② 取①中浅蓝色的上层清液,滴加 KSCN 溶液,溶液变红,出现白色浑浊。振荡后
白色浑浊物增多,红色褪去。经检验,白色不溶物是 CuSCN。
③ 向 2 mL 0.l mol/L CuSO4 溶液中滴加 KSCN 溶液,未观察到白色浑浊。放置 24 小
时后,出现白色不溶物。
已知:CuCl 和 CuSCN 均为白色不溶固体
下列说法不.正.确.的是
A.①中产生白色不溶物的可能原因是 Cu + Cu2+ + 2Cl == 2CuCl↓
B.由③可知②中白色浑浊不是 Cu2+与 SCN 直接反应生成的
C.②中红色褪去的原因是 Fe3+被完全消耗了
D.实验表明:Ksp(CuSCN) < Ksp(CuCl)
5
第二部分
本部分共 5 题,共 58 分。
15. (9 分)Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体 M,其晶胞示意图如下。
:
:
:
(1)Zn2+的价层电子排布式是__________。
(2)C、O、N 的电负性从大到小的顺序是__________________。
(3) 三乙撑二胺( )与 Zn2+能形成配位键的原因是________________________________。
(4)在晶体 M 每个空腔中装入一个顺式偶氮苯分子后形成晶体 M1,晶胞示意图如右图。一
定条件下随着偶氮苯顺反结构的变化,晶体骨架发生畸变,
晶体在 M1和 M2两种结构之间相互转化,
可以吸收和释放 N2,被称为“会呼吸”的晶体。
晶体 装载分子 晶胞中 Zn2+个数 晶胞体积/cm3
M1 顺式偶氮苯 x 1.30×10 24
M 反式偶氮苯 4 2.46×10 242
资料:ⅰ.
ⅱ.M1和 M2相互转化时,Zn2+的配体和配体数均不变
① N2 的电子式是________________。
② 偶氮苯( )中 N 的杂化轨道类型是__________。偶氮苯存在顺反异
构的原因是分子中两个氮原子间存在__________(填“σ 键”或“π 键”)。
③ x = __________。
④ 晶胞密度小则晶体内部的空隙大。能让“会呼吸”的晶体吸收N2的条件是______光照射。
6
16. (11 分)己二腈[NC(CH)4CN]是合成尼龙-66 的中间体,其制备方法如下。
Ⅰ. 己二酸氨化法
(1)下列说法正确的是 (填字母)。
a.己二腈的分子中含有碳氮三键
b.反应②和④中均有 H2O 生成
c.该方法原子利用率为 100%
(2)若反应③中硝酸的还原产物为 NO2,理论上生产 1 mol 己二酸产生 NO2 的物质的量
是 mol。
Ⅱ. 丙烯腈(CH2=CHCN)电解二聚法(两极均为惰性电极)
通电
电解原理如图 a,总反应为 4CH2=CHCN + 2H2O 2NC(CH2)4CN +O2↑,主要副
产物为丙腈(C2H5CN)。
图 a 图 b
(3)电极 X 为 (填“阴”或“阳”)极
(4)若 Y 极区溶液呈酸性,会加快丙腈的生成,导致单位时间己二腈的产率降低。结合图 a
分析原因是 。
(5)写出 ⅰ 的电极反应式: 。
(6)己二腈、丙腈的生成速率与季铵盐浓度的关系如图 b。当季铵盐浓度为 1.5×10–2 mol·L–1
时,每小时通过质子交换膜的 H+的物质的量最少为 mol。
7
17. (12 分)靛蓝类色素是人类所知最古老的色素之一,广泛用于食品、医药和印染工业。靛蓝(化
合物 X)和多环化合物 Y 的一种合成路线如下所示(部分反应条件或试剂略去)。
已知:i.
(1)A 的名称是 。
(2)下列说法中,正确的是 (填序号)。
a. 由 A 制备 B 时,需要使用浓硝酸和浓硫酸
b. D 中含有的官能团只有硝基
c. D→E 可以通过取代反应实现
(3)E→G 的化学方程式是 。
(4)I 的结构简式是 。
(5)J 在一定条件下发生反应,可以生成化合物 X、乙酸和水,生成物中化合物 X 和乙酸的物
质的量比是 。
(6)K 中除苯环外,还含有一个五元环,K 的结构简式是 。
(7)已知: ii.
ⅲ. 亚胺结构( )中 C=N 键性质类似于羰基,在一定条件下能发生
类似 i 的反应。
M 与 L 在一定条件下转化为 Y 的一种路线如下图。
写出中间产物 1、中间产物 2 的结构简式 、 。
8
18. (13 分)黏土钒矿中,钒以+3 价、+4 价、+5 价的化合物存在,还包括 SiO2、Fe2O3 和铝硅酸
盐(Al2O3·SiO2)等。采用以下流程可由黏土钒矿制备 V2O5、Fe2O3 和硫酸铝铵。
已知:ⅰ. 有机酸性萃取剂 HR 的萃取原理为:
Mn+(aq) + nHR(org) MRn (org) + nH+(aq) org 表示有机溶液
ⅱ. 酸性溶液中,HR 对+4 价钒萃取能力强,而对+5 价钒的萃取能力较弱
ⅲ. HR 能萃取 Fe3+而不能萃取 Fe2+
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有________________________。
(2)滤渣的主要成分是____________。
(3)浸出液中钒以+4 价、+5 价的形式存在,简述加入铁粉的原因:______________。
(4)从平衡移动原理解释加入 20% H2SO4 溶液的作用:___________________。
+
(5)KClO 和 VO2+反应生成 VO 和 Cl 3 2 的离子方程式是_________________。
(6)测定 V2O5 产品的纯度
+
称取 V 2O5 产品 a g,先加入硫酸将 V2O5 转化为 VO2 ,加入指示剂后,用 c mol/L
+
(NH4)2Fe(SO4)2 溶液滴定将 VO2 转化为 VO2+至终点,消耗(NH4)2Fe(SO4)2 溶液的体积为 V
mL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是________________(V2O5 的
摩尔质量为 M g/mol)。
(7)从无机层获得 Fe(OH)3 的离子方程式是_____________________________。
(8)硫酸铝铵固体中含有少量硫酸铵杂质,
根据右图的溶解度曲线,进一步提纯
硫酸铝铵的操作是加热溶解、______、洗涤、干燥。
9
19. (13 分)探究溶液中 Ag+与单质 S 的反应。
资料:Ag2S 不溶于 6 mol/L 盐酸,Ag2SO3和 Ag2SO4 在 6 mol/L 盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将 10 mL 0.04 mol/L AgNO3 溶液(pH≈6)与 0.01 g S 粉混合,水浴加热,充分
反应后,过滤,得到无色溶液 a(pH≈1),沉淀除 S、洗涤后得到黑色固体 b。
(1)研究黑色固体 b 的组成
① 根据 S 具有__________性,推测 b 中可能含有 Ag2S、Ag、Ag2SO3或 Ag2SO4。
② 检验黑色固体 b 的成分
实验Ⅱ.
i.取少量滤液 c,先加入足量稀盐酸,再滴加 BaCl2 溶液,未出现白色沉淀,判断黑色固
体 b 中不含________________。
ii.用滤液 c 继续实验证明了黑色固体 b 中不含Ag2SO3,可选择的试剂是_____(_ 填序号)。
a.酸性 KMnO4溶液 b.H2O2和 BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体 b 中不含 Ag。根据沉淀 e 含有 Ag、气体含有 H2S,写出
同时生成 Ag 和 H2S 的离子方程式:__________________________________。
(2)研究无色溶液 a 的组成
2
结合上述实验结果,分析溶液 a 中可能存在 SO4 或 H2SO3,依据是_____________________。
实验Ⅲ.
① 说明溶液 a 中不含 H2SO3的实验证据是________________________________________。
② 加入足量稀盐酸的作用是____________________________________________________。
(3)在注射器中进行实验Ⅳ,探究 Ag2SO4 溶液与 S 的反应,所得产物与实验Ⅰ相同。
向注射器中加入的物质是______________________________________________________。
(4)用酸化的 NaNO3 溶液(pH≈6)与 S 进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液
中 Ag+与 S 反应的离子方程式并简要说明 Ag+的作用:_________________________________。
10
首都师大附中 2023—2024 学年第二学期考前练习 高三化学 参考答案
选择 1-5 CDDBC 6-10 BCACC 11-14 BCBC
15.(9 分)
(1)3d10(1 分)
(2)O>N>C(1 分)
(3)三乙撑二胺中的 N 给出孤电子对,Zn2+有空轨道能接受孤电子对(2 分)
(4) ① (1 分)
② sp2(1 分) π 键(1 分)
③ 2(1 分)
④ 紫外(1 分)
16.(11 分)
(1)ab(2 分)
(2)8(2 分)
(3)阳(1 分)
(4)H+浓度增大,H+和丙烯腈在阴极竞争得电子,减慢反应ⅰ,同时生成的 H 浓度增大加快了反
应ⅲ(2 分)
(5)2CH2=CHCN + 2H2O + 2e- → NC(CH2)4CN+2OH-(2 分)
(6)8.6×10-3(2 分)
17.(12 分)
(1)甲苯(1 分)
(2)ac(2 分)
(3) (2 分)
(4) (1 分)
(5)1:2(2 分)
(6) (2 分)
11
(7)中间产物 1: (1 分) 中间产物 2: (1 分)
18.(13 分)
(1)使用浓硫酸、升温至 250 ℃ (2 分)
(2)SiO2(1 分)
(3)将溶液中的+5 价钒、Fe3+分别转化为+4 价钒、Fe2+,利于+4 价钒的萃取,实现钒元素和铁元
素的分离(2 分)
(4)加入 20% H SO ,增大 c(H+),平衡 Mn+(aq) + nHR(org) MR (org)+ nH+2 4 n (aq)逆向移动,使
萃取的钒脱离有机层返回到无机层,与萃取剂分离(2 分)
+
(5)ClO + 6VO2+ + 3H O == Cl 3 2 + 6VO 2 + 6H+ (2 分)
(6) c V M (1 分)
2000a
(7)4Fe2+
+
+ O2 + 8NH3·H2O +2H2O == 4Fe(OH)3↓+ 8NH4 (2 分)
(8)冷却结晶、过滤(1 分)
19.(13 分)
(1) ① 氧化性和还原(1 分)
② i.Ag2SO4(1 分)
ii.bc(2 分)
ⅲ.Ag +2S + 2H + Fe == 2Ag + Fe2+ + H2S↑(2 分)
(2)S 转化为 Ag2S 发生了还原反应,反应必然同时发生氧化反应,能发生氧化反应
2
的只有 S, 故在 pH≈1 的溶液中可能存在 SO4 或 H2SO3(1 分)
① 向溶液 a 中加入足量稀盐酸后,再加入碘水和淀粉溶液,蓝色不褪去(1 分)
+ 2 ② 排除 Ag 对 SO4 和 H2SO3检验的干扰(2 分)
(3) 10 mL 0.02 mol/L Ag2SO4溶液与 0.01 g S 粉(1 分)
△ 2
(4) 6Ag+ + 4S + 4H2O == 3Ag2S + SO4 + 8H+
形成 Ag2S 难溶物,降低 c(S2 ),提高 S 的氧化性,利于反应发生(2 分)
12
高三化学 2024.05.28
本试卷共 8 页,100 分。考试时长 90 分钟。考生务必将答案答在答题纸上,在试卷上作答无
效。考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:S 32
第一部分
本部分共 14 题,每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 北京 2022 年冬奥会中使用了大量新材料,下列属于无机非金属材料的是
A B C D
“飞扬”火炬中的聚 颁奖礼服中的石墨烯 可降解餐具中的聚乳
速滑冰刀中的钛合金
硅氮烷树脂 发热材料 酸材料
2. 下列图示或化学用语表示不.正.确.的是
A B C D
乙炔的空间结构模型 SO2的 VSEPR 模型 反-2-丁烯的结构简式 乙醇的核磁共振氢谱
3. 下列物质的性质不.能.用化学键解释的是
A.金属铜具有导电性 B.氮气化学性质稳定
C.金刚石硬度大 D.碘单质常温为固体
4. 下列说法不.正.确.的是 O H
A.疫苗等生物制剂需要在低温下保存 B.蛋白质、氨基酸中均含有 C N
C.在伤口处涂抹医用酒精可消毒、杀菌 D.蛋白质水解可以得到氨基酸
1
5. 下列事实不.能.直接从原子结构角度解释的是
A.化合物 ICl 中 I 为 +1 价 B.第一电离能:B>Al
C.沸点:CS2>CO2 D.热稳定性:NH3>PH3
6. 汽车尾气中的 NOx、CO、碳氢化合物通过排气系统的净化装置(催化剂主要由 Rh、Pd、Pt
等物质和稀土材料组成)转化为无害气体,净化原理如下。下列分析不.正.确.的是
A.催化剂能提高反应速率 B.NOx、CO 均发生了氧化反应
C.CO 转化为 CO2 时,CeO2转化为 CeO2-m D.催化剂对化学反应有选择性
7. 下列方程式不.能.准确解释相应实验现象的是
△
A.MnO2 和浓盐酸共热产生黄绿色气体:MnO2 + 4H+ + 2Cl === Mn2+ + Cl2↑+ 2H2O
B.Na 加入滴有酚酞的水中,溶液变红:2Na + 2H + 2O === 2Na + 2OH + H2↑
△
C.加热 Fe 和 S 的混合物生成黑色固体:2Fe + 3S === Fe2S3
D.加热蓝色的 CuCl2溶液,溶液变绿:
[Cu(H O) ]2+(aq) + 4Cl 2 4 (aq) [CuCl 2 4] (aq) + 4H2O(l) ΔH>0
(蓝色) (黄色)
8. 用下图装置(夹持、加热装置已略)进行实验,②中现象不.能.证实①中发生了反应的是
①中实验 ②中现象
加热 1 溴丁烷与 NaOH 的乙醇溶液的混
A 酸性 KMnO4溶液褪色
合物
B 加热NH4Cl溶液和浓NaOH溶液的混合物 AgNO3 溶液先变浑浊后澄清
饱和Na2CO3溶液的上层有无
C 加热乙酸、乙醇和浓硫酸的混合物
色油状液体产生
将铁粉、碳粉和 NaCl 溶液的混合物放置
D 导管中倒吸一段水柱
一段时间
2
9. 向盛有 1 mol/L NH4Cl 溶液的烧杯中,加入少量氨水,再加入过量 Mg 粉,有大量气泡
产生。将湿润的红色石蕊试纸放在烧杯口,试纸变蓝。溶液的 pH 随时间的变化如下图。
下列说法不.正.确.的是
+
A.随着反应的进行,c(NH4 )降低
B.产生的气体是混合物
+
C.pH=9 时,溶液中 c(NH4 ) + 2c(Mg2+)<c(Cl )
+
D.溶液的 pH 升高可能是 Mg 与 NH4 、H2O 反应的结果
10. 液流电池可以实现光伏发电和风力发电电能的储存和释放。一种非金属有机物液流电池的工作
原理如下图。
AQDS:
AQDSH2:
下列说法不.正.确.的是
A. 放电时,正极反应式为 Br + 2e 2 === 2Br
B.放电时,物质 a 为 AQDSH2
C.充电时,AQDS/AQDSH2储液罐中的 pH 减小,H+通过质子交换膜到达溴极室
D.增大储液罐体积,可提高液流电池的储能容量
3
11. 聚乳酸(PLA)是最具潜力的可降解高分子材料之一,对其进行基团修饰可进行材料的改性,
从而拓展 PLA 的应用范围。PLA 和某改性的 PLA 的合成路线如下图。
下列说法不.正.确.的是
A.反应①是缩聚反应
B.反应②中,参与聚合的 F 和 E 的物质的量之比是 m∶n
C.改性的 PLA 中,m∶n 越大,其在水中的溶解性越好
D.在合成中 Bn 的作用是保护羟基,防止羟基参与聚合反应
12. 氧化铈(CeO2)是应用广泛的稀土氧化物。一种用氟碳铈矿(CeFCO3,含 BaO、SiO2等杂质)
为原料制备 CeO2的工艺如下图。
下列说法不.正.确.的是
A. 滤渣 A 的主要成分为 BaSO4 和 SiO2
B. 步骤①、②中均有过滤操作
C. 该过程中,铈元素的化合价变化了两次
D. 步骤②反应的离子方程式为 2Ce3+ + 6HCO 3 === Ce2(CO3)3↓ + 3CO2↑ + 3H2O
4
13. 工业上用碳热还原 BaSO4制备 BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
已知:碳热还原 BaSO4 过程中可能发生下列反应。
ⅰ. BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) ΔH 1
ⅱ. BaSO4(s) + 4C(s) = 4CO(g) + BaS(s) ΔH2 = +571.2 kJ·mol-1
ⅲ. BaSO4(s) + 4CO(g) = 4CO2(g) + BaS(s) ΔH3 = 118.8 kJ·mol-1
下列关于碳热还原 BaSO4过程的说法正确的是
A.ΔH1=+113.1 kJ·mol-1
B.400 C 后,反应后组分的变化是由 C(s) + CO2(g) 2CO(g)的移动导致的
C.温度升高,C(s) + CO2(g) 2CO(g)的平衡常数 K减小
D.反应过程中,生成的 CO2和 CO 的物质的量之和始终等于投入 C 的物质的量
14. 某小组对 FeCl3 溶液与 Cu 粉混合后再加 KSCN 溶液的实验进行如下研究。
① 向 2 mL 0.l mol/L FeCl3 溶液中加入过量 Cu 粉,充分反应后,溶液变蓝。2 天后,
溶液变为浅蓝色,有白色不溶物生成。
② 取①中浅蓝色的上层清液,滴加 KSCN 溶液,溶液变红,出现白色浑浊。振荡后
白色浑浊物增多,红色褪去。经检验,白色不溶物是 CuSCN。
③ 向 2 mL 0.l mol/L CuSO4 溶液中滴加 KSCN 溶液,未观察到白色浑浊。放置 24 小
时后,出现白色不溶物。
已知:CuCl 和 CuSCN 均为白色不溶固体
下列说法不.正.确.的是
A.①中产生白色不溶物的可能原因是 Cu + Cu2+ + 2Cl == 2CuCl↓
B.由③可知②中白色浑浊不是 Cu2+与 SCN 直接反应生成的
C.②中红色褪去的原因是 Fe3+被完全消耗了
D.实验表明:Ksp(CuSCN) < Ksp(CuCl)
5
第二部分
本部分共 5 题,共 58 分。
15. (9 分)Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体 M,其晶胞示意图如下。
:
:
:
(1)Zn2+的价层电子排布式是__________。
(2)C、O、N 的电负性从大到小的顺序是__________________。
(3) 三乙撑二胺( )与 Zn2+能形成配位键的原因是________________________________。
(4)在晶体 M 每个空腔中装入一个顺式偶氮苯分子后形成晶体 M1,晶胞示意图如右图。一
定条件下随着偶氮苯顺反结构的变化,晶体骨架发生畸变,
晶体在 M1和 M2两种结构之间相互转化,
可以吸收和释放 N2,被称为“会呼吸”的晶体。
晶体 装载分子 晶胞中 Zn2+个数 晶胞体积/cm3
M1 顺式偶氮苯 x 1.30×10 24
M 反式偶氮苯 4 2.46×10 242
资料:ⅰ.
ⅱ.M1和 M2相互转化时,Zn2+的配体和配体数均不变
① N2 的电子式是________________。
② 偶氮苯( )中 N 的杂化轨道类型是__________。偶氮苯存在顺反异
构的原因是分子中两个氮原子间存在__________(填“σ 键”或“π 键”)。
③ x = __________。
④ 晶胞密度小则晶体内部的空隙大。能让“会呼吸”的晶体吸收N2的条件是______光照射。
6
16. (11 分)己二腈[NC(CH)4CN]是合成尼龙-66 的中间体,其制备方法如下。
Ⅰ. 己二酸氨化法
(1)下列说法正确的是 (填字母)。
a.己二腈的分子中含有碳氮三键
b.反应②和④中均有 H2O 生成
c.该方法原子利用率为 100%
(2)若反应③中硝酸的还原产物为 NO2,理论上生产 1 mol 己二酸产生 NO2 的物质的量
是 mol。
Ⅱ. 丙烯腈(CH2=CHCN)电解二聚法(两极均为惰性电极)
通电
电解原理如图 a,总反应为 4CH2=CHCN + 2H2O 2NC(CH2)4CN +O2↑,主要副
产物为丙腈(C2H5CN)。
图 a 图 b
(3)电极 X 为 (填“阴”或“阳”)极
(4)若 Y 极区溶液呈酸性,会加快丙腈的生成,导致单位时间己二腈的产率降低。结合图 a
分析原因是 。
(5)写出 ⅰ 的电极反应式: 。
(6)己二腈、丙腈的生成速率与季铵盐浓度的关系如图 b。当季铵盐浓度为 1.5×10–2 mol·L–1
时,每小时通过质子交换膜的 H+的物质的量最少为 mol。
7
17. (12 分)靛蓝类色素是人类所知最古老的色素之一,广泛用于食品、医药和印染工业。靛蓝(化
合物 X)和多环化合物 Y 的一种合成路线如下所示(部分反应条件或试剂略去)。
已知:i.
(1)A 的名称是 。
(2)下列说法中,正确的是 (填序号)。
a. 由 A 制备 B 时,需要使用浓硝酸和浓硫酸
b. D 中含有的官能团只有硝基
c. D→E 可以通过取代反应实现
(3)E→G 的化学方程式是 。
(4)I 的结构简式是 。
(5)J 在一定条件下发生反应,可以生成化合物 X、乙酸和水,生成物中化合物 X 和乙酸的物
质的量比是 。
(6)K 中除苯环外,还含有一个五元环,K 的结构简式是 。
(7)已知: ii.
ⅲ. 亚胺结构( )中 C=N 键性质类似于羰基,在一定条件下能发生
类似 i 的反应。
M 与 L 在一定条件下转化为 Y 的一种路线如下图。
写出中间产物 1、中间产物 2 的结构简式 、 。
8
18. (13 分)黏土钒矿中,钒以+3 价、+4 价、+5 价的化合物存在,还包括 SiO2、Fe2O3 和铝硅酸
盐(Al2O3·SiO2)等。采用以下流程可由黏土钒矿制备 V2O5、Fe2O3 和硫酸铝铵。
已知:ⅰ. 有机酸性萃取剂 HR 的萃取原理为:
Mn+(aq) + nHR(org) MRn (org) + nH+(aq) org 表示有机溶液
ⅱ. 酸性溶液中,HR 对+4 价钒萃取能力强,而对+5 价钒的萃取能力较弱
ⅲ. HR 能萃取 Fe3+而不能萃取 Fe2+
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有________________________。
(2)滤渣的主要成分是____________。
(3)浸出液中钒以+4 价、+5 价的形式存在,简述加入铁粉的原因:______________。
(4)从平衡移动原理解释加入 20% H2SO4 溶液的作用:___________________。
+
(5)KClO 和 VO2+反应生成 VO 和 Cl 3 2 的离子方程式是_________________。
(6)测定 V2O5 产品的纯度
+
称取 V 2O5 产品 a g,先加入硫酸将 V2O5 转化为 VO2 ,加入指示剂后,用 c mol/L
+
(NH4)2Fe(SO4)2 溶液滴定将 VO2 转化为 VO2+至终点,消耗(NH4)2Fe(SO4)2 溶液的体积为 V
mL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是________________(V2O5 的
摩尔质量为 M g/mol)。
(7)从无机层获得 Fe(OH)3 的离子方程式是_____________________________。
(8)硫酸铝铵固体中含有少量硫酸铵杂质,
根据右图的溶解度曲线,进一步提纯
硫酸铝铵的操作是加热溶解、______、洗涤、干燥。
9
19. (13 分)探究溶液中 Ag+与单质 S 的反应。
资料:Ag2S 不溶于 6 mol/L 盐酸,Ag2SO3和 Ag2SO4 在 6 mol/L 盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将 10 mL 0.04 mol/L AgNO3 溶液(pH≈6)与 0.01 g S 粉混合,水浴加热,充分
反应后,过滤,得到无色溶液 a(pH≈1),沉淀除 S、洗涤后得到黑色固体 b。
(1)研究黑色固体 b 的组成
① 根据 S 具有__________性,推测 b 中可能含有 Ag2S、Ag、Ag2SO3或 Ag2SO4。
② 检验黑色固体 b 的成分
实验Ⅱ.
i.取少量滤液 c,先加入足量稀盐酸,再滴加 BaCl2 溶液,未出现白色沉淀,判断黑色固
体 b 中不含________________。
ii.用滤液 c 继续实验证明了黑色固体 b 中不含Ag2SO3,可选择的试剂是_____(_ 填序号)。
a.酸性 KMnO4溶液 b.H2O2和 BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体 b 中不含 Ag。根据沉淀 e 含有 Ag、气体含有 H2S,写出
同时生成 Ag 和 H2S 的离子方程式:__________________________________。
(2)研究无色溶液 a 的组成
2
结合上述实验结果,分析溶液 a 中可能存在 SO4 或 H2SO3,依据是_____________________。
实验Ⅲ.
① 说明溶液 a 中不含 H2SO3的实验证据是________________________________________。
② 加入足量稀盐酸的作用是____________________________________________________。
(3)在注射器中进行实验Ⅳ,探究 Ag2SO4 溶液与 S 的反应,所得产物与实验Ⅰ相同。
向注射器中加入的物质是______________________________________________________。
(4)用酸化的 NaNO3 溶液(pH≈6)与 S 进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液
中 Ag+与 S 反应的离子方程式并简要说明 Ag+的作用:_________________________________。
10
首都师大附中 2023—2024 学年第二学期考前练习 高三化学 参考答案
选择 1-5 CDDBC 6-10 BCACC 11-14 BCBC
15.(9 分)
(1)3d10(1 分)
(2)O>N>C(1 分)
(3)三乙撑二胺中的 N 给出孤电子对,Zn2+有空轨道能接受孤电子对(2 分)
(4) ① (1 分)
② sp2(1 分) π 键(1 分)
③ 2(1 分)
④ 紫外(1 分)
16.(11 分)
(1)ab(2 分)
(2)8(2 分)
(3)阳(1 分)
(4)H+浓度增大,H+和丙烯腈在阴极竞争得电子,减慢反应ⅰ,同时生成的 H 浓度增大加快了反
应ⅲ(2 分)
(5)2CH2=CHCN + 2H2O + 2e- → NC(CH2)4CN+2OH-(2 分)
(6)8.6×10-3(2 分)
17.(12 分)
(1)甲苯(1 分)
(2)ac(2 分)
(3) (2 分)
(4) (1 分)
(5)1:2(2 分)
(6) (2 分)
11
(7)中间产物 1: (1 分) 中间产物 2: (1 分)
18.(13 分)
(1)使用浓硫酸、升温至 250 ℃ (2 分)
(2)SiO2(1 分)
(3)将溶液中的+5 价钒、Fe3+分别转化为+4 价钒、Fe2+,利于+4 价钒的萃取,实现钒元素和铁元
素的分离(2 分)
(4)加入 20% H SO ,增大 c(H+),平衡 Mn+(aq) + nHR(org) MR (org)+ nH+2 4 n (aq)逆向移动,使
萃取的钒脱离有机层返回到无机层,与萃取剂分离(2 分)
+
(5)ClO + 6VO2+ + 3H O == Cl 3 2 + 6VO 2 + 6H+ (2 分)
(6) c V M (1 分)
2000a
(7)4Fe2+
+
+ O2 + 8NH3·H2O +2H2O == 4Fe(OH)3↓+ 8NH4 (2 分)
(8)冷却结晶、过滤(1 分)
19.(13 分)
(1) ① 氧化性和还原(1 分)
② i.Ag2SO4(1 分)
ii.bc(2 分)
ⅲ.Ag +2S + 2H + Fe == 2Ag + Fe2+ + H2S↑(2 分)
(2)S 转化为 Ag2S 发生了还原反应,反应必然同时发生氧化反应,能发生氧化反应
2
的只有 S, 故在 pH≈1 的溶液中可能存在 SO4 或 H2SO3(1 分)
① 向溶液 a 中加入足量稀盐酸后,再加入碘水和淀粉溶液,蓝色不褪去(1 分)
+ 2 ② 排除 Ag 对 SO4 和 H2SO3检验的干扰(2 分)
(3) 10 mL 0.02 mol/L Ag2SO4溶液与 0.01 g S 粉(1 分)
△ 2
(4) 6Ag+ + 4S + 4H2O == 3Ag2S + SO4 + 8H+
形成 Ag2S 难溶物,降低 c(S2 ),提高 S 的氧化性,利于反应发生(2 分)
12
同课章节目录
