2024年中考化学冲刺专项攻略:计算题(含解析)
文档属性
| 名称 | 2024年中考化学冲刺专项攻略:计算题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 856.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-01 10:42:33 | ||
图片预览



文档简介
2024年中考化学冲刺专项攻略:计算题
1.某生产化肥碳酸氢铵(NH4HCO3)的企业,做了一个大型的广告(如图),该化肥主要成分是碳酸氢铵所含杂质不含氮元素,计算
(1)碳酸氢铵的相对分子质量是
(2)碳酸氢铵中各原子的个数比
(3)氮、氢、碳、氧四种元素的质量比
(4)碳酸氢铵中氮元素的质量分数为 (结果精确到0.1%)
(5)通过上述计算判断该广告属于 (填“虚假”或“真实”广告);每袋化肥中最多含氮元素 kg
(6)15.8kg的碳酸氢铵和 kgCO(NH2)2所含氮元素质量相等。
2.侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下: 。请计算:若要生产 NaHCO38.4t,则理论上需要氯化钠的质量。
3.某同学利用废旧1号电池拆下的锌片制取氢气,他取20g这种含杂质的锌片,放入98g溶质的质量分数为20%的稀硫酸中,恰好完全反应(杂质不反应)。求这种含杂质的锌片中金属锌的含量是
4.小明同学为测定某大理石中碳酸钙的质量分数,他在烧杯中放入100g大理石和219g稀盐酸,恰好完全反应(大理石的主要成分为碳酸钙,其他杂质不与盐酸反应),最后烧杯中剩余物的质量为297克。请计算:
(1)反应产生的二氧化碳的质量为 g;
(2)求大理石中碳酸钙的质量分数 。
5.食醋中含有醋酸,醋酸的化学式为 ,计算
(1)醋酸的相对分子质量
(2)醋酸中碳、氢两种元素的质量比 (写最简整数比)
(3) g醋酸中含有碳元素的质量为
6.实验室用稀盐酸中和氢氧化钠溶液,当溶液时,测得生成的溶液的总质量为,溶质质量分数为,试求
(1)所用稀盐酸中溶质的质量分数为多少?
(2)原氢氧化钠溶液中溶质的质量分数为多少?
7.“蛟龙号”是我国研制的深海载人潜水器。潜水器的供氧装置中发生的反应为2Na2O2+2CO2=2Na2CO3+O2。计算:用这种方法制取16g氧气,需要过氧化钠的质量。
8.为测定某纯碱样品中Na2CO3的质量分数,取20g该样品于烧杯中,滴加稀硫酸至不再产生气泡为止,加入稀硫酸的质量与产生气体的质量关系如图所示。(反应的化学方程式为:;杂质不参加反应)
(1)H2SO4中硫、氧原子个数比是 。
(2)列式计算该纯碱样品中Na2CO3的质量分数。
9.小红同学取某地石灰石样品12.5g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 20 20 20 20 20
生成气体的总质量/g 1.1 2.2 m 4.4 4.4
请计算:
(1)m的值;
(2)石灰石样品中碳酸钙的质量分数;
(3)所用稀盐酸溶质的质量分数是多少?(要求写出计算过程)
10.为了测定某地区石灰石中碳酸钙的质量分数,现有20g石灰石样品,并取稀盐酸200g,将稀盐酸平均分成4份,进行如下实验:(计算结果保留至0.1%)
实验 1 2 3 4
加入盐酸的质量(g) 50 50 50 50
生成CO2的质量(g) 1.76 3.52 4.4 m
(1)上表中m的数值为 。
(2)计算石灰石样品中碳酸钙的质量分数。
(3)计算石灰石样品中碳元素的质量分数。
11.为了测定某品牌食用碱(主要成分为碳酸钠,含少量氯化钠杂质)中碳酸钠的质量分数。化学兴趣小组的同学将10.0g食用碱样品加到盛有90.0g水的烧杯中,完全溶解后,往其中逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表所示:
实验次数 第1次 第2次 第3次 第4次 第5次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 172.0 192.0
请计算:
(1)反应生成沉淀的总质量为 g。
(2)该品牌食用碱中碳酸钠的质量分数。(写出计算过程)
12.某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取20 g该固体混合物,向其中逐滴加入稀H2SO4,测得剩余固体的质量与加入稀H2SO4的质量关系如图所示。回答下列问题:
(1)该固体混合物中铜元素的质量为 ;
(2)计算稀H2SO4中溶质的质量分数(写出计算过程)。
13.小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 第1次 第2次 第3次 第4次
剩余固体质量(g) 10.8 9.6 8.1 8.1
试计算:
(1)完全反应后生成二氧化碳的质量是 g
(2)求珍珠粉中碳酸钙的质量分数.
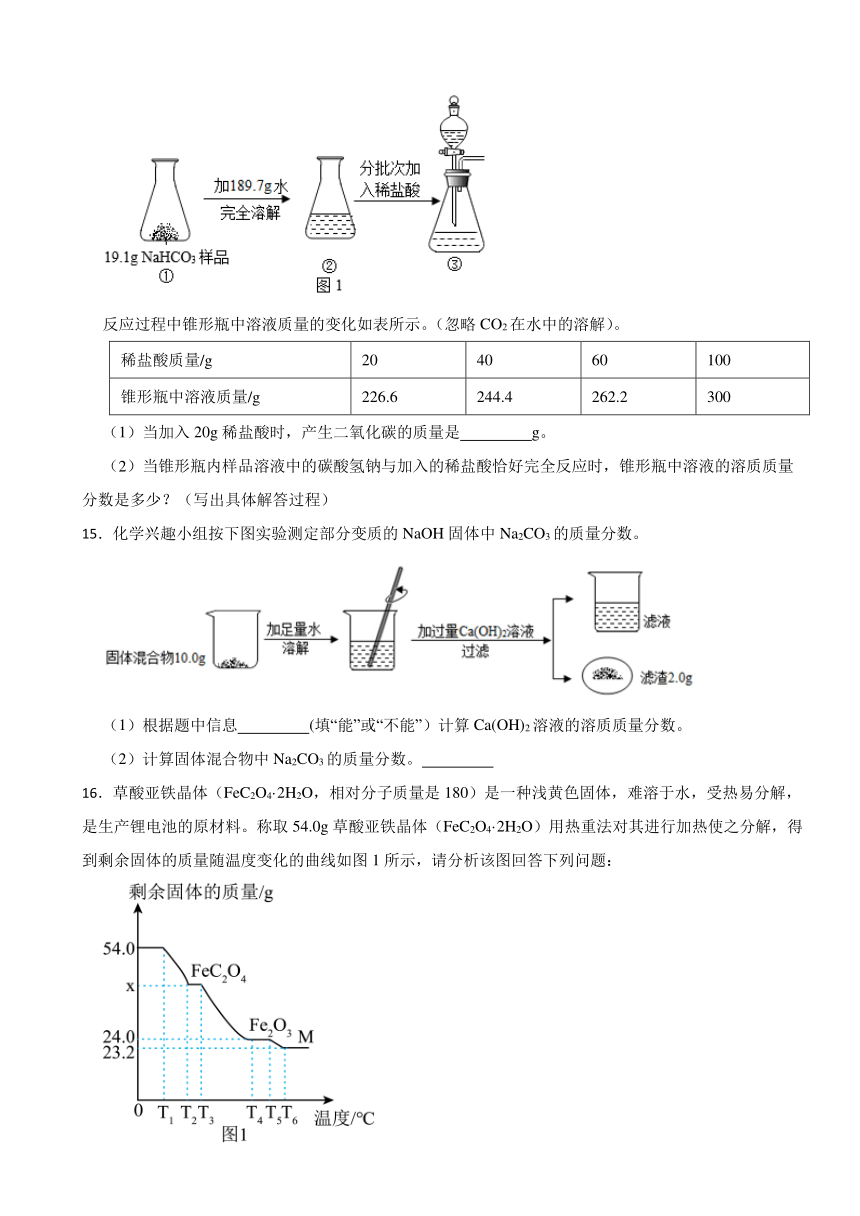
14.小苏打(NaHCO3)是发酵粉的主要成分。化学兴趣小组为探究某品牌小苏打样品(含NaCl杂质)中碳酸氢钠的含量设计了如图1所示的实验。
反应过程中锥形瓶中溶液质量的变化如表所示。(忽略CO2在水中的溶解)。
稀盐酸质量/g 20 40 60 100
锥形瓶中溶液质量/g 226.6 244.4 262.2 300
(1)当加入20g稀盐酸时,产生二氧化碳的质量是 g。
(2)当锥形瓶内样品溶液中的碳酸氢钠与加入的稀盐酸恰好完全反应时,锥形瓶中溶液的溶质质量分数是多少?(写出具体解答过程)
15.化学兴趣小组按下图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息 (填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
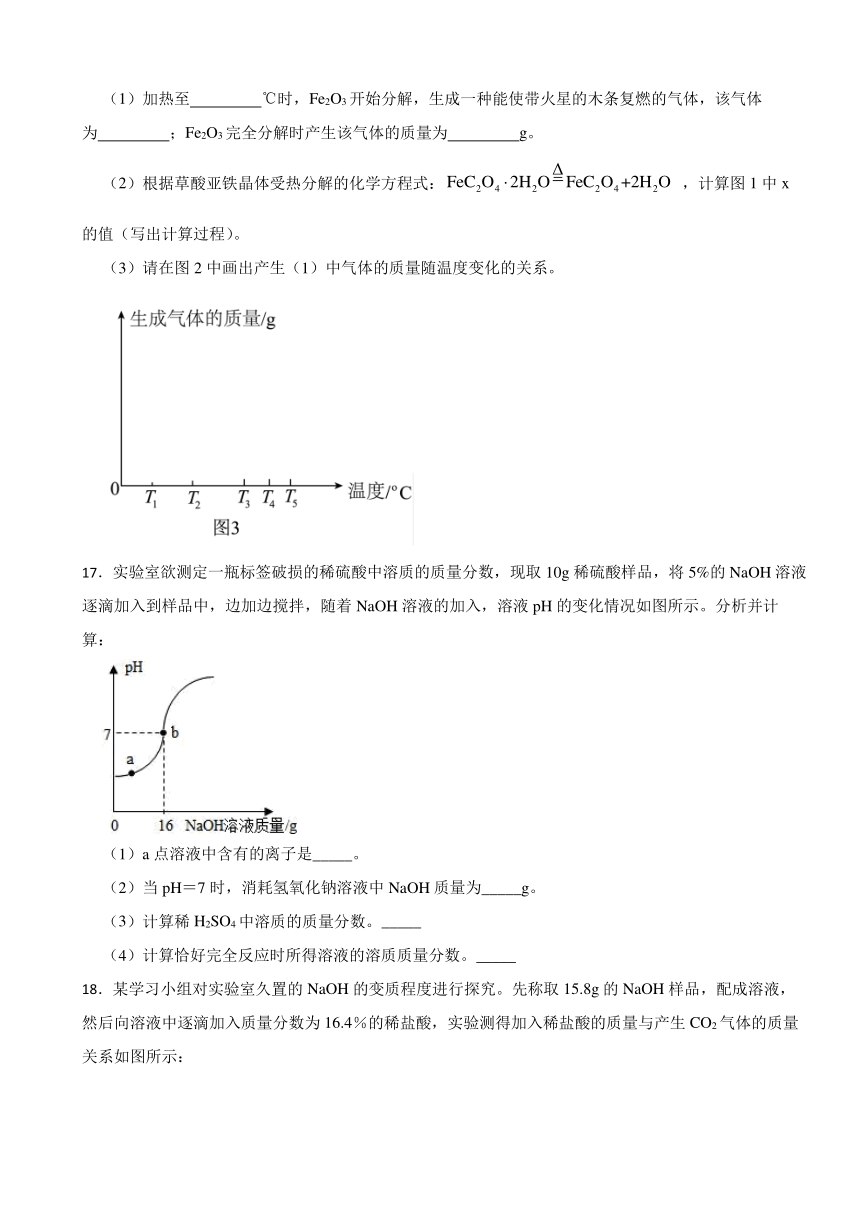
16.草酸亚铁晶体(FeC2O4·2H2O,相对分子质量是180)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料。称取54.0g草酸亚铁晶体(FeC2O4·2H2O)用热重法对其进行加热使之分解,得到剩余固体的质量随温度变化的曲线如图1所示,请分析该图回答下列问题:
(1)加热至 ℃时,Fe2O3开始分解,生成一种能使带火星的木条复燃的气体,该气体为 ;Fe2O3完全分解时产生该气体的质量为 g。
(2)根据草酸亚铁晶体受热分解的化学方程式: ,计算图1中x的值(写出计算过程)。
(3)请在图2中画出产生(1)中气体的质量随温度变化的关系。
17.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。_____
(4)计算恰好完全反应时所得溶液的溶质质量分数。_____
18.某学习小组对实验室久置的NaOH的变质程度进行探究。先称取15.8g的NaOH样品,配成溶液,然后向溶液中逐滴加入质量分数为16.4%的稀盐酸,实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示:
(1)该样品中Na2CO3的质量分数是 (精确到0.1%)。
(2)实验过程中稀盐酸与NaOH反应所用的质量(精确到0.1)。
(3)根据“稀盐酸与NaOH反应所用的质量”,对照图像,你发现了什么问题?
19.为强化对水资源的保护,我省各地对主要河流建立了市级河长制。某研究实践小组在一次环保调查中,对一硫酸厂生产车间排放的废水进行了检测。取澄清废水样品100g,逐滴加入氯化钡溶液,生成沉淀与加入氯化钡溶液的质量关系如下图所示。(杂质不参与反应)
(1)判定废水中所含硫酸已完全反应的方法是 。
(2)实验过程中生成硫酸钡的质量是 g。
(3)该车间产生的废水需经过处理才能向外排放,从经济和处理效果分析,下列物质中,最适合用于废水处理的是____(填序号)。
A.氢氧化钠 B.氧化铜 C.熟石灰 D.食盐
(4)该车间排放的废水中所含硫酸的质量分数是多少?(写出计算过程)
20.钙是身体内重要的常量元素,对身体的发育起到非常重要的作用。右图是某钙片的部分说明书,请分析:
主要成分:每片含碳酸钙1.25克,维生素D3200国际单位。 规格:2克/片 用法用量:口服,咀嚼后咽下。成人,一次1片,一日1-2次;儿童一次半片,一日1-2次。
(1)该钙片属于 (填“纯净物”或“混合物”)。
(2)碳酸钙中碳、氧元素的质量比为 。
(3)每片钙片中碳酸钙的质量分数为 。
(4)缺钙或补钙过多,都会对孩子的身体产生重大的影响。若按照儿童用量服用该钙片,每天最多摄入钙元素的质量为 。
21.某校兴趣小组取一定量的氯酸钾和二氧化锰的混合物放入大试管中加热。剩余固体质量与时间的变化如下表所示:
时间/min t0 t1 t2 t3 t4 t5 T6
剩余固体质量/g 26.5 26.5 24.1 21.7 m 16.9 16.9
(1)从反应开始到t6时,产生氧气的总质量是 g。
(2)其中m= 。
(3)求混合物中氯酸钾的质量(写出计算过程)。
(4)请在下图中画出产生O2的曲线。
22.某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品6 g放入20 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,反应后溶液的总质量为50 g。试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)反应后所得溶液中溶质的质量分数。
23.某校学习小组同学探究实验室中久置的NaOH的变质程度。
【实验过程】先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,逐滴加入一定质量分数的稀硫酸至过量,根据生成CO2质量算出Na2CO3的质量,从而确定样品中NaOH的质量分数及变质程度。
【数据处理】
(1)由图得知:产生CO2的最大量为________g。
写出以下计算过程:
(2)该样品中Na2CO3的质量为多少?
(3)该样品中NaOH的质量分数为多少?
(4)NaOH的变质程度________(用质量分数表示,数据精确到0.1%)。
【反思交流】
(5)从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入强酸,首先反应的物质是________;
(6)根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比较,反应时所消耗强酸的量________(填“无法确定”或“相同”或“不相同”)。
24.利用萤石[主要成分氟化钙(CaF2)]来合成含氟化学品,一直以来是化学工业研究的重点项目下列是合成六氟磷酸锂(LiPF6)的几种方法。据此回答下列问题:(相对分子质量:P2O5-142,PF5-126,LiPF6-152)
(1)LiPF6中锂元素和磷元素质量比为 .
(2)氢氟酸具有腐蚀性和毒性,“非氢氟酸法”与传统方法相比,具有的优点是 .
(3)“非氯法”的第一步反应为6P2O5+5CaF2 2PF5↑+5Ca(PO5)2,现有14.2kg P2O5,不计损耗,理论上可以得到多少kg PF5?(写出计算过程)
(4)“非氯法”第二步反应为:PF5+LiF LiPF6中用126 kg PF5制取LiPF6,生成LiPF6的质量与时间的关系如图2所示,则在t1时,已经消耗了 kg PF5(结果精确至 0.1)。
25.为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸(杂质不与盐酸反应,也不溶于水),实验测得的数据如图甲所示。
(1)该样品完全反应,生成二氧化碳的质量是 g。
(2)已知石灰石中碳酸钙的质量分数为 ,求该石灰石样品中碳酸钙的质量分数。(写出计算过程)
(3)随着稀盐酸的加入,请在图乙中画出溶液中钙元素的质量变化示意图。
26.为探究铜及其化合物的性质,进行如下实验:称取已部分被H2还原的氧化铜粉末(含Cu和CuO)7.2g置于烧杯中,向其中加入50g稀硫酸,充分反应后,再向烧杯中加入溶质质量分数为20%的NaOH溶液,加NaOH溶液的过程中,烧杯内固体物质的质量与加入NaOH溶液的质量关系如图所示。
请计算:
(1)Cu和CuO的混合物中,Cu元素和O元素的质量比为______(化为最简整数比)。
(2)实验所用稀硫酸中硫酸溶质的质量分数。(写出计算过程)
(3)拐点a的横坐标数值为______。纵坐标数值为______。
27.生理盐水是医疗上常用的一种溶液,某化学兴趣小组为了测定某生理盐水的溶质质量分数,取260g该生理盐水样品于烧杯内,向其中加入80g硝酸银溶液,恰好完全反应,过滤,称得滤液的质量为334.26g。
(1)当加入硝酸银溶液的质量分别为40g和80g时,烧杯中阳离子的种类 (选填“相同”或“不同”)。
(2)反应后生成沉淀的质量为 g。
(3)计算该生理盐水的溶质质量分数 。(写出计算过程)
(4)现需配制500g该生理盐水,下列操作失误会引起所配溶液的溶质质量分数偏小的是____(填字母)。
A.用托盘天平称量氯化钠时,将砝码放左盘,氯化钠放右盘(1g以下使用游码)
B.用量筒量取蒸馏水,读数时仰视量筒内液体凹液面最低处
C.将量筒中的水倒入烧杯时,有少量水洒出
D.将配好的氯化钠溶液转移到细口瓶中时,不慎洒出部分溶液
28.化学课上,老师拿来一包氧化铜和铜的固体混合物,兴趣小组的同学取18g该混合物于烧杯中,将一定质量分数的稀硫酸分5次加入到烧杯中,充分反应,记录相关数据如下表所示:
实验次数 第1次 第2次 第3次 第4次 第5次
加入稀硫酸的质量/g 30 60 90 120 150
剩余固体的质量/g 16 a 12 11 11
计算:
(1)表中a的值为 。混合物中铜的质量分数为 。
(2)所用稀硫酸的溶质质量分数是多少?(写出计算过程,结果精确到0.1%)
(3)在坐标中画出加入稀硫酸的质量与剩余固体质量的相应曲线关系,标注必要的数据。
29.某化学兴趣小组的同学利用压强传感器、数据采集器和计算机等数字化实验设备,测定铝片与足量浓度为9.8%的稀硫酸反应时气体压强的变化,实验结果如图所示:
(1)开始一段时间气体压强不变,其原因是 。
(2)计算该铝片中氧化铝的质量。
(3)在图中画出加入40 g稀硫酸与铝片反应产生气体的质量的关系图。
(4)该铝片中铝元素的质量分数为 。(得数保留0.1%)
30.某校学习小组同学探究实验室中久置的NaOH的变质程度。
【实验过程】先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,逐滴加入一定质量分数的稀硫酸至过量,根据生成CO2质量算出Na2CO3的质量,从而确定样品中NaOH的质量分数及变质程度。
【数据处理】
(1)由图得知:产生CO2的最大量为________g。
写出以下计算过程:
(2)该样品中Na2CO3的质量为多少?
(3)该样品中NaOH的质量分数为多少?
(4)NaOH的变质程度________(用质量分数表示,数据精确到0.1%)。
【反思交流】
(5)从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入强酸,首先反应的物质是________;
(6)根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比较,反应时所消耗强酸的量________(填“无法确定”或“相同”或“不相同”)。
答案解析部分
1.【答案】(1)79
(2)1:5:1:3
(3)14:5:12:48
(4)17.7%
(5)虚假;8.86
(6)6.0
【解析】【解答】(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,碳酸氢铵的相对分子质量为14+1×4+1+12+16×3=79;(2)1个碳酸氢铵分子是由1个氮原子、5个氢原子、1个碳原子和3个氧原子构成的,则碳酸氢铵中氮、氢、碳、氧四种原子的个数比为1:5:1:3;(3)碳酸氢铵中氮、氢、碳、氧元素质量比为14:(1×5):12:(16×3)=14:5:12:48;(4)碳酸氢铵中氮元素的质量分数为 ×100%≈17.7%;(5)碳酸氢铵中氮元素的质量分数小于24.1%,因此该广告是虚假的,原因是该化肥中含氮量不可能高于纯碳酸氢铵中氮元素的质量分数;每袋化肥中氮元素的质量为50kg×17.72%=8.86kg;(6)若要达到同样的施肥效果即氮元素的质量相同,设需要尿素的质量为x,15.8kg× ×100%=x× ×100%,解得:x=6.0kg,则需要买6.0kg尿素与原15.8kg碳酸氢铵所含氮元素质量相等。
【分析】根据化学式的有关计算进行解答。
(1)化学式可以反映出物质的组成元素的种类;
(2)化学式可以反映出一个该物质分子含有的原子个数;
(3)可以根据化学式判断物质的种类;
(4)根据化学式可以求出物质的相对分子质量,相对分子质量等于各原子个数与相对原子质量乘积的和;
(5)根据化学式可以求出物质中各元素的质量比,各元素质量比等于原子个数与相对原子质量乘积的比;
(6)根据化学式可以求出物质中某元素的质量分数,某元素的质量分数等于该元素原子个数与相对原子质量乘积与分子的相对分子质量之比。
2.【答案】解:设需要氯化钠的质量为x
答:需要氯化钠的质量为5.85t。
【解析】【分析】先设未知数,正确写出题目中的化学方程式;再找准有关物质,已知量是碳酸氢钠的质量,未知量是氯化钠的质量;列比例式计算。
3.【答案】65%
【解析】【解答】设:20g这种含杂质的锌片中锌的质量是x。
Zn+ H2SO4═ZnSO4+H2↑
65 98
x 98g×20%
x=13g;
则这种含杂质的锌片中金属锌的质量分数是 。
答:这种含杂质的锌片中金属锌的质量分数是65%。
【分析】根据硫酸的溶质质量和溶质质量分数计算溶质质量,利用溶质的质量结合反应的方程式计算锌的质量,进而计算锌的质量分数
4.【答案】(1)22
(2)50%
【解析】【解答】(1)由题意可知,反应后生产二氧化碳的质量为:100g+219g-297g═22g;(2)设参加反应的碳酸钙的质量为x;
CaCO3 +2HCl=CaCl2+H2O+ CO2↑
100 44
x 22g
x=50g,则大理石中碳酸钙的质量分数为 ×100%=50%;
答:(1)反应产生的二氧化碳的质量为22g,(2)大理石中碳酸钙的质量分数约为50%。
【分析】(1)根据质量守恒定律,计算生成二氧化碳的质量。
(2)根据二氧化碳的质量,利用碳酸钙与稀盐酸反应的方程式即可计算碳酸钙的质量。
5.【答案】(1)60
(2)6:1
(3)12
【解析】【解答】(1)醋酸的相对分子质量为: 。
(2)醋酸中碳、氢两种元素的质量比 。
(3)含4.8g碳元素的醋酸质量为: ,故填12。
【分析】(1)相对分子质量等于元素的相对原子质量与原子个数的乘积之和。
(2)在化学式中,元素的质量比等于元素的相对原子质量与原子个数的乘积之比。
(3)物质中元素的质量=物质的质量×化学式中该元素的质量分数。
6.【答案】(1)
(2)
【解析】【解答】(1)反应生成氯化钠质量为100g×5.85%=5.85g,消耗稀盐酸质量为50g
设所用稀盐酸的溶质质量分数为x
NaOH+ HCl= NaCl+ H2O
36.5 58.5
50gx 5.85g
36.5:58.5=50gx:5.85g
x=7.3%
(2)设原氢氧化钠溶液中溶质质量分数为y
NaOH+ HCl= NaCl+ H2O
40 58.5
50gy 5.85g
40:58.5=50gy:5.85g
y=8%
【分析】(1)根据反应后溶液质量及溶质质量分数计算出生成氯化钠质量,由氯化钠质量及方程式中氯化钠和氯化氢质量关系,计算氯化氢质量及盐酸中溶质质量分数分析;
(2)根据氯化钠质量及方程式中氯化钠和氢氧化钠质量关系,计算氢氧化钠质量,由此计算氢氧化钠质量分数分析。
7.【答案】解:设需要过氧化钠的质量为x
x=78g
答:需要过氧化钠的为78g。
【解析】【分析】根据生成氧气的质量代入方程式中,利用方程式中物质间质量关系计算过氧化钠质量分析。
8.【答案】(1)1:4
(2)解:设该纯碱样品中Na2CO3的质量为x,
该纯碱样品中Na2CO3的质量分数:
答:该纯碱样品中Na2CO3的质量分数为53%
【解析】【解答】(1) H2SO4 由硫酸分子构成,1个硫酸分子由1个硫原子、2个氢原子和4个氧原子构成,故H2SO4 中硫、氧原子的个数比是1:4.
【分析】 (1)根据硫酸由硫酸分子构成,1个硫酸分子由个1个硫原子、2个氢原子和4个氧原子构成来解答;
(2)根据碳酸钠与硫酸反应的变化图示分析得出二氧化碳的质量,再根据二氧化碳的质量和式量以及碳酸钠的式量来计算出20g碳酸钠样品中的碳酸钠的质量来解答。
9.【答案】(1)解:分五次加入盐酸后,前两次,每次都增加1.1g二氧化碳,第四、五都生成4.4g二氧化碳,说明第三次没有完全反应,也增加1.1g,所以m值是3.3
答:m值是3.3
(2)解:设样品中碳酸钙的质量为x,参加反应氯化氢的质量为y,根据题目中提供的信息可知,碳酸钙与盐酸反应完全时所生成的二氧化碳的质量为4.4g;
CaCO3+ 2HCl═ CaCl2+H2O+ CO2↑
100 73
44
x y
4.4g
,x=10g
,y=7.3g
石灰石样品中碳酸钙的质量分数: 100%=80%
答:石灰石样品中碳酸钙的质量分数为80%
(3)解:所用稀盐酸溶质的质量分数: 100%= 9.125%
答:所用稀盐酸溶质的质量分数为9.125%
【解析】【分析】根据化学方程式计算分析,利用方程式进行计算时,要先写出有关反应方程式,根据方程式量的关系找出相关物质的相对质量比,再从题中找出已知物质的质量,利用相对质量比与实际质量比相等利出比例式求解,注意溶液之间的反应,参加反应的物质为溶液中的溶质,代入方程式中的质量必须是参加反应或生成的纯净物的质量。
10.【答案】(1)4.4
(2)设石灰石样品中碳酸钙的质量为x,则:
x=10g
石灰石样品中碳酸钙的质量分数为
答:石灰石样品中碳酸钙的质量分数为50.0%
(3)10g碳酸钙中碳元素的质量为:
石灰石样品中碳元素的质量分数为:。
答:石灰石样品中碳元素的质量分数为6.0%。
【解析】【解答】(1)由表格中的数据可知,第1次加入50g盐酸与石灰石样品反应可产生1.76g二氧化碳,第2次50g盐酸与石灰石样品反应可产生3.52g二氧化碳,3.52g-1.76g=1.76g;说明每次加入50g盐酸与石灰石样品反应可产生1.76g二氧化碳,第3次加入盐酸后,应产生1.76g×3=5.28g二氧化碳,实际产生4.4g,故第3次反应中的碳酸钙已消耗完,所以第四次反应生成的气体质量与第三次的一样多,即m=4.4。
【分析】(1)根据表格中的数据可知,每次加入50g盐酸与石灰石样品反应可产生1.76g二氧化碳,第3次加入盐酸后,实际产生4.4g二氧化碳分析。
(2) 先设未知数,正确写出碳酸钙与盐酸反应的化学方程式;再找准有关物质,已知量是生成二氧化碳的质量,未知量是常见反应碳酸钙的质量;列比例式计算。
(3)物质中元素的质量=物质的质量×化学式中该元素的质量分数。
石灰石样品中碳元素的质量分数=。
11.【答案】(1)8.0/8
(2)解:设该品牌食用碱中碳酸钠的质量分数为x
x=84.8%
答:该品牌食用碱中碳酸钠的质量分数为84.8%
【解析】【解答】(1)由质量守恒定律可知,反应生成沉淀的总质量为10.0g+90.0g+100.0g-192.0g=8.0g、
【分析】(1)根据反应后溶液减少质量即为生成沉淀质量分析;
(2)根据反应生成碳酸钙质量及方程式中物质间质量关系计算碳酸钠质量,由此计算食用碱中碳酸钠质量分数分析。
12.【答案】(1)16.8 g
(2)解:设稀硫酸中溶质的质量分数为x。
CuO+ H2SO4=CuSO4+H2O
80 98
16g 49 g×x
x=40%
答:稀H2SO4中溶质的质量分数是40%。
【解析】【分析】(1)铜不与硫酸反应,加入硫酸后剩余固体为铜,由此确定出氧化铜和铜单质的质量,再由化学式中元素元素质量为物质质量×元素质量分数计算出氧化铜中铜元素质量,混合物中铜元素为氧化铜中铜元素与铜单质和;
(2)根据氧化铜的质量代入方程式,利用方程式中物质间的质量关系计算硫酸的质量分析。
13.【答案】(1)4.4
(2)解:设碳酸钙质量为x
答:珍珠粉中碳酸钙的质量分数为80%。
【解析】【解答】(1)碳酸钙高温煅烧生成氧化钙和二氧化碳气体,固体减少质量就是生成二氧化碳气体的质量12.5g-8.1g=4.4g
【分析】(1)根据反应后固体减少质量为生成二氧化碳质量分析;
(2)根据生成二氧化碳质量代入方程式中,利用方程式中物质间质量关系计算碳酸钙质量分析。
14.【答案】(1)2.2
(2)解:设19.1g小苏打样品中原有碳酸氢钠的质量为x,恰好完全反应,生成氯化钠的质量为y。
解得:x=16.8g;y=11.7g
溶质的质量分数为:=5%
答:恰好完全反应时,锥形瓶中溶液的溶质质量分数是5%。
【解析】【解答】(1)依据质量守恒定律,分析表中数据可知,产生二氧化碳的质量是19.1g+189.7g+20g-226.5g=2.2g;
(2)由表格可知,2.2g二氧化碳需要盐酸20g,4.4g二氧化碳需要盐酸40g,6.6g二氧化碳需要盐酸60g,则8.8g二氧化碳需要盐酸80g,所以恰好反应需要盐酸80克,利用8.8g二氧化碳计算恰好完全反应时生成的氯化钠的质量,同时计算出样品中碳酸氢钠的质量,恰好反应后,溶液中的溶质是氯化钠,而氯化钠来自两部分:小苏打中含有的和反应新生成的,则溶质的质量分数为两部分氯化钠的质量除以溶液的质量,过程见答案。
【分析】(1)根据质量守恒定律,分析表中数据,产生二氧化碳的质量=反应前总质量-反应后溶液的质量。
(2)先设未知数,正确写出碳酸氢钠与盐酸反应的化学方程式;再找准有关物质,已知量是二氧化碳的质量,未知量是碳酸氢钠,生成氯化钠的质量;列比例式计算。
15.【答案】(1)不能
(2)21.2%
【解析】【解答】(1)题目中不知道氢氧化钙溶液的质量,氢氧化钙过量,也无法计算氢氧化钙的质量,所以不能计算Ca(OH)2溶液的溶质质量分数。(2)设固体混合物中Na2CO3的质量为x
固体混合物中Na2CO3的质量分数为
【分析】
16.【答案】(1)T5;氧气;0.8
(2)x=43.2g
(3)
17.【答案】(1)Na+、H+、SO42-(2)0.8(3)稀H2SO4的溶质质量分数是9.8%;(4)恰好完全反应时所得溶液的溶质质量分数是5.5%。
18.【答案】(1)33.5%
(2)解:参加反应氢氧化钠的质量为
设与氢氧化钠反应的稀盐酸的质量为x
答:实验过程中稀盐酸与NaOH反应所用的质量
(3)通过图像计算,生成2.2g二氧化碳消耗盐酸的质量应为22.3g,则对应与氢氧化钠反应的盐酸的质量为75g-22.3g=52.7g,与计算所得稀盐酸与NaOH反应所用的质量58.4g不相符。
19.【答案】(1)不再有沉淀产生
(2)23.3
(3)C
(4)解:设100g样品中所含硫酸的质量为x,
则样品中所含硫酸的质量分数为
答:该车间排放的废水中所含硫酸的质量分数为9.8%。
【解析】【解答】(1)硫酸能与氯化钡反应生成硫酸钡沉淀和盐酸,则若沉淀不再增加,则说明硫酸已完全反应;
(2)由图可知,生成的硫酸钡的质量为23.3g;
(3)A、氢氧化钠价格较高,且具有很强的腐蚀性,不适用于处理废水,不符合题意;
B、氧化铜能与硫酸反应生成硫酸铜和水,硫酸铜会污染环境,不适用于处理废水,不符合题意;
C、熟石灰为氢氧化钙的俗称,能与硫酸反应生成硫酸钙和水,且价格较低,能用于处理废水,符合题意;
D、食盐为氯化钠的俗称,不能与硫酸反应,则不能用于处理硫酸废水,不符合题意。
故答案为:C。
【分析】(1)硫酸能与氯化钡反应生成硫酸钡沉淀和盐酸;
(2)由图明显可以得到生成的硫酸钡的质量为23.3g;
(3)熟石灰能与硫酸反应生成硫酸钙和水,且价格较低,能用于处理废水;
(4)根据化学方程式计算可得硫酸的质量,硫酸质量除以溶液总质量得到废水中所含硫酸的质量分数
20.【答案】(1)混合物
(2)1:4
(3)62.5%
(4)0.5g
【解析】【解答】(1)根据说明书,每片钙片中含有碳酸钙、维生素D等物质,属于混合物;
(2) 碳酸钙中碳、氧三种元素的质量比为12∶(16×3)=1:4;
(3)每片含碳酸钙1.25克,每片钙片中碳酸钙的质量分数为=62.5%;
(4)儿童一次半片,一日1-2次,每天最多吃一片,一片钙片中钙元素的质量为:=0.5g。
【分析】(1)混合物由多种物质组成,纯净物由一种物质组成;
(2)(3)(4)根据化学式和质量分数的相关计算分析。
21.【答案】(1)9.6
(2)19.3
(3)解:设混合物中氯酸钾的质量为x,
答:混合物中氯酸钾的质量24.5g;
(4)
22.【答案】(1)由质量守恒定律,生成二氧化碳的质量为:20g+6g+26.2g-50g=2.2g;
(2)设Na2CO3的质量为x,生成的NaCl的质量为y
x=5.3g ,y=5.85g
反应溶液中氯化钠的质量为:5.85g+(6g-5.3g)=6.55g
反应后所得溶液中溶质的质量分数是
答:(1)生成二氧化碳的质量是2.2g;
(2)反应后所得溶液中溶质的质量分数是13.1%。
23.【答案】(1) 2.2
(2) 解:设该样品中Na2CO3的质量为x
x=5.3g
答:该样品中碳酸钠的质量为5.3g
(3) 则样品中NaOH质量分数为:
答:该样品中NaOH的质量分数为75.0%
(4) 解:设变质的氢氧化钠的质量为y
y=4g
则氢氧化钠的变质程度是:
答:氢氧化钠的变质程度是20.1%
(5) 氢氧化钠
(6) 相同
24.【答案】(1)7:31
(2)非氟酸法更安全
(3)设:理论上可以得到x kg PF5,
6P2O5 + 5CaF2 2PF5↑ +5Ca(PO5)2
852 252
14.2kg x
=
x=4.2 kg
答:理论上可以得到kgPF,质量为4.2kg
(4)95.7
【解析】【解答】(1)LiPF6中锂元素和磷元素质量比=7:31;
(2)氢氟酸具有腐蚀性和毒性,“非氢氟酸法”与传统方法相比,具有的优点是非氟酸法更安全;
(3)设:理论上可以得到x kg PF5, 将14.2kg P2O5 代入化学方程式,列比例式,可得x=4.2 kg 即PF5质量为4.2kg ;
(4)设:在t1 时,已经消耗了质量为y。
根据图示可知,在时,生成的的质量115.5g。则有:
PF5 +LiF LiPF6
126 152
y 115.5kg
y=95.7kg。
答:在t1时 ,已经消耗了质量为95.7kg。
【分析】(1)锂元素和磷元素质量比的计算分析;
(2)根据氢氟酸的性质分析;
(3)(4)根据质量守恒定律和化学方程式的计算方法分析。
25.【答案】(1)4.4
(2)设参加反应的碳酸钙的质量为x。
则该石灰石样品中碳酸钙的质量分数为。
(3)
26.【答案】(1)8:1
(2)14.7%
解:设与氧化铜反应的硫酸的质量是x,与氢氧化钠反应的硫酸的质量是y,则有
实验所用稀硫酸中溶质的质量分数为×100%=14.7%;
答:实验所用稀硫酸中溶质的质量分数为14.7%;
(3)30;8.1
27.【答案】(1)相同
(2)5.74g
(3)设该生理盐水中氯化钠的质量为x,x=2.34g该生理盐水的溶质质量分数=
(4)A;B
【解析】【解答】(1)取260g该生理盐水样品于烧杯内,向其中加入80g硝酸银溶液,恰好完全反应,生成氯化银沉淀和硝酸钠,烧杯中阳离子为钠离子。如果260g该生理盐水,向其中加入40g硝酸银溶液,生理盐水有剩余,溶液是硝酸钠和氯化钠的混合物,但阳离子都是钠离子,故烧杯中阳离子的种类不变,故填:相同;
(2)根据质量守恒定律,生成沉淀的质量=260 g+80 g-334.26g=5.74g;
(4)A、用托盘天平称量氯化钠时,将砝码和氯化钠放颠倒了,则氯化钠的实际质量等于砝码质量-游码示数,导致称量的氯化钠的质量偏小,由溶质质量分数的计算公式可知,所配制的溶液的质量分数变小了,故A选项符合题意;
B、用量筒量取蒸馏水时,仰视读数,读数小于实际数,所量取水多了,由溶质质量分数的计算公式可知,所配制的溶液的质量分数变小了,故B选项符合题意;
C、将量筒中的水倒入烧杯时,有水洒出,导致溶液中的水的质量偏小,由溶质质量分数的计算公式可知,所配制的溶液的质量分数变大了,故C选项不符合题意;
D、在转移配好的氯化钠溶液时,洒出部分溶液,由于溶液具有均一性,对所配溶液的溶质质量分数无影响,故D选项不符合题意。
故答案为:AB。
【分析】(1)向其中加入80g硝酸银溶液,恰好完全反应;
(2)根据质量守恒定律,结合反应前后各物质的质量可得反应后生成沉淀的质量;
(3) 根据化学方程式得到氯化钠的质量,氯化钠的质量除以溶液的质量等于溶质质量分数;
(4) 所配溶液的溶质质量分数偏小 ,要么溶质质量偏小,要么溶剂质量偏大。
28.【答案】(1)14;61.1%
(2)解:设所用稀硫酸的溶质质量分数为x
x≈8.2%
答:所用稀硫酸的溶质质量分数是8.2%
(3)
【解析】【解答】(1)由表中数据可知,第1次加入稀硫酸,消耗固体的质量为:18g-16g=2g,第3次加入稀硫酸,消耗固体的总质量为:18g-12g=6g,说明每加入30g稀硫酸,消耗固体的质量为2g,故第2次加入稀硫酸,剩余固体的质量为:18g-4g=14g,则a的值为14。
混合物中最终剩余的11g固体即为铜的质量,则混合物中铜的质量分数为。
(3)由表可知,加入30g稀硫酸,消耗固体的质量为2g,剩余固体16g,设氧化铜恰好完全反应时,加入稀硫酸的质量为y,,y=105g,即加入稀硫酸的质量为105g时,剩余固体的质量为11g,之后,继续加入稀硫酸,剩余固体的质量不变,在图中表示为:
。
【分析】(1)根据表中数据可知每加入30g稀硫酸,消耗固体的质量为2g,以及混合物中的铜不与稀硫酸反应进行分析;
(2)先设未知数,正确写出化学方程式,再找准有关物质,已知量是第1次加稀硫酸参加反应的氧化铜的质量,未知量是稀硫酸的溶质质量分数,列比例式计算,最后简明写出答案;
(3)根据参加反应的氧化铜的质量与反应消耗的稀硫酸的质量成正比,确定氧化铜恰好完全反应时所需的稀硫酸的质量进行分析。
29.【答案】(1)铝片表面有一层致密的氧化铝薄膜,稀硫酸与氧化铝反应生成硫酸铝和水,不生成气体,压强几乎不变
(2)解:由图像可知,与氧化铝反应消耗的稀硫酸的质量为10g;
设与稀硫酸反应的氧化铝的质量为x
=
x=0.34 g
答:氧化铝的质量为0.34 g。
(3)
(4)77.1%
30.【答案】(1) 2.2
(2) 解:设该样品中Na2CO3的质量为x
x=5.3g
答:该样品中碳酸钠的质量为5.3g
(3) 则样品中NaOH质量分数为:
答:该样品中NaOH的质量分数为75.0%
(4) 解:设变质的氢氧化钠的质量为y
y=4g
则氢氧化钠的变质程度是:
答:氢氧化钠的变质程度是20.1%
(5) 氢氧化钠
(6) 相同
1.某生产化肥碳酸氢铵(NH4HCO3)的企业,做了一个大型的广告(如图),该化肥主要成分是碳酸氢铵所含杂质不含氮元素,计算
(1)碳酸氢铵的相对分子质量是
(2)碳酸氢铵中各原子的个数比
(3)氮、氢、碳、氧四种元素的质量比
(4)碳酸氢铵中氮元素的质量分数为 (结果精确到0.1%)
(5)通过上述计算判断该广告属于 (填“虚假”或“真实”广告);每袋化肥中最多含氮元素 kg
(6)15.8kg的碳酸氢铵和 kgCO(NH2)2所含氮元素质量相等。
2.侯德榜是我国著名的化学家,发明了侯氏制碱法,其反应原理如下: 。请计算:若要生产 NaHCO38.4t,则理论上需要氯化钠的质量。
3.某同学利用废旧1号电池拆下的锌片制取氢气,他取20g这种含杂质的锌片,放入98g溶质的质量分数为20%的稀硫酸中,恰好完全反应(杂质不反应)。求这种含杂质的锌片中金属锌的含量是
4.小明同学为测定某大理石中碳酸钙的质量分数,他在烧杯中放入100g大理石和219g稀盐酸,恰好完全反应(大理石的主要成分为碳酸钙,其他杂质不与盐酸反应),最后烧杯中剩余物的质量为297克。请计算:
(1)反应产生的二氧化碳的质量为 g;
(2)求大理石中碳酸钙的质量分数 。
5.食醋中含有醋酸,醋酸的化学式为 ,计算
(1)醋酸的相对分子质量
(2)醋酸中碳、氢两种元素的质量比 (写最简整数比)
(3) g醋酸中含有碳元素的质量为
6.实验室用稀盐酸中和氢氧化钠溶液,当溶液时,测得生成的溶液的总质量为,溶质质量分数为,试求
(1)所用稀盐酸中溶质的质量分数为多少?
(2)原氢氧化钠溶液中溶质的质量分数为多少?
7.“蛟龙号”是我国研制的深海载人潜水器。潜水器的供氧装置中发生的反应为2Na2O2+2CO2=2Na2CO3+O2。计算:用这种方法制取16g氧气,需要过氧化钠的质量。
8.为测定某纯碱样品中Na2CO3的质量分数,取20g该样品于烧杯中,滴加稀硫酸至不再产生气泡为止,加入稀硫酸的质量与产生气体的质量关系如图所示。(反应的化学方程式为:;杂质不参加反应)
(1)H2SO4中硫、氧原子个数比是 。
(2)列式计算该纯碱样品中Na2CO3的质量分数。
9.小红同学取某地石灰石样品12.5g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
第1次 第2次 第3次 第4次 第5次
加入稀盐酸的质量/g 20 20 20 20 20
生成气体的总质量/g 1.1 2.2 m 4.4 4.4
请计算:
(1)m的值;
(2)石灰石样品中碳酸钙的质量分数;
(3)所用稀盐酸溶质的质量分数是多少?(要求写出计算过程)
10.为了测定某地区石灰石中碳酸钙的质量分数,现有20g石灰石样品,并取稀盐酸200g,将稀盐酸平均分成4份,进行如下实验:(计算结果保留至0.1%)
实验 1 2 3 4
加入盐酸的质量(g) 50 50 50 50
生成CO2的质量(g) 1.76 3.52 4.4 m
(1)上表中m的数值为 。
(2)计算石灰石样品中碳酸钙的质量分数。
(3)计算石灰石样品中碳元素的质量分数。
11.为了测定某品牌食用碱(主要成分为碳酸钠,含少量氯化钠杂质)中碳酸钠的质量分数。化学兴趣小组的同学将10.0g食用碱样品加到盛有90.0g水的烧杯中,完全溶解后,往其中逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表所示:
实验次数 第1次 第2次 第3次 第4次 第5次
加入CaCl2溶液的质量/g 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.0 136.0 154.0 172.0 192.0
请计算:
(1)反应生成沉淀的总质量为 g。
(2)该品牌食用碱中碳酸钠的质量分数。(写出计算过程)
12.某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取20 g该固体混合物,向其中逐滴加入稀H2SO4,测得剩余固体的质量与加入稀H2SO4的质量关系如图所示。回答下列问题:
(1)该固体混合物中铜元素的质量为 ;
(2)计算稀H2SO4中溶质的质量分数(写出计算过程)。
13.小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 第1次 第2次 第3次 第4次
剩余固体质量(g) 10.8 9.6 8.1 8.1
试计算:
(1)完全反应后生成二氧化碳的质量是 g
(2)求珍珠粉中碳酸钙的质量分数.
14.小苏打(NaHCO3)是发酵粉的主要成分。化学兴趣小组为探究某品牌小苏打样品(含NaCl杂质)中碳酸氢钠的含量设计了如图1所示的实验。
反应过程中锥形瓶中溶液质量的变化如表所示。(忽略CO2在水中的溶解)。
稀盐酸质量/g 20 40 60 100
锥形瓶中溶液质量/g 226.6 244.4 262.2 300
(1)当加入20g稀盐酸时,产生二氧化碳的质量是 g。
(2)当锥形瓶内样品溶液中的碳酸氢钠与加入的稀盐酸恰好完全反应时,锥形瓶中溶液的溶质质量分数是多少?(写出具体解答过程)
15.化学兴趣小组按下图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息 (填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
16.草酸亚铁晶体(FeC2O4·2H2O,相对分子质量是180)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料。称取54.0g草酸亚铁晶体(FeC2O4·2H2O)用热重法对其进行加热使之分解,得到剩余固体的质量随温度变化的曲线如图1所示,请分析该图回答下列问题:
(1)加热至 ℃时,Fe2O3开始分解,生成一种能使带火星的木条复燃的气体,该气体为 ;Fe2O3完全分解时产生该气体的质量为 g。
(2)根据草酸亚铁晶体受热分解的化学方程式: ,计算图1中x的值(写出计算过程)。
(3)请在图2中画出产生(1)中气体的质量随温度变化的关系。
17.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。_____
(4)计算恰好完全反应时所得溶液的溶质质量分数。_____
18.某学习小组对实验室久置的NaOH的变质程度进行探究。先称取15.8g的NaOH样品,配成溶液,然后向溶液中逐滴加入质量分数为16.4%的稀盐酸,实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示:
(1)该样品中Na2CO3的质量分数是 (精确到0.1%)。
(2)实验过程中稀盐酸与NaOH反应所用的质量(精确到0.1)。
(3)根据“稀盐酸与NaOH反应所用的质量”,对照图像,你发现了什么问题?
19.为强化对水资源的保护,我省各地对主要河流建立了市级河长制。某研究实践小组在一次环保调查中,对一硫酸厂生产车间排放的废水进行了检测。取澄清废水样品100g,逐滴加入氯化钡溶液,生成沉淀与加入氯化钡溶液的质量关系如下图所示。(杂质不参与反应)
(1)判定废水中所含硫酸已完全反应的方法是 。
(2)实验过程中生成硫酸钡的质量是 g。
(3)该车间产生的废水需经过处理才能向外排放,从经济和处理效果分析,下列物质中,最适合用于废水处理的是____(填序号)。
A.氢氧化钠 B.氧化铜 C.熟石灰 D.食盐
(4)该车间排放的废水中所含硫酸的质量分数是多少?(写出计算过程)
20.钙是身体内重要的常量元素,对身体的发育起到非常重要的作用。右图是某钙片的部分说明书,请分析:
主要成分:每片含碳酸钙1.25克,维生素D3200国际单位。 规格:2克/片 用法用量:口服,咀嚼后咽下。成人,一次1片,一日1-2次;儿童一次半片,一日1-2次。
(1)该钙片属于 (填“纯净物”或“混合物”)。
(2)碳酸钙中碳、氧元素的质量比为 。
(3)每片钙片中碳酸钙的质量分数为 。
(4)缺钙或补钙过多,都会对孩子的身体产生重大的影响。若按照儿童用量服用该钙片,每天最多摄入钙元素的质量为 。
21.某校兴趣小组取一定量的氯酸钾和二氧化锰的混合物放入大试管中加热。剩余固体质量与时间的变化如下表所示:
时间/min t0 t1 t2 t3 t4 t5 T6
剩余固体质量/g 26.5 26.5 24.1 21.7 m 16.9 16.9
(1)从反应开始到t6时,产生氧气的总质量是 g。
(2)其中m= 。
(3)求混合物中氯酸钾的质量(写出计算过程)。
(4)请在下图中画出产生O2的曲线。
22.某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品6 g放入20 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,反应后溶液的总质量为50 g。试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)反应后所得溶液中溶质的质量分数。
23.某校学习小组同学探究实验室中久置的NaOH的变质程度。
【实验过程】先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,逐滴加入一定质量分数的稀硫酸至过量,根据生成CO2质量算出Na2CO3的质量,从而确定样品中NaOH的质量分数及变质程度。
【数据处理】
(1)由图得知:产生CO2的最大量为________g。
写出以下计算过程:
(2)该样品中Na2CO3的质量为多少?
(3)该样品中NaOH的质量分数为多少?
(4)NaOH的变质程度________(用质量分数表示,数据精确到0.1%)。
【反思交流】
(5)从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入强酸,首先反应的物质是________;
(6)根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比较,反应时所消耗强酸的量________(填“无法确定”或“相同”或“不相同”)。
24.利用萤石[主要成分氟化钙(CaF2)]来合成含氟化学品,一直以来是化学工业研究的重点项目下列是合成六氟磷酸锂(LiPF6)的几种方法。据此回答下列问题:(相对分子质量:P2O5-142,PF5-126,LiPF6-152)
(1)LiPF6中锂元素和磷元素质量比为 .
(2)氢氟酸具有腐蚀性和毒性,“非氢氟酸法”与传统方法相比,具有的优点是 .
(3)“非氯法”的第一步反应为6P2O5+5CaF2 2PF5↑+5Ca(PO5)2,现有14.2kg P2O5,不计损耗,理论上可以得到多少kg PF5?(写出计算过程)
(4)“非氯法”第二步反应为:PF5+LiF LiPF6中用126 kg PF5制取LiPF6,生成LiPF6的质量与时间的关系如图2所示,则在t1时,已经消耗了 kg PF5(结果精确至 0.1)。
25.为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸(杂质不与盐酸反应,也不溶于水),实验测得的数据如图甲所示。
(1)该样品完全反应,生成二氧化碳的质量是 g。
(2)已知石灰石中碳酸钙的质量分数为 ,求该石灰石样品中碳酸钙的质量分数。(写出计算过程)
(3)随着稀盐酸的加入,请在图乙中画出溶液中钙元素的质量变化示意图。
26.为探究铜及其化合物的性质,进行如下实验:称取已部分被H2还原的氧化铜粉末(含Cu和CuO)7.2g置于烧杯中,向其中加入50g稀硫酸,充分反应后,再向烧杯中加入溶质质量分数为20%的NaOH溶液,加NaOH溶液的过程中,烧杯内固体物质的质量与加入NaOH溶液的质量关系如图所示。
请计算:
(1)Cu和CuO的混合物中,Cu元素和O元素的质量比为______(化为最简整数比)。
(2)实验所用稀硫酸中硫酸溶质的质量分数。(写出计算过程)
(3)拐点a的横坐标数值为______。纵坐标数值为______。
27.生理盐水是医疗上常用的一种溶液,某化学兴趣小组为了测定某生理盐水的溶质质量分数,取260g该生理盐水样品于烧杯内,向其中加入80g硝酸银溶液,恰好完全反应,过滤,称得滤液的质量为334.26g。
(1)当加入硝酸银溶液的质量分别为40g和80g时,烧杯中阳离子的种类 (选填“相同”或“不同”)。
(2)反应后生成沉淀的质量为 g。
(3)计算该生理盐水的溶质质量分数 。(写出计算过程)
(4)现需配制500g该生理盐水,下列操作失误会引起所配溶液的溶质质量分数偏小的是____(填字母)。
A.用托盘天平称量氯化钠时,将砝码放左盘,氯化钠放右盘(1g以下使用游码)
B.用量筒量取蒸馏水,读数时仰视量筒内液体凹液面最低处
C.将量筒中的水倒入烧杯时,有少量水洒出
D.将配好的氯化钠溶液转移到细口瓶中时,不慎洒出部分溶液
28.化学课上,老师拿来一包氧化铜和铜的固体混合物,兴趣小组的同学取18g该混合物于烧杯中,将一定质量分数的稀硫酸分5次加入到烧杯中,充分反应,记录相关数据如下表所示:
实验次数 第1次 第2次 第3次 第4次 第5次
加入稀硫酸的质量/g 30 60 90 120 150
剩余固体的质量/g 16 a 12 11 11
计算:
(1)表中a的值为 。混合物中铜的质量分数为 。
(2)所用稀硫酸的溶质质量分数是多少?(写出计算过程,结果精确到0.1%)
(3)在坐标中画出加入稀硫酸的质量与剩余固体质量的相应曲线关系,标注必要的数据。
29.某化学兴趣小组的同学利用压强传感器、数据采集器和计算机等数字化实验设备,测定铝片与足量浓度为9.8%的稀硫酸反应时气体压强的变化,实验结果如图所示:
(1)开始一段时间气体压强不变,其原因是 。
(2)计算该铝片中氧化铝的质量。
(3)在图中画出加入40 g稀硫酸与铝片反应产生气体的质量的关系图。
(4)该铝片中铝元素的质量分数为 。(得数保留0.1%)
30.某校学习小组同学探究实验室中久置的NaOH的变质程度。
【实验过程】先称取21.2g 的NaOH样品(杂质为Na2CO3),配成溶液,逐滴加入一定质量分数的稀硫酸至过量,根据生成CO2质量算出Na2CO3的质量,从而确定样品中NaOH的质量分数及变质程度。
【数据处理】
(1)由图得知:产生CO2的最大量为________g。
写出以下计算过程:
(2)该样品中Na2CO3的质量为多少?
(3)该样品中NaOH的质量分数为多少?
(4)NaOH的变质程度________(用质量分数表示,数据精确到0.1%)。
【反思交流】
(5)从图中0~A点说明:在NaOH 与Na2CO3的混合溶液中,加入强酸,首先反应的物质是________;
(6)根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比较,反应时所消耗强酸的量________(填“无法确定”或“相同”或“不相同”)。
答案解析部分
1.【答案】(1)79
(2)1:5:1:3
(3)14:5:12:48
(4)17.7%
(5)虚假;8.86
(6)6.0
【解析】【解答】(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,碳酸氢铵的相对分子质量为14+1×4+1+12+16×3=79;(2)1个碳酸氢铵分子是由1个氮原子、5个氢原子、1个碳原子和3个氧原子构成的,则碳酸氢铵中氮、氢、碳、氧四种原子的个数比为1:5:1:3;(3)碳酸氢铵中氮、氢、碳、氧元素质量比为14:(1×5):12:(16×3)=14:5:12:48;(4)碳酸氢铵中氮元素的质量分数为 ×100%≈17.7%;(5)碳酸氢铵中氮元素的质量分数小于24.1%,因此该广告是虚假的,原因是该化肥中含氮量不可能高于纯碳酸氢铵中氮元素的质量分数;每袋化肥中氮元素的质量为50kg×17.72%=8.86kg;(6)若要达到同样的施肥效果即氮元素的质量相同,设需要尿素的质量为x,15.8kg× ×100%=x× ×100%,解得:x=6.0kg,则需要买6.0kg尿素与原15.8kg碳酸氢铵所含氮元素质量相等。
【分析】根据化学式的有关计算进行解答。
(1)化学式可以反映出物质的组成元素的种类;
(2)化学式可以反映出一个该物质分子含有的原子个数;
(3)可以根据化学式判断物质的种类;
(4)根据化学式可以求出物质的相对分子质量,相对分子质量等于各原子个数与相对原子质量乘积的和;
(5)根据化学式可以求出物质中各元素的质量比,各元素质量比等于原子个数与相对原子质量乘积的比;
(6)根据化学式可以求出物质中某元素的质量分数,某元素的质量分数等于该元素原子个数与相对原子质量乘积与分子的相对分子质量之比。
2.【答案】解:设需要氯化钠的质量为x
答:需要氯化钠的质量为5.85t。
【解析】【分析】先设未知数,正确写出题目中的化学方程式;再找准有关物质,已知量是碳酸氢钠的质量,未知量是氯化钠的质量;列比例式计算。
3.【答案】65%
【解析】【解答】设:20g这种含杂质的锌片中锌的质量是x。
Zn+ H2SO4═ZnSO4+H2↑
65 98
x 98g×20%
x=13g;
则这种含杂质的锌片中金属锌的质量分数是 。
答:这种含杂质的锌片中金属锌的质量分数是65%。
【分析】根据硫酸的溶质质量和溶质质量分数计算溶质质量,利用溶质的质量结合反应的方程式计算锌的质量,进而计算锌的质量分数
4.【答案】(1)22
(2)50%
【解析】【解答】(1)由题意可知,反应后生产二氧化碳的质量为:100g+219g-297g═22g;(2)设参加反应的碳酸钙的质量为x;
CaCO3 +2HCl=CaCl2+H2O+ CO2↑
100 44
x 22g
x=50g,则大理石中碳酸钙的质量分数为 ×100%=50%;
答:(1)反应产生的二氧化碳的质量为22g,(2)大理石中碳酸钙的质量分数约为50%。
【分析】(1)根据质量守恒定律,计算生成二氧化碳的质量。
(2)根据二氧化碳的质量,利用碳酸钙与稀盐酸反应的方程式即可计算碳酸钙的质量。
5.【答案】(1)60
(2)6:1
(3)12
【解析】【解答】(1)醋酸的相对分子质量为: 。
(2)醋酸中碳、氢两种元素的质量比 。
(3)含4.8g碳元素的醋酸质量为: ,故填12。
【分析】(1)相对分子质量等于元素的相对原子质量与原子个数的乘积之和。
(2)在化学式中,元素的质量比等于元素的相对原子质量与原子个数的乘积之比。
(3)物质中元素的质量=物质的质量×化学式中该元素的质量分数。
6.【答案】(1)
(2)
【解析】【解答】(1)反应生成氯化钠质量为100g×5.85%=5.85g,消耗稀盐酸质量为50g
设所用稀盐酸的溶质质量分数为x
NaOH+ HCl= NaCl+ H2O
36.5 58.5
50gx 5.85g
36.5:58.5=50gx:5.85g
x=7.3%
(2)设原氢氧化钠溶液中溶质质量分数为y
NaOH+ HCl= NaCl+ H2O
40 58.5
50gy 5.85g
40:58.5=50gy:5.85g
y=8%
【分析】(1)根据反应后溶液质量及溶质质量分数计算出生成氯化钠质量,由氯化钠质量及方程式中氯化钠和氯化氢质量关系,计算氯化氢质量及盐酸中溶质质量分数分析;
(2)根据氯化钠质量及方程式中氯化钠和氢氧化钠质量关系,计算氢氧化钠质量,由此计算氢氧化钠质量分数分析。
7.【答案】解:设需要过氧化钠的质量为x
x=78g
答:需要过氧化钠的为78g。
【解析】【分析】根据生成氧气的质量代入方程式中,利用方程式中物质间质量关系计算过氧化钠质量分析。
8.【答案】(1)1:4
(2)解:设该纯碱样品中Na2CO3的质量为x,
该纯碱样品中Na2CO3的质量分数:
答:该纯碱样品中Na2CO3的质量分数为53%
【解析】【解答】(1) H2SO4 由硫酸分子构成,1个硫酸分子由1个硫原子、2个氢原子和4个氧原子构成,故H2SO4 中硫、氧原子的个数比是1:4.
【分析】 (1)根据硫酸由硫酸分子构成,1个硫酸分子由个1个硫原子、2个氢原子和4个氧原子构成来解答;
(2)根据碳酸钠与硫酸反应的变化图示分析得出二氧化碳的质量,再根据二氧化碳的质量和式量以及碳酸钠的式量来计算出20g碳酸钠样品中的碳酸钠的质量来解答。
9.【答案】(1)解:分五次加入盐酸后,前两次,每次都增加1.1g二氧化碳,第四、五都生成4.4g二氧化碳,说明第三次没有完全反应,也增加1.1g,所以m值是3.3
答:m值是3.3
(2)解:设样品中碳酸钙的质量为x,参加反应氯化氢的质量为y,根据题目中提供的信息可知,碳酸钙与盐酸反应完全时所生成的二氧化碳的质量为4.4g;
CaCO3+ 2HCl═ CaCl2+H2O+ CO2↑
100 73
44
x y
4.4g
,x=10g
,y=7.3g
石灰石样品中碳酸钙的质量分数: 100%=80%
答:石灰石样品中碳酸钙的质量分数为80%
(3)解:所用稀盐酸溶质的质量分数: 100%= 9.125%
答:所用稀盐酸溶质的质量分数为9.125%
【解析】【分析】根据化学方程式计算分析,利用方程式进行计算时,要先写出有关反应方程式,根据方程式量的关系找出相关物质的相对质量比,再从题中找出已知物质的质量,利用相对质量比与实际质量比相等利出比例式求解,注意溶液之间的反应,参加反应的物质为溶液中的溶质,代入方程式中的质量必须是参加反应或生成的纯净物的质量。
10.【答案】(1)4.4
(2)设石灰石样品中碳酸钙的质量为x,则:
x=10g
石灰石样品中碳酸钙的质量分数为
答:石灰石样品中碳酸钙的质量分数为50.0%
(3)10g碳酸钙中碳元素的质量为:
石灰石样品中碳元素的质量分数为:。
答:石灰石样品中碳元素的质量分数为6.0%。
【解析】【解答】(1)由表格中的数据可知,第1次加入50g盐酸与石灰石样品反应可产生1.76g二氧化碳,第2次50g盐酸与石灰石样品反应可产生3.52g二氧化碳,3.52g-1.76g=1.76g;说明每次加入50g盐酸与石灰石样品反应可产生1.76g二氧化碳,第3次加入盐酸后,应产生1.76g×3=5.28g二氧化碳,实际产生4.4g,故第3次反应中的碳酸钙已消耗完,所以第四次反应生成的气体质量与第三次的一样多,即m=4.4。
【分析】(1)根据表格中的数据可知,每次加入50g盐酸与石灰石样品反应可产生1.76g二氧化碳,第3次加入盐酸后,实际产生4.4g二氧化碳分析。
(2) 先设未知数,正确写出碳酸钙与盐酸反应的化学方程式;再找准有关物质,已知量是生成二氧化碳的质量,未知量是常见反应碳酸钙的质量;列比例式计算。
(3)物质中元素的质量=物质的质量×化学式中该元素的质量分数。
石灰石样品中碳元素的质量分数=。
11.【答案】(1)8.0/8
(2)解:设该品牌食用碱中碳酸钠的质量分数为x
x=84.8%
答:该品牌食用碱中碳酸钠的质量分数为84.8%
【解析】【解答】(1)由质量守恒定律可知,反应生成沉淀的总质量为10.0g+90.0g+100.0g-192.0g=8.0g、
【分析】(1)根据反应后溶液减少质量即为生成沉淀质量分析;
(2)根据反应生成碳酸钙质量及方程式中物质间质量关系计算碳酸钠质量,由此计算食用碱中碳酸钠质量分数分析。
12.【答案】(1)16.8 g
(2)解:设稀硫酸中溶质的质量分数为x。
CuO+ H2SO4=CuSO4+H2O
80 98
16g 49 g×x
x=40%
答:稀H2SO4中溶质的质量分数是40%。
【解析】【分析】(1)铜不与硫酸反应,加入硫酸后剩余固体为铜,由此确定出氧化铜和铜单质的质量,再由化学式中元素元素质量为物质质量×元素质量分数计算出氧化铜中铜元素质量,混合物中铜元素为氧化铜中铜元素与铜单质和;
(2)根据氧化铜的质量代入方程式,利用方程式中物质间的质量关系计算硫酸的质量分析。
13.【答案】(1)4.4
(2)解:设碳酸钙质量为x
答:珍珠粉中碳酸钙的质量分数为80%。
【解析】【解答】(1)碳酸钙高温煅烧生成氧化钙和二氧化碳气体,固体减少质量就是生成二氧化碳气体的质量12.5g-8.1g=4.4g
【分析】(1)根据反应后固体减少质量为生成二氧化碳质量分析;
(2)根据生成二氧化碳质量代入方程式中,利用方程式中物质间质量关系计算碳酸钙质量分析。
14.【答案】(1)2.2
(2)解:设19.1g小苏打样品中原有碳酸氢钠的质量为x,恰好完全反应,生成氯化钠的质量为y。
解得:x=16.8g;y=11.7g
溶质的质量分数为:=5%
答:恰好完全反应时,锥形瓶中溶液的溶质质量分数是5%。
【解析】【解答】(1)依据质量守恒定律,分析表中数据可知,产生二氧化碳的质量是19.1g+189.7g+20g-226.5g=2.2g;
(2)由表格可知,2.2g二氧化碳需要盐酸20g,4.4g二氧化碳需要盐酸40g,6.6g二氧化碳需要盐酸60g,则8.8g二氧化碳需要盐酸80g,所以恰好反应需要盐酸80克,利用8.8g二氧化碳计算恰好完全反应时生成的氯化钠的质量,同时计算出样品中碳酸氢钠的质量,恰好反应后,溶液中的溶质是氯化钠,而氯化钠来自两部分:小苏打中含有的和反应新生成的,则溶质的质量分数为两部分氯化钠的质量除以溶液的质量,过程见答案。
【分析】(1)根据质量守恒定律,分析表中数据,产生二氧化碳的质量=反应前总质量-反应后溶液的质量。
(2)先设未知数,正确写出碳酸氢钠与盐酸反应的化学方程式;再找准有关物质,已知量是二氧化碳的质量,未知量是碳酸氢钠,生成氯化钠的质量;列比例式计算。
15.【答案】(1)不能
(2)21.2%
【解析】【解答】(1)题目中不知道氢氧化钙溶液的质量,氢氧化钙过量,也无法计算氢氧化钙的质量,所以不能计算Ca(OH)2溶液的溶质质量分数。(2)设固体混合物中Na2CO3的质量为x
固体混合物中Na2CO3的质量分数为
【分析】
16.【答案】(1)T5;氧气;0.8
(2)x=43.2g
(3)
17.【答案】(1)Na+、H+、SO42-(2)0.8(3)稀H2SO4的溶质质量分数是9.8%;(4)恰好完全反应时所得溶液的溶质质量分数是5.5%。
18.【答案】(1)33.5%
(2)解:参加反应氢氧化钠的质量为
设与氢氧化钠反应的稀盐酸的质量为x
答:实验过程中稀盐酸与NaOH反应所用的质量
(3)通过图像计算,生成2.2g二氧化碳消耗盐酸的质量应为22.3g,则对应与氢氧化钠反应的盐酸的质量为75g-22.3g=52.7g,与计算所得稀盐酸与NaOH反应所用的质量58.4g不相符。
19.【答案】(1)不再有沉淀产生
(2)23.3
(3)C
(4)解:设100g样品中所含硫酸的质量为x,
则样品中所含硫酸的质量分数为
答:该车间排放的废水中所含硫酸的质量分数为9.8%。
【解析】【解答】(1)硫酸能与氯化钡反应生成硫酸钡沉淀和盐酸,则若沉淀不再增加,则说明硫酸已完全反应;
(2)由图可知,生成的硫酸钡的质量为23.3g;
(3)A、氢氧化钠价格较高,且具有很强的腐蚀性,不适用于处理废水,不符合题意;
B、氧化铜能与硫酸反应生成硫酸铜和水,硫酸铜会污染环境,不适用于处理废水,不符合题意;
C、熟石灰为氢氧化钙的俗称,能与硫酸反应生成硫酸钙和水,且价格较低,能用于处理废水,符合题意;
D、食盐为氯化钠的俗称,不能与硫酸反应,则不能用于处理硫酸废水,不符合题意。
故答案为:C。
【分析】(1)硫酸能与氯化钡反应生成硫酸钡沉淀和盐酸;
(2)由图明显可以得到生成的硫酸钡的质量为23.3g;
(3)熟石灰能与硫酸反应生成硫酸钙和水,且价格较低,能用于处理废水;
(4)根据化学方程式计算可得硫酸的质量,硫酸质量除以溶液总质量得到废水中所含硫酸的质量分数
20.【答案】(1)混合物
(2)1:4
(3)62.5%
(4)0.5g
【解析】【解答】(1)根据说明书,每片钙片中含有碳酸钙、维生素D等物质,属于混合物;
(2) 碳酸钙中碳、氧三种元素的质量比为12∶(16×3)=1:4;
(3)每片含碳酸钙1.25克,每片钙片中碳酸钙的质量分数为=62.5%;
(4)儿童一次半片,一日1-2次,每天最多吃一片,一片钙片中钙元素的质量为:=0.5g。
【分析】(1)混合物由多种物质组成,纯净物由一种物质组成;
(2)(3)(4)根据化学式和质量分数的相关计算分析。
21.【答案】(1)9.6
(2)19.3
(3)解:设混合物中氯酸钾的质量为x,
答:混合物中氯酸钾的质量24.5g;
(4)
22.【答案】(1)由质量守恒定律,生成二氧化碳的质量为:20g+6g+26.2g-50g=2.2g;
(2)设Na2CO3的质量为x,生成的NaCl的质量为y
x=5.3g ,y=5.85g
反应溶液中氯化钠的质量为:5.85g+(6g-5.3g)=6.55g
反应后所得溶液中溶质的质量分数是
答:(1)生成二氧化碳的质量是2.2g;
(2)反应后所得溶液中溶质的质量分数是13.1%。
23.【答案】(1) 2.2
(2) 解:设该样品中Na2CO3的质量为x
x=5.3g
答:该样品中碳酸钠的质量为5.3g
(3) 则样品中NaOH质量分数为:
答:该样品中NaOH的质量分数为75.0%
(4) 解:设变质的氢氧化钠的质量为y
y=4g
则氢氧化钠的变质程度是:
答:氢氧化钠的变质程度是20.1%
(5) 氢氧化钠
(6) 相同
24.【答案】(1)7:31
(2)非氟酸法更安全
(3)设:理论上可以得到x kg PF5,
6P2O5 + 5CaF2 2PF5↑ +5Ca(PO5)2
852 252
14.2kg x
=
x=4.2 kg
答:理论上可以得到kgPF,质量为4.2kg
(4)95.7
【解析】【解答】(1)LiPF6中锂元素和磷元素质量比=7:31;
(2)氢氟酸具有腐蚀性和毒性,“非氢氟酸法”与传统方法相比,具有的优点是非氟酸法更安全;
(3)设:理论上可以得到x kg PF5, 将14.2kg P2O5 代入化学方程式,列比例式,可得x=4.2 kg 即PF5质量为4.2kg ;
(4)设:在t1 时,已经消耗了质量为y。
根据图示可知,在时,生成的的质量115.5g。则有:
PF5 +LiF LiPF6
126 152
y 115.5kg
y=95.7kg。
答:在t1时 ,已经消耗了质量为95.7kg。
【分析】(1)锂元素和磷元素质量比的计算分析;
(2)根据氢氟酸的性质分析;
(3)(4)根据质量守恒定律和化学方程式的计算方法分析。
25.【答案】(1)4.4
(2)设参加反应的碳酸钙的质量为x。
则该石灰石样品中碳酸钙的质量分数为。
(3)
26.【答案】(1)8:1
(2)14.7%
解:设与氧化铜反应的硫酸的质量是x,与氢氧化钠反应的硫酸的质量是y,则有
实验所用稀硫酸中溶质的质量分数为×100%=14.7%;
答:实验所用稀硫酸中溶质的质量分数为14.7%;
(3)30;8.1
27.【答案】(1)相同
(2)5.74g
(3)设该生理盐水中氯化钠的质量为x,x=2.34g该生理盐水的溶质质量分数=
(4)A;B
【解析】【解答】(1)取260g该生理盐水样品于烧杯内,向其中加入80g硝酸银溶液,恰好完全反应,生成氯化银沉淀和硝酸钠,烧杯中阳离子为钠离子。如果260g该生理盐水,向其中加入40g硝酸银溶液,生理盐水有剩余,溶液是硝酸钠和氯化钠的混合物,但阳离子都是钠离子,故烧杯中阳离子的种类不变,故填:相同;
(2)根据质量守恒定律,生成沉淀的质量=260 g+80 g-334.26g=5.74g;
(4)A、用托盘天平称量氯化钠时,将砝码和氯化钠放颠倒了,则氯化钠的实际质量等于砝码质量-游码示数,导致称量的氯化钠的质量偏小,由溶质质量分数的计算公式可知,所配制的溶液的质量分数变小了,故A选项符合题意;
B、用量筒量取蒸馏水时,仰视读数,读数小于实际数,所量取水多了,由溶质质量分数的计算公式可知,所配制的溶液的质量分数变小了,故B选项符合题意;
C、将量筒中的水倒入烧杯时,有水洒出,导致溶液中的水的质量偏小,由溶质质量分数的计算公式可知,所配制的溶液的质量分数变大了,故C选项不符合题意;
D、在转移配好的氯化钠溶液时,洒出部分溶液,由于溶液具有均一性,对所配溶液的溶质质量分数无影响,故D选项不符合题意。
故答案为:AB。
【分析】(1)向其中加入80g硝酸银溶液,恰好完全反应;
(2)根据质量守恒定律,结合反应前后各物质的质量可得反应后生成沉淀的质量;
(3) 根据化学方程式得到氯化钠的质量,氯化钠的质量除以溶液的质量等于溶质质量分数;
(4) 所配溶液的溶质质量分数偏小 ,要么溶质质量偏小,要么溶剂质量偏大。
28.【答案】(1)14;61.1%
(2)解:设所用稀硫酸的溶质质量分数为x
x≈8.2%
答:所用稀硫酸的溶质质量分数是8.2%
(3)
【解析】【解答】(1)由表中数据可知,第1次加入稀硫酸,消耗固体的质量为:18g-16g=2g,第3次加入稀硫酸,消耗固体的总质量为:18g-12g=6g,说明每加入30g稀硫酸,消耗固体的质量为2g,故第2次加入稀硫酸,剩余固体的质量为:18g-4g=14g,则a的值为14。
混合物中最终剩余的11g固体即为铜的质量,则混合物中铜的质量分数为。
(3)由表可知,加入30g稀硫酸,消耗固体的质量为2g,剩余固体16g,设氧化铜恰好完全反应时,加入稀硫酸的质量为y,,y=105g,即加入稀硫酸的质量为105g时,剩余固体的质量为11g,之后,继续加入稀硫酸,剩余固体的质量不变,在图中表示为:
。
【分析】(1)根据表中数据可知每加入30g稀硫酸,消耗固体的质量为2g,以及混合物中的铜不与稀硫酸反应进行分析;
(2)先设未知数,正确写出化学方程式,再找准有关物质,已知量是第1次加稀硫酸参加反应的氧化铜的质量,未知量是稀硫酸的溶质质量分数,列比例式计算,最后简明写出答案;
(3)根据参加反应的氧化铜的质量与反应消耗的稀硫酸的质量成正比,确定氧化铜恰好完全反应时所需的稀硫酸的质量进行分析。
29.【答案】(1)铝片表面有一层致密的氧化铝薄膜,稀硫酸与氧化铝反应生成硫酸铝和水,不生成气体,压强几乎不变
(2)解:由图像可知,与氧化铝反应消耗的稀硫酸的质量为10g;
设与稀硫酸反应的氧化铝的质量为x
=
x=0.34 g
答:氧化铝的质量为0.34 g。
(3)
(4)77.1%
30.【答案】(1) 2.2
(2) 解:设该样品中Na2CO3的质量为x
x=5.3g
答:该样品中碳酸钠的质量为5.3g
(3) 则样品中NaOH质量分数为:
答:该样品中NaOH的质量分数为75.0%
(4) 解:设变质的氢氧化钠的质量为y
y=4g
则氢氧化钠的变质程度是:
答:氢氧化钠的变质程度是20.1%
(5) 氢氧化钠
(6) 相同
同课章节目录
