第一节 原子的构成 课时1 原子的结构 原子质量的计量课件(共23张PPT)
文档属性
| 名称 | 第一节 原子的构成 课时1 原子的结构 原子质量的计量课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 954.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-01 22:42:03 | ||
图片预览








文档简介
(共23张PPT)
第一节 原子的构成
课时1 原子的结构 原子质量的计量
学习目标
1.以汤姆森发现电子和卢瑟福α粒子轰击金箔实验事实为基础,引领学生推论原子内部的结构奥秘。
2.理解相对原子质量的概念,了解原子的实际质量与相对原子质量的区别与联系,会查相对原子质量表。
3.通过学习和反思活动,让学生们进一步认识到实验在科学探究过程中的价值,通过对原子结构奧秘的探究,让学生们认识到人类认识微观世界的智慧,体会到科学真理的来之不易。
情景导入
汤姆森经过研究发现,原子中有一种带电的粒子,但原子呈电中性,原子里例究竟还有什么?
水分子很小,它的直径只有千万分之一毫米。构成水分子的氢原子和氧原子岂不更小?这么小的原子还能再分吗?科学家们一直在探索……
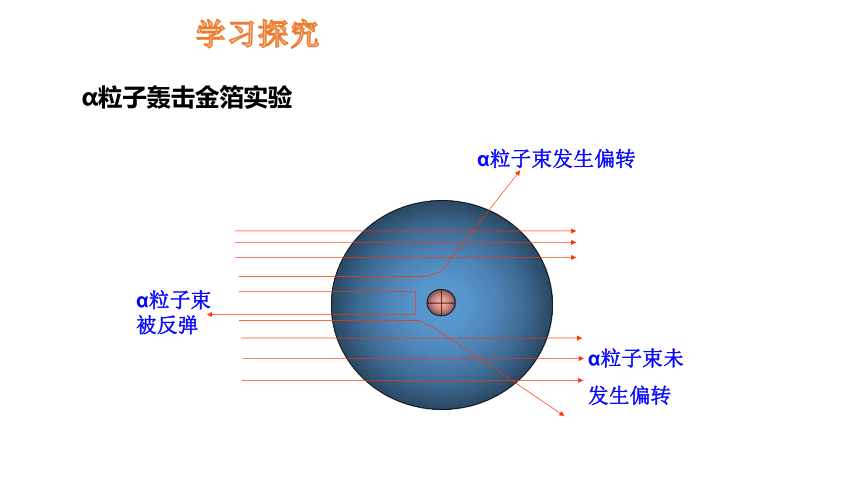
学习探究
α粒子轰击金箔实验
α粒子束未
发生偏转
α粒子束发生偏转
α粒子束被反弹
学习探究
α粒子轰击金箔实验
(1)极少数α 粒子被反弹回来:α 粒子碰到了质量很大、但体
积很小的原子核。
(2)一小部分α 粒子发生偏转:α 粒子遇到了带有正电荷物质,
因同性相斥而偏转。
(3)绝大多数α 粒子顺利穿过金箔:原子内部有相对较大的空间。
一、原子的结构
1.原子的构成
原子是由居于原子中心的______和________构成的。如图所示:
原子核
核外电子
原子
原子核
核外电子
质子
中子
(1个质子带1个单位正电荷)
(不带电)
(1个电子带1个单位负电荷)
核电荷数:原子核(质子)所带的正电荷数就叫核电荷数。
观察表中不同原子中各微粒的数目,你能找出哪些规律?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
原子中:1.核电荷数=质子数=核外电子数。
2.质子数不一定等于中子数。
3.不是所有的原子都有中子(氢原子没有中子)。
4.原子种类不同,质子数不同。
1.原子一般由质子、中子、电子构成,但不是所有的原子中都含有中子,如普通氢原子中不含有中子。
2.不同种原子中质子数一定不同,即原子的种类由质子数决定。
3.同种原子中,质子数相等,中子数不一定相等。
解析:根据卢瑟福的原子观点:①原子中心是原子核,电子在核外空间做绕核运动,①错误;②原子可分为原子核和核外电子,②正确;③原子呈球形,③正确;④电子带负电,④正确;⑤原子核带正电,⑤正确;⑥原子核体积很小,原子质量主要集中在原子核上,⑥正确;故选A。
例1 科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学理论。关于原子结构的学说有:①在球体内充斥正电荷,电子镶嵌其中 ②原子是可分的 ③原子呈球形 ④原子中有带负电的电子 ⑤原子中有带正电的原子核 ⑥原子核很小,但集中了原子的大部分质量其中经过卢瑟福传承和发展后形成的观点是( )
A.②③④⑤⑥ B.①②③④ C.④⑤⑥ D.⑤⑥
A
解析:在原子中,核电荷数=质子数=核外电子数,故铯原子的核外电子数为55,C正确。
例2 科学家约翰 帕特森向人们展示了一款真正意义上的原子手表,它内置了一个芯片级的铯原子钟,每1 000年仅有1秒的误差。已知这种铯原子核内质子数为55,相对原子质量为133,则其核外电子数为( )
A.188 B.78 C.55 D.23
C
2.原子构成的物质
原子是构成物质的一种基本粒子。例如:金属(金、银等)、稀有气体(氦、氖等)、金刚石和石墨是由原子直接构成的。
下列事实能说明原子的什么性质?
(1)报纸上的一个小黑点就含有1018 个碳原子。
(2)长期放在一起的金块和铅块会融合在一起分不开。
(3)水银温度计受热时水银柱上升。
原子质量和体积很小
原子在不停的运动且存在相互作用
原子间有间隔
项目 分子 原子
相同点
本质区别
联系
分解
构成
在化学变化中分子可以再分,而原子不可以再分
分子
原子
3.原子和分子的比较
(1)分子和原子都是构成物质的一种粒子。
(3)分子和原子都不显电性
(2)分子和原子的基本性质相同(小、运动、间隔)。
解析:分子和原子之间是无法直接比较大小的,故A错;原子既可以构成分子,也可以直接构成物质,故B错;原子在化学变化中不能再分,原子本身也有构成它的粒子,脱离化学变化这一前提,原子可以再分,故C错。
例3 下列物质由原子直接构成的是( )
A.金 B.氧气
C.二氧化硫 D.食盐
A
例4 分子和原子的主要区别是( )
A.分子大,原子小 B.分子可直接构成物质,而原子不能
C.分子可分成原子,而原子不能再分
D.在化学变化中,分子可分而原子不能再分
D
二、原子质量的计量
通过探究原子再小也有质量,那么不同的原子之间的质量是否有差异呢?
1.概念
相对原子质量是以一个碳12原子的实际质量(1.993×10-26 kg)的1/12作为基准,计算出其他原子的相对原子质量,就是这种原子的相对原子质量。
碳原子
碳原子的1/12
2.相对原子质量的计算方法
(1)相对原子质量=
碳12原子的实际质量1/12
原子的实际质量
相对原子质量不等于原子的实际质量,相对原子质量的单位是“1”,常略去不写,所以看起来是一个数值,而原子质量的单位是“g”或“kg”。
(2)相对原子质量≈质子数+中子数。
解析:相对原子质量不等于原子的实际质量,相对原子质量是原子实际质量与碳12原子质量的1/12的比值;相对原子质量与原子质量成正比,原子质量越大、相对原子质量越大;相对原子质量的单位为“1”。
例1 下列关于相对原子质量的说法正确的是( )
A.相对原子质量就是原子的实际质量
B.相对原子质量是原子质量与一种碳原子质量的比值
C.原子质量越大,相对原子质量就越大
D.相对原子质量的单位为“g”
C
解析:因为原子中核电荷数=核内质子数=核外电子数,由题意知该原子的核电荷数为16,故其核内质子数为16;根据相对原子质量=质子数+中子数,则该原子的相对原子质量为16+16=32。
例2 一种X原子的原子核内核电荷数为16,中子数为16,则该原子的相对原子质量为( )
A.16 B.18 C.32 D.18
C
课堂小结
1.原子的结构
物质
宏观
微观
构成
分子
构成
构成
物质由微粒构成
微粒有结构
结构有层次
宏微结合
原子
原子核
电子
+
-
质子
中子
+
不带电
模型法
微粒观
课堂小结
2.相对原子质量的计算方法
(1)相对原子质量=
(2)相对原子质量≈质子数+中子数。
碳12原子的实际质量1/12
原子的实际质量
随 堂 测试
2.学习完“原子的构成”之后,萍萍同学形成了以下认识,其中错误的是( )
A. 原子由居于中心的原子核和核外电子构成
B. 核外电子在离核远近不同的区域中运动
C. 原子核的质量和电子的质量相差不大
D. 原子核的体积与整个原子的体积相比要小很多
C
1.“嫦娥五号”完成我国首次月球采样任务,带回1 731 g 月壤,月壤中含有丰富的氦3。已知氦3的质子数为2,中子数为1。则氦3 的核外电子数为( )
A. 1 B. 2 C. 3 D. 4
B
3. 在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上。
(1)构成物质的粒子很多,有些物质是由________构成的,如铝、硅等;有些物质是由________构成的,如氧气、二氧化碳等。
(2)保持水的化学性质的最小粒子是水__________,保持铜的化学性质的最小粒子是铜____________。
(3)在化学变化中,________可以再分,________不能再分,只能重新组合。
(4)带正电荷的有________________,带负电荷的有________,不显电性的有________________________。
(5)在同一原子中,数目一定相等的是______________。
分子
原子
原子核、质子
电子
分子、原子、中子
质子、电子
原子
分子
原子
分子
第一节 原子的构成
课时1 原子的结构 原子质量的计量
学习目标
1.以汤姆森发现电子和卢瑟福α粒子轰击金箔实验事实为基础,引领学生推论原子内部的结构奥秘。
2.理解相对原子质量的概念,了解原子的实际质量与相对原子质量的区别与联系,会查相对原子质量表。
3.通过学习和反思活动,让学生们进一步认识到实验在科学探究过程中的价值,通过对原子结构奧秘的探究,让学生们认识到人类认识微观世界的智慧,体会到科学真理的来之不易。
情景导入
汤姆森经过研究发现,原子中有一种带电的粒子,但原子呈电中性,原子里例究竟还有什么?
水分子很小,它的直径只有千万分之一毫米。构成水分子的氢原子和氧原子岂不更小?这么小的原子还能再分吗?科学家们一直在探索……
学习探究
α粒子轰击金箔实验
α粒子束未
发生偏转
α粒子束发生偏转
α粒子束被反弹
学习探究
α粒子轰击金箔实验
(1)极少数α 粒子被反弹回来:α 粒子碰到了质量很大、但体
积很小的原子核。
(2)一小部分α 粒子发生偏转:α 粒子遇到了带有正电荷物质,
因同性相斥而偏转。
(3)绝大多数α 粒子顺利穿过金箔:原子内部有相对较大的空间。
一、原子的结构
1.原子的构成
原子是由居于原子中心的______和________构成的。如图所示:
原子核
核外电子
原子
原子核
核外电子
质子
中子
(1个质子带1个单位正电荷)
(不带电)
(1个电子带1个单位负电荷)
核电荷数:原子核(质子)所带的正电荷数就叫核电荷数。
观察表中不同原子中各微粒的数目,你能找出哪些规律?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
原子中:1.核电荷数=质子数=核外电子数。
2.质子数不一定等于中子数。
3.不是所有的原子都有中子(氢原子没有中子)。
4.原子种类不同,质子数不同。
1.原子一般由质子、中子、电子构成,但不是所有的原子中都含有中子,如普通氢原子中不含有中子。
2.不同种原子中质子数一定不同,即原子的种类由质子数决定。
3.同种原子中,质子数相等,中子数不一定相等。
解析:根据卢瑟福的原子观点:①原子中心是原子核,电子在核外空间做绕核运动,①错误;②原子可分为原子核和核外电子,②正确;③原子呈球形,③正确;④电子带负电,④正确;⑤原子核带正电,⑤正确;⑥原子核体积很小,原子质量主要集中在原子核上,⑥正确;故选A。
例1 科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学理论。关于原子结构的学说有:①在球体内充斥正电荷,电子镶嵌其中 ②原子是可分的 ③原子呈球形 ④原子中有带负电的电子 ⑤原子中有带正电的原子核 ⑥原子核很小,但集中了原子的大部分质量其中经过卢瑟福传承和发展后形成的观点是( )
A.②③④⑤⑥ B.①②③④ C.④⑤⑥ D.⑤⑥
A
解析:在原子中,核电荷数=质子数=核外电子数,故铯原子的核外电子数为55,C正确。
例2 科学家约翰 帕特森向人们展示了一款真正意义上的原子手表,它内置了一个芯片级的铯原子钟,每1 000年仅有1秒的误差。已知这种铯原子核内质子数为55,相对原子质量为133,则其核外电子数为( )
A.188 B.78 C.55 D.23
C
2.原子构成的物质
原子是构成物质的一种基本粒子。例如:金属(金、银等)、稀有气体(氦、氖等)、金刚石和石墨是由原子直接构成的。
下列事实能说明原子的什么性质?
(1)报纸上的一个小黑点就含有1018 个碳原子。
(2)长期放在一起的金块和铅块会融合在一起分不开。
(3)水银温度计受热时水银柱上升。
原子质量和体积很小
原子在不停的运动且存在相互作用
原子间有间隔
项目 分子 原子
相同点
本质区别
联系
分解
构成
在化学变化中分子可以再分,而原子不可以再分
分子
原子
3.原子和分子的比较
(1)分子和原子都是构成物质的一种粒子。
(3)分子和原子都不显电性
(2)分子和原子的基本性质相同(小、运动、间隔)。
解析:分子和原子之间是无法直接比较大小的,故A错;原子既可以构成分子,也可以直接构成物质,故B错;原子在化学变化中不能再分,原子本身也有构成它的粒子,脱离化学变化这一前提,原子可以再分,故C错。
例3 下列物质由原子直接构成的是( )
A.金 B.氧气
C.二氧化硫 D.食盐
A
例4 分子和原子的主要区别是( )
A.分子大,原子小 B.分子可直接构成物质,而原子不能
C.分子可分成原子,而原子不能再分
D.在化学变化中,分子可分而原子不能再分
D
二、原子质量的计量
通过探究原子再小也有质量,那么不同的原子之间的质量是否有差异呢?
1.概念
相对原子质量是以一个碳12原子的实际质量(1.993×10-26 kg)的1/12作为基准,计算出其他原子的相对原子质量,就是这种原子的相对原子质量。
碳原子
碳原子的1/12
2.相对原子质量的计算方法
(1)相对原子质量=
碳12原子的实际质量1/12
原子的实际质量
相对原子质量不等于原子的实际质量,相对原子质量的单位是“1”,常略去不写,所以看起来是一个数值,而原子质量的单位是“g”或“kg”。
(2)相对原子质量≈质子数+中子数。
解析:相对原子质量不等于原子的实际质量,相对原子质量是原子实际质量与碳12原子质量的1/12的比值;相对原子质量与原子质量成正比,原子质量越大、相对原子质量越大;相对原子质量的单位为“1”。
例1 下列关于相对原子质量的说法正确的是( )
A.相对原子质量就是原子的实际质量
B.相对原子质量是原子质量与一种碳原子质量的比值
C.原子质量越大,相对原子质量就越大
D.相对原子质量的单位为“g”
C
解析:因为原子中核电荷数=核内质子数=核外电子数,由题意知该原子的核电荷数为16,故其核内质子数为16;根据相对原子质量=质子数+中子数,则该原子的相对原子质量为16+16=32。
例2 一种X原子的原子核内核电荷数为16,中子数为16,则该原子的相对原子质量为( )
A.16 B.18 C.32 D.18
C
课堂小结
1.原子的结构
物质
宏观
微观
构成
分子
构成
构成
物质由微粒构成
微粒有结构
结构有层次
宏微结合
原子
原子核
电子
+
-
质子
中子
+
不带电
模型法
微粒观
课堂小结
2.相对原子质量的计算方法
(1)相对原子质量=
(2)相对原子质量≈质子数+中子数。
碳12原子的实际质量1/12
原子的实际质量
随 堂 测试
2.学习完“原子的构成”之后,萍萍同学形成了以下认识,其中错误的是( )
A. 原子由居于中心的原子核和核外电子构成
B. 核外电子在离核远近不同的区域中运动
C. 原子核的质量和电子的质量相差不大
D. 原子核的体积与整个原子的体积相比要小很多
C
1.“嫦娥五号”完成我国首次月球采样任务,带回1 731 g 月壤,月壤中含有丰富的氦3。已知氦3的质子数为2,中子数为1。则氦3 的核外电子数为( )
A. 1 B. 2 C. 3 D. 4
B
3. 在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上。
(1)构成物质的粒子很多,有些物质是由________构成的,如铝、硅等;有些物质是由________构成的,如氧气、二氧化碳等。
(2)保持水的化学性质的最小粒子是水__________,保持铜的化学性质的最小粒子是铜____________。
(3)在化学变化中,________可以再分,________不能再分,只能重新组合。
(4)带正电荷的有________________,带负电荷的有________,不显电性的有________________________。
(5)在同一原子中,数目一定相等的是______________。
分子
原子
原子核、质子
电子
分子、原子、中子
质子、电子
原子
分子
原子
分子
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
