第二节 元素 课时2 元素周期表简介课件(共14张PPT)
文档属性
| 名称 | 第二节 元素 课时2 元素周期表简介课件(共14张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-01 23:01:56 | ||
图片预览





文档简介
(共14张PPT)
第二节 元素
课时2 元素周期表简介
学习目标
1.熟记1~20元素名称及其符号。
2.认识元素周期表结构,知道元素周期表提供的信息。
3.能根据原子序数在周期表中找到指定的元素。
自然界的每种元素之间都存在着一定的规律,它们之间的规律从哪里可以很快地找出来呢?这就是接下来我们要学的元素周期表。
情景导入
一、元素周期表的结构
1.元素周期表
将元素按_____________由小到大的顺序排列起来,并分成几行,是性质相似的元素排在同一列中,从而得到第一张元素周期表。
相对原子质量
2.原子序数
元素周期表中每种元素都有一个序号,称为原子序数。
原子序数=质子数=原子核外电子数
学习探究
3.元素周期表中每一格的信息(以碳元素为例)
原子序数
元素符号
元素名称
相对原子质量
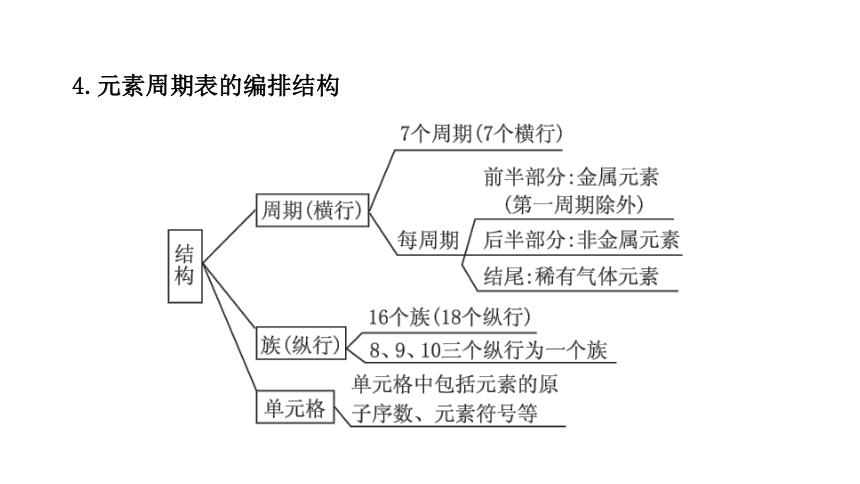
4.元素周期表的编排结构
解析:铈是金属元素。
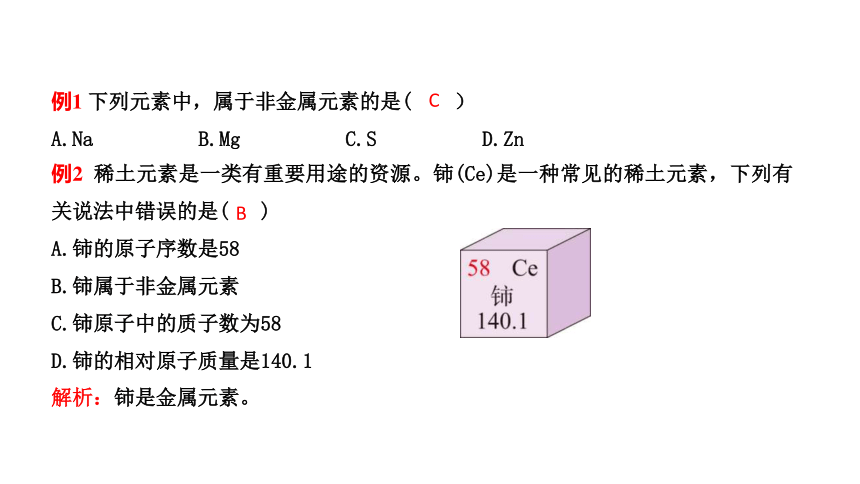
例1 下列元素中,属于非金属元素的是( )
A.Na B.Mg C.S D.Zn
C
例2 稀土元素是一类有重要用途的资源。铈(Ce)是一种常见的稀土元素,下列有关说法中错误的是( )
A.铈的原子序数是58
B.铈属于非金属元素
C.铈原子中的质子数为58
D.铈的相对原子质量是140.1
B
观察1~18号元素的原子结构示意图,你发现了什么规律?
氢H 氦He
锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar
二、元素周期表的应用
(1)从左到右,由金属元素到非金属元素过渡。
(2)从左到右,原子序数由小到大依次递增。
(3)同一周期的元素原子电子层数相同。
周期数=电子层数
(4)同一主族的元素原子最外层电子数相同。
主族数=最外层电子数
1.元素周期律
2.元素周期表的意义
(1)元素周期表是学习和研究化学、探索未知世界最有力的工具之一。
(2)元素周期表为发现新的元素和化合物、预测新元素的结构和性质提供了线索。
(3)由于元素周期表中位置越接近的元素化学性质越相似,启发人们在元素周期表的一定区域内寻找新物质(如半导体材料、催化剂、农药)。
解析:①为钠离子,③为氯离子,两者对应的元素位于元素周期表中同一周期。
例3 下列是一些粒子的结构示意图,有关说法错误的是( )
A.②④表示的两种元素化学性质相似
B.①③对应的元素位于元素周期表中同一纵行
C.②⑤⑥属于同一周期元素的原子
D.⑤⑥两种粒子能形成 AB2型化合物
B
课堂小结
元素周期表
简介
每一横行叫一个周期,共7个周期
每一纵行叫一个族,共16个族
元素之间随着原子序数的递增,元素的性质出现了周期性的变化
随 堂 测试
C
1.青岛是一座美丽的海滨城市下图为海水中富含的钠元素和氯元素在元素周期表中的部分信息,下列有关说法不正确的是( )
A.氯是一种非金属元素
B.钠元素的相对原子质量是22.99
C.钠原子的中子数为11
D.氯元素的原子序数为17
2. 元素周期表是学习和研究化学的重要工具,试根据图示回答相应问题:
(1)图甲是铯元素在元素周期表中的信息,则铯元素属于 (填“金属”或“非金属”)元素,该元素原子的核外电子数为 。
(2)图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下 判断正确的是( )
A.原子序数Z>Y B.核外电子数:X=Y
C.Y和Z处于同一周期
金属
55
AC
第二节 元素
课时2 元素周期表简介
学习目标
1.熟记1~20元素名称及其符号。
2.认识元素周期表结构,知道元素周期表提供的信息。
3.能根据原子序数在周期表中找到指定的元素。
自然界的每种元素之间都存在着一定的规律,它们之间的规律从哪里可以很快地找出来呢?这就是接下来我们要学的元素周期表。
情景导入
一、元素周期表的结构
1.元素周期表
将元素按_____________由小到大的顺序排列起来,并分成几行,是性质相似的元素排在同一列中,从而得到第一张元素周期表。
相对原子质量
2.原子序数
元素周期表中每种元素都有一个序号,称为原子序数。
原子序数=质子数=原子核外电子数
学习探究
3.元素周期表中每一格的信息(以碳元素为例)
原子序数
元素符号
元素名称
相对原子质量
4.元素周期表的编排结构
解析:铈是金属元素。
例1 下列元素中,属于非金属元素的是( )
A.Na B.Mg C.S D.Zn
C
例2 稀土元素是一类有重要用途的资源。铈(Ce)是一种常见的稀土元素,下列有关说法中错误的是( )
A.铈的原子序数是58
B.铈属于非金属元素
C.铈原子中的质子数为58
D.铈的相对原子质量是140.1
B
观察1~18号元素的原子结构示意图,你发现了什么规律?
氢H 氦He
锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar
二、元素周期表的应用
(1)从左到右,由金属元素到非金属元素过渡。
(2)从左到右,原子序数由小到大依次递增。
(3)同一周期的元素原子电子层数相同。
周期数=电子层数
(4)同一主族的元素原子最外层电子数相同。
主族数=最外层电子数
1.元素周期律
2.元素周期表的意义
(1)元素周期表是学习和研究化学、探索未知世界最有力的工具之一。
(2)元素周期表为发现新的元素和化合物、预测新元素的结构和性质提供了线索。
(3)由于元素周期表中位置越接近的元素化学性质越相似,启发人们在元素周期表的一定区域内寻找新物质(如半导体材料、催化剂、农药)。
解析:①为钠离子,③为氯离子,两者对应的元素位于元素周期表中同一周期。
例3 下列是一些粒子的结构示意图,有关说法错误的是( )
A.②④表示的两种元素化学性质相似
B.①③对应的元素位于元素周期表中同一纵行
C.②⑤⑥属于同一周期元素的原子
D.⑤⑥两种粒子能形成 AB2型化合物
B
课堂小结
元素周期表
简介
每一横行叫一个周期,共7个周期
每一纵行叫一个族,共16个族
元素之间随着原子序数的递增,元素的性质出现了周期性的变化
随 堂 测试
C
1.青岛是一座美丽的海滨城市下图为海水中富含的钠元素和氯元素在元素周期表中的部分信息,下列有关说法不正确的是( )
A.氯是一种非金属元素
B.钠元素的相对原子质量是22.99
C.钠原子的中子数为11
D.氯元素的原子序数为17
2. 元素周期表是学习和研究化学的重要工具,试根据图示回答相应问题:
(1)图甲是铯元素在元素周期表中的信息,则铯元素属于 (填“金属”或“非金属”)元素,该元素原子的核外电子数为 。
(2)图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下 判断正确的是( )
A.原子序数Z>Y B.核外电子数:X=Y
C.Y和Z处于同一周期
金属
55
AC
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
