第一节 化学反应中的质量守恒课件(共21张PPT)
文档属性
| 名称 | 第一节 化学反应中的质量守恒课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-01 23:33:37 | ||
图片预览







文档简介
(共21张PPT)
第五单元 定量研究化学反应
第一节 化学反应中的质量守恒
学习目标
1.通过对化学反应的微观分析,了解化学反应中元素的种类、原子的数量和质量不发生变化,理解质量守恒的含义和实质。
2.通过实验探究化学反应中反应物和生成物的质量关系,理解并描述质量守恒定律的内容。
3.通过运用质量守恒定律对生活和生产中化学现象进行解释,提高分析解决实际问题的能力。
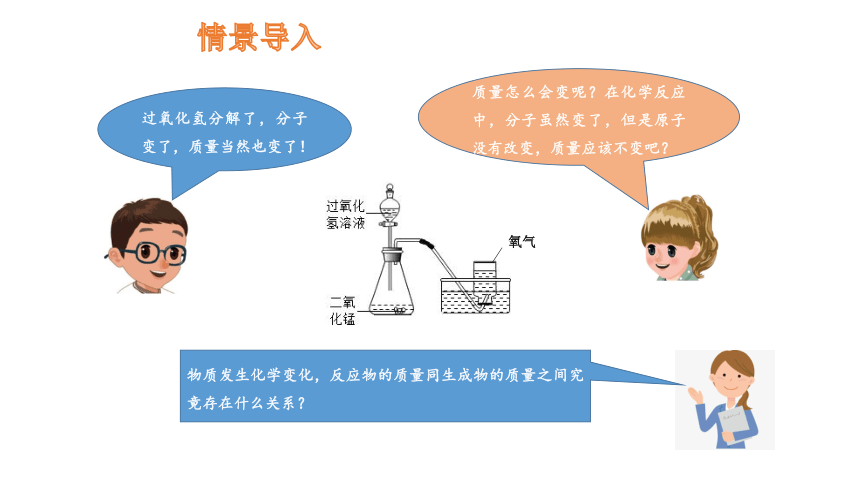
情景导入
过氧化氢分解了,分子变了,质量当然也变了!
质量怎么会变呢?在化学反应中,分子虽然变了,但是原子没有改变,质量应该不变吧?
物质发生化学变化,反应物的质量同生成物的质量之间究竟存在什么关系?
氧气
一、探究化学反应前后物质质量有无变化
学习探究
(2)参加化学反应的各物质的质量之和等于生成的各物质的质量之和。
【猜想和假设】
(1)参加化学反应的各物质的质量之和大于生成的各物质的质量之和。
(3)参加化学反应的各物质的质量之和小于生成的各物质的质量之和。
方案一:盐酸与大理石反应前后质量的测定
盐酸 + 碳酸钙 → 氯化钙 + 二氧化碳 + 水
HCl CaCO3 CaCl2 CO2 H2O
你预计这个反应
前后的称量结果
是否会有变化?
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验分析
有气泡冒出,气球膨胀,天平保持平衡
m1
m2
m1=m2
生成的CO2不会逸散到空气中,反应前后质量相等
方案二:氢氧化钠溶液和硫酸铜溶液反应前后质量的测定
硫酸铜 + 氢氧化钠 →
CuSO4 NaOH
氢氧化铜 + 硫酸钠
Cu(OH)2 Na2SO4
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验分析
有蓝色沉淀生成,天平保持平衡
m1
m2
m1=m2
反应前后质量相等
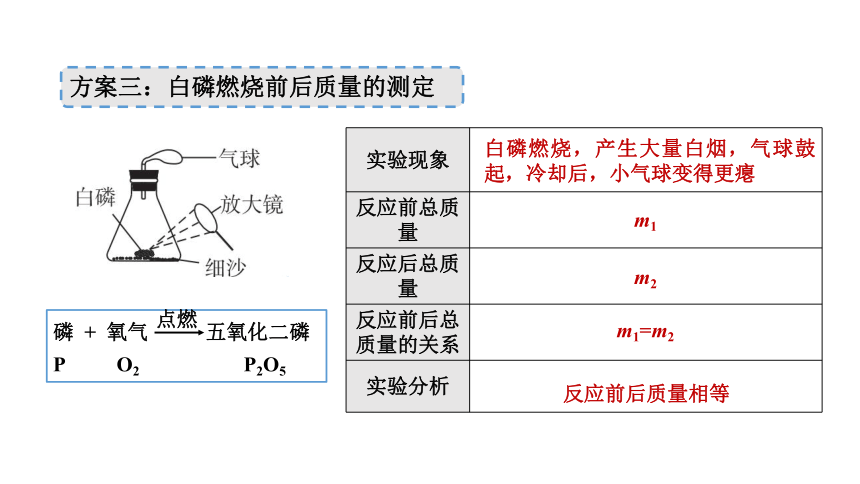
方案三:白磷燃烧前后质量的测定
磷 + 氧气 五氧化二磷
P O2 P2O5
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验分析
白磷燃烧,产生大量白烟,气球鼓起,冷却后,小气球变得更瘪
m1
m2
m1=m2
反应前后质量相等
点燃
质量守恒定律内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
注意事项
(1)参加化学反应:只对参加化学反应的物质而言,
不参加化学反应的物质不考虑。
(2)各物质:指所有的物质,尤其注意参加反应的或生成的气体、沉淀(固体)、水(液)不能忽略。
(3)质量总和:仅对质量求和,不是体积,也不是分子个数相加。
(4)质量守恒定律只适用于化学变化。
生成物
反应物
解析:参加反应的红磷和氧气的总质量一定等于反应后生成五氧化二磷的质量,没有参加反应的物质质量不能计算在内,A错误。
例1 如图是通过红磷燃烧来验证质量守恒定律的实验,下列说法错误的是 ( )
A.反应前锥形瓶内红磷和氧气的总质量一定等于反应
后生成五氧化二磷的质量
B.红磷燃烧结束,锥形瓶应冷却后再放在天平上称量
C.实验过程中气球先变大后变瘪
D.瓶底的细砂起隔热作用
A
二、质量守恒定律的微观解释
参加反应的各
物质的质量
总和
生成的各物质的质量
总和
化学反应前后物质的总质量为什么不变?
1.化学反应的微观实质
+
氧分子
氧原子
氢原子
氢分子
水分子
分子
原子
分解
新分子
重组
(1)请从微观和宏观两个方面归纳在化学变化过程中,有哪些方面一定不变,哪些方面可能改变,哪些方面一定改变。
(2)分析为什么所有的化学反应都遵守质量守恒定律。
化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合而生成其他物质(生成物)的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
2.化学反应前后的变与不变
在化学反应中有六不变、两改变、两个可能改变
物质总质量
解析:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
例2 化学反应前后,肯定没有发生变化的是 ( )
①物质的总质量 ②物质种类 ③分子数目
④分子种类 ⑤元素种类 ⑥原子数目
A ①⑤⑥ B.②③④ C.①②③ D.④⑤⑥
A
(1)解释一些化学变化中的质量变化。例如:根据质量守恒定律解释铁丝在氧气中燃烧后,生成物的质量比原来铁丝的质量大。
(2)推断物质的组成元素。
(3)推断物质的化学式。
3.质量守恒定律的应用
铁丝在氧气中燃烧时有氧气参加,生成物四氧化三铁的质量比原来铁丝的质量大。
(4)根据质量守恒定律进行各物质的质量计算。
元素守恒
守恒思想
原子守恒
确定元素的种类
依据某一元素质量进行计算
确定化学方程式中某一物质的化学式
确定化学方程式中各物质的化学计量数
解析:反应前后元素的种类不变,各元素的原子个数不变,所以X的化学式应为NO2 。
例3 现有反应2Cu(NO3)2 === 2CuO + O2↑+ 4X↑(等号两边各原子数目相等),则X的化学式为( )
A.NO B.NO2 C.NH3 D.N2O
B
课堂小结
“两”变
“六”不变
“两”个可能变
内容
原因
质量守恒定律
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
应用
②进行有关的计算
①解释现象
随 堂 测试
B
1.下列现象可用质量守恒定律解释的是( )
A.10 g水受热变成10 g水蒸气
B.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
C.铁在氧气中燃烧后,生成物的质量比铁的质量增加
D.蜡烛受热熔化,冷却后质量不变
2.a克木炭在b克氧气中燃烧,生成二氧化碳的质量( )
A.大于(a+b)克 B.小于(a+b)克
C.等于(a+b)克 D.小于或等于(a+b)克
D
随 堂 测试
A
3.下图是水分解的微观示意图,其中“ ”表示氧原子,“●”表示氢原子。下列说法正确的是( )
A.反应前后元素的种类没有发生变化
B.反应前后原子的种类发生了变化
C.反应前后原子的数目发生了变化
D.该反应不符合质量守恒定律
第五单元 定量研究化学反应
第一节 化学反应中的质量守恒
学习目标
1.通过对化学反应的微观分析,了解化学反应中元素的种类、原子的数量和质量不发生变化,理解质量守恒的含义和实质。
2.通过实验探究化学反应中反应物和生成物的质量关系,理解并描述质量守恒定律的内容。
3.通过运用质量守恒定律对生活和生产中化学现象进行解释,提高分析解决实际问题的能力。
情景导入
过氧化氢分解了,分子变了,质量当然也变了!
质量怎么会变呢?在化学反应中,分子虽然变了,但是原子没有改变,质量应该不变吧?
物质发生化学变化,反应物的质量同生成物的质量之间究竟存在什么关系?
氧气
一、探究化学反应前后物质质量有无变化
学习探究
(2)参加化学反应的各物质的质量之和等于生成的各物质的质量之和。
【猜想和假设】
(1)参加化学反应的各物质的质量之和大于生成的各物质的质量之和。
(3)参加化学反应的各物质的质量之和小于生成的各物质的质量之和。
方案一:盐酸与大理石反应前后质量的测定
盐酸 + 碳酸钙 → 氯化钙 + 二氧化碳 + 水
HCl CaCO3 CaCl2 CO2 H2O
你预计这个反应
前后的称量结果
是否会有变化?
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验分析
有气泡冒出,气球膨胀,天平保持平衡
m1
m2
m1=m2
生成的CO2不会逸散到空气中,反应前后质量相等
方案二:氢氧化钠溶液和硫酸铜溶液反应前后质量的测定
硫酸铜 + 氢氧化钠 →
CuSO4 NaOH
氢氧化铜 + 硫酸钠
Cu(OH)2 Na2SO4
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验分析
有蓝色沉淀生成,天平保持平衡
m1
m2
m1=m2
反应前后质量相等
方案三:白磷燃烧前后质量的测定
磷 + 氧气 五氧化二磷
P O2 P2O5
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验分析
白磷燃烧,产生大量白烟,气球鼓起,冷却后,小气球变得更瘪
m1
m2
m1=m2
反应前后质量相等
点燃
质量守恒定律内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
注意事项
(1)参加化学反应:只对参加化学反应的物质而言,
不参加化学反应的物质不考虑。
(2)各物质:指所有的物质,尤其注意参加反应的或生成的气体、沉淀(固体)、水(液)不能忽略。
(3)质量总和:仅对质量求和,不是体积,也不是分子个数相加。
(4)质量守恒定律只适用于化学变化。
生成物
反应物
解析:参加反应的红磷和氧气的总质量一定等于反应后生成五氧化二磷的质量,没有参加反应的物质质量不能计算在内,A错误。
例1 如图是通过红磷燃烧来验证质量守恒定律的实验,下列说法错误的是 ( )
A.反应前锥形瓶内红磷和氧气的总质量一定等于反应
后生成五氧化二磷的质量
B.红磷燃烧结束,锥形瓶应冷却后再放在天平上称量
C.实验过程中气球先变大后变瘪
D.瓶底的细砂起隔热作用
A
二、质量守恒定律的微观解释
参加反应的各
物质的质量
总和
生成的各物质的质量
总和
化学反应前后物质的总质量为什么不变?
1.化学反应的微观实质
+
氧分子
氧原子
氢原子
氢分子
水分子
分子
原子
分解
新分子
重组
(1)请从微观和宏观两个方面归纳在化学变化过程中,有哪些方面一定不变,哪些方面可能改变,哪些方面一定改变。
(2)分析为什么所有的化学反应都遵守质量守恒定律。
化学反应的过程,就是参加反应的各物质(反应物)的原子重新组合而生成其他物质(生成物)的过程。在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不
变
物质的种类
分子的种类
改变
可能
改变
分子数目
元素的化合价
宏观
2.化学反应前后的变与不变
在化学反应中有六不变、两改变、两个可能改变
物质总质量
解析:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
例2 化学反应前后,肯定没有发生变化的是 ( )
①物质的总质量 ②物质种类 ③分子数目
④分子种类 ⑤元素种类 ⑥原子数目
A ①⑤⑥ B.②③④ C.①②③ D.④⑤⑥
A
(1)解释一些化学变化中的质量变化。例如:根据质量守恒定律解释铁丝在氧气中燃烧后,生成物的质量比原来铁丝的质量大。
(2)推断物质的组成元素。
(3)推断物质的化学式。
3.质量守恒定律的应用
铁丝在氧气中燃烧时有氧气参加,生成物四氧化三铁的质量比原来铁丝的质量大。
(4)根据质量守恒定律进行各物质的质量计算。
元素守恒
守恒思想
原子守恒
确定元素的种类
依据某一元素质量进行计算
确定化学方程式中某一物质的化学式
确定化学方程式中各物质的化学计量数
解析:反应前后元素的种类不变,各元素的原子个数不变,所以X的化学式应为NO2 。
例3 现有反应2Cu(NO3)2 === 2CuO + O2↑+ 4X↑(等号两边各原子数目相等),则X的化学式为( )
A.NO B.NO2 C.NH3 D.N2O
B
课堂小结
“两”变
“六”不变
“两”个可能变
内容
原因
质量守恒定律
参加化学反应的各物质
生成的各物质的质量总和
的质量总和等于反应后
应用
②进行有关的计算
①解释现象
随 堂 测试
B
1.下列现象可用质量守恒定律解释的是( )
A.10 g水受热变成10 g水蒸气
B.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
C.铁在氧气中燃烧后,生成物的质量比铁的质量增加
D.蜡烛受热熔化,冷却后质量不变
2.a克木炭在b克氧气中燃烧,生成二氧化碳的质量( )
A.大于(a+b)克 B.小于(a+b)克
C.等于(a+b)克 D.小于或等于(a+b)克
D
随 堂 测试
A
3.下图是水分解的微观示意图,其中“ ”表示氧原子,“●”表示氢原子。下列说法正确的是( )
A.反应前后元素的种类没有发生变化
B.反应前后原子的种类发生了变化
C.反应前后原子的数目发生了变化
D.该反应不符合质量守恒定律
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
