【世纪金榜】2015-2016学年高中化学 2.1原子核外电子的运动课件 苏教版选修3
文档属性
| 名称 | 【世纪金榜】2015-2016学年高中化学 2.1原子核外电子的运动课件 苏教版选修3 |

|
|
| 格式 | zip | ||
| 文件大小 | 672.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-09 00:00:00 | ||
图片预览











文档简介
课件54张PPT。专题2 原子结构与元素的性质
第一单元 原子核外电子的运动一、人类对原子结构的认识
1.原子模型的演变:卢瑟福α粒子的散射原子核氢原子稳定的轨道放出能量吸收能量不连续跃迁2.电子云:大小近远二、原子核外电子的运动特征
1.电子层:
(1)分层依据。分层依据电子的_____差异主要_________的不同能量运动区域(2)表示方法。nKLMNO变远2.原子轨道:1357球形纺锤形3.自旋运动:原子核外电子有___种不同的自旋状态,通常用“___”
和“___”表示。↑↓两三、原子核外电子的排布
1.核外电子排布遵循的三个原理:
(1)能量最低原理:原子核外电子先占据_________的轨道,然后依次
进入_________的轨道,这样使整个原子处于_____的能量状态。
(2)泡利不相容原理:每个原子轨道上最多只能容纳_____自旋状态
_____的电子。
(3)洪特规则:原子核外电子在能量相同的各个轨道上排布时,电子
尽可能分占_______________,且自旋状态_____。能量最低能量较高最低两个不同不同的原子轨道相同2.电子排布的表示方法:
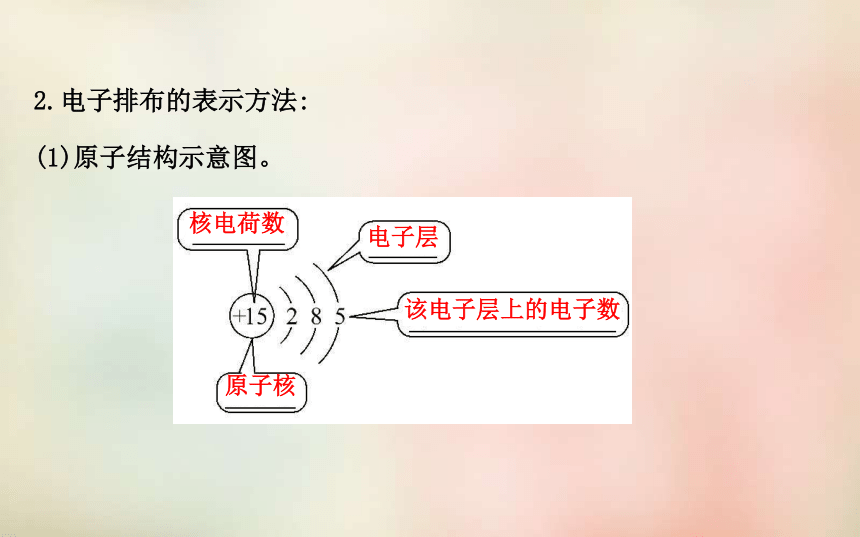
(1)原子结构示意图。核电荷数电子层该电子层上的电子数原子核(2)电子排布式。电子层原子轨迹电子数(3)轨道表示式。轨迹电子自旋状态相反【自我小测】
1.思考辨析:
(1)电子云中小点的疏密表示电子的多少。 ( )
分析:×。电子云中小点的疏密代表的是电子在该区域出现的几率的大小,不代表真实的电子。
(2)p轨道的能量比s轨道能量高。 ( )
分析:×。不一定,只有电子层数相同时才成立。若电子层数不相同时,p轨道能量可能会小,如3s>2p。(3)每一个电子层都有s、p、d等轨道。 ( )
分析:×。K层只有s轨道,L层只有s、p轨道。
(4)外围电子就是元素的最外层电子。 ( )
分析:×。对于主族元素来说,外围电子就是最外层电子,对于过渡元素来说,外围电子一般还包括次外层的部分电子甚至还包括一部分倒数第三层电子。(5)任何一种原子的核外电子排布都遵循能量最低原理、泡利不相容
原理、洪特规则。 ( )
分析:×。处于激发态的原子,核外电子排布不遵循能量最低原理,但
遵循泡利不相容原理和洪特规则。
(6)电子排布式的书写与电子进入原子轨道的顺序一致。 ( )
分析:×。如26Fe,原子轨道能量从低到高排列为1s 2s 2p 3s 3p 4s 3d,
但是核外电子排布式在书写时却将同一层的电子移到一起,即
1s22s22p63s23p63d64s2。2.多电子原子中,原子轨道能量高低排列错误的是 ( )
A.2s<3s<4s B.2px<2py<2pz
C.3s<3p<3d D.3px=3py=3pz
【解析】选B。电子层和原子轨道形状相同时,能量相同。3.下列电子层中,原子轨道的数目为4的是 ( )
A.K层 B.L层 C.M层 D.N层
【解析】选B。第n电子层中,原子轨道的数目为n2,因此原子轨道数是4的电子层数为2,为L层。4.(SJ·P17改编)某基态原子的第3电子层上有3个电子,则第2电子层上的电子数有 ( )
A.2个 B. 8个 C. 10个 D. 18个
【解析】选B。当第3电子层上有电子时,第2层上已经排满8个电子。5.(SJ·P16改编)下列基态原子的轨道表示式违反洪特规则的
是 ( )
【解析】选A。根据洪特规则,核外电子在排布时应该尽可能分占不同的原子轨道,并且自旋状态相同,因此A项不符合。6.下列关于铝原子核外电子排布式的书写正确的是 ( )
A.1s22s83s3 B.3s23p1
C.1s22s23s22p63p1 D.1s22s22p63s23p1
【解析】选D。电子排布式的书写要遵循能量最低原理、泡利不相容原理和洪特规则。一、电子层与原子轨道的关系
【自主导练】
1.(2015·广元高二检测)下列说法中正确的是 ( )
A.第3电子层上有s、p两个原子轨道
B.2p2表示第2电子层上有两个电子
C.同一原子中,1s、2p、4p电子的能量逐渐减小
D.2p、3p、4p轨道上最多容纳的电子数相同【解题指南】解答本题要注意以下两点:
(1)原子轨道类型与轨道数目的关系;
(2)电子层与原子轨道数目以及最多容纳电子数的关系。
【解析】选D。第3电子层上有一个s轨道、三个p轨道,共4个原子轨道,A项不正确;2p2表示2p轨道上排了两个电子,B不正确;同一原子中,1s、2p、4p电子的能量逐渐升高,C项不正确;每个电子层上都有3个p轨道,每个轨道上最多容纳2个电子,D项正确。2.(2015·郑州高二检测)某元素X的M层有4个p电子,下列叙述错误的是 ( )
A.N层不含电子
B.该元素是硫元素
C.L层一定有8个电子
D.原子最外层电子数为4
【解析】选D。依题意可知,该元素原子K、L、M层容纳的电子数分别为2、8、6,N层不含电子,故该元素是硫元素。D项叙述是错误的,该元素的最外层电子数应为6。【互动探究】(1)X元素原子核外有几个未成对电子?
提示:因为该元素的M层上有4个p电子,三个p轨道,根据核外电子排布的原则,该元素的原子核外有2个未成对电子。
(2)若将题干改成“某元素X有4个p电子”,那么该元素是什么元素?
提示:若元素有4个p电子,这4个电子一定在2p轨道上,K、L层容纳的电子数分别为2、6,则该元素为氧元素。【总结归纳】
1.电子层与原子轨道的关系:2.不同原子轨道的能量大小关系:【警示】(1)原子轨道类型是指该原子轨道形状的区别,s轨道是球形,p轨道是纺锤形等。
(2)原子轨道数目是指轨道有多少个伸展方向,即多少个原子轨道,如s轨道只有1个原子轨道,p轨道有3个原子轨道。【拓展深化】电子层数和轨道类型均不同时,原子中的价电子在外层分布时存在原子轨道能量交错现象。如E4s(双选)(2015·启东高二检测)下列有关认识正确的是 ( )
A.各原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各电子层的轨道都是从s轨道开始至f轨道结束
C.各电子层含有的原子轨道数为n-1
D.各电子层含有的电子数为2n2
【解析】选A、D。原子核外第一电子层只有s轨道,第二电子层只有s、p轨道,B错;各电子层含有的原子轨道数目为n2,C错。【补偿训练】下列说法中不正确的是 ( )
A.同一原子中,2s、3s、4s轨道离原子核的平均距离依次增大
B.同一原子中,2p、3d、4f轨道的轨道数依次增多
C.p轨道呈纺锤形,随着电子层的增加,p轨道的数量也在增多
D.对于npx、npy、npz轨道上的电子,具有相同的能量,其电子云的形状也相同【解析】选C。同一原子中,电子层数越高,表示原子轨道离原子核的平均距离越大,A正确;2p、3d、4f轨道的轨道数依次为3、5、7,依次增多,B正确;无论在哪个电子层,p轨道都是3个,C错误;同一电子层形状相同的原子轨道的能量相等,其电子云的形状也相同,D正确。二、基态原子核外电子排布规律及表示方法
1.原子核外电子排布的3个原理:
(1)能量最低原理。
(2)泡利不相容原理。
(3)洪特规则。2.核外电子排布的3点认识:
(1)多电子原子轨道能量高低顺序可以概括为Ens(2)核外电子排布并非全是按照电子层的顺序逐层排布的,排满K层后再排到L层,排满了L层再排到M层,但并非排满M层后再排到N层,根据能量最低原理电子进入轨道的顺序是排满4s后再进入3d。(3)有少数元素的基态原子的电子排布对于能量最低原理有1个电子的偏差。因为能量相同的原子轨道在全充满(如p6和d10)、半充满(如p3和d5)和全空(如p0和d0)状态时,体系的能量较低,原子较稳定。3.核外电子排布的表示方法:【拓展深化】原子最外层、次外层及倒数第三层最多容纳电子数的原因:
(1)依据。
能量最低原理中的排布顺序,其实质是各原子轨道的能量高低顺序可由公式得出:ns<(n-2)f<(n-1)d①最外层由ns、np组成,电子数不大于2+6=8。
②次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
③倒数第三层由(n-2)s(n-2)p(n-2)d(n-2)f组成,电子数不大于2+6+10+14=32。【针对训练】
1.(2015·信阳高二检测)A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子和1个空轨道,次外层有
2个电子,其元素符号为 。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的轨道表示式为________。(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为 ,
其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对
电子,E的元素符号为 ,其基态原子的价电子排布式为 。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n= ;
原子中能量最高的是 (填原子轨道)电子。【解题指南】解答本题要注意以下两点:
(1)核外电子排布遵循能量最低原理、泡利不相容原理和洪特规则。
(2)原子结构示意图是其他核外电子表示方法的基础。【解析】(1)A元素基态原子次外层有两个电子,故次外层为K层,A元
素有两个电子层,由题意可写出其轨道表示式为 ,则该元素核外有6个电子,为碳元素,其元素符号为C。
(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。
(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即26号元素铁。(4)根据题意要求,首先写出电子排布式:
1s22s22p63s23p63d104s1,该元素为29号元素Cu。
(5)s轨道类型上只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子最外层电子排布式为2s22p3,由此可知F是氮元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中2p轨道上的电子能量最高。答案:(1)C
(2)Cl
(3)Fe 1s22s22p63s23p63d64s2或[Ar]3d64s2
(4)Cu 3d104s1
(5)2 2p【互动探究】
(1)上题(1)中若A元素基态原子的最外层有2个未成对电子,次外层有2个电子,则该元素可能为哪种元素?
提示:次外层有2个电子,则该元素核外有两层电子,最外层有2个未成对电子,则该元素的2p轨道上有2个或4个电子,该元素为碳元素或氧元素。(2)上题(2)中,B元素的原子核外轨道的数目是多少?
提示:该元素为氯元素,其电子排布式为1s22s22p63s23p5,其中1s、2s、3s轨道各一个,2p轨道和3p轨道各3个,一共9个。2.下列元素的电子排布式违背了哪条原则,写出其正确的外围电子排布式。【解析】(1)对于碳原子来说,2p有3个能量相同的原子轨道,2p上的2个电子应该以自旋状态相同的方式分布在两个不同的2p轨道上。
(2)根据轨道能量高低顺序可知E4s(3)对于22Ti来说,3p共有3个轨道,最多可以排6个电子,不能排10个电子。答案:【易错提醒】核外电子排布式书写的注意事项
(1)激发态原子核外电子排布式不再遵循能量最低原理。
(2)核外电子排布式书写时要按照电子层由低到高、原子轨道类型s、p、d、f顺序书写。书写时注意要遵循核外电子排布规律。
(3)根据洪特规则,原子轨道半满或全满时能量较低,较稳定,因此书写时要注意轨道半满或全满的特殊情况。
(4)注意看清题目要求,是书写原子核外电子排布式还是外围电子排布式。【补偿训练】1.下列关于硅原子的核外电子排布表示式中,错误的
是 ( )
A.电子排布式:1s22s22p63s23p2
B.外围电子排布式:3s23p2
C.轨道表示式:[Ne]
D.原子结构示意图:【解析】选C。A和B两个选项都是电子排布式,C是轨道表示式,违背了洪特规则;D为原子结构示意图。2.(2015·南京高二检测)根据下列叙述,写出元素名称,画出原子结构示意图,并写出核外电子排布式。
(1)A元素原子核外M层电子数是L层电子数的一半:
, , 。
(2)B元素原子的最外层电子数是次外层电子数的1.5倍:
, , 。(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃: , , 。
(4)D元素的次外层电子数是最外层电子数的 :
, , 。 【解析】(1)A原子的L层排满有8个电子,故M层有4个电子;
(2)B原子次外层电子数只能为2,故最外层电子数为3;
(3)C元素为F,2F2+2H2O====4HF+O2;
(4)D元素最外层电子数为8,次外层电子数为2。答案:(1)硅 1s22s22p63s23p2
(2)硼 1s22s22p1
(3)氟 1s22s22p5
(4)氖 1s22s22p6
第一单元 原子核外电子的运动一、人类对原子结构的认识
1.原子模型的演变:卢瑟福α粒子的散射原子核氢原子稳定的轨道放出能量吸收能量不连续跃迁2.电子云:大小近远二、原子核外电子的运动特征
1.电子层:
(1)分层依据。分层依据电子的_____差异主要_________的不同能量运动区域(2)表示方法。nKLMNO变远2.原子轨道:1357球形纺锤形3.自旋运动:原子核外电子有___种不同的自旋状态,通常用“___”
和“___”表示。↑↓两三、原子核外电子的排布
1.核外电子排布遵循的三个原理:
(1)能量最低原理:原子核外电子先占据_________的轨道,然后依次
进入_________的轨道,这样使整个原子处于_____的能量状态。
(2)泡利不相容原理:每个原子轨道上最多只能容纳_____自旋状态
_____的电子。
(3)洪特规则:原子核外电子在能量相同的各个轨道上排布时,电子
尽可能分占_______________,且自旋状态_____。能量最低能量较高最低两个不同不同的原子轨道相同2.电子排布的表示方法:
(1)原子结构示意图。核电荷数电子层该电子层上的电子数原子核(2)电子排布式。电子层原子轨迹电子数(3)轨道表示式。轨迹电子自旋状态相反【自我小测】
1.思考辨析:
(1)电子云中小点的疏密表示电子的多少。 ( )
分析:×。电子云中小点的疏密代表的是电子在该区域出现的几率的大小,不代表真实的电子。
(2)p轨道的能量比s轨道能量高。 ( )
分析:×。不一定,只有电子层数相同时才成立。若电子层数不相同时,p轨道能量可能会小,如3s>2p。(3)每一个电子层都有s、p、d等轨道。 ( )
分析:×。K层只有s轨道,L层只有s、p轨道。
(4)外围电子就是元素的最外层电子。 ( )
分析:×。对于主族元素来说,外围电子就是最外层电子,对于过渡元素来说,外围电子一般还包括次外层的部分电子甚至还包括一部分倒数第三层电子。(5)任何一种原子的核外电子排布都遵循能量最低原理、泡利不相容
原理、洪特规则。 ( )
分析:×。处于激发态的原子,核外电子排布不遵循能量最低原理,但
遵循泡利不相容原理和洪特规则。
(6)电子排布式的书写与电子进入原子轨道的顺序一致。 ( )
分析:×。如26Fe,原子轨道能量从低到高排列为1s 2s 2p 3s 3p 4s 3d,
但是核外电子排布式在书写时却将同一层的电子移到一起,即
1s22s22p63s23p63d64s2。2.多电子原子中,原子轨道能量高低排列错误的是 ( )
A.2s<3s<4s B.2px<2py<2pz
C.3s<3p<3d D.3px=3py=3pz
【解析】选B。电子层和原子轨道形状相同时,能量相同。3.下列电子层中,原子轨道的数目为4的是 ( )
A.K层 B.L层 C.M层 D.N层
【解析】选B。第n电子层中,原子轨道的数目为n2,因此原子轨道数是4的电子层数为2,为L层。4.(SJ·P17改编)某基态原子的第3电子层上有3个电子,则第2电子层上的电子数有 ( )
A.2个 B. 8个 C. 10个 D. 18个
【解析】选B。当第3电子层上有电子时,第2层上已经排满8个电子。5.(SJ·P16改编)下列基态原子的轨道表示式违反洪特规则的
是 ( )
【解析】选A。根据洪特规则,核外电子在排布时应该尽可能分占不同的原子轨道,并且自旋状态相同,因此A项不符合。6.下列关于铝原子核外电子排布式的书写正确的是 ( )
A.1s22s83s3 B.3s23p1
C.1s22s23s22p63p1 D.1s22s22p63s23p1
【解析】选D。电子排布式的书写要遵循能量最低原理、泡利不相容原理和洪特规则。一、电子层与原子轨道的关系
【自主导练】
1.(2015·广元高二检测)下列说法中正确的是 ( )
A.第3电子层上有s、p两个原子轨道
B.2p2表示第2电子层上有两个电子
C.同一原子中,1s、2p、4p电子的能量逐渐减小
D.2p、3p、4p轨道上最多容纳的电子数相同【解题指南】解答本题要注意以下两点:
(1)原子轨道类型与轨道数目的关系;
(2)电子层与原子轨道数目以及最多容纳电子数的关系。
【解析】选D。第3电子层上有一个s轨道、三个p轨道,共4个原子轨道,A项不正确;2p2表示2p轨道上排了两个电子,B不正确;同一原子中,1s、2p、4p电子的能量逐渐升高,C项不正确;每个电子层上都有3个p轨道,每个轨道上最多容纳2个电子,D项正确。2.(2015·郑州高二检测)某元素X的M层有4个p电子,下列叙述错误的是 ( )
A.N层不含电子
B.该元素是硫元素
C.L层一定有8个电子
D.原子最外层电子数为4
【解析】选D。依题意可知,该元素原子K、L、M层容纳的电子数分别为2、8、6,N层不含电子,故该元素是硫元素。D项叙述是错误的,该元素的最外层电子数应为6。【互动探究】(1)X元素原子核外有几个未成对电子?
提示:因为该元素的M层上有4个p电子,三个p轨道,根据核外电子排布的原则,该元素的原子核外有2个未成对电子。
(2)若将题干改成“某元素X有4个p电子”,那么该元素是什么元素?
提示:若元素有4个p电子,这4个电子一定在2p轨道上,K、L层容纳的电子数分别为2、6,则该元素为氧元素。【总结归纳】
1.电子层与原子轨道的关系:2.不同原子轨道的能量大小关系:【警示】(1)原子轨道类型是指该原子轨道形状的区别,s轨道是球形,p轨道是纺锤形等。
(2)原子轨道数目是指轨道有多少个伸展方向,即多少个原子轨道,如s轨道只有1个原子轨道,p轨道有3个原子轨道。【拓展深化】电子层数和轨道类型均不同时,原子中的价电子在外层分布时存在原子轨道能量交错现象。如E4s
A.各原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各电子层的轨道都是从s轨道开始至f轨道结束
C.各电子层含有的原子轨道数为n-1
D.各电子层含有的电子数为2n2
【解析】选A、D。原子核外第一电子层只有s轨道,第二电子层只有s、p轨道,B错;各电子层含有的原子轨道数目为n2,C错。【补偿训练】下列说法中不正确的是 ( )
A.同一原子中,2s、3s、4s轨道离原子核的平均距离依次增大
B.同一原子中,2p、3d、4f轨道的轨道数依次增多
C.p轨道呈纺锤形,随着电子层的增加,p轨道的数量也在增多
D.对于npx、npy、npz轨道上的电子,具有相同的能量,其电子云的形状也相同【解析】选C。同一原子中,电子层数越高,表示原子轨道离原子核的平均距离越大,A正确;2p、3d、4f轨道的轨道数依次为3、5、7,依次增多,B正确;无论在哪个电子层,p轨道都是3个,C错误;同一电子层形状相同的原子轨道的能量相等,其电子云的形状也相同,D正确。二、基态原子核外电子排布规律及表示方法
1.原子核外电子排布的3个原理:
(1)能量最低原理。
(2)泡利不相容原理。
(3)洪特规则。2.核外电子排布的3点认识:
(1)多电子原子轨道能量高低顺序可以概括为Ens
(1)依据。
能量最低原理中的排布顺序,其实质是各原子轨道的能量高低顺序可由公式得出:ns<(n-2)f<(n-1)d
②次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
③倒数第三层由(n-2)s(n-2)p(n-2)d(n-2)f组成,电子数不大于2+6+10+14=32。【针对训练】
1.(2015·信阳高二检测)A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子和1个空轨道,次外层有
2个电子,其元素符号为 。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的轨道表示式为________。(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为 ,
其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对
电子,E的元素符号为 ,其基态原子的价电子排布式为 。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n= ;
原子中能量最高的是 (填原子轨道)电子。【解题指南】解答本题要注意以下两点:
(1)核外电子排布遵循能量最低原理、泡利不相容原理和洪特规则。
(2)原子结构示意图是其他核外电子表示方法的基础。【解析】(1)A元素基态原子次外层有两个电子,故次外层为K层,A元
素有两个电子层,由题意可写出其轨道表示式为 ,则该元素核外有6个电子,为碳元素,其元素符号为C。
(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。
(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2,即26号元素铁。(4)根据题意要求,首先写出电子排布式:
1s22s22p63s23p63d104s1,该元素为29号元素Cu。
(5)s轨道类型上只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子最外层电子排布式为2s22p3,由此可知F是氮元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中2p轨道上的电子能量最高。答案:(1)C
(2)Cl
(3)Fe 1s22s22p63s23p63d64s2或[Ar]3d64s2
(4)Cu 3d104s1
(5)2 2p【互动探究】
(1)上题(1)中若A元素基态原子的最外层有2个未成对电子,次外层有2个电子,则该元素可能为哪种元素?
提示:次外层有2个电子,则该元素核外有两层电子,最外层有2个未成对电子,则该元素的2p轨道上有2个或4个电子,该元素为碳元素或氧元素。(2)上题(2)中,B元素的原子核外轨道的数目是多少?
提示:该元素为氯元素,其电子排布式为1s22s22p63s23p5,其中1s、2s、3s轨道各一个,2p轨道和3p轨道各3个,一共9个。2.下列元素的电子排布式违背了哪条原则,写出其正确的外围电子排布式。【解析】(1)对于碳原子来说,2p有3个能量相同的原子轨道,2p上的2个电子应该以自旋状态相同的方式分布在两个不同的2p轨道上。
(2)根据轨道能量高低顺序可知E4s
(1)激发态原子核外电子排布式不再遵循能量最低原理。
(2)核外电子排布式书写时要按照电子层由低到高、原子轨道类型s、p、d、f顺序书写。书写时注意要遵循核外电子排布规律。
(3)根据洪特规则,原子轨道半满或全满时能量较低,较稳定,因此书写时要注意轨道半满或全满的特殊情况。
(4)注意看清题目要求,是书写原子核外电子排布式还是外围电子排布式。【补偿训练】1.下列关于硅原子的核外电子排布表示式中,错误的
是 ( )
A.电子排布式:1s22s22p63s23p2
B.外围电子排布式:3s23p2
C.轨道表示式:[Ne]
D.原子结构示意图:【解析】选C。A和B两个选项都是电子排布式,C是轨道表示式,违背了洪特规则;D为原子结构示意图。2.(2015·南京高二检测)根据下列叙述,写出元素名称,画出原子结构示意图,并写出核外电子排布式。
(1)A元素原子核外M层电子数是L层电子数的一半:
, , 。
(2)B元素原子的最外层电子数是次外层电子数的1.5倍:
, , 。(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃: , , 。
(4)D元素的次外层电子数是最外层电子数的 :
, , 。 【解析】(1)A原子的L层排满有8个电子,故M层有4个电子;
(2)B原子次外层电子数只能为2,故最外层电子数为3;
(3)C元素为F,2F2+2H2O====4HF+O2;
(4)D元素最外层电子数为8,次外层电子数为2。答案:(1)硅 1s22s22p63s23p2
(2)硼 1s22s22p1
(3)氟 1s22s22p5
(4)氖 1s22s22p6
