【世纪金榜】2015-2016学年高中化学 3.1金属键 金属晶体课件 苏教版选修3
文档属性
| 名称 | 【世纪金榜】2015-2016学年高中化学 3.1金属键 金属晶体课件 苏教版选修3 |

|
|
| 格式 | zip | ||
| 文件大小 | 844.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-09 20:45:58 | ||
图片预览










文档简介
课件50张PPT。专题3 微粒间作用力与物质性质
第一单元 金属键 金属晶体一、金属键与金属特性
1.金属键:金属离子自由电子相互作用金属阳离子自由电子金属单质合金中无方向性和饱和性原子半径自由电子2.金属键理论对金属物理性质的解释:
(1)导电性。
在外电场作用下,自由电子将会发生_________,形成电流。
(2)导热性。
金属受热时,自由电子与金属离子(或金属原子)的碰撞频率增加,
_________把能量传给_____________________,从而把能量从温度
高的区域传到温度低的区域。定向运动自由电子金属离子(或金属原子)(3)延展性。
金属键没有方向性,在外力作用下,金属原子间发生相对滑动时,
各层金属原子间保持_______的作用,不会断裂。金属键二、金属晶体
1.含义:
(1)晶体:具有_______________的固体,晶体外形规则是其内部
结构规则的外部表现,构成晶体的粒子的排列是有规则的。
(2)晶胞:能够反映_____________的基本重复单位,它在空间是
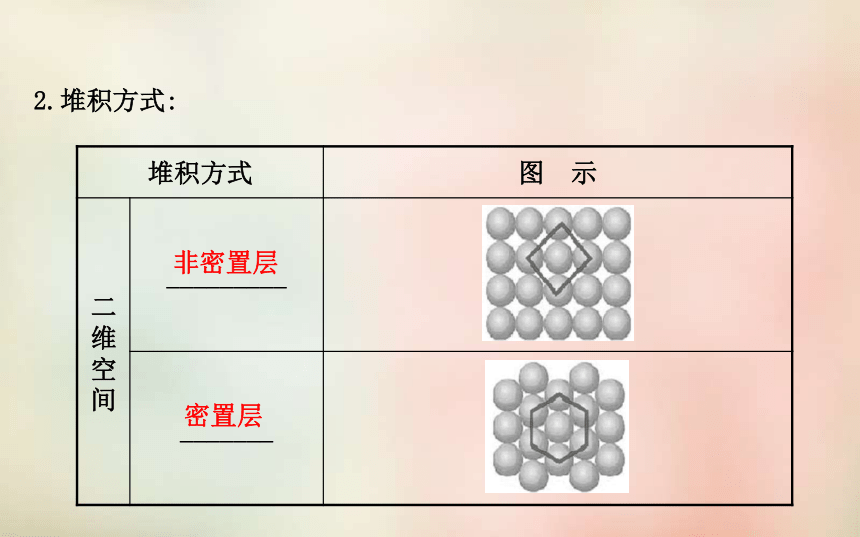
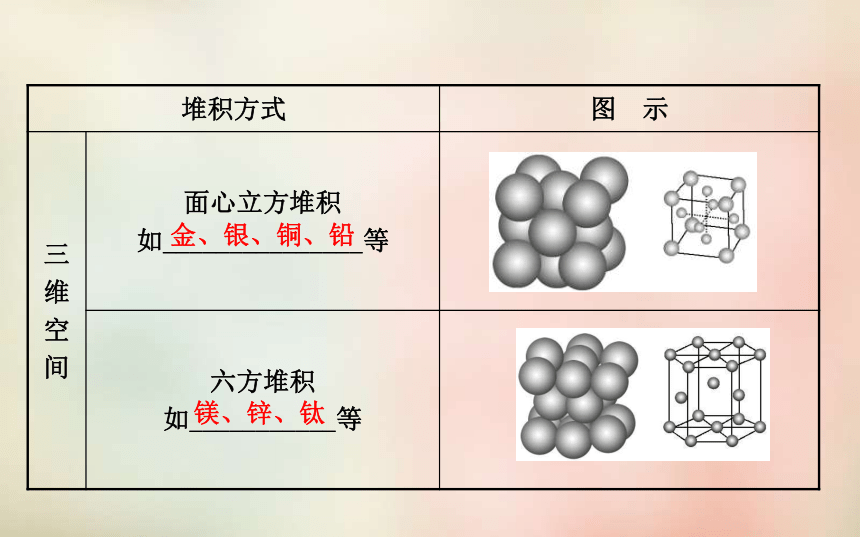
_________延伸的。规则的几何外形晶体结构特征连续重复2.堆积方式:非密置层密置层钋钠、钾、铬、钼、钨金、银、铜、铅镁、锌、钛3.合金:
(1)定义。
一种金属与另一种或几种_____(或_______)的融合体。
(2)性能。
①合金的熔点比各成分金属都要___。
②合金比各成分金属具有更好的硬度、强度和机械加工性能。金属非金属低【自我小测】
1.思考辨析:
(1)金属被制成各种形状时金属键没有被破坏。 ( )
分析:√。金属受到外力作用时,只是各层之间发生滑动,金属键没有被破坏。
(2)金属导电和电解质导电的原理一样。 ( )
分析:×。金属导电是自由电子的定向移动,是物理变化,电解质溶液导电实际是电解过程,为化学变化。(3)晶胞中的一个微粒都属于该晶胞独立拥有。 ( )
分析:×。晶胞是晶体的重复单位,所以晶胞中一个微粒可能被几个晶胞共有。
(4)金属晶体绝大多数采用密堆积方式。 ( )
分析:√。由于金属键没有饱和性和方向性,金属原子能从各个方向相互靠近,彼此相切,紧密堆积成晶体,密堆积能充分利用空间,使晶体能量降低。(5)合金所有的性能都低于其成分金属。 ( )
分析:×。合金的熔、沸点低于成分金属,但在强度、硬度、韧性等方面会强于成分金属。2.金属晶体的形成是因为晶体中存在 ( )
①金属原子 ②金属离子 ③自由电子 ④阴离子
A.只有① B.只有③ C.②③ D.②④
【解析】选C。金属原子失去部分或者全部外围电子形成的金属离子,与“脱落”下的自由电子相互作用形成金属晶体。3.下列有关金属键的叙述错误的是 ( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
【解析】选B。金属离子与自由电子的静电作用,包括引力和斥力,其中电子属于整块金属,金属键的强弱决定金属的性质,自由电子被整块电子共用,因此无方向性和饱和性。4.如图这种堆积方式是 ( )
A.面心立方堆积
B.简单立方堆积
C.六方堆积
D.体心立方堆积
【解析】选B。简单立方堆积只有晶胞的8个顶点有原子。5.(SJ·P37改编)金属钾、铜的部分结构和性质的数据如下表所示,则下列说法错误的是 ( )A.单位体积内自由电子数目:KB.金属键强弱顺序为KC.金属的硬度大小顺序为KD.两者最外层电子数目相等,因此其金属键的强弱取决于原子半径大小【解析】选D。决定金属键强弱的因素是单位体积内自由电子数目和原子半径的大小,金属键越强,金属的熔沸点越高,硬度越大;金属单位体积内自由电子的数目则取决于金属的外围电子数目,而不是金属的最外层电子数目。6.某晶胞结构如图所示,该晶胞中含有的原子个数为 ( )
A.1个 B.2个 C.8个 D.9个
【解析】选B。该晶胞中含有的原子个数为1×1+8× =2个。一、金属键与金属性质的关系
1.金属键:2.金属键对金属物理性质的影响:【拓展深化】金属熔、沸点高低递变规律
(1)同一周期,从左到右熔沸点依次升高;
(2)同主族,从上到下(如碱金属)熔、沸点依次降低;
(3)合金的熔、沸点比其成分金属的熔、沸点都低;
(4)金属汞是常温下唯一呈液体的金属。【针对训练】
1.(2015·武汉高二检测)要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小有关。铝钠合金有着广泛的应用,现有三种晶体:①铝、②钠、③铝钠合金,它们的熔点从低到高的顺序是 ( )
A.①②③ B.②①③
C.③②① D.③①②【解题指南】解答本题时要注意以下3点:
(1)金属键的成键微粒是金属离子和自由电子;
(2)金属键的强弱决定了金属熔沸点高低;
(3)可以用“三看法”比较原子或离子的半径。
【解析】选C。三种晶体中,一般合金的熔点低于组成金属单质的熔点,而铝与钠比较,钠的熔点较低。【方法规律】金属键对金属物理性质的影响
(1)金属键越强,金属熔、沸点越高。
(2)金属键越强,金属硬度越大。
(3)金属键越强,金属越难失电子,金属性越弱,如Na的金属键强于K,则Na比K难失电子,金属性Na比K弱。2.(2015·南昌高二检测)关于金属性质和原因的描述不正确的
是 ( )
A.金属键影响金属的物理性质
B.金属导电与电解质溶液导电一样,都是阴阳离子定向移动引起的
C.金属具有良好的导热性能,是因为自由电子在受热后,加快了运动速度,自由电子通过与金属离子发生碰撞,传递了能量
D.金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破坏金属键【解析】选B。金属具有金属光泽、有导电性、导热性、延展性等物理性质,这些都与金属键有关;金属导电性是在外加电场作用下,自由电子定向移动形成电流;导热性是自由电子受热后,与金属离子发生碰撞,传递能量;良好的延展性是由于金属晶体中原子层能够滑动,但此时金属键未被破坏。【补偿训练】1.下列说法正确的是 ( )
A.晶体是具有一定几何外观的,所以汞不属于金属晶体
B.金属一般具有较高的硬度,而钠可以用小刀切,但钠属于金属晶体
C.塑料具有一定的延展性,所以属于金属晶体
D.金属晶体一般具有较高的硬度,所以金刚石属于金属晶体
【解析】选B。汞在固态时也是金属晶体,所以A错误;钠是金属,所以是金属晶体,B正确;塑料和金刚石不是金属,不可能是金属晶体,C、D错误。2.下列关于金属及金属键的说法正确的是 ( )
A.金属键具有方向性和饱和性
B.金属键是金属阳离子与自由电子间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属阳离子吸收并放出可见光【解析】选B。A项,金属键是金属阳离子和自由电子之间的相互作用,自由电子属于整个晶体,不具有方向性和饱和性;C项,金属导电是因在外加电场作用下,自由电子的定向移动形成电流;D项,自由电子对可见光的选择性吸收和反射使得金属晶体具有金属光泽和一定颜色。二、金属晶体的堆积方式以及晶胞的有关计算
【自主导练】
1.(2015·淄博高二检测)现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知:
(1)甲晶体中X与Y的个数比是 ;
(2)乙晶体中A与B的个数比是 ;
(3)一个丙晶胞中有 个C粒子,有 个D粒子。【解题指南】解答本题注意以下两点:
(1)根据均摊法确定一个晶胞中所含的微粒数;
(2)晶胞是晶体中的最小重复单元,它向三维空间内延伸。【解析】根据均摊法:甲中体心X为1,顶点Y为 ×6,所以
X∶Y=1∶ =4∶3;同理可计算出乙、丙中微粒个数及其比值。
答案:(1)4∶3 (2)1∶1 (3)4 4【互动探究】
(1)甲晶体的化学式是什么?
提示:由于该晶体中两种微粒的个数之比为4∶3,因此该晶体的化学式为X4Y3。
(2)丙晶胞中距离C粒子等距离且最近的D粒子有多少个?
提示:以体心位置的C粒子为例,与它等距离且最近的D粒子应该在晶胞中六个面的面心位置,共6个。2.(1)如图所示为二维平面晶体示意图,所表示的化学式为AX3的是 。(2)如图为一个金属铜的晶胞,请完成以下各题。①该晶胞“实际”拥有的铜原子数是 个。
②该晶胞称为 。(填序号)
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
③此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度为ρg·cm-3,则阿伏加德罗常数为 (用a、ρ表示)。【解析】(1)由图中直接相邻的原子数可以求得a、b中的原子数之比
分别为1∶2、1∶3,求出化学式分别为AX2、AX3,故答案为b。
(2)①用“均摊法”:8× +6× =4;②该晶胞为面心立方晶胞;③ ·64=ρ·a3,NA= 。
答案:(1)b (2)①4 ②C ③【总结归纳】
1.晶胞中粒子数目的计算——均摊法:如某个粒子为n个晶胞所共
有,则该粒子有 属于这个晶胞。
长方体(正方体)晶胞中不同位置的粒子数的计算:2.晶胞密度的有关计算。
假设某晶体的晶胞如图所示,以M表示该晶体的摩尔质量,NA表示阿伏加德罗常数,N表示一个晶胞中所含的微粒数,a表示晶胞的棱长,ρ表示晶体的密度,计算如下:
该晶胞的质量用密度表示:m=ρ·a3
用摩尔质量表示:m=
则有:ρ·a3=【警示】晶胞计算注意问题
(1)利用均摊法计算晶胞中的原子个数时,不同位置的原子对晶胞的
贡献不同:立方晶胞中顶点贡献 ,棱上贡献 ,面上贡献 ,晶胞中
的原子属于该晶胞。
(2)进行晶胞相关计算时,注意棱长不一定是原子的直径或两种原子半径之和,计算时要看清晶胞的结构,找出棱长与原子半径的数学关系。(3)注意晶胞计算公式中各符号的含义和单位,计算时需将相对分子
质量代入,需化简时要化简。
(4)立方晶胞的面对角线与边长a的关系:面对角线等于 a;晶胞的
体对角线与边长的关系:体对角线等于 a。
(5)晶体的密度是晶体的质量与晶体体积的比值,可把晶胞扩大阿伏加德罗常数(NA)倍,再进行计算。【针对训练】
1.某晶体的一部分如图所示,这种晶体中A、B、
C三种粒子数之比是 ( )
A.3∶9∶4 B.1∶4∶2
C.2∶9∶4 D.3∶8∶4【解析】选B。晶胞中A原子位于顶点,为12个晶胞共有,故晶胞中
含有A原子6× 个;B原子位于棱上,底面棱上的B原子为4个
晶胞共有,侧面棱上的B原子为6个晶胞共有,故晶胞中含有B原子
6× +3× =2个;C原子位于晶胞中心,故晶胞中含有C原子1个,
A、B、C三种原子的个数比为 ∶2∶1=1∶4∶2。2.(2015·南京高二检测)金属钠晶体为体心立方堆积(晶胞如图),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为 ( )【解析】选C。根据题给信息,一个钠晶体的晶胞中有2个钠原子
(金属钠晶体为体心立方堆积,钠原子个数= ×8+1=2)。若钠原
子的半径为r(cm),则晶胞的体对角线为4r(cm),那么晶胞的
体积为( )3 cm3,根据密度= ,得ρ=
转换得r= 选C。
第一单元 金属键 金属晶体一、金属键与金属特性
1.金属键:金属离子自由电子相互作用金属阳离子自由电子金属单质合金中无方向性和饱和性原子半径自由电子2.金属键理论对金属物理性质的解释:
(1)导电性。
在外电场作用下,自由电子将会发生_________,形成电流。
(2)导热性。
金属受热时,自由电子与金属离子(或金属原子)的碰撞频率增加,
_________把能量传给_____________________,从而把能量从温度
高的区域传到温度低的区域。定向运动自由电子金属离子(或金属原子)(3)延展性。
金属键没有方向性,在外力作用下,金属原子间发生相对滑动时,
各层金属原子间保持_______的作用,不会断裂。金属键二、金属晶体
1.含义:
(1)晶体:具有_______________的固体,晶体外形规则是其内部
结构规则的外部表现,构成晶体的粒子的排列是有规则的。
(2)晶胞:能够反映_____________的基本重复单位,它在空间是
_________延伸的。规则的几何外形晶体结构特征连续重复2.堆积方式:非密置层密置层钋钠、钾、铬、钼、钨金、银、铜、铅镁、锌、钛3.合金:
(1)定义。
一种金属与另一种或几种_____(或_______)的融合体。
(2)性能。
①合金的熔点比各成分金属都要___。
②合金比各成分金属具有更好的硬度、强度和机械加工性能。金属非金属低【自我小测】
1.思考辨析:
(1)金属被制成各种形状时金属键没有被破坏。 ( )
分析:√。金属受到外力作用时,只是各层之间发生滑动,金属键没有被破坏。
(2)金属导电和电解质导电的原理一样。 ( )
分析:×。金属导电是自由电子的定向移动,是物理变化,电解质溶液导电实际是电解过程,为化学变化。(3)晶胞中的一个微粒都属于该晶胞独立拥有。 ( )
分析:×。晶胞是晶体的重复单位,所以晶胞中一个微粒可能被几个晶胞共有。
(4)金属晶体绝大多数采用密堆积方式。 ( )
分析:√。由于金属键没有饱和性和方向性,金属原子能从各个方向相互靠近,彼此相切,紧密堆积成晶体,密堆积能充分利用空间,使晶体能量降低。(5)合金所有的性能都低于其成分金属。 ( )
分析:×。合金的熔、沸点低于成分金属,但在强度、硬度、韧性等方面会强于成分金属。2.金属晶体的形成是因为晶体中存在 ( )
①金属原子 ②金属离子 ③自由电子 ④阴离子
A.只有① B.只有③ C.②③ D.②④
【解析】选C。金属原子失去部分或者全部外围电子形成的金属离子,与“脱落”下的自由电子相互作用形成金属晶体。3.下列有关金属键的叙述错误的是 ( )
A.金属键没有饱和性和方向性
B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
C.金属键中的电子属于整块金属
D.金属的性质和金属固体的形成都与金属键有关
【解析】选B。金属离子与自由电子的静电作用,包括引力和斥力,其中电子属于整块金属,金属键的强弱决定金属的性质,自由电子被整块电子共用,因此无方向性和饱和性。4.如图这种堆积方式是 ( )
A.面心立方堆积
B.简单立方堆积
C.六方堆积
D.体心立方堆积
【解析】选B。简单立方堆积只有晶胞的8个顶点有原子。5.(SJ·P37改编)金属钾、铜的部分结构和性质的数据如下表所示,则下列说法错误的是 ( )A.单位体积内自由电子数目:K
A.1个 B.2个 C.8个 D.9个
【解析】选B。该晶胞中含有的原子个数为1×1+8× =2个。一、金属键与金属性质的关系
1.金属键:2.金属键对金属物理性质的影响:【拓展深化】金属熔、沸点高低递变规律
(1)同一周期,从左到右熔沸点依次升高;
(2)同主族,从上到下(如碱金属)熔、沸点依次降低;
(3)合金的熔、沸点比其成分金属的熔、沸点都低;
(4)金属汞是常温下唯一呈液体的金属。【针对训练】
1.(2015·武汉高二检测)要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小有关。铝钠合金有着广泛的应用,现有三种晶体:①铝、②钠、③铝钠合金,它们的熔点从低到高的顺序是 ( )
A.①②③ B.②①③
C.③②① D.③①②【解题指南】解答本题时要注意以下3点:
(1)金属键的成键微粒是金属离子和自由电子;
(2)金属键的强弱决定了金属熔沸点高低;
(3)可以用“三看法”比较原子或离子的半径。
【解析】选C。三种晶体中,一般合金的熔点低于组成金属单质的熔点,而铝与钠比较,钠的熔点较低。【方法规律】金属键对金属物理性质的影响
(1)金属键越强,金属熔、沸点越高。
(2)金属键越强,金属硬度越大。
(3)金属键越强,金属越难失电子,金属性越弱,如Na的金属键强于K,则Na比K难失电子,金属性Na比K弱。2.(2015·南昌高二检测)关于金属性质和原因的描述不正确的
是 ( )
A.金属键影响金属的物理性质
B.金属导电与电解质溶液导电一样,都是阴阳离子定向移动引起的
C.金属具有良好的导热性能,是因为自由电子在受热后,加快了运动速度,自由电子通过与金属离子发生碰撞,传递了能量
D.金属晶体具有良好的延展性,是因为金属晶体中的原子层可以滑动而不破坏金属键【解析】选B。金属具有金属光泽、有导电性、导热性、延展性等物理性质,这些都与金属键有关;金属导电性是在外加电场作用下,自由电子定向移动形成电流;导热性是自由电子受热后,与金属离子发生碰撞,传递能量;良好的延展性是由于金属晶体中原子层能够滑动,但此时金属键未被破坏。【补偿训练】1.下列说法正确的是 ( )
A.晶体是具有一定几何外观的,所以汞不属于金属晶体
B.金属一般具有较高的硬度,而钠可以用小刀切,但钠属于金属晶体
C.塑料具有一定的延展性,所以属于金属晶体
D.金属晶体一般具有较高的硬度,所以金刚石属于金属晶体
【解析】选B。汞在固态时也是金属晶体,所以A错误;钠是金属,所以是金属晶体,B正确;塑料和金刚石不是金属,不可能是金属晶体,C、D错误。2.下列关于金属及金属键的说法正确的是 ( )
A.金属键具有方向性和饱和性
B.金属键是金属阳离子与自由电子间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属阳离子吸收并放出可见光【解析】选B。A项,金属键是金属阳离子和自由电子之间的相互作用,自由电子属于整个晶体,不具有方向性和饱和性;C项,金属导电是因在外加电场作用下,自由电子的定向移动形成电流;D项,自由电子对可见光的选择性吸收和反射使得金属晶体具有金属光泽和一定颜色。二、金属晶体的堆积方式以及晶胞的有关计算
【自主导练】
1.(2015·淄博高二检测)现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知:
(1)甲晶体中X与Y的个数比是 ;
(2)乙晶体中A与B的个数比是 ;
(3)一个丙晶胞中有 个C粒子,有 个D粒子。【解题指南】解答本题注意以下两点:
(1)根据均摊法确定一个晶胞中所含的微粒数;
(2)晶胞是晶体中的最小重复单元,它向三维空间内延伸。【解析】根据均摊法:甲中体心X为1,顶点Y为 ×6,所以
X∶Y=1∶ =4∶3;同理可计算出乙、丙中微粒个数及其比值。
答案:(1)4∶3 (2)1∶1 (3)4 4【互动探究】
(1)甲晶体的化学式是什么?
提示:由于该晶体中两种微粒的个数之比为4∶3,因此该晶体的化学式为X4Y3。
(2)丙晶胞中距离C粒子等距离且最近的D粒子有多少个?
提示:以体心位置的C粒子为例,与它等距离且最近的D粒子应该在晶胞中六个面的面心位置,共6个。2.(1)如图所示为二维平面晶体示意图,所表示的化学式为AX3的是 。(2)如图为一个金属铜的晶胞,请完成以下各题。①该晶胞“实际”拥有的铜原子数是 个。
②该晶胞称为 。(填序号)
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
③此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度为ρg·cm-3,则阿伏加德罗常数为 (用a、ρ表示)。【解析】(1)由图中直接相邻的原子数可以求得a、b中的原子数之比
分别为1∶2、1∶3,求出化学式分别为AX2、AX3,故答案为b。
(2)①用“均摊法”:8× +6× =4;②该晶胞为面心立方晶胞;③ ·64=ρ·a3,NA= 。
答案:(1)b (2)①4 ②C ③【总结归纳】
1.晶胞中粒子数目的计算——均摊法:如某个粒子为n个晶胞所共
有,则该粒子有 属于这个晶胞。
长方体(正方体)晶胞中不同位置的粒子数的计算:2.晶胞密度的有关计算。
假设某晶体的晶胞如图所示,以M表示该晶体的摩尔质量,NA表示阿伏加德罗常数,N表示一个晶胞中所含的微粒数,a表示晶胞的棱长,ρ表示晶体的密度,计算如下:
该晶胞的质量用密度表示:m=ρ·a3
用摩尔质量表示:m=
则有:ρ·a3=【警示】晶胞计算注意问题
(1)利用均摊法计算晶胞中的原子个数时,不同位置的原子对晶胞的
贡献不同:立方晶胞中顶点贡献 ,棱上贡献 ,面上贡献 ,晶胞中
的原子属于该晶胞。
(2)进行晶胞相关计算时,注意棱长不一定是原子的直径或两种原子半径之和,计算时要看清晶胞的结构,找出棱长与原子半径的数学关系。(3)注意晶胞计算公式中各符号的含义和单位,计算时需将相对分子
质量代入,需化简时要化简。
(4)立方晶胞的面对角线与边长a的关系:面对角线等于 a;晶胞的
体对角线与边长的关系:体对角线等于 a。
(5)晶体的密度是晶体的质量与晶体体积的比值,可把晶胞扩大阿伏加德罗常数(NA)倍,再进行计算。【针对训练】
1.某晶体的一部分如图所示,这种晶体中A、B、
C三种粒子数之比是 ( )
A.3∶9∶4 B.1∶4∶2
C.2∶9∶4 D.3∶8∶4【解析】选B。晶胞中A原子位于顶点,为12个晶胞共有,故晶胞中
含有A原子6× 个;B原子位于棱上,底面棱上的B原子为4个
晶胞共有,侧面棱上的B原子为6个晶胞共有,故晶胞中含有B原子
6× +3× =2个;C原子位于晶胞中心,故晶胞中含有C原子1个,
A、B、C三种原子的个数比为 ∶2∶1=1∶4∶2。2.(2015·南京高二检测)金属钠晶体为体心立方堆积(晶胞如图),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为 ( )【解析】选C。根据题给信息,一个钠晶体的晶胞中有2个钠原子
(金属钠晶体为体心立方堆积,钠原子个数= ×8+1=2)。若钠原
子的半径为r(cm),则晶胞的体对角线为4r(cm),那么晶胞的
体积为( )3 cm3,根据密度= ,得ρ=
转换得r= 选C。
