【世纪金榜】2015-2016学年高中化学 3.2离子键 离子晶体课件 苏教版选修3
文档属性
| 名称 | 【世纪金榜】2015-2016学年高中化学 3.2离子键 离子晶体课件 苏教版选修3 |

|
|
| 格式 | zip | ||
| 文件大小 | 550.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-09 20:46:53 | ||
图片预览











文档简介
课件46张PPT。第二单元
离子键 离子晶体一、离子键阴、阳离子静电作用活泼的金属元素活泼的非金属元素阴、阳离子静电作用无方向性和饱和性二、离子晶体
1.概念及性质:阴、阳离子离子键阴、阳离子离子键硬度熔点2.晶格能(符号为U):
(1)定义:拆开______离子晶体使之形成_____阴离子和阳离子所
_____的能量。
(2)晶格能与晶体物理性质的关系。
①晶格能越___,离子键越_____,离子晶体的熔、沸点越___,硬度
越大。
②离子所带电荷_____,离子半径_____,晶格能越大。1 mol气态吸收大牢固高越多越小3.离子晶体的结构类型:(1)氯化钠型(如图)。
①在晶体中,每个Na+或Cl-周围各排列__个带有相反电荷的离子。
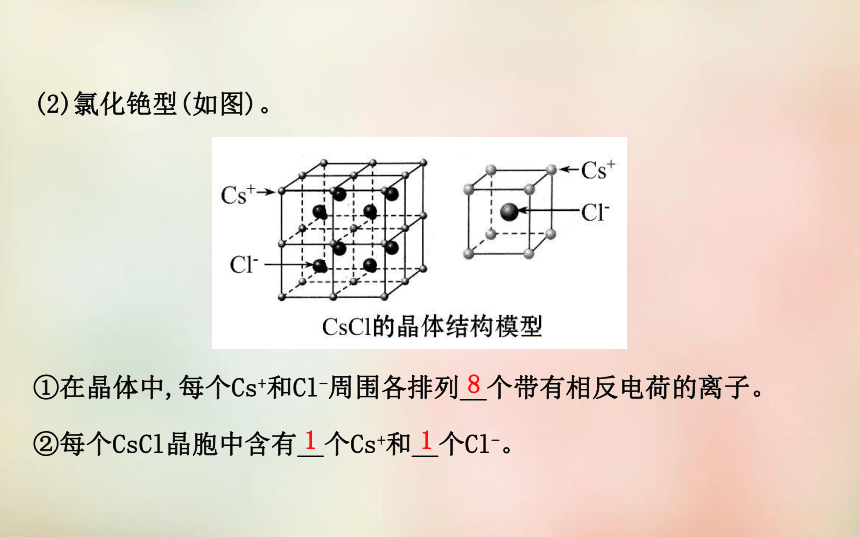
②每个NaCl晶胞中含有__个Na+和__个Cl-。644(2)氯化铯型(如图)。
①在晶体中,每个Cs+和Cl-周围各排列__个带有相反电荷的离子。
②每个CsCl晶胞中含有__个Cs+和__个Cl-。811【自我小测】
1.思考辨析:
(1)离子键是阴、阳离子间强烈的相互吸引作用。 ( )
分析:×。离子键是阴、阳离子间强烈的静电作用。静电作用既包括阴、阳离子的相互吸引作用,也包括离子间的排斥作用。
(2)离子半径越小,所带电荷越多,离子键越强。 ( )
分析:√。离子半径越小,所带电荷越多,晶格能越大,离子键越强。(3)活泼的金属元素和活泼的非金属元素间一定能形成离子
键。 ( )
分析:×。活泼的金属元素和活泼的非金属元素之间不一定形成离子键,如铝元素和氯元素形成的AlCl3是以共价键相结合。
(4)NaCl晶体的化学式为NaCl,因此晶胞中Na+与Cl-个数分别
为1。 ( )
分析:×。离子晶体的化学式是晶胞中微粒的个数之比。NaCl晶胞中Na+和Cl-分别为4个。(5)MgO的熔、沸点和硬度均高于CaO。 ( )
分析:√。MgO和CaO比较,O2-相同,Mg2+与Ca2+所带电荷数相同,但Mg2+半径小,所以晶格能MgO>CaO,熔、沸点MgO>CaO,硬度MgO>CaO。2.(SJ·P42改编)下列各组数值是相应元素的原子序数,其中所表示的原子能以离子键结合成AB2型化合物的是 ( )
A.1与6 B.8与12
C.9与12 D.8与14
【解析】选C。其中氧元素与氟元素分别与镁元素形成离子化合物,但是氧元素与镁元素形成AB型化合物。3.离子晶体不可能具有的性质是 ( )
A.较高的熔、沸点 B.良好的导电性
C.溶于极性溶剂 D.坚硬而易粉碎
【解析】选B。离子晶体一般不具有导电性。4.下列关于晶格能的说法中正确的是 ( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指由气态阴离子和气态阳离子相结合生成1 mol离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
【解析】选C。晶格能指拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量,其逆过程释放的能量也是晶格能。5.下列说法正确的是 ( )
A.金属元素与非金属元素化合时一定形成离子键
B.非金属元素的原子间不可能形成离子键
C.阴、阳离子之间相互吸引形成离子键
D.离子键没有方向性和饱和性【解析】选D。AlCl3为分子晶体,铝元素与氯元素形成的是共价键,
故A错;NH4NO3中无金属元素,但N 与N 之间形成的是离子键,故B错;离子键的实质是阴、阳离子之间的相互作用,而此相互作用既包括阴、阳离子之间的相互引力,又包括原子核与电子之间的相互引力、原子核之间的相互斥力,还包括核外电子之间的相互斥力,故C错。6.(双选)(SJ·P42改编)具有下列外围电子排布式的基态原子中,能形成离子化合物的是 ( )
A.2s22p2与2s22p4 B.3s23p4与2s22p4
C.3s2与2s22p5 D.3s2与2s22p4
【解析】选C、D。A选项中的两种元素为C与O,形成CO2;B项中的两种元素为S与O,可以形成SO2;C项中的两元素形成离子化合物MgF2;D项为Mg与O两元素,形成离子化合物MgO。一、离子晶体的性质
1.离子晶体的物理性质及其原因:2.离子晶体熔沸点高低的比较:
(1)离子晶体晶格能越大,熔、沸点越高。离子半径越小,离子所带电荷越多,晶格能越大。
(2)离子核外电子排布相同时,核电荷数越大,离子半径越小。
(3)离子最外层电子数相同时,电子层数越多,离子半径越大。【点拨】离子晶体中的“不一定”
(1)离子晶体中不一定都含有金属元素,如NH4NO3晶体。
(2)离子晶体的熔点不一定低于原子晶体,如MgO的熔点(2 852℃)高于SiO2的熔点(1 610℃)。
(3)离子晶体中除含离子键外不一定不含其他化学键,如CH3COONH4中除含离子键外,还含有共价键、配位键。(4)由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是分子晶体。
(5)含有阳离子的晶体不一定是离子晶体,也可能是金属晶体。
(6)离子晶体中不一定不含分子,如CuSO4·5H2O晶体。【针对训练】
1.(2015·天津高二检测)NaF、NaI和MgO均为离子晶体,有关数据如表:试判断这三种化合物熔点由高到低的顺序是 ( )
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
【解题指南】解答本题注意以下两点:
(1)离子半径的大小和离子电荷数的多少决定离子键的强弱。
(2)离子键的强弱决定离子晶体熔沸点的高低。【解析】选B。本题考查离子晶体熔点高低的判断方法。离子晶体的熔点与晶格能有关。晶格能越大,晶体的熔点就越高。晶格能与离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。在上述三种晶体中,MgO的键长最短,离子电荷数又高,故其晶格能最大,熔点最高;NaF的核间距小于NaI,故NaF的晶格能大于NaI,熔点高于NaI。【方法规律】离子半径大小的比较方法
(1)同一元素的阴离子半径大于原子半径;阳离子半径小于原子半
径,且阳离子的电荷数越多,半径越小。如r(F-)>r(F),r(Fe3+)<
r(Fe2+)(2)同周期电子层结构相同的阳离子的半径随离子的电荷数增加而
减小,阴离子的半径随离子的电荷数增加而增大。如r(Na+)>r(Mg2+)>r(Al3+),r(F-)(3)同主族元素电荷数相同的离子半径随离子的电子层数增加而增大。如r(F-)①固态时不导电,熔融状态导电 ②能溶于水,其水溶液导电
③低熔点 ④高沸点 ⑤易升华
A.①②③ B.①②④
C.①④⑤ D.②③④
【解析】选B。卤素与碱金属形成的化合物为典型的离子化合物,具备离子晶体的性质。【补偿训练】1.(2015·平顶山高二检测)离子晶体熔点的高低取决于晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是 ( )
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>KCl>NaCl D.CaO>BaO>NaCl>KCl【解析】选D。对于离子晶体来说,离子所带电荷数越多,阴、阳离子核间距离越小,晶格能越大,离子键越强,熔点越高,阳离子半径大小顺序为Ba2+>K+>Ca2+>Na+;阴离子半径:Cl->O2-,比较可得只有D项是正确的。2.(2015·金华高二检测)下列说法正确的是 ( )
A.含有金属元素的化合物一定是离子化合物
B.ⅠA族和ⅦA族原子化合时,一定形成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,可能形成离子键
【解析】选D。AlCl3中含有金属元素,但AlCl3不是离子化合物,故A错;ⅠA族中的H与ⅦA族中的Cl形成HCl时,不含离子键,故B错;NH4Cl是由非金属元素构成的离子化合物,故C错。二、离子晶体的结构
【自主导练】
1.(2015·济宁高二检测)NaCl晶体模型如图所示:(1)在NaCl晶体中,每个Na+周围同时吸引 个Cl-,每个Cl-周
围同时吸引着 个Na+。
(2)在NaCl晶胞中含有 个Na+、 个Cl-,晶体中每个
Na+周围与它距离最近且相等的Na+共有 个。
(3)假设晶胞的边长为a,那么钠离子和氯离子的最近距离是 。【解题指南】解答本题应注意以下两点:
(1)配位数是最邻近的等距离的带相反电荷的离子。
(2)利用“均摊法”计算晶体中拥有粒子数目。【解析】在氯化钠晶体中,一个Na+位于晶胞的中心,12个Na+分别位于
晶胞的12条棱上,则属于该晶胞的Na+相当于3个( ×12=3,棱边上的
每个Na+同时被4个晶胞共用,属于该晶胞的Na+仅占 ),因此一个晶胞
中共含有4个Na+;8个Cl-分别位于晶胞的8个顶点上,则属于该晶胞的
Cl-相当于1个( ×8=1,顶点上的每个Cl-同时被8个晶胞共用,属于该
晶胞的Cl-仅占 ),6个Cl-分别位于晶胞的6个面心上,则属于该晶胞
的Cl-相当于3个( ×6=3,面心上的每个Cl-同时被2个晶胞共用,属于
该晶胞的Cl-仅占 ),所以一个晶胞中共含有4个Cl-。可见NaCl晶体中Na+、Cl-的个数比为1∶1。图中位于晶胞中心的Na+实际上共有3个平面通过它,通过中心Na+的每个平面都有4个Na+位于平面的四角,这4个Na+与中心Na+距离最近且相等。所以在NaCl晶体中,每个Na+周围与它距离最近且相等的Na+共有12个。距离体心位置的钠离子最近的氯离子在晶胞的六个面的面心位置,因此两离子之间的距离为a/2。
答案:(1)6 6 (2)4 4 12 (3)a/2【互动探究】(1)上题(2)中Na+周围等距且最近的Na+数目就是它的配位数吗?
提示:不是,配位数是指距离最近的带异性电荷离子的个数,Na+的配位数是6。
(2)图中钠离子比氯离子的半径小,原因是什么?
提示:钠离子的核外电子有两层,氯离子的核外电子有三层,因此钠离子半径小于氯离子半径。2.某离子晶体的晶胞结构如右图所示,
则该离子晶体的化学式为( )
A.abc B.abc3
C.ab2c3 D.ab3c
【解析】选D。a位于晶胞内部,属于该晶胞;b位于棱上,每个晶胞中
含有b:12× =3个;c位于顶点,每个晶胞中含有c:8× =1个,因此该晶体的化学式为ab3c。【易错提醒】计算晶胞中微粒个数时的易错点
不同形状的晶胞,相同位置的粒子对晶胞的贡献不一定相同,如同是
位于棱上,正方体晶胞中粒子对晶胞的贡献是 ,三棱柱晶胞中粒子
对晶胞的贡献是 或 ,六棱柱晶胞中粒子对晶胞的贡献为 或 。
因此计算时要注意晶胞的不同形状。【总结归纳】
1.AB型离子晶体的空间结构:
常见的AB型离子晶体有NaCl型、CsCl型2.影响配位数的因素:
(1)因为离子键没有方向性,所以离子的电荷不影响配位数。阴、阳离子的半径比值(r+/r-)影响配位数的多少,半径大小比值越大,配位数就越大。(2)化合物的组成比例也是影响配位数的一个重要因素。【警示】(1)离子晶体除含有离子键外,还可能有共价键,如Na2O2、NaOH、NH4Cl晶体。
(2)离子晶体的化学式仅表示晶体中阴、阳离子的个数比,并不代表其分子组成,因为离子晶体中没有分子。
(3)推断离子晶体的性质要从离子键的强弱入手,而判断离子键的强弱一般要从离子半径入手,所以掌握离子半径比较方法是解决这类问题的前提条件。【拓展深化】晶体化学式的确定方法
(1)根据晶胞中粒子位置的特点,利用均摊法确定晶胞中每种粒子的个数。
(2)根据各粒子的最简个数比书写化学式。
(3)某些晶胞可能是长方体型、六棱柱型、三棱柱型等,注意不同晶胞的不同特点。【针对训练】
(2015·邯郸高二检测)如图所示是从NaCl或CsCl晶体结构中分割出
来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)【解析】选C。NaCl晶胞是立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+等距离的Cl-有6个,且构成正八面体,同理,与每个Cl-等距离的6个Na+也构成正八面体,由此可知图(1)和(4)属于从NaCl晶体中分割出来的,C项正确。【补偿训练】(2015·铜川高二检测)
元素X的某价态离子Xn+中所有电子正好充满K、L、
M三个电子层,它与N3-形成晶体的晶胞结构如图所示。
(1)该晶体的阳离子与阴离子个数比为_________
_________________________________________。
(2)该晶体中Xn+中n=____________________。
(3)X元素的原子序数是________________。
(4)晶体中每个N3-被 个等距离的Xn+包围。【解析】(1)Xn+位于晶胞的棱上,其数目为12× =3个,N3-位于晶胞
的顶点,其数目为8× =1个,故其个数比为3∶1。
(2)由晶体的化学式X3N知X所带的电荷数为1。(3)因为X+的K、L、M三个电子层正好充满,故为2、8、18,所以X的原子序数是29。(4)N3-位于晶胞顶点,故其被6个X+在上、下、左、右、前、后包围。
答案:(1)3∶1 (2)1 (3)29 (4)6
离子键 离子晶体一、离子键阴、阳离子静电作用活泼的金属元素活泼的非金属元素阴、阳离子静电作用无方向性和饱和性二、离子晶体
1.概念及性质:阴、阳离子离子键阴、阳离子离子键硬度熔点2.晶格能(符号为U):
(1)定义:拆开______离子晶体使之形成_____阴离子和阳离子所
_____的能量。
(2)晶格能与晶体物理性质的关系。
①晶格能越___,离子键越_____,离子晶体的熔、沸点越___,硬度
越大。
②离子所带电荷_____,离子半径_____,晶格能越大。1 mol气态吸收大牢固高越多越小3.离子晶体的结构类型:(1)氯化钠型(如图)。
①在晶体中,每个Na+或Cl-周围各排列__个带有相反电荷的离子。
②每个NaCl晶胞中含有__个Na+和__个Cl-。644(2)氯化铯型(如图)。
①在晶体中,每个Cs+和Cl-周围各排列__个带有相反电荷的离子。
②每个CsCl晶胞中含有__个Cs+和__个Cl-。811【自我小测】
1.思考辨析:
(1)离子键是阴、阳离子间强烈的相互吸引作用。 ( )
分析:×。离子键是阴、阳离子间强烈的静电作用。静电作用既包括阴、阳离子的相互吸引作用,也包括离子间的排斥作用。
(2)离子半径越小,所带电荷越多,离子键越强。 ( )
分析:√。离子半径越小,所带电荷越多,晶格能越大,离子键越强。(3)活泼的金属元素和活泼的非金属元素间一定能形成离子
键。 ( )
分析:×。活泼的金属元素和活泼的非金属元素之间不一定形成离子键,如铝元素和氯元素形成的AlCl3是以共价键相结合。
(4)NaCl晶体的化学式为NaCl,因此晶胞中Na+与Cl-个数分别
为1。 ( )
分析:×。离子晶体的化学式是晶胞中微粒的个数之比。NaCl晶胞中Na+和Cl-分别为4个。(5)MgO的熔、沸点和硬度均高于CaO。 ( )
分析:√。MgO和CaO比较,O2-相同,Mg2+与Ca2+所带电荷数相同,但Mg2+半径小,所以晶格能MgO>CaO,熔、沸点MgO>CaO,硬度MgO>CaO。2.(SJ·P42改编)下列各组数值是相应元素的原子序数,其中所表示的原子能以离子键结合成AB2型化合物的是 ( )
A.1与6 B.8与12
C.9与12 D.8与14
【解析】选C。其中氧元素与氟元素分别与镁元素形成离子化合物,但是氧元素与镁元素形成AB型化合物。3.离子晶体不可能具有的性质是 ( )
A.较高的熔、沸点 B.良好的导电性
C.溶于极性溶剂 D.坚硬而易粉碎
【解析】选B。离子晶体一般不具有导电性。4.下列关于晶格能的说法中正确的是 ( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指由气态阴离子和气态阳离子相结合生成1 mol离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
【解析】选C。晶格能指拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量,其逆过程释放的能量也是晶格能。5.下列说法正确的是 ( )
A.金属元素与非金属元素化合时一定形成离子键
B.非金属元素的原子间不可能形成离子键
C.阴、阳离子之间相互吸引形成离子键
D.离子键没有方向性和饱和性【解析】选D。AlCl3为分子晶体,铝元素与氯元素形成的是共价键,
故A错;NH4NO3中无金属元素,但N 与N 之间形成的是离子键,故B错;离子键的实质是阴、阳离子之间的相互作用,而此相互作用既包括阴、阳离子之间的相互引力,又包括原子核与电子之间的相互引力、原子核之间的相互斥力,还包括核外电子之间的相互斥力,故C错。6.(双选)(SJ·P42改编)具有下列外围电子排布式的基态原子中,能形成离子化合物的是 ( )
A.2s22p2与2s22p4 B.3s23p4与2s22p4
C.3s2与2s22p5 D.3s2与2s22p4
【解析】选C、D。A选项中的两种元素为C与O,形成CO2;B项中的两种元素为S与O,可以形成SO2;C项中的两元素形成离子化合物MgF2;D项为Mg与O两元素,形成离子化合物MgO。一、离子晶体的性质
1.离子晶体的物理性质及其原因:2.离子晶体熔沸点高低的比较:
(1)离子晶体晶格能越大,熔、沸点越高。离子半径越小,离子所带电荷越多,晶格能越大。
(2)离子核外电子排布相同时,核电荷数越大,离子半径越小。
(3)离子最外层电子数相同时,电子层数越多,离子半径越大。【点拨】离子晶体中的“不一定”
(1)离子晶体中不一定都含有金属元素,如NH4NO3晶体。
(2)离子晶体的熔点不一定低于原子晶体,如MgO的熔点(2 852℃)高于SiO2的熔点(1 610℃)。
(3)离子晶体中除含离子键外不一定不含其他化学键,如CH3COONH4中除含离子键外,还含有共价键、配位键。(4)由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是分子晶体。
(5)含有阳离子的晶体不一定是离子晶体,也可能是金属晶体。
(6)离子晶体中不一定不含分子,如CuSO4·5H2O晶体。【针对训练】
1.(2015·天津高二检测)NaF、NaI和MgO均为离子晶体,有关数据如表:试判断这三种化合物熔点由高到低的顺序是 ( )
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
【解题指南】解答本题注意以下两点:
(1)离子半径的大小和离子电荷数的多少决定离子键的强弱。
(2)离子键的强弱决定离子晶体熔沸点的高低。【解析】选B。本题考查离子晶体熔点高低的判断方法。离子晶体的熔点与晶格能有关。晶格能越大,晶体的熔点就越高。晶格能与离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。在上述三种晶体中,MgO的键长最短,离子电荷数又高,故其晶格能最大,熔点最高;NaF的核间距小于NaI,故NaF的晶格能大于NaI,熔点高于NaI。【方法规律】离子半径大小的比较方法
(1)同一元素的阴离子半径大于原子半径;阳离子半径小于原子半
径,且阳离子的电荷数越多,半径越小。如r(F-)>r(F),r(Fe3+)<
r(Fe2+)
减小,阴离子的半径随离子的电荷数增加而增大。如r(Na+)>r(Mg2+)>r(Al3+),r(F-)
③低熔点 ④高沸点 ⑤易升华
A.①②③ B.①②④
C.①④⑤ D.②③④
【解析】选B。卤素与碱金属形成的化合物为典型的离子化合物,具备离子晶体的性质。【补偿训练】1.(2015·平顶山高二检测)离子晶体熔点的高低取决于晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是 ( )
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>KCl>NaCl D.CaO>BaO>NaCl>KCl【解析】选D。对于离子晶体来说,离子所带电荷数越多,阴、阳离子核间距离越小,晶格能越大,离子键越强,熔点越高,阳离子半径大小顺序为Ba2+>K+>Ca2+>Na+;阴离子半径:Cl->O2-,比较可得只有D项是正确的。2.(2015·金华高二检测)下列说法正确的是 ( )
A.含有金属元素的化合物一定是离子化合物
B.ⅠA族和ⅦA族原子化合时,一定形成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,可能形成离子键
【解析】选D。AlCl3中含有金属元素,但AlCl3不是离子化合物,故A错;ⅠA族中的H与ⅦA族中的Cl形成HCl时,不含离子键,故B错;NH4Cl是由非金属元素构成的离子化合物,故C错。二、离子晶体的结构
【自主导练】
1.(2015·济宁高二检测)NaCl晶体模型如图所示:(1)在NaCl晶体中,每个Na+周围同时吸引 个Cl-,每个Cl-周
围同时吸引着 个Na+。
(2)在NaCl晶胞中含有 个Na+、 个Cl-,晶体中每个
Na+周围与它距离最近且相等的Na+共有 个。
(3)假设晶胞的边长为a,那么钠离子和氯离子的最近距离是 。【解题指南】解答本题应注意以下两点:
(1)配位数是最邻近的等距离的带相反电荷的离子。
(2)利用“均摊法”计算晶体中拥有粒子数目。【解析】在氯化钠晶体中,一个Na+位于晶胞的中心,12个Na+分别位于
晶胞的12条棱上,则属于该晶胞的Na+相当于3个( ×12=3,棱边上的
每个Na+同时被4个晶胞共用,属于该晶胞的Na+仅占 ),因此一个晶胞
中共含有4个Na+;8个Cl-分别位于晶胞的8个顶点上,则属于该晶胞的
Cl-相当于1个( ×8=1,顶点上的每个Cl-同时被8个晶胞共用,属于该
晶胞的Cl-仅占 ),6个Cl-分别位于晶胞的6个面心上,则属于该晶胞
的Cl-相当于3个( ×6=3,面心上的每个Cl-同时被2个晶胞共用,属于
该晶胞的Cl-仅占 ),所以一个晶胞中共含有4个Cl-。可见NaCl晶体中Na+、Cl-的个数比为1∶1。图中位于晶胞中心的Na+实际上共有3个平面通过它,通过中心Na+的每个平面都有4个Na+位于平面的四角,这4个Na+与中心Na+距离最近且相等。所以在NaCl晶体中,每个Na+周围与它距离最近且相等的Na+共有12个。距离体心位置的钠离子最近的氯离子在晶胞的六个面的面心位置,因此两离子之间的距离为a/2。
答案:(1)6 6 (2)4 4 12 (3)a/2【互动探究】(1)上题(2)中Na+周围等距且最近的Na+数目就是它的配位数吗?
提示:不是,配位数是指距离最近的带异性电荷离子的个数,Na+的配位数是6。
(2)图中钠离子比氯离子的半径小,原因是什么?
提示:钠离子的核外电子有两层,氯离子的核外电子有三层,因此钠离子半径小于氯离子半径。2.某离子晶体的晶胞结构如右图所示,
则该离子晶体的化学式为( )
A.abc B.abc3
C.ab2c3 D.ab3c
【解析】选D。a位于晶胞内部,属于该晶胞;b位于棱上,每个晶胞中
含有b:12× =3个;c位于顶点,每个晶胞中含有c:8× =1个,因此该晶体的化学式为ab3c。【易错提醒】计算晶胞中微粒个数时的易错点
不同形状的晶胞,相同位置的粒子对晶胞的贡献不一定相同,如同是
位于棱上,正方体晶胞中粒子对晶胞的贡献是 ,三棱柱晶胞中粒子
对晶胞的贡献是 或 ,六棱柱晶胞中粒子对晶胞的贡献为 或 。
因此计算时要注意晶胞的不同形状。【总结归纳】
1.AB型离子晶体的空间结构:
常见的AB型离子晶体有NaCl型、CsCl型2.影响配位数的因素:
(1)因为离子键没有方向性,所以离子的电荷不影响配位数。阴、阳离子的半径比值(r+/r-)影响配位数的多少,半径大小比值越大,配位数就越大。(2)化合物的组成比例也是影响配位数的一个重要因素。【警示】(1)离子晶体除含有离子键外,还可能有共价键,如Na2O2、NaOH、NH4Cl晶体。
(2)离子晶体的化学式仅表示晶体中阴、阳离子的个数比,并不代表其分子组成,因为离子晶体中没有分子。
(3)推断离子晶体的性质要从离子键的强弱入手,而判断离子键的强弱一般要从离子半径入手,所以掌握离子半径比较方法是解决这类问题的前提条件。【拓展深化】晶体化学式的确定方法
(1)根据晶胞中粒子位置的特点,利用均摊法确定晶胞中每种粒子的个数。
(2)根据各粒子的最简个数比书写化学式。
(3)某些晶胞可能是长方体型、六棱柱型、三棱柱型等,注意不同晶胞的不同特点。【针对训练】
(2015·邯郸高二检测)如图所示是从NaCl或CsCl晶体结构中分割出
来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)【解析】选C。NaCl晶胞是立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+等距离的Cl-有6个,且构成正八面体,同理,与每个Cl-等距离的6个Na+也构成正八面体,由此可知图(1)和(4)属于从NaCl晶体中分割出来的,C项正确。【补偿训练】(2015·铜川高二检测)
元素X的某价态离子Xn+中所有电子正好充满K、L、
M三个电子层,它与N3-形成晶体的晶胞结构如图所示。
(1)该晶体的阳离子与阴离子个数比为_________
_________________________________________。
(2)该晶体中Xn+中n=____________________。
(3)X元素的原子序数是________________。
(4)晶体中每个N3-被 个等距离的Xn+包围。【解析】(1)Xn+位于晶胞的棱上,其数目为12× =3个,N3-位于晶胞
的顶点,其数目为8× =1个,故其个数比为3∶1。
(2)由晶体的化学式X3N知X所带的电荷数为1。(3)因为X+的K、L、M三个电子层正好充满,故为2、8、18,所以X的原子序数是29。(4)N3-位于晶胞顶点,故其被6个X+在上、下、左、右、前、后包围。
答案:(1)3∶1 (2)1 (3)29 (4)6
