【世纪金榜】2015-2016学年高中化学 3.3共价键 原子晶体课件 苏教版选修3
文档属性
| 名称 | 【世纪金榜】2015-2016学年高中化学 3.3共价键 原子晶体课件 苏教版选修3 |

|
|
| 格式 | zip | ||
| 文件大小 | 559.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-09 20:47:27 | ||
图片预览










文档简介
课件47张PPT。第三单元
共价键 原子晶体一、共价键
1.概念:元素的原子之间通过___________形成的化学键。
2.本质:当成键原子相互接近时,原子轨道发生重叠,自旋方向_____
的未成对电子形成___________,两原子核间的电子密度_____,体系
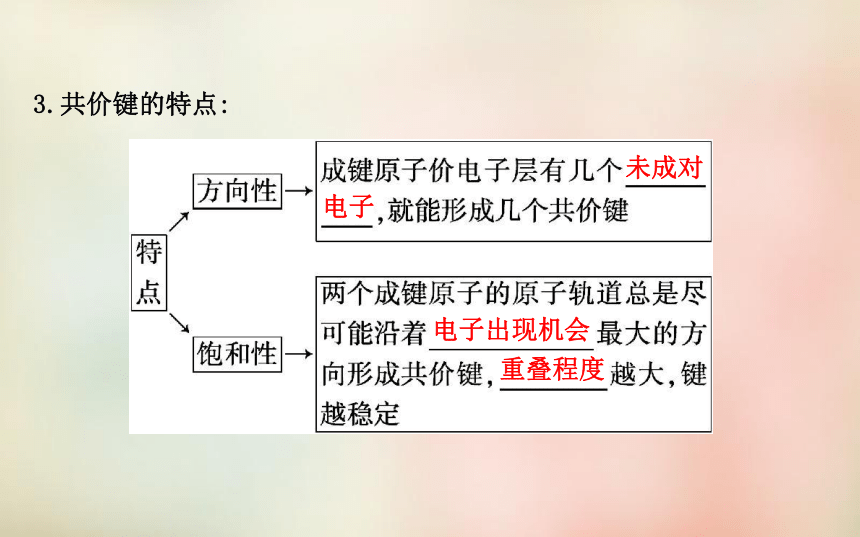
的能量_____。共用电子对相反共用电子对增加降低3.共价键的特点:未成对电子电子出现机会重叠程度二、共价键的类型
1.σ键与π键:
(1)σ键:原子轨道以“_______”方式重叠而形成的共价键。
(2)π键:原子轨道以“_______”方式重叠而形成的共价键。
(3)区别:有机物中,碳原子与碳原子间形成π键的重叠程度比形成σ
键的重叠程度_______,所以___键比___键牢固,故反应中___键易断裂。头碰头肩并肩小得多σππ2.非极性键和极性键:
(1)非极性键:两个成键原子吸引电子的能力_____,共用电子对不发
生偏移。
(2)极性键。
①两个成键原子吸引电子的能力_____,共用电子对发生偏移。
②在极性键中,成键原子吸引电子的能力差别越大,共用电子对发生
偏移的程度_____,共价键的极性_____。相同不同越大越强3.特殊的共价键——配位键:一对电子共价键孤电子对三、共价键的键能与化学反应的反应热:
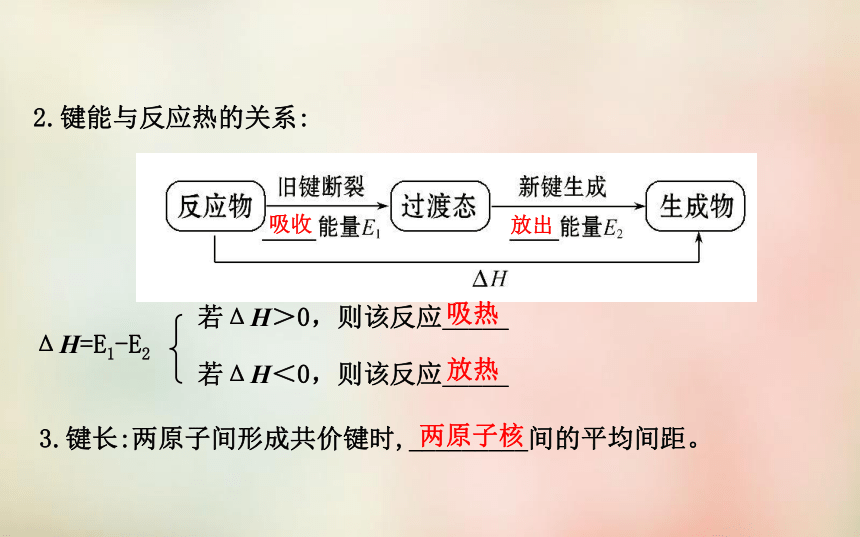
1.键能的概念:在101 kPa、298 K条件下,1 mol气态AB分子生成
_____A原子和B原子的过程中所_____的能量,称为AB间共价键的键能。气态吸收2.键能与反应热的关系:
ΔH=E1-E2若ΔH>0,则该反应_____
若ΔH<0,则该反应_____3.键长:两原子间形成共价键时,_________间的平均间距。吸收放出吸热放热两原子核四、原子晶体原子共价键很高很大【自我小测】
1.思考辨析:
(1)所有轨道形成的共价键均有方向性。 ( )
分析:×。因为s轨道的空间取向是球形对称,故两个s轨道形成的共价键无方向性。如H2分子中的共价键。
(2)只要形成共价键就有σ键。 ( )
分析:√。在共价键的形成过程中,不管两原子如何靠近,总有原子轨道头碰头相互重叠,所以共价键的形成过程总有σ键形成。(3)一般共价键与配位键形成过程完全一样。 ( )
分析:×。共用电子对的来源不同,普通共价键的电子对是由两个原子各提供1个,配位键的电子对是由一个原子提供,被两个原子共用。但成键后,二者没有任何区别。
(4)原子晶体一般硬度大,熔、沸点高。 ( )
分析:√。原子晶体通过共价键形成,一般硬度大,熔、沸点高。
(5)非金属单质中都存在共价键。 ( )
分析:×。稀有气体属于单原子分子。2.相距很远的两个氢原子,相互逐渐接近,在这一过程中,体系能量
将 ( )
A.先变大后变小 B.先变小后变大
C.逐渐变小 D.逐渐变大
【解析】选B。两原子距离远时,吸引力起主要作用,体系能量降低,两原子距离近时,斥力起主要作用,体系能量升高。3.下列物质的晶体中不存在分子的是 ( )
A.SiO2 B.SO2
C.CS2 D.CO2
【解析】选A。SiO2是原子晶体,构成晶体的粒子是原子。4.(双选)(SJ·P52改编)下列分子中,既含有σ键又含有π键的
是 ( )
A.CH3CH3 B.N2
C.C2H2 D.Cl2
【解析】选B、C。如果两原子间形成多种化学键,则一定有一个σ键,其余为π键,而B、C两个选项中都有叁键,因此既含有σ键又含有π键。5.根据下列性质判断,属于原子晶体的物质是 ( )
A.熔点2 700℃,导电性好,延展性强
B.无色晶体,熔点3 550℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800℃,熔化时能导电
D.熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电
【解析】选B。原子晶体一般熔、沸点高,硬度大,不导电。6.(SJ·P52改编)已知N≡N键的键能是945 kJ·mol-1,H—H键的键能是436 kJ·mol-1,N2(g)+3H2(g)====2NH3(g)的焓变为-93 kJ·mol-1,则,N—H键的键能是 ( )
A.208 kJ·mol-1 B.435 kJ·mol-1
C.93 kJ·mol-1 D.391 kJ·mol-1【解析】选D。反应物的键能减去产物的键能等于焓变,而每个
氨气分子中有3个N—H键,设N—H键的键能为x,945 kJ·mol-1+3×
436 kJ·mol-1-6x=-93 kJ·mol-1,因此x=391 kJ·mol-1。一、共价键的特征及类型
【自主导练】
1.(2015·保定高二检测)下列说法不正确的是 ( )
A.σ键比π键重叠程度大,形成的共价键强,所以π键比σ键更易断裂
B.两个原子间形成共价键时,最多有一个σ键,可以有多个π键
C.有方向性是共价键共有的特征
D.N2分子中有一个σ键,2个π键【解题指南】解答本题时要注意以下两点:
(1)共价键有方向性和饱和性;
(2)分子由于σ键比π键的重叠程度大,因此σ键比π键更稳定。
【解析】选C。方向性和饱和性是共价键的特征,但是并不是所有的共价键都有方向性,比如s-s轨道头碰头所形成的σ键就没有方向性。【方法规律】σ键和π键的判断方法:2.(2015·大同高二检测)下列说法正确的是 ( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,放出能量为2×463 kJ【解题指南】解答本题时要注意以下两点:
(1)非金属原子之间形成共价键;
(2)判断分子稳定性,可通过键长、非金属性强弱、电负性差值等因素分析。
【解析】选B。键能与键长都是描述分子稳定性的重要参数,且键能越大,键长越短,分子越稳定;B项中元素周期表中的ⅠA族(除H外)和ⅦA族元素间形成离子键;水分子中键角为104.5°;D项断键应吸收2×463 kJ的能量。【总结归纳】
1.共价键的分类:2.极性键、非极性键的判断方法:【点拨】
(1)共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
(2)共价键的方向性决定了分子的立体结构。
(3)并不是所有的共价键都有方向性,如两个s电子形成的共价键就没有方向性。【针对训练】
下列分子中存在π键的是 ( )
A.H2 B.Cl2
C.N2 D.HCl
【解析】选C。在N2中,两个氮原子的2pz形成一个σ键,2px形成一个π键,两个2py也形成一个π键。【补偿训练】(双选)(2015·锦州高二检测)下列说法中正确的
是 ( )
A.键能愈小,表示化学键越牢固,难以断裂
B.两原子核越近,键长愈短,化学键愈牢固,性质越稳定
C.破坏化学键时,消耗能量,而形成新的化学键时,则释放能量
D.键能、键长只能定性地分析化学键的特性
【解析】选B、C。键能越大,键长越短,化学键越牢固。【拓展深化】离子键、共价键和金属键的比较:二、原子晶体的结构和性质
1.原子晶体的结构:2.原子晶体的物理性质:
(1)因为原子晶体中原子间以较强的共价键相结合,熔化时需要很多的能量克服共价键。所以原子晶体的熔、沸点很高,硬度很大。
(2)因为构成原子晶体的原子最外层电子都成键,结构稳定,键能较大,所以原子晶体一般不导电,难溶于水。【拓展深化】原子晶体能量高低的规律:
原子晶体的熔、沸点高低取决于共价键的键长和键能,键长越短,键能
越大,共价键越稳定,物质的熔、沸点越高。
若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半
径越小,则化学键的键长越短,化学键就越强,键就越牢固,破坏化学键
需要的能量就越大,故晶体的熔点就越高,如比较金刚石、碳化硅、晶
体硅的熔点高低。
原子半径:CC—Si>
Si—Si,熔点:金刚石>碳化硅>晶体硅。【针对训练】
1.(2015·嘉兴高二检测)晶体硅(Si)和金刚砂(SiC)都具有与金刚石相似的空间结构,根据下表中的数据,回答下列问题:(1)晶体硅(Si)和金刚砂(SiC)属于 晶体;
(2)晶体硅(Si)中,平均一个硅原子所成共价键的个数是 个;
(3)上述三种物质的熔、沸点高低顺序是________________;
(4)上述三种物质的硬度大小顺序是________________。
【解题指南】解答本题时要注意以下两点:
(1)键能和键长影响共价键的稳定性;
(2)原子晶体的熔、沸点和硬度的高低均受共价键的影响。【解析】在原子晶体里,所有原子都以共价键相互结合,整块晶体是一个三维的共价键网状结构。所以,影响原子晶体的熔、沸点、硬度的主要因素就是共价键的键能大小,键能越大,原子晶体的熔、沸点越高、硬度越大,而共价键的键能又与键长相关,一般来说,键长越短,键能越大,键长越长,键能越小。
共价键键长:C—C键共价键键能:C—C键>C—Si键>Si—Si键。答案:(1)原子 (2)2
(3)金刚石>碳化硅>晶体硅
(4)金刚石>碳化硅>晶体硅2.(2015·长治高二检测)下面关于SiO2晶体网状结构的叙述正确的
是 ( )
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环上,有3个硅原子和3个氧原子
C.最小的环上,硅和氧原子数之比为1∶2
D.最小的环上,有6个硅原子和6个氧原子【解析】选D。二氧化硅是原子晶体,为空间网状结构,存在硅氧四面体结构,硅处于中心,氧处于4个顶点,所以A项错误;在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以D对,B、C都错误。3.
请回答下列问题:
(1)比较下列两种物质的熔点高低(填“>”或“<”):
SiCl4 SiO2。(2)如图立方体中心的“ ”表示硅晶体中的一个原子,请在立方体
的顶点用“ ”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g) Si(s)+ 4HCl(g),该反应的反应热
ΔH= kJ·mol-1。【解析】(1)SiCl4为分子晶体,SiO2是原子晶体,显然是原子晶体的熔点高。
(2)晶体硅的结构与金刚石的结构相似,根据硅原子与硅原子可形成四个相等的硅硅键,可推知与立方体中心的一个硅原子相邻的硅原子有四个,这四个硅原子可形成一个正四面体,分别位于立方体中互不相邻的四个顶点上。(3)根据题中所给的键能数据,可求出该反应物中旧化学键的键能之和
为4×360 kJ·mol-1+2×436 kJ·mol-1=2 312 kJ·mol-1,生成物中
新化学键的键能之和为4×431 kJ·mol-1+2×176 kJ·mol-1(每摩尔
硅晶体中含有2 mol硅硅键)=2 076 kJ·mol-1,所以反应热ΔH=
2 312 kJ·mol-1-2 076 kJ·mol-1=236 kJ·mol-1。答案:(1)<
(2)
(3)236【补偿训练】1.在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得了原子晶体干冰,下列推断正确的是 ( )
A.原子晶体干冰易气化,可用作制冷剂
B.原子晶体干冰熔、沸点低,有的硬度很小
C.原子晶体干冰硬度大,可用于耐磨材料
D.每摩原子晶体干冰中含2 mol C—O键【解析】选C。原子晶体熔、沸点高,硬度大,因此A、B错,C正确;原子晶体干冰的结构与二氧化硅相似,因此每摩原子晶体干冰中含4 mol C—O键,D错。2.(双选)关于晶体的下列说法正确的是 ( )
A.原子晶体中只含有共价键
B.任何晶体中,若含有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.离子晶体中含有离子键,可能含有共价键
【解析】选A、D。金属晶体中含有阳离子但没有阴离子,B错;原子晶体的熔点不一定比金属晶体的高,如钨的熔点是3 410℃,而晶体硅的熔点是1 410℃,C错。
共价键 原子晶体一、共价键
1.概念:元素的原子之间通过___________形成的化学键。
2.本质:当成键原子相互接近时,原子轨道发生重叠,自旋方向_____
的未成对电子形成___________,两原子核间的电子密度_____,体系
的能量_____。共用电子对相反共用电子对增加降低3.共价键的特点:未成对电子电子出现机会重叠程度二、共价键的类型
1.σ键与π键:
(1)σ键:原子轨道以“_______”方式重叠而形成的共价键。
(2)π键:原子轨道以“_______”方式重叠而形成的共价键。
(3)区别:有机物中,碳原子与碳原子间形成π键的重叠程度比形成σ
键的重叠程度_______,所以___键比___键牢固,故反应中___键易断裂。头碰头肩并肩小得多σππ2.非极性键和极性键:
(1)非极性键:两个成键原子吸引电子的能力_____,共用电子对不发
生偏移。
(2)极性键。
①两个成键原子吸引电子的能力_____,共用电子对发生偏移。
②在极性键中,成键原子吸引电子的能力差别越大,共用电子对发生
偏移的程度_____,共价键的极性_____。相同不同越大越强3.特殊的共价键——配位键:一对电子共价键孤电子对三、共价键的键能与化学反应的反应热:
1.键能的概念:在101 kPa、298 K条件下,1 mol气态AB分子生成
_____A原子和B原子的过程中所_____的能量,称为AB间共价键的键能。气态吸收2.键能与反应热的关系:
ΔH=E1-E2若ΔH>0,则该反应_____
若ΔH<0,则该反应_____3.键长:两原子间形成共价键时,_________间的平均间距。吸收放出吸热放热两原子核四、原子晶体原子共价键很高很大【自我小测】
1.思考辨析:
(1)所有轨道形成的共价键均有方向性。 ( )
分析:×。因为s轨道的空间取向是球形对称,故两个s轨道形成的共价键无方向性。如H2分子中的共价键。
(2)只要形成共价键就有σ键。 ( )
分析:√。在共价键的形成过程中,不管两原子如何靠近,总有原子轨道头碰头相互重叠,所以共价键的形成过程总有σ键形成。(3)一般共价键与配位键形成过程完全一样。 ( )
分析:×。共用电子对的来源不同,普通共价键的电子对是由两个原子各提供1个,配位键的电子对是由一个原子提供,被两个原子共用。但成键后,二者没有任何区别。
(4)原子晶体一般硬度大,熔、沸点高。 ( )
分析:√。原子晶体通过共价键形成,一般硬度大,熔、沸点高。
(5)非金属单质中都存在共价键。 ( )
分析:×。稀有气体属于单原子分子。2.相距很远的两个氢原子,相互逐渐接近,在这一过程中,体系能量
将 ( )
A.先变大后变小 B.先变小后变大
C.逐渐变小 D.逐渐变大
【解析】选B。两原子距离远时,吸引力起主要作用,体系能量降低,两原子距离近时,斥力起主要作用,体系能量升高。3.下列物质的晶体中不存在分子的是 ( )
A.SiO2 B.SO2
C.CS2 D.CO2
【解析】选A。SiO2是原子晶体,构成晶体的粒子是原子。4.(双选)(SJ·P52改编)下列分子中,既含有σ键又含有π键的
是 ( )
A.CH3CH3 B.N2
C.C2H2 D.Cl2
【解析】选B、C。如果两原子间形成多种化学键,则一定有一个σ键,其余为π键,而B、C两个选项中都有叁键,因此既含有σ键又含有π键。5.根据下列性质判断,属于原子晶体的物质是 ( )
A.熔点2 700℃,导电性好,延展性强
B.无色晶体,熔点3 550℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800℃,熔化时能导电
D.熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电
【解析】选B。原子晶体一般熔、沸点高,硬度大,不导电。6.(SJ·P52改编)已知N≡N键的键能是945 kJ·mol-1,H—H键的键能是436 kJ·mol-1,N2(g)+3H2(g)====2NH3(g)的焓变为-93 kJ·mol-1,则,N—H键的键能是 ( )
A.208 kJ·mol-1 B.435 kJ·mol-1
C.93 kJ·mol-1 D.391 kJ·mol-1【解析】选D。反应物的键能减去产物的键能等于焓变,而每个
氨气分子中有3个N—H键,设N—H键的键能为x,945 kJ·mol-1+3×
436 kJ·mol-1-6x=-93 kJ·mol-1,因此x=391 kJ·mol-1。一、共价键的特征及类型
【自主导练】
1.(2015·保定高二检测)下列说法不正确的是 ( )
A.σ键比π键重叠程度大,形成的共价键强,所以π键比σ键更易断裂
B.两个原子间形成共价键时,最多有一个σ键,可以有多个π键
C.有方向性是共价键共有的特征
D.N2分子中有一个σ键,2个π键【解题指南】解答本题时要注意以下两点:
(1)共价键有方向性和饱和性;
(2)分子由于σ键比π键的重叠程度大,因此σ键比π键更稳定。
【解析】选C。方向性和饱和性是共价键的特征,但是并不是所有的共价键都有方向性,比如s-s轨道头碰头所形成的σ键就没有方向性。【方法规律】σ键和π键的判断方法:2.(2015·大同高二检测)下列说法正确的是 ( )
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463 kJ·mol-1,即18 g H2O分解成H2和O2时,放出能量为2×463 kJ【解题指南】解答本题时要注意以下两点:
(1)非金属原子之间形成共价键;
(2)判断分子稳定性,可通过键长、非金属性强弱、电负性差值等因素分析。
【解析】选B。键能与键长都是描述分子稳定性的重要参数,且键能越大,键长越短,分子越稳定;B项中元素周期表中的ⅠA族(除H外)和ⅦA族元素间形成离子键;水分子中键角为104.5°;D项断键应吸收2×463 kJ的能量。【总结归纳】
1.共价键的分类:2.极性键、非极性键的判断方法:【点拨】
(1)共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
(2)共价键的方向性决定了分子的立体结构。
(3)并不是所有的共价键都有方向性,如两个s电子形成的共价键就没有方向性。【针对训练】
下列分子中存在π键的是 ( )
A.H2 B.Cl2
C.N2 D.HCl
【解析】选C。在N2中,两个氮原子的2pz形成一个σ键,2px形成一个π键,两个2py也形成一个π键。【补偿训练】(双选)(2015·锦州高二检测)下列说法中正确的
是 ( )
A.键能愈小,表示化学键越牢固,难以断裂
B.两原子核越近,键长愈短,化学键愈牢固,性质越稳定
C.破坏化学键时,消耗能量,而形成新的化学键时,则释放能量
D.键能、键长只能定性地分析化学键的特性
【解析】选B、C。键能越大,键长越短,化学键越牢固。【拓展深化】离子键、共价键和金属键的比较:二、原子晶体的结构和性质
1.原子晶体的结构:2.原子晶体的物理性质:
(1)因为原子晶体中原子间以较强的共价键相结合,熔化时需要很多的能量克服共价键。所以原子晶体的熔、沸点很高,硬度很大。
(2)因为构成原子晶体的原子最外层电子都成键,结构稳定,键能较大,所以原子晶体一般不导电,难溶于水。【拓展深化】原子晶体能量高低的规律:
原子晶体的熔、沸点高低取决于共价键的键长和键能,键长越短,键能
越大,共价键越稳定,物质的熔、沸点越高。
若没有告知键长或键能数据时,可比较原子半径的大小。一般原子半
径越小,则化学键的键长越短,化学键就越强,键就越牢固,破坏化学键
需要的能量就越大,故晶体的熔点就越高,如比较金刚石、碳化硅、晶
体硅的熔点高低。
原子半径:C
Si—Si,熔点:金刚石>碳化硅>晶体硅。【针对训练】
1.(2015·嘉兴高二检测)晶体硅(Si)和金刚砂(SiC)都具有与金刚石相似的空间结构,根据下表中的数据,回答下列问题:(1)晶体硅(Si)和金刚砂(SiC)属于 晶体;
(2)晶体硅(Si)中,平均一个硅原子所成共价键的个数是 个;
(3)上述三种物质的熔、沸点高低顺序是________________;
(4)上述三种物质的硬度大小顺序是________________。
【解题指南】解答本题时要注意以下两点:
(1)键能和键长影响共价键的稳定性;
(2)原子晶体的熔、沸点和硬度的高低均受共价键的影响。【解析】在原子晶体里,所有原子都以共价键相互结合,整块晶体是一个三维的共价键网状结构。所以,影响原子晶体的熔、沸点、硬度的主要因素就是共价键的键能大小,键能越大,原子晶体的熔、沸点越高、硬度越大,而共价键的键能又与键长相关,一般来说,键长越短,键能越大,键长越长,键能越小。
共价键键长:C—C键
(3)金刚石>碳化硅>晶体硅
(4)金刚石>碳化硅>晶体硅2.(2015·长治高二检测)下面关于SiO2晶体网状结构的叙述正确的
是 ( )
A.存在四面体结构单元,O处于中心,Si处于4个顶点
B.最小的环上,有3个硅原子和3个氧原子
C.最小的环上,硅和氧原子数之比为1∶2
D.最小的环上,有6个硅原子和6个氧原子【解析】选D。二氧化硅是原子晶体,为空间网状结构,存在硅氧四面体结构,硅处于中心,氧处于4个顶点,所以A项错误;在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以D对,B、C都错误。3.
请回答下列问题:
(1)比较下列两种物质的熔点高低(填“>”或“<”):
SiCl4 SiO2。(2)如图立方体中心的“ ”表示硅晶体中的一个原子,请在立方体
的顶点用“ ”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g) Si(s)+ 4HCl(g),该反应的反应热
ΔH= kJ·mol-1。【解析】(1)SiCl4为分子晶体,SiO2是原子晶体,显然是原子晶体的熔点高。
(2)晶体硅的结构与金刚石的结构相似,根据硅原子与硅原子可形成四个相等的硅硅键,可推知与立方体中心的一个硅原子相邻的硅原子有四个,这四个硅原子可形成一个正四面体,分别位于立方体中互不相邻的四个顶点上。(3)根据题中所给的键能数据,可求出该反应物中旧化学键的键能之和
为4×360 kJ·mol-1+2×436 kJ·mol-1=2 312 kJ·mol-1,生成物中
新化学键的键能之和为4×431 kJ·mol-1+2×176 kJ·mol-1(每摩尔
硅晶体中含有2 mol硅硅键)=2 076 kJ·mol-1,所以反应热ΔH=
2 312 kJ·mol-1-2 076 kJ·mol-1=236 kJ·mol-1。答案:(1)<
(2)
(3)236【补偿训练】1.在40 GPa高压下,用激光器加热到1 800 K时,人们成功制得了原子晶体干冰,下列推断正确的是 ( )
A.原子晶体干冰易气化,可用作制冷剂
B.原子晶体干冰熔、沸点低,有的硬度很小
C.原子晶体干冰硬度大,可用于耐磨材料
D.每摩原子晶体干冰中含2 mol C—O键【解析】选C。原子晶体熔、沸点高,硬度大,因此A、B错,C正确;原子晶体干冰的结构与二氧化硅相似,因此每摩原子晶体干冰中含4 mol C—O键,D错。2.(双选)关于晶体的下列说法正确的是 ( )
A.原子晶体中只含有共价键
B.任何晶体中,若含有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高
D.离子晶体中含有离子键,可能含有共价键
【解析】选A、D。金属晶体中含有阳离子但没有阴离子,B错;原子晶体的熔点不一定比金属晶体的高,如钨的熔点是3 410℃,而晶体硅的熔点是1 410℃,C错。
