【世纪金榜】2015-2016学年高中化学 4.2配合物的形成和应用课件 苏教版选修3
文档属性
| 名称 | 【世纪金榜】2015-2016学年高中化学 4.2配合物的形成和应用课件 苏教版选修3 |

|
|
| 格式 | zip | ||
| 文件大小 | 482.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-09 00:00:00 | ||
图片预览











文档简介
课件35张PPT。第二单元
配合物的形成和应用一、配合物的形成
1.探究配合物的形成过程:蓝色沉淀溶解深蓝色溶液2.配合物:
(1)概念。
由_____________的配位体与_____________的中心原子以_______
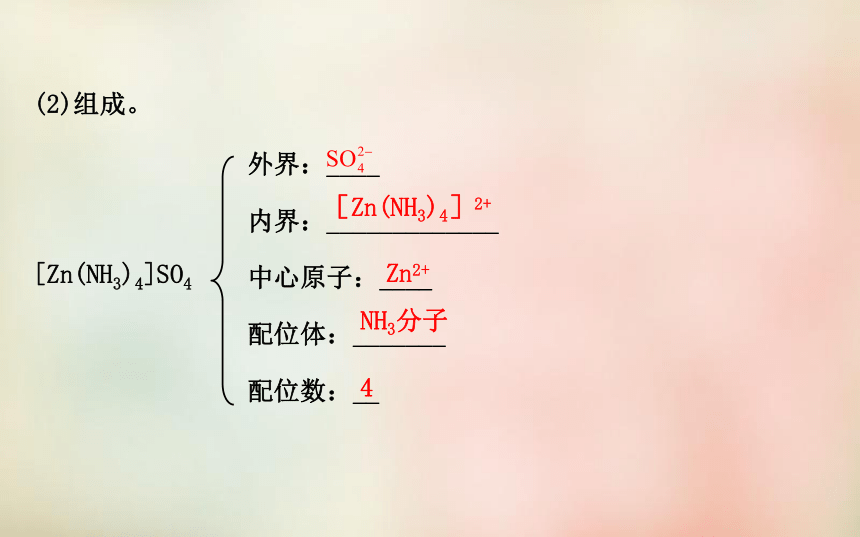
结合形成的化合物。提供孤电子对接受孤电子对配位键(2)组成。
[Zn(NH3)4]SO4外界:____
内界:_____________
中心原子:____
配位体:_______
配位数:__[Zn(NH3)4]2+Zn2+NH3分子4(3)形成条件。
①配位体有_________。如中性分子有____________等;离子有
____________等。
②中心原子有_______,如___________________等。孤电子对H2O、NH3、COF-、Cl-、CN-空轨道Fe3+、Cu2+、Zn2+、Ag+3.配合物异构现象:
(1)产生异构现象的原因。
①含有_____或_________配位体。
②配位体_____________不同。两种两种以上空间排列方式(2)分类。
(3)异构体的性质。
顺、反异构体在颜色、极性、溶解性、活性等方面都有差异。相邻对角二、配合物的应用
1.在实验研究方面的应用:
(1)检验金属离子:如可用KSCN溶液检验____的存在,Fe3++nSCN-
[Fe(SCN)n](3-n)+(红色溶液);可用[Ag(NH3)2]OH溶液检验_____的存
在。
(2)分离物质:如将CuSO4和Fe2(SO4)3混合液中CuSO4与Fe2(SO4)3分
离开,可用_______,Cu2+生成[Cu(NH3)4]2+。
(3)定量测定物质的组成。Fe3+醛基浓氨水(4)溶解某些特殊物质:金和铂之所以能溶于王水中,也是与生成配离子的反应有关。
Au+HNO3+4HCl====H[AuCl4]+NO↑+2H2O
3Pt+4HNO3+18HCl====3H2[PtCl6]+4NO↑+8H2O
2.在生产中的应用:在生产中,配合物被广泛用于染色、电镀、硬水软化、金属冶炼等领域。
3.应用于尖端研究领域:如激光材料、超导材料、抗癌药物的研究,催化剂的研制等。【自我小测】
1.思考辨析:
(1)所有的配合物都有内界和外界。 ( )
分析:×。有些配合物没有外界,如Fe(SCN)3中Fe3+和3个SCN-全部处于内界。
(2)对于配合物K2Cu(CN)4来说,中心原子是K+。 ( )
分析:×。对于配合物K2Cu(CN)4来说,K+是配合物的外界,配合物的内界是[Cu(CN)4]2-,其中在内界中,Cu2+是中心原子,CN-是配位体。(3)配位化合物中一定存在配位键。 ( )
分析:√。由配合物的定义可知,配合物中一定含有配位键。
(4)Fe3+可以用KSCN溶液检验,主要是利用了Fe3+可以与SCN-反应生成配合物显示红色的原理。 ( )
分析:√。Fe3+可以用KSCN溶液检验,主要是利用了反应Fe3++nSCN-====[Fe(SCN)n](3-n)+,而[Fe(SCN)n](3-n)+就是一个配离子。(5)Cu2+与氨气分子中的氮原子形成配位键。 ( )
分析:√。Cu2+与氨气分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。2.下列关于配合物的说法中不正确的是 ( )
A.许多过渡金属离子对多种配位体具有很强的结合力,因而过渡金属配合物远比主族金属配合物多
B.配合物中,中心离子与配位体间、配离子与酸根离子间都是以配位键结合
C.配离子中,中心离子提供空轨道,配位体提供孤电子对
D.中心离子所结合配位体的个数称为配位数,不同离子的配位数可能不同【解析】选B。过渡金属原子核外电子的排布特点决定了过渡金属离子能提供空轨道,容易与多种配位体结合,因而能形成多种配合物,A项正确;配合物中配离子内的中心离子与配位体间是以配位键结合,配离子与酸根离子间是以离子键结合,B项不正确;配离子中,中心离子提供空轨道,配位体提供孤电子对,C项正确;不同离子的配位数可能不同,[Cu(H2O)4]2+中Cu2+的配位数为4,[Ag(NH3)2]+中Ag+的配位数为2,[Fe(SCN)6]3-中Fe3+的配位数为6,D项正确。3.(SJ·P83改编)向含有1 mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的AgNO3溶液,生成氯化银沉淀的物质的量为 ( )
A.0 mol B.1 mol C.2 mol D.3 mol
【解析】选C。对于配合物[Co(NH3)5Cl]Cl2,外界是2个Cl-,内界是[Co(NH3)5Cl]2+,所以该配合物若与足量的AgNO3溶液反应,由于只有外界的Cl-能与AgNO3溶液中的Ag+反应生成氯化银沉淀,所以生成氯化银的物质的量是2 mol。4.(SJ·P83改编)下列配合物中配位数为2的是 ( )
A.[Ag(NH3)2]+ B.[PtCl2(NH3)2]
C.[Co(NH3)6]3+ D.[Ni(CN)4]2-
【解析】选A。配位数是指直接同中心原子配位的原子或分子的数目,B、D两项配位数为4,C项配位数为6。一、配位键与配合物
1.配位键:
(1)形成条件:①中心原子必须有空轨道;②配位原子必须有孤电子对。
(2)表示方法:配位键用“A→B”表示,A为提供孤电子对的原(离)子,B为接受孤电子对的原(离)子。2.配合物:
(1)组成。
配合物的组成包含中心原子、配位体、配位数、内界和外界等概念。以[Cu(NH3)4]SO4为例说明如下。(2)电离。
配合物的内界和外界之间多是以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离,但程度非常小,可谓“强中有弱”。
如[Co(NH3)5Cl]Cl2====[Co(NH3)5Cl]2++2Cl-。3.配合物的空间构型。
配合物的空间构型指的是配位体围绕着中心原子排布的几何构型。配合物的中心原子、配位体的种类和数目的不同,可以形成不同空间构型的配合物。二、配合物的应用
配合物在许多方面有着广泛的应用。在实验研究中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成;在生产中,配合物也发挥着重大的作用。
如配合物在实验研究中的重要作用:1.银镜反应。
Ag++NH3·H2O====AgOH↓+N
AgOH+2NH3====[Ag(NH3)2]++OH-
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3↑+H2O
2.Fe3+的检验。
Fe3++nSCN-====[Fe(SCN)n](3-n)+3.用于物质的分离。
用浓氨水可分离CuSO4溶液和Fe2(SO4)3溶液,而不能用NaOH溶液。
Cu2++2NH3·H2O====
Cu(OH)2↓+2N
Cu(OH)2+4NH3·H2O====
[Cu(NH3)4]2++2OH-+4H2O 产生蓝色沉淀,加过量氨水沉淀 又溶解变成深蓝色溶液
Fe3++3NH3·H2OFe(OH)3↓+3N ,产生红褐色沉淀不溶于过量氨水用NaOH溶液,均出现沉淀且得到无色溶液Cu2++2OH-====Cu(OH)2↓
Fe3++3OH-====Fe(OH)3↓ 【拓展深化】配合物的性质
(1)配合物的稳定性。
配合物中,中心原子在配位体的影响下,其价层轨道进行杂化,配位原子的孤电子对进入中心原子的空轨道产生较强的作用,因而配合物有较强的稳定性。显然配合物的稳定性与配位键的强弱有关,配合物中配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与配位体的性质有关。(2)配合物的颜色。
多数配合物都有颜色,如[Fe(SCN)6]3-为红色,[Cu(NH3)4]2+为深蓝色,[Fe(C6H5O)6]3-为紫色。(3)配合物的溶解性。
有的配合物易溶于水,如[Ag(NH3)2]OH、Fe(SCN)3,有的配合物难溶于水。尽管大部分配合物易溶于水,但溶于水后配离子却难电离。如向含[FeCl4]-的溶液中滴加AgNO3溶液,不会产生白色沉淀。
配合物的颜色、溶解性还与其空间构型有关。如顺式Pt(NH3)2Cl2为棕黄色,在水中溶解度较大;反式Pt(NH3)2Cl2为淡黄色,难溶于水。【针对训练】
1.(2015·无锡高二检测)(1)Zn的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为 。
(2)若BCl3与XYn通过硼原子与X原子间的配位键结合形成配合物,则该配合物中提供孤电子对的原子是 。
【解题指南】解答本题时要注意以下两点:
(1)配位键属于σ键;
(2)B为缺电子结构。【解析】(1)[Zn(NH3)4]Cl2中NH3与Zn2+形成配位键,NH3中有3个σ键,所以1 mol配合物中共有16 mol(或16×6.02×1023个)σ键。
(2)BCl3与XYn通过硼原子和X原子间的配位键形成配合物,硼原子只有空轨道,无孤电子对,因此形成配位键时,X原子提供孤电子对,硼原子提供空轨道。
答案:(1)16NA(或16×6.02×1023) (2)X2.关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是 ( )
A.配位体为水分子,配位原子是O,外界为Br-
B.中心原子的配位数为6
C.中心原子Cr采取sp3杂化
D.中心原子的化合价为+2价
【解析】选B。[Cr(H2O)4Br2]Br·2H2O中的内界为[Cr(H2O)4Br2]+,Cr3+为中心原子,配位体为H2O和Br-,配位数为6,外界为Br-,Cr3+提供空轨道数为6,不是sp3杂化。【补偿训练】(2015·常州高二检测)下列关于配合物的说法中,正确的是 ( )
A.配合物的外界是指配合物中的阴离子
B.只有过渡金属元素能形成配合物
C.化学式为Pt(NH3)2Cl2的物质只有一种
D.Na3[AlF6]的中心原子的配位数为6【解析】选D。本题考查的是配合物的结构。配合物的外界可以是阳离子也可以是阴离子;不仅仅是过渡金属元素能形成配合物,Al3+也可,如Na3[AlF6]。Na3[AlF6]的中心原子是Al3+,配位体是F-,其配位数是6;Pt(NH3)2Cl2存在顺反异构体。
配合物的形成和应用一、配合物的形成
1.探究配合物的形成过程:蓝色沉淀溶解深蓝色溶液2.配合物:
(1)概念。
由_____________的配位体与_____________的中心原子以_______
结合形成的化合物。提供孤电子对接受孤电子对配位键(2)组成。
[Zn(NH3)4]SO4外界:____
内界:_____________
中心原子:____
配位体:_______
配位数:__[Zn(NH3)4]2+Zn2+NH3分子4(3)形成条件。
①配位体有_________。如中性分子有____________等;离子有
____________等。
②中心原子有_______,如___________________等。孤电子对H2O、NH3、COF-、Cl-、CN-空轨道Fe3+、Cu2+、Zn2+、Ag+3.配合物异构现象:
(1)产生异构现象的原因。
①含有_____或_________配位体。
②配位体_____________不同。两种两种以上空间排列方式(2)分类。
(3)异构体的性质。
顺、反异构体在颜色、极性、溶解性、活性等方面都有差异。相邻对角二、配合物的应用
1.在实验研究方面的应用:
(1)检验金属离子:如可用KSCN溶液检验____的存在,Fe3++nSCN-
[Fe(SCN)n](3-n)+(红色溶液);可用[Ag(NH3)2]OH溶液检验_____的存
在。
(2)分离物质:如将CuSO4和Fe2(SO4)3混合液中CuSO4与Fe2(SO4)3分
离开,可用_______,Cu2+生成[Cu(NH3)4]2+。
(3)定量测定物质的组成。Fe3+醛基浓氨水(4)溶解某些特殊物质:金和铂之所以能溶于王水中,也是与生成配离子的反应有关。
Au+HNO3+4HCl====H[AuCl4]+NO↑+2H2O
3Pt+4HNO3+18HCl====3H2[PtCl6]+4NO↑+8H2O
2.在生产中的应用:在生产中,配合物被广泛用于染色、电镀、硬水软化、金属冶炼等领域。
3.应用于尖端研究领域:如激光材料、超导材料、抗癌药物的研究,催化剂的研制等。【自我小测】
1.思考辨析:
(1)所有的配合物都有内界和外界。 ( )
分析:×。有些配合物没有外界,如Fe(SCN)3中Fe3+和3个SCN-全部处于内界。
(2)对于配合物K2Cu(CN)4来说,中心原子是K+。 ( )
分析:×。对于配合物K2Cu(CN)4来说,K+是配合物的外界,配合物的内界是[Cu(CN)4]2-,其中在内界中,Cu2+是中心原子,CN-是配位体。(3)配位化合物中一定存在配位键。 ( )
分析:√。由配合物的定义可知,配合物中一定含有配位键。
(4)Fe3+可以用KSCN溶液检验,主要是利用了Fe3+可以与SCN-反应生成配合物显示红色的原理。 ( )
分析:√。Fe3+可以用KSCN溶液检验,主要是利用了反应Fe3++nSCN-====[Fe(SCN)n](3-n)+,而[Fe(SCN)n](3-n)+就是一个配离子。(5)Cu2+与氨气分子中的氮原子形成配位键。 ( )
分析:√。Cu2+与氨气分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。2.下列关于配合物的说法中不正确的是 ( )
A.许多过渡金属离子对多种配位体具有很强的结合力,因而过渡金属配合物远比主族金属配合物多
B.配合物中,中心离子与配位体间、配离子与酸根离子间都是以配位键结合
C.配离子中,中心离子提供空轨道,配位体提供孤电子对
D.中心离子所结合配位体的个数称为配位数,不同离子的配位数可能不同【解析】选B。过渡金属原子核外电子的排布特点决定了过渡金属离子能提供空轨道,容易与多种配位体结合,因而能形成多种配合物,A项正确;配合物中配离子内的中心离子与配位体间是以配位键结合,配离子与酸根离子间是以离子键结合,B项不正确;配离子中,中心离子提供空轨道,配位体提供孤电子对,C项正确;不同离子的配位数可能不同,[Cu(H2O)4]2+中Cu2+的配位数为4,[Ag(NH3)2]+中Ag+的配位数为2,[Fe(SCN)6]3-中Fe3+的配位数为6,D项正确。3.(SJ·P83改编)向含有1 mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的AgNO3溶液,生成氯化银沉淀的物质的量为 ( )
A.0 mol B.1 mol C.2 mol D.3 mol
【解析】选C。对于配合物[Co(NH3)5Cl]Cl2,外界是2个Cl-,内界是[Co(NH3)5Cl]2+,所以该配合物若与足量的AgNO3溶液反应,由于只有外界的Cl-能与AgNO3溶液中的Ag+反应生成氯化银沉淀,所以生成氯化银的物质的量是2 mol。4.(SJ·P83改编)下列配合物中配位数为2的是 ( )
A.[Ag(NH3)2]+ B.[PtCl2(NH3)2]
C.[Co(NH3)6]3+ D.[Ni(CN)4]2-
【解析】选A。配位数是指直接同中心原子配位的原子或分子的数目,B、D两项配位数为4,C项配位数为6。一、配位键与配合物
1.配位键:
(1)形成条件:①中心原子必须有空轨道;②配位原子必须有孤电子对。
(2)表示方法:配位键用“A→B”表示,A为提供孤电子对的原(离)子,B为接受孤电子对的原(离)子。2.配合物:
(1)组成。
配合物的组成包含中心原子、配位体、配位数、内界和外界等概念。以[Cu(NH3)4]SO4为例说明如下。(2)电离。
配合物的内界和外界之间多是以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离,但程度非常小,可谓“强中有弱”。
如[Co(NH3)5Cl]Cl2====[Co(NH3)5Cl]2++2Cl-。3.配合物的空间构型。
配合物的空间构型指的是配位体围绕着中心原子排布的几何构型。配合物的中心原子、配位体的种类和数目的不同,可以形成不同空间构型的配合物。二、配合物的应用
配合物在许多方面有着广泛的应用。在实验研究中,人们常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成;在生产中,配合物也发挥着重大的作用。
如配合物在实验研究中的重要作用:1.银镜反应。
Ag++NH3·H2O====AgOH↓+N
AgOH+2NH3====[Ag(NH3)2]++OH-
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3↑+H2O
2.Fe3+的检验。
Fe3++nSCN-====[Fe(SCN)n](3-n)+3.用于物质的分离。
用浓氨水可分离CuSO4溶液和Fe2(SO4)3溶液,而不能用NaOH溶液。
Cu2++2NH3·H2O====
Cu(OH)2↓+2N
Cu(OH)2+4NH3·H2O====
[Cu(NH3)4]2++2OH-+4H2O 产生蓝色沉淀,加过量氨水沉淀 又溶解变成深蓝色溶液
Fe3++3NH3·H2OFe(OH)3↓+3N ,产生红褐色沉淀不溶于过量氨水用NaOH溶液,均出现沉淀且得到无色溶液Cu2++2OH-====Cu(OH)2↓
Fe3++3OH-====Fe(OH)3↓ 【拓展深化】配合物的性质
(1)配合物的稳定性。
配合物中,中心原子在配位体的影响下,其价层轨道进行杂化,配位原子的孤电子对进入中心原子的空轨道产生较强的作用,因而配合物有较强的稳定性。显然配合物的稳定性与配位键的强弱有关,配合物中配位键越强,配合物越稳定。当作为中心原子的金属离子相同时,配合物的稳定性与配位体的性质有关。(2)配合物的颜色。
多数配合物都有颜色,如[Fe(SCN)6]3-为红色,[Cu(NH3)4]2+为深蓝色,[Fe(C6H5O)6]3-为紫色。(3)配合物的溶解性。
有的配合物易溶于水,如[Ag(NH3)2]OH、Fe(SCN)3,有的配合物难溶于水。尽管大部分配合物易溶于水,但溶于水后配离子却难电离。如向含[FeCl4]-的溶液中滴加AgNO3溶液,不会产生白色沉淀。
配合物的颜色、溶解性还与其空间构型有关。如顺式Pt(NH3)2Cl2为棕黄色,在水中溶解度较大;反式Pt(NH3)2Cl2为淡黄色,难溶于水。【针对训练】
1.(2015·无锡高二检测)(1)Zn的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为 。
(2)若BCl3与XYn通过硼原子与X原子间的配位键结合形成配合物,则该配合物中提供孤电子对的原子是 。
【解题指南】解答本题时要注意以下两点:
(1)配位键属于σ键;
(2)B为缺电子结构。【解析】(1)[Zn(NH3)4]Cl2中NH3与Zn2+形成配位键,NH3中有3个σ键,所以1 mol配合物中共有16 mol(或16×6.02×1023个)σ键。
(2)BCl3与XYn通过硼原子和X原子间的配位键形成配合物,硼原子只有空轨道,无孤电子对,因此形成配位键时,X原子提供孤电子对,硼原子提供空轨道。
答案:(1)16NA(或16×6.02×1023) (2)X2.关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是 ( )
A.配位体为水分子,配位原子是O,外界为Br-
B.中心原子的配位数为6
C.中心原子Cr采取sp3杂化
D.中心原子的化合价为+2价
【解析】选B。[Cr(H2O)4Br2]Br·2H2O中的内界为[Cr(H2O)4Br2]+,Cr3+为中心原子,配位体为H2O和Br-,配位数为6,外界为Br-,Cr3+提供空轨道数为6,不是sp3杂化。【补偿训练】(2015·常州高二检测)下列关于配合物的说法中,正确的是 ( )
A.配合物的外界是指配合物中的阴离子
B.只有过渡金属元素能形成配合物
C.化学式为Pt(NH3)2Cl2的物质只有一种
D.Na3[AlF6]的中心原子的配位数为6【解析】选D。本题考查的是配合物的结构。配合物的外界可以是阳离子也可以是阴离子;不仅仅是过渡金属元素能形成配合物,Al3+也可,如Na3[AlF6]。Na3[AlF6]的中心原子是Al3+,配位体是F-,其配位数是6;Pt(NH3)2Cl2存在顺反异构体。
