【世纪金榜】2015-2016学年高中化学 3.4分子间作用力 分子晶体课件 苏教版选修3
文档属性
| 名称 | 【世纪金榜】2015-2016学年高中化学 3.4分子间作用力 分子晶体课件 苏教版选修3 |

|
|
| 格式 | zip | ||
| 文件大小 | 693.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-09 20:50:09 | ||
图片预览










文档简介
课件56张PPT。第四单元
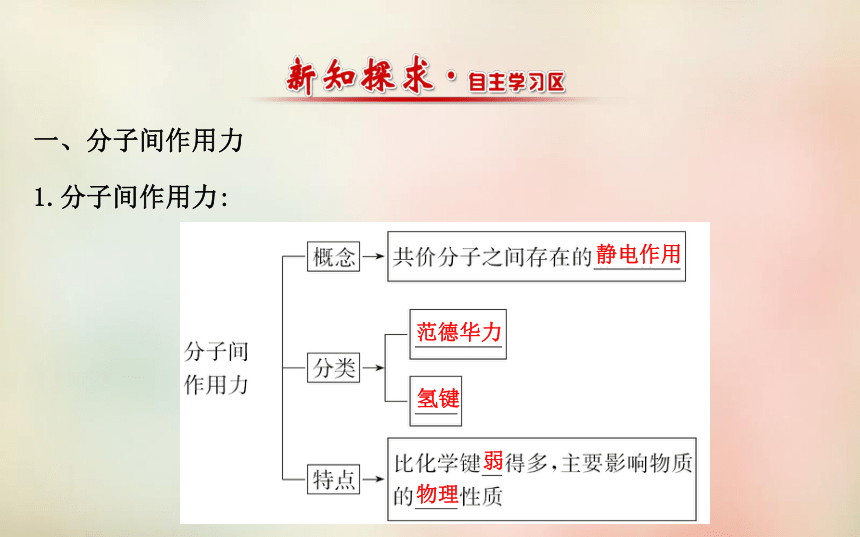
分子间作用力 分子晶体一、分子间作用力
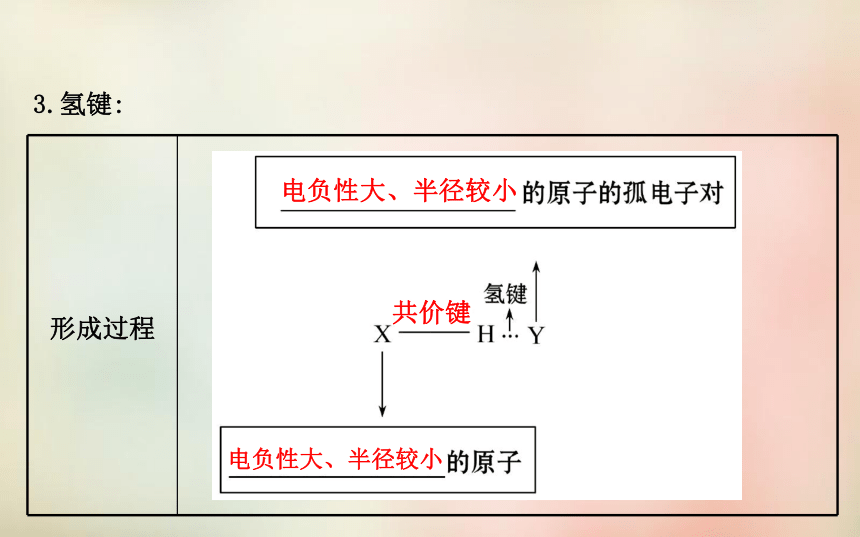
1.分子间作用力:静电作用范德华力氢键弱物理2.范德华力:方向性饱和性结构和组成越大越高3.氢键:电负性大、半径较小共价键电负性大、半径较小X—H…YN、O、F氢键方向性饱和性分子内氢键分子间氢键升高降低电离、溶解二、分子晶体分子分子间作用力分子分子间作用力较小较低非金属氢化物非金属单质非金属氧化物酸有机物【自我小测】
1.思考辨析:
(1)分子间作用力是化学键的一种。 ( )
分析:×。分子间作用力较小,不属于化学键。
(2)相对分子质量越大,分子间作用力越大,熔沸点越高,所以硫化氢的熔、沸点大于水。 ( )
分析:×。水中不仅存在范德华力,还存在氢键,所以水的熔、沸点大于硫化氢。(3)分子晶体的熔、沸点一定比金属晶体的低。 ( )
分析:×。分子晶体的熔、沸点不一定比金属晶体的低,如碘的熔点比汞的高。
(4)并不是所有的分子中都存在共价键,但所有的分子晶体中都存在分子间作用力。 ( )
分析:√。并不是所有的分子中都有共价键,如稀有气体,但是所有分子晶体中都有分子间作用力。(5)存在氢键的分子的熔、沸点比一般分子的高。 ( )
分析:×。分子间氢键的存在会导致物质的熔、沸点升高,但是分子内氢键的存在会降低物质的熔、沸点。
(6)分子晶体熔化时,只破坏分子间作用力,不破坏分子内的化学
键。 ( )
分析:√。分子晶体熔化时,只是分子间的距离变大,分子并没有变化,所以不破坏分子内的化学键。2.下列晶体中,不是分子晶体的是 ( )
A.氯化铵 B.硫酸
C.氦气 D.三氧化硫
【解析】选A。A项中晶体的组成微粒为阴、阳离子,因此氯化铵不是分子晶体。3.下列物质中分子间能形成氢键的是 ( )
A.N2 B.HBr C.NH3 D.H2S
【解析】选C。电负性大的元素与H形成的化合物可以形成氢键。4.下列变化中,吸收热量是用于克服分子间作用力的是 ( )
A.加热金属铁使之熔化
B.加热晶体碘使之变成蒸气
C.加热碘化氢使之分解
D.加热金刚石使之熔化【解析】选B。铁属于金属晶体,熔化时克服金属键,故A错误;碘单质的晶体属于分子晶体,加热晶体碘使之变成蒸气克服分子间作用力,故B正确;加热碘化氢使之分解克服的是共价键,故C错误;加热金刚石使之熔化,克服的是共价键,故D错误。5.(SJ·P60改编)下列有关氢键的因果说法中,正确的是( )【解析】选C。氢键属于分子间作用力,它比化学键弱;分子内氢键的存在可以降低物质的熔、沸点;由于氨气分子与水分子之间可以形成氢键,因此氨气的溶解度较大;邻羟基苯甲醛存在分子内氢键,因此它的熔、沸点比对羟基苯甲醛的熔点低。一、分子间作用力
1.范德华力、氢键与共价键的比较:2.范德华力对物质性质的影响:
(1)对物质熔、沸点的影响。
一般来说,组成和结构相似的物质,相对分子质量越大,范德华力
越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,
Rn>Xe>Kr>Ar>Ne>He。
(2)对物质溶解性的影响。
如在273 K、101 kPa时,氧气在水中的溶解度(0.049 cm3·L-1)比
氮气在水中的溶解度(0.024 cm3·L-1)大,就是因为O2与水分子之间
的范德华力比N2与水分子之间的范德华力大所导致的。3.氢键对物质性质的影响:
(1)对物质熔、沸点的影响。
①某些氢化物分子间存在氢键,如H2O、NH3,HF等,会使其在同主族氢化物中沸点反常,如H2O>H2Te>H2Se>H2S。
②当氢键存在于分子内时,它对物质性质的影响与分子间氢键对物质性质产生的影响是不同的。邻羟基苯甲醛的氢键存在于分子内部,对羟基苯甲醛存在分子间氢键,因此对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。(2)对物质密度的影响。
氢键的存在,会使某些物质的密度出现反常,如液态水变为冰,密度会变小。
(3)对物质溶解度的影响。
如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键。
(4)氢键对物质结构的影响。
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构、DNA的双螺旋结构等。【针对训练】
1.(2015·银川高二检测)下列说法不正确的是 ( )
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成对物质的溶解度有影响
C.分子间有氢键必有范德华力
D.氢键是一种特殊的化学键,它广泛地存在于自然界中【解题指南】解答本题时要注意以下两点:
(1)分子间作用力包括氢键和范德华力,它们影响物质的物理性质。
(2)范德华力普遍存在于分子中,氢键只存在于一些特殊的物质中。【解析】选D。分子间作用力是分子间相互作用力的总称,A正确;范德华力是分子与分子间的相互作用力,而氢键是分子间比范德华力稍强的作用力,它们可以同时存在于分子之间,C正确;分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度等也有影响,B正确;氢键不是化学键,化学键是原子与原子间强烈的相互作用,D错误。2.(2015·黄山高二检测)下列属于分子晶体性质的是 ( )
A.固体中含有共价键
B.能溶于CS2,熔点112.8℃,沸点444.6℃
C.熔点1 400℃,可作半导体材料,难溶于水
D.由原子构成,质软,导电【解题指南】解答本题需注意以下两点:
(1)掌握分子晶体的物理性质:低熔点、易升华、硬度小,一般不导电;
(2)分子晶体中可能含有共价键,含有共价键的固体不一定是分子晶体。
【解析】选B。分子晶体中不一定含有共价键,A错误;分子晶体熔点一般比较低,C错误;分子晶体由分子构成,一般不导电,D错误。【方法规律】分子晶体的判断方法
(1)依据组成晶体的微粒和微粒间的作用力判断:组成分子晶体的微粒是分子,微粒间的作用力是分子间作用力。
(2)依据物质的分类判断:大多数非金属单质、气态氢化物、非金属氧化物、酸、绝大多数有机化合物形成的晶体是分子晶体。
(3)依据晶体的熔、沸点判断:分子晶体的熔、沸点较低。
(4)依据熔融状态下是否导电判断:分子晶体在熔融状态下不导电。【补偿训练】1.下列现象与氢键有关的是 ( )
①HF的沸点比同主族其他元素的氢化物高
②甲硫醇(CH3SH)比甲醇的沸点低
③HBr在水中的溶解性很大
④邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的低
⑤H2O是一种非常稳定的化合物
A.①②④ B.全部
C.①④⑤ D.①②③④【解析】选A。①是因为HF分子间存在氢键,②是因为甲醇分子间存在氢键,③是因为HBr与水的极性相同,④邻羟基苯甲醛形成了分子内氢键,对羟基苯甲醛形成了分子间氢键,⑤是因为水中的H—O键稳定。2.下列叙述与分子间作用力无关的是 ( )
A.气体物质加压或降温时能凝结或凝固
B.干冰易升华
C.氟、氯、溴、碘单质的熔沸点依次升高
D.氯化钠的熔点较高
【解析】选D。NaCl的熔点高是因为NaCl晶体的晶格能较高,离子键较强。二、分子晶体的结构及性质
【自主导练】
1.(2015·梧州高二检测)冰是人类珍贵的淡水资源,在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的冰晶体,其结构示意图如图所示:(1)1 mol冰中有 mol“氢键”。
(2)在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在
冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华
热是51 kJ·mol-1,则冰晶体中氢键的能量为 kJ·mol-1。
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小
关系是 ,其判断依据是 。【解题指南】解答本题要注意以下两点:
(1)分子间作用力包括氢键和范德华力;
(2)分子间氢键的存在使物质的熔、沸点升高。【解析】(1)由于1个水分子与4个水分子形成4个氢键,而每个氢键
被两个H2O分子共有,所以1 mol冰中含有4× mol=2 mol氢键。
(2)氢键的能量为打开H…Y作用力需要的能量。1个冰晶体分子有两
个氢键,则键能为 =20 kJ·mol-1。
(3)某些氢化物分子间存在氢键,如H2O、NH3、HF等,会使同主族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。答案:(1)2 (2)20
(3)x>z>y 水分子间存在氢键,故沸点最高,硒化氢比硫化氢相对分子质量大,分子间作用力大,故硒化氢沸点高【方法规律】影响物质性质的因素2.(2015·绥化高二检测)下图是干冰晶体的晶胞,由图可知,每个CO2分子周围距离相等且最近的CO2分子数目为 ( )
A.6 B.8 C.10 D.12【解析】选D。根据干冰结构特点,干冰晶体是一种面心立方结构,每个CO2周围等距离且最近的CO2有12个(同层4个,上层4个,下层4个)。【总结归纳】
1.典型的分子晶体模型:2.分子晶体的变化规律:
(1)对于组成和结构相似、晶体中不含氢键的物质来说,随着相对分子质量的增大,范德华力增大,熔、沸点升高。如卤素单质、四卤化碳、稀有气体等。
(2)同分异构体中,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物的同分异构体熔、沸点一般遵循“邻位>间位>对位”的顺序。3.易形成分子晶体的物质:
(1)所有非金属氢化物,如水、硫化氢、氨、过氧化氢、甲烷等。
(2)部分非金属单质,如卤素X2、碘、氧气、硫(S8)、氮气(N2)、白磷(P4)、C60等。
(3)部分非金属氧化物,如CO2、SO2、SO3、P4O6、P4O10等。
(4)几乎所有的酸,如H2SO4、HNO3、H3PO4、H2SiO3、H2SO3等。
(5)绝大多数有机物,如苯、乙醇、乙酸、葡萄糖等。【警示】分子晶体的注意问题
(1)分子晶体可能由原子构成,如稀有气体。
(2)分子晶体中含有物质的分子,分子是形成晶体的粒子。
(3)分子晶体的熔、沸点较低,一般熔、沸点的大小规律是原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点变化较大,要依据具体物质来比较。
(4)分子晶体熔化时,不破坏化学键,破坏的是分子间作用力。【针对训练】
(2015·珠海高二检测)科学家发现的C60是一种新的分子,它具有空
心类足球的结构,被称为“足球分子”。最近科学家又确认存在着
另一种“分子足球N60”,它与C60的结构相似,在高温或机械撞击时,
其积蓄的巨大能量会在一瞬间释放出来。下列关于N60的说法中不正
确的是 ( )A.N60易溶于水
B.N60是N2的一种同素异形体
C.等物质的量分解吸收的热量N60>N2
D.N60是共价键结合的空心球状结构
【解析】选A。根据相似相溶原理,N60为非极性分子,水为极性分子,N60不易溶于水。【补偿训练】如图为硼分子的基本结构单元,已知它为正二十面体,有二十个等边三角形和一定数目的顶角,每一个顶点各有一个硼原子,通过观察,此分子由 个硼原子构成。【解析】该晶体的晶胞由二十个等边三角形构成,而每个等边三角
形有3个顶点,这样共有20×3=60(个)顶点,但每个顶点又被相邻的
5个等边三角形所共有,所以该晶胞实际拥有的顶点数应为20×3×
=12(个)。
答案:12三、四种晶体类型的比较【针对训练】
1.下列说法中正确的是 ( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔、沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合【解析】选D。选项A中离子晶体中每个离子周围吸引带相反电荷离子的个数与离子半径有关,如一个Cs+可同时吸引8个Cl-;选项B中金属内部的自由电子不是在电场力的作用下产生的;选项C中分子晶体的熔、沸点很低,在常温下也有呈固态的,如S属于分子晶体,但它在常温下为固态。2.下面的排序不正确的是 ( )
A.晶体熔点由低到高:CF4B.熔点由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI【解析】选C。A中全为分子晶体,相对分子质量越大,分子间作用力越大,熔点越高,正确;B中全为原子晶体,原子半径越小,共价键键长越短,越牢固,熔点越高,正确;C中全为金属晶体,原子半径越小,金属键越强,熔点越高,错误;D中全为离子晶体,离子所带电荷相同,离子半径越小,晶格能越大,正确。【补偿训练】下列有关冰晶体的说法,正确的是 ( )
A.冰晶体中氢原子和氧原子以共价键结合,属于原子晶体
B.冰晶体中水分子之间的作用力是范德华力和氢键,属于原子晶体
C.冰晶体中水分子之间的作用力是共价键,属于分子晶体
D.冰晶体中水分子之间的作用力是范德华力和氢键,属于分子晶体
【解析】选D。在冰晶体中,氢元素和氧元素是以共价键结合的,但水分子之间是以范德华力和氢键结合的,因此冰晶体属于分子晶体。
分子间作用力 分子晶体一、分子间作用力
1.分子间作用力:静电作用范德华力氢键弱物理2.范德华力:方向性饱和性结构和组成越大越高3.氢键:电负性大、半径较小共价键电负性大、半径较小X—H…YN、O、F氢键方向性饱和性分子内氢键分子间氢键升高降低电离、溶解二、分子晶体分子分子间作用力分子分子间作用力较小较低非金属氢化物非金属单质非金属氧化物酸有机物【自我小测】
1.思考辨析:
(1)分子间作用力是化学键的一种。 ( )
分析:×。分子间作用力较小,不属于化学键。
(2)相对分子质量越大,分子间作用力越大,熔沸点越高,所以硫化氢的熔、沸点大于水。 ( )
分析:×。水中不仅存在范德华力,还存在氢键,所以水的熔、沸点大于硫化氢。(3)分子晶体的熔、沸点一定比金属晶体的低。 ( )
分析:×。分子晶体的熔、沸点不一定比金属晶体的低,如碘的熔点比汞的高。
(4)并不是所有的分子中都存在共价键,但所有的分子晶体中都存在分子间作用力。 ( )
分析:√。并不是所有的分子中都有共价键,如稀有气体,但是所有分子晶体中都有分子间作用力。(5)存在氢键的分子的熔、沸点比一般分子的高。 ( )
分析:×。分子间氢键的存在会导致物质的熔、沸点升高,但是分子内氢键的存在会降低物质的熔、沸点。
(6)分子晶体熔化时,只破坏分子间作用力,不破坏分子内的化学
键。 ( )
分析:√。分子晶体熔化时,只是分子间的距离变大,分子并没有变化,所以不破坏分子内的化学键。2.下列晶体中,不是分子晶体的是 ( )
A.氯化铵 B.硫酸
C.氦气 D.三氧化硫
【解析】选A。A项中晶体的组成微粒为阴、阳离子,因此氯化铵不是分子晶体。3.下列物质中分子间能形成氢键的是 ( )
A.N2 B.HBr C.NH3 D.H2S
【解析】选C。电负性大的元素与H形成的化合物可以形成氢键。4.下列变化中,吸收热量是用于克服分子间作用力的是 ( )
A.加热金属铁使之熔化
B.加热晶体碘使之变成蒸气
C.加热碘化氢使之分解
D.加热金刚石使之熔化【解析】选B。铁属于金属晶体,熔化时克服金属键,故A错误;碘单质的晶体属于分子晶体,加热晶体碘使之变成蒸气克服分子间作用力,故B正确;加热碘化氢使之分解克服的是共价键,故C错误;加热金刚石使之熔化,克服的是共价键,故D错误。5.(SJ·P60改编)下列有关氢键的因果说法中,正确的是( )【解析】选C。氢键属于分子间作用力,它比化学键弱;分子内氢键的存在可以降低物质的熔、沸点;由于氨气分子与水分子之间可以形成氢键,因此氨气的溶解度较大;邻羟基苯甲醛存在分子内氢键,因此它的熔、沸点比对羟基苯甲醛的熔点低。一、分子间作用力
1.范德华力、氢键与共价键的比较:2.范德华力对物质性质的影响:
(1)对物质熔、沸点的影响。
一般来说,组成和结构相似的物质,相对分子质量越大,范德华力
越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,
Rn>Xe>Kr>Ar>Ne>He。
(2)对物质溶解性的影响。
如在273 K、101 kPa时,氧气在水中的溶解度(0.049 cm3·L-1)比
氮气在水中的溶解度(0.024 cm3·L-1)大,就是因为O2与水分子之间
的范德华力比N2与水分子之间的范德华力大所导致的。3.氢键对物质性质的影响:
(1)对物质熔、沸点的影响。
①某些氢化物分子间存在氢键,如H2O、NH3,HF等,会使其在同主族氢化物中沸点反常,如H2O>H2Te>H2Se>H2S。
②当氢键存在于分子内时,它对物质性质的影响与分子间氢键对物质性质产生的影响是不同的。邻羟基苯甲醛的氢键存在于分子内部,对羟基苯甲醛存在分子间氢键,因此对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。(2)对物质密度的影响。
氢键的存在,会使某些物质的密度出现反常,如液态水变为冰,密度会变小。
(3)对物质溶解度的影响。
如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键。
(4)氢键对物质结构的影响。
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构、DNA的双螺旋结构等。【针对训练】
1.(2015·银川高二检测)下列说法不正确的是 ( )
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成对物质的溶解度有影响
C.分子间有氢键必有范德华力
D.氢键是一种特殊的化学键,它广泛地存在于自然界中【解题指南】解答本题时要注意以下两点:
(1)分子间作用力包括氢键和范德华力,它们影响物质的物理性质。
(2)范德华力普遍存在于分子中,氢键只存在于一些特殊的物质中。【解析】选D。分子间作用力是分子间相互作用力的总称,A正确;范德华力是分子与分子间的相互作用力,而氢键是分子间比范德华力稍强的作用力,它们可以同时存在于分子之间,C正确;分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度等也有影响,B正确;氢键不是化学键,化学键是原子与原子间强烈的相互作用,D错误。2.(2015·黄山高二检测)下列属于分子晶体性质的是 ( )
A.固体中含有共价键
B.能溶于CS2,熔点112.8℃,沸点444.6℃
C.熔点1 400℃,可作半导体材料,难溶于水
D.由原子构成,质软,导电【解题指南】解答本题需注意以下两点:
(1)掌握分子晶体的物理性质:低熔点、易升华、硬度小,一般不导电;
(2)分子晶体中可能含有共价键,含有共价键的固体不一定是分子晶体。
【解析】选B。分子晶体中不一定含有共价键,A错误;分子晶体熔点一般比较低,C错误;分子晶体由分子构成,一般不导电,D错误。【方法规律】分子晶体的判断方法
(1)依据组成晶体的微粒和微粒间的作用力判断:组成分子晶体的微粒是分子,微粒间的作用力是分子间作用力。
(2)依据物质的分类判断:大多数非金属单质、气态氢化物、非金属氧化物、酸、绝大多数有机化合物形成的晶体是分子晶体。
(3)依据晶体的熔、沸点判断:分子晶体的熔、沸点较低。
(4)依据熔融状态下是否导电判断:分子晶体在熔融状态下不导电。【补偿训练】1.下列现象与氢键有关的是 ( )
①HF的沸点比同主族其他元素的氢化物高
②甲硫醇(CH3SH)比甲醇的沸点低
③HBr在水中的溶解性很大
④邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的低
⑤H2O是一种非常稳定的化合物
A.①②④ B.全部
C.①④⑤ D.①②③④【解析】选A。①是因为HF分子间存在氢键,②是因为甲醇分子间存在氢键,③是因为HBr与水的极性相同,④邻羟基苯甲醛形成了分子内氢键,对羟基苯甲醛形成了分子间氢键,⑤是因为水中的H—O键稳定。2.下列叙述与分子间作用力无关的是 ( )
A.气体物质加压或降温时能凝结或凝固
B.干冰易升华
C.氟、氯、溴、碘单质的熔沸点依次升高
D.氯化钠的熔点较高
【解析】选D。NaCl的熔点高是因为NaCl晶体的晶格能较高,离子键较强。二、分子晶体的结构及性质
【自主导练】
1.(2015·梧州高二检测)冰是人类珍贵的淡水资源,在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的冰晶体,其结构示意图如图所示:(1)1 mol冰中有 mol“氢键”。
(2)在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在
冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华
热是51 kJ·mol-1,则冰晶体中氢键的能量为 kJ·mol-1。
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小
关系是 ,其判断依据是 。【解题指南】解答本题要注意以下两点:
(1)分子间作用力包括氢键和范德华力;
(2)分子间氢键的存在使物质的熔、沸点升高。【解析】(1)由于1个水分子与4个水分子形成4个氢键,而每个氢键
被两个H2O分子共有,所以1 mol冰中含有4× mol=2 mol氢键。
(2)氢键的能量为打开H…Y作用力需要的能量。1个冰晶体分子有两
个氢键,则键能为 =20 kJ·mol-1。
(3)某些氢化物分子间存在氢键,如H2O、NH3、HF等,会使同主族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。答案:(1)2 (2)20
(3)x>z>y 水分子间存在氢键,故沸点最高,硒化氢比硫化氢相对分子质量大,分子间作用力大,故硒化氢沸点高【方法规律】影响物质性质的因素2.(2015·绥化高二检测)下图是干冰晶体的晶胞,由图可知,每个CO2分子周围距离相等且最近的CO2分子数目为 ( )
A.6 B.8 C.10 D.12【解析】选D。根据干冰结构特点,干冰晶体是一种面心立方结构,每个CO2周围等距离且最近的CO2有12个(同层4个,上层4个,下层4个)。【总结归纳】
1.典型的分子晶体模型:2.分子晶体的变化规律:
(1)对于组成和结构相似、晶体中不含氢键的物质来说,随着相对分子质量的增大,范德华力增大,熔、沸点升高。如卤素单质、四卤化碳、稀有气体等。
(2)同分异构体中,支链越多,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。芳香烃及其衍生物的同分异构体熔、沸点一般遵循“邻位>间位>对位”的顺序。3.易形成分子晶体的物质:
(1)所有非金属氢化物,如水、硫化氢、氨、过氧化氢、甲烷等。
(2)部分非金属单质,如卤素X2、碘、氧气、硫(S8)、氮气(N2)、白磷(P4)、C60等。
(3)部分非金属氧化物,如CO2、SO2、SO3、P4O6、P4O10等。
(4)几乎所有的酸,如H2SO4、HNO3、H3PO4、H2SiO3、H2SO3等。
(5)绝大多数有机物,如苯、乙醇、乙酸、葡萄糖等。【警示】分子晶体的注意问题
(1)分子晶体可能由原子构成,如稀有气体。
(2)分子晶体中含有物质的分子,分子是形成晶体的粒子。
(3)分子晶体的熔、沸点较低,一般熔、沸点的大小规律是原子晶体>离子晶体>分子晶体。金属晶体的熔、沸点变化较大,要依据具体物质来比较。
(4)分子晶体熔化时,不破坏化学键,破坏的是分子间作用力。【针对训练】
(2015·珠海高二检测)科学家发现的C60是一种新的分子,它具有空
心类足球的结构,被称为“足球分子”。最近科学家又确认存在着
另一种“分子足球N60”,它与C60的结构相似,在高温或机械撞击时,
其积蓄的巨大能量会在一瞬间释放出来。下列关于N60的说法中不正
确的是 ( )A.N60易溶于水
B.N60是N2的一种同素异形体
C.等物质的量分解吸收的热量N60>N2
D.N60是共价键结合的空心球状结构
【解析】选A。根据相似相溶原理,N60为非极性分子,水为极性分子,N60不易溶于水。【补偿训练】如图为硼分子的基本结构单元,已知它为正二十面体,有二十个等边三角形和一定数目的顶角,每一个顶点各有一个硼原子,通过观察,此分子由 个硼原子构成。【解析】该晶体的晶胞由二十个等边三角形构成,而每个等边三角
形有3个顶点,这样共有20×3=60(个)顶点,但每个顶点又被相邻的
5个等边三角形所共有,所以该晶胞实际拥有的顶点数应为20×3×
=12(个)。
答案:12三、四种晶体类型的比较【针对训练】
1.下列说法中正确的是 ( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔、沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合【解析】选D。选项A中离子晶体中每个离子周围吸引带相反电荷离子的个数与离子半径有关,如一个Cs+可同时吸引8个Cl-;选项B中金属内部的自由电子不是在电场力的作用下产生的;选项C中分子晶体的熔、沸点很低,在常温下也有呈固态的,如S属于分子晶体,但它在常温下为固态。2.下面的排序不正确的是 ( )
A.晶体熔点由低到高:CF4
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI【解析】选C。A中全为分子晶体,相对分子质量越大,分子间作用力越大,熔点越高,正确;B中全为原子晶体,原子半径越小,共价键键长越短,越牢固,熔点越高,正确;C中全为金属晶体,原子半径越小,金属键越强,熔点越高,错误;D中全为离子晶体,离子所带电荷相同,离子半径越小,晶格能越大,正确。【补偿训练】下列有关冰晶体的说法,正确的是 ( )
A.冰晶体中氢原子和氧原子以共价键结合,属于原子晶体
B.冰晶体中水分子之间的作用力是范德华力和氢键,属于原子晶体
C.冰晶体中水分子之间的作用力是共价键,属于分子晶体
D.冰晶体中水分子之间的作用力是范德华力和氢键,属于分子晶体
【解析】选D。在冰晶体中,氢元素和氧元素是以共价键结合的,但水分子之间是以范德华力和氢键结合的,因此冰晶体属于分子晶体。
