【世纪金榜】2015-2016学年高中化学 模块复习课2 微粒间作用力与物质性质课件 苏教版选修3
文档属性
| 名称 | 【世纪金榜】2015-2016学年高中化学 模块复习课2 微粒间作用力与物质性质课件 苏教版选修3 |  | |
| 格式 | zip | ||
| 文件大小 | 659.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-12-09 20:52:09 | ||
图片预览









文档简介
课件32张PPT。第2课
微粒间作用力与物质性质一、微粒间作用力
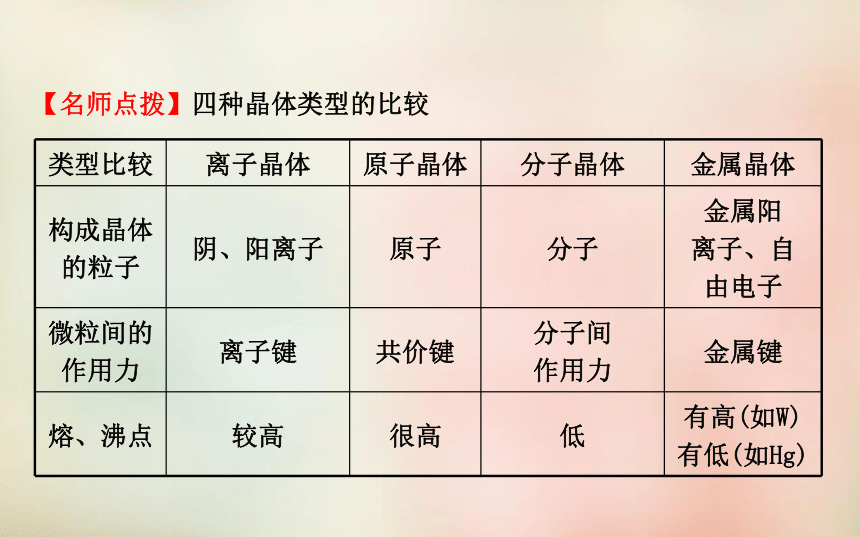
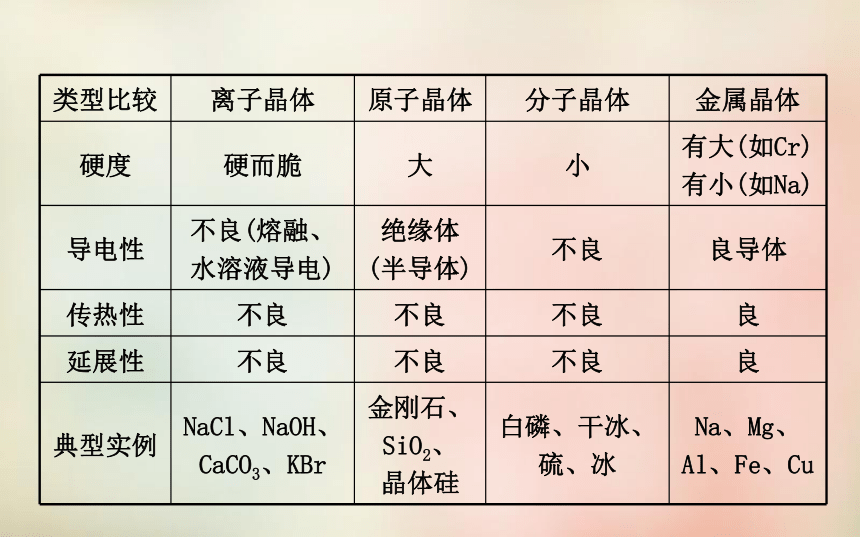
1.共价键:方向性 饱和性头碰头肩并肩σ键A→B稳定稳定金属离子无方向性、无饱和性无方向性、无饱和性静电作用分子电负性电负性金属阳离子和自由电子金属键阴离子和阳离子离子键原子共价键分子范德华力一、四种晶体类型的比较
1.下列叙述中正确的是 ( )
A.分子晶体溶解于水时,都只需克服分子间作用力
B.离子晶体中一定含有金属阳离子
C.金属晶体容易导电,是因为其中含有自由电子
D.原子晶体中只存在非极性共价键【解析】选C。HCl是分子晶体,溶于水时破坏共价键,A错误;离子晶
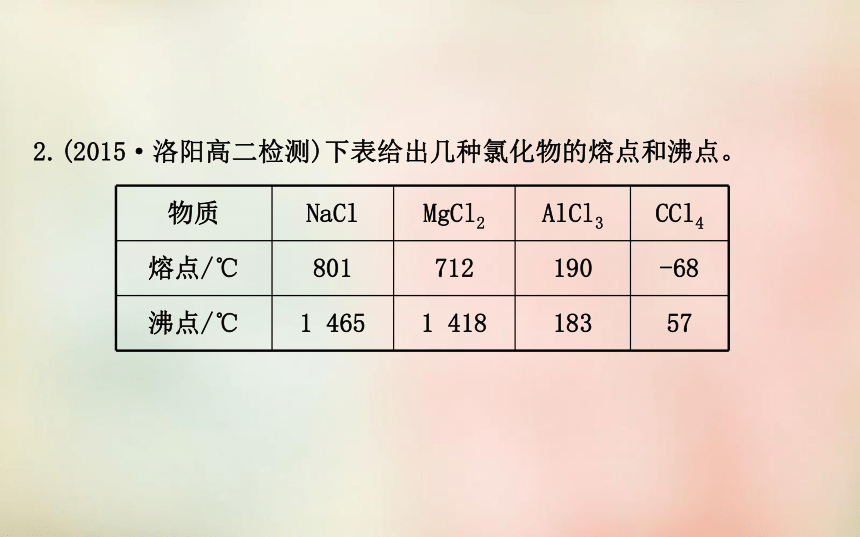
体中也可能含有N 而无金属离子,B错误;原子晶体SiO2中存在极性共价键,D错误。2.(2015·洛阳高二检测)下表给出几种氯化物的熔点和沸点。4种氯化物的下列说法:
(1)AlCl3在加热时可升华
(2)SiCl4属于分子晶体
(3)1 500℃时NaCl的分子组成可用NaCl表示
(4)AlCl3是典型的离子晶体
其中与表中数据一致的是 ( )
A.只有(1)和(2) B.只有(3)
C.只有(1)(2)(3) D.全部一致【解析】选C。由表中数据看出AlCl3的沸点比熔点低,加热可升华,表明它是分子晶体;CCl4与SiCl4组成相似,故SiCl4是分子晶体;NaCl是离子晶体,只有高温呈气态时,组成才是单个NaCl分子。【名师点拨】四种晶体类型的比较二、判断晶体类型的方法
1.(2015·徐州高二检测)下列数据是对应物质的熔点(℃),据此做出的下列判断中错误的是 ( )A.铝的化合物的晶体中有离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同元素的氧化物可形成相同类型的晶体
【解析】选B。离子晶体有NaCl、Na2O、AlF3、Al2O3;原子晶体是SiO2;分子晶体有AlCl3、BCl3、CO2。2.(2015·无锡高二检测)干冰和二氧化硅晶体同属ⅣA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是 ( )
A.二氧化硅相对分子质量大于二氧化碳相对分子质量
B.C—O键键能比Si—O键键能小
C.干冰为分子晶体,二氧化硅为原子晶体
D.干冰易升华,二氧化硅不能【解析】选C。干冰和SiO2所属晶体类型不同,干冰为分子晶体,熔化时破坏分子间作用力,SiO2为原子晶体,熔化时破坏共价键,所以熔点较高。【名师点拨】判断晶体类型的方法
1.依据组成晶体的晶格质点和质点间的作用判断:
(1)离子晶体的晶格质点是阴、阳离子,质点间的作用是离子键。
(2)原子晶体的晶格质点是原子,质点间的作用是共价键。
(3)分子晶体的晶格质点是分子,质点间的作用为分子间作用力。
(4)金属晶体的晶格质点是金属阳离子和自由电子,质点间的作用是金属键。2.依据物质的类型判断:
(1)金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。3.依据晶体的熔点判断:
(1)离子晶体的熔点较高,常在数百至1 000余摄氏度。
(2)原子晶体熔点高,常在1 000至几千摄氏度。
(3)分子晶体熔点低,常在数百摄氏度以下。
(4)金属晶体多数熔点高,但也有相当低的。4.依据导电性判断:
(1)离子晶体在水溶液或熔融态下能导电。
(2)原子晶体一般为非导体,但硅等少数物质能导电。
(3)分子晶体为非导体,但分子晶体中的电解质溶于水,使分子内的化学键断裂形成自由离子也能导电。
(4)金属晶体是电的良导体。5.依据硬度和机械性能判断:
(1)离子晶体硬度较大或略硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小。
(4)金属晶体多数硬度大,但也有较低的,且具有延展性。三、有关晶体中粒子数的计算
1.(2015·咸阳高二检测)已知某离子晶体晶胞如图所示,其摩尔质量为M,阿伏加德罗常数为NA,晶体的密度为dg·cm-3。下列说法中正确的是 ( )A.晶体晶胞中阴、阳离子的个数都为1
B.其中阴、阳离子的配位数都是4
C.该晶胞可能是NaCl的晶胞
D.该晶体中两个距离最近的阳离子的核间距为 【解析】选C。A项用均摊法分析,晶体晶胞中阴、阳离子的个数都
为4;B项中阴、阳离子的配位数都是6;C项该晶胞为面心立方晶胞,
符合NaCl晶胞的特征,根据氯化钠的晶胞结构图进行计算:设晶胞边
长为acm,则两个距离最近的阳离子的核间距离为 acm,4×M=
NA×a3cm3×dg·cm-3,可求出a,进而求得核间距,D项错误。2.(2015·潍坊高二检测)钡在氧气中燃烧时
得到一种钡的氧化物晶体,结构如图所示,
有关说法不正确的是( )
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体的晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个【解析】选B。由晶胞结构及“均摊法”计算:一个晶胞中含Ba2+:
8× +6× =4个,含 :12× +1=4个,故晶体化学式是BaO2,其
他选项可结合NaCl晶胞知识做出判断。3.(2015·常州高二检测)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为 ,图
Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为 。
(2)图Ⅱ所示的物质结构中最外层已达8电子结构的原子是 。
H3BO3晶体中硼原子个数与极性键个数之比为 。
(3)三种晶体中熔点最低的是 ,其晶体受热熔化时,克服的微
粒之间的相互作用力为 。【解析】(1)从图Ⅰ可看出面心上的一个Ca2+连接四个F-,若将旁边的晶胞画出,也应连四个F-,则一个Ca2+连有8个F-。铜属于面心立方堆积,配位数为12。(2)H是两电子,B从图Ⅱ看,只形成三个共价键,应为6个电子,只有氧为8电子。H3BO3属于分子晶体,一个B连有三个O,三个O又连有三个H,所以一个B对应6个极性键。(3)熔点大小规律:原子晶体>离子晶体>分子晶体,金属晶体看具体情况,此题H3BO3为分子晶体,应最小,熔化时破坏分子间作用力。
答案:(1)8 12 (2)O 1∶6
(3)H3BO3 分子间作用力【名师点拨】晶体中粒子数的计算
“均摊法”的基本思想是晶胞中任意位置上的一个粒子被n个晶胞共用,那么每个晶胞分得这个粒子的份额就是1/n。
1.立方晶胞:
(1)每个顶点上的粒子被8个晶胞共用,每个粒子只有 属于该晶胞。
(2)每条棱上的粒子被4个晶胞共用,每个粒子只有 属于该晶胞。
(3)每个面心上的粒子被两个晶胞共用,每个粒子只有 属于该晶胞。
(4)晶胞内的粒子完全属于该晶胞。2.六方晶胞:
(1)每个顶点上的粒子被6个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用。
(3)每个面心上的粒子被两个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。3.三棱晶胞:
(1)每个顶点上的粒子被12个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被6个晶胞共用。
(3)每个面心上的粒子被两个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。
微粒间作用力与物质性质一、微粒间作用力
1.共价键:方向性 饱和性头碰头肩并肩σ键A→B稳定稳定金属离子无方向性、无饱和性无方向性、无饱和性静电作用分子电负性电负性金属阳离子和自由电子金属键阴离子和阳离子离子键原子共价键分子范德华力一、四种晶体类型的比较
1.下列叙述中正确的是 ( )
A.分子晶体溶解于水时,都只需克服分子间作用力
B.离子晶体中一定含有金属阳离子
C.金属晶体容易导电,是因为其中含有自由电子
D.原子晶体中只存在非极性共价键【解析】选C。HCl是分子晶体,溶于水时破坏共价键,A错误;离子晶
体中也可能含有N 而无金属离子,B错误;原子晶体SiO2中存在极性共价键,D错误。2.(2015·洛阳高二检测)下表给出几种氯化物的熔点和沸点。4种氯化物的下列说法:
(1)AlCl3在加热时可升华
(2)SiCl4属于分子晶体
(3)1 500℃时NaCl的分子组成可用NaCl表示
(4)AlCl3是典型的离子晶体
其中与表中数据一致的是 ( )
A.只有(1)和(2) B.只有(3)
C.只有(1)(2)(3) D.全部一致【解析】选C。由表中数据看出AlCl3的沸点比熔点低,加热可升华,表明它是分子晶体;CCl4与SiCl4组成相似,故SiCl4是分子晶体;NaCl是离子晶体,只有高温呈气态时,组成才是单个NaCl分子。【名师点拨】四种晶体类型的比较二、判断晶体类型的方法
1.(2015·徐州高二检测)下列数据是对应物质的熔点(℃),据此做出的下列判断中错误的是 ( )A.铝的化合物的晶体中有离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同元素的氧化物可形成相同类型的晶体
【解析】选B。离子晶体有NaCl、Na2O、AlF3、Al2O3;原子晶体是SiO2;分子晶体有AlCl3、BCl3、CO2。2.(2015·无锡高二检测)干冰和二氧化硅晶体同属ⅣA族元素的最高价氧化物,它们的熔、沸点差别很大的原因是 ( )
A.二氧化硅相对分子质量大于二氧化碳相对分子质量
B.C—O键键能比Si—O键键能小
C.干冰为分子晶体,二氧化硅为原子晶体
D.干冰易升华,二氧化硅不能【解析】选C。干冰和SiO2所属晶体类型不同,干冰为分子晶体,熔化时破坏分子间作用力,SiO2为原子晶体,熔化时破坏共价键,所以熔点较高。【名师点拨】判断晶体类型的方法
1.依据组成晶体的晶格质点和质点间的作用判断:
(1)离子晶体的晶格质点是阴、阳离子,质点间的作用是离子键。
(2)原子晶体的晶格质点是原子,质点间的作用是共价键。
(3)分子晶体的晶格质点是分子,质点间的作用为分子间作用力。
(4)金属晶体的晶格质点是金属阳离子和自由电子,质点间的作用是金属键。2.依据物质的类型判断:
(1)金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。
(2)大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。
(3)常见的原子晶体单质有金刚石、晶体硅、晶体硼等;常见的原子晶体化合物有碳化硅、二氧化硅等。3.依据晶体的熔点判断:
(1)离子晶体的熔点较高,常在数百至1 000余摄氏度。
(2)原子晶体熔点高,常在1 000至几千摄氏度。
(3)分子晶体熔点低,常在数百摄氏度以下。
(4)金属晶体多数熔点高,但也有相当低的。4.依据导电性判断:
(1)离子晶体在水溶液或熔融态下能导电。
(2)原子晶体一般为非导体,但硅等少数物质能导电。
(3)分子晶体为非导体,但分子晶体中的电解质溶于水,使分子内的化学键断裂形成自由离子也能导电。
(4)金属晶体是电的良导体。5.依据硬度和机械性能判断:
(1)离子晶体硬度较大或略硬而脆。
(2)原子晶体硬度大。
(3)分子晶体硬度小。
(4)金属晶体多数硬度大,但也有较低的,且具有延展性。三、有关晶体中粒子数的计算
1.(2015·咸阳高二检测)已知某离子晶体晶胞如图所示,其摩尔质量为M,阿伏加德罗常数为NA,晶体的密度为dg·cm-3。下列说法中正确的是 ( )A.晶体晶胞中阴、阳离子的个数都为1
B.其中阴、阳离子的配位数都是4
C.该晶胞可能是NaCl的晶胞
D.该晶体中两个距离最近的阳离子的核间距为 【解析】选C。A项用均摊法分析,晶体晶胞中阴、阳离子的个数都
为4;B项中阴、阳离子的配位数都是6;C项该晶胞为面心立方晶胞,
符合NaCl晶胞的特征,根据氯化钠的晶胞结构图进行计算:设晶胞边
长为acm,则两个距离最近的阳离子的核间距离为 acm,4×M=
NA×a3cm3×dg·cm-3,可求出a,进而求得核间距,D项错误。2.(2015·潍坊高二检测)钡在氧气中燃烧时
得到一种钡的氧化物晶体,结构如图所示,
有关说法不正确的是( )
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体的晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个【解析】选B。由晶胞结构及“均摊法”计算:一个晶胞中含Ba2+:
8× +6× =4个,含 :12× +1=4个,故晶体化学式是BaO2,其
他选项可结合NaCl晶胞知识做出判断。3.(2015·常州高二检测)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为 ,图
Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为 。
(2)图Ⅱ所示的物质结构中最外层已达8电子结构的原子是 。
H3BO3晶体中硼原子个数与极性键个数之比为 。
(3)三种晶体中熔点最低的是 ,其晶体受热熔化时,克服的微
粒之间的相互作用力为 。【解析】(1)从图Ⅰ可看出面心上的一个Ca2+连接四个F-,若将旁边的晶胞画出,也应连四个F-,则一个Ca2+连有8个F-。铜属于面心立方堆积,配位数为12。(2)H是两电子,B从图Ⅱ看,只形成三个共价键,应为6个电子,只有氧为8电子。H3BO3属于分子晶体,一个B连有三个O,三个O又连有三个H,所以一个B对应6个极性键。(3)熔点大小规律:原子晶体>离子晶体>分子晶体,金属晶体看具体情况,此题H3BO3为分子晶体,应最小,熔化时破坏分子间作用力。
答案:(1)8 12 (2)O 1∶6
(3)H3BO3 分子间作用力【名师点拨】晶体中粒子数的计算
“均摊法”的基本思想是晶胞中任意位置上的一个粒子被n个晶胞共用,那么每个晶胞分得这个粒子的份额就是1/n。
1.立方晶胞:
(1)每个顶点上的粒子被8个晶胞共用,每个粒子只有 属于该晶胞。
(2)每条棱上的粒子被4个晶胞共用,每个粒子只有 属于该晶胞。
(3)每个面心上的粒子被两个晶胞共用,每个粒子只有 属于该晶胞。
(4)晶胞内的粒子完全属于该晶胞。2.六方晶胞:
(1)每个顶点上的粒子被6个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被3个晶胞共用。
(3)每个面心上的粒子被两个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。3.三棱晶胞:
(1)每个顶点上的粒子被12个晶胞共用。
(2)每条横棱上的粒子被4个晶胞共用;每条纵棱上的粒子被6个晶胞共用。
(3)每个面心上的粒子被两个晶胞共用。
(4)晶胞内的粒子完全属于该晶胞。
