8.1自然资源的开发利用(含解析) 2023~2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 8.1自然资源的开发利用(含解析) 2023~2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-02 18:44:20 | ||
图片预览




文档简介
8.1自然资源的开发利用 2023~2024学年高一下学期化学人教版(2019)必修第二册
一、单选题,共14小题
1.(23-24高二上·广东湛江·期中)琴棋书画诗酒花是古人享受人生的七绝。下列物品的主要材料为金属的是
A.端石佛手砚 B.明玉雕凤纹笔杆 C.稻谷耕作全景图通草纸外销画 D.清外销银浮雕人物龙柄带“史溢泉、开利店”铭啤酒杯
A.A B.B C.C D.D
2.(23-24高一上·辽宁·阶段练习)有两种金属组成的合金68g与足量的硫酸溶液反应,产生氢气4g,则该合金的组成可能为
A.K、Ca B.Na、Fe C.Al、Cu D.Zn、Ag
3.(2023高一·全国·专题练习)下列关于金属冶炼的说法中,正确的是
A.金属冶炼的本质是将化合态的金属元素还原为金属单质的过程
B.锈蚀后的铁制品没有回收冶炼价值
C.像钾、钠等活泼金属可以通过热分解法来冶炼
D.金属的冶炼方法与金属离子的氧化性无关
4.(21-22高一下·云南文山·期末)科学、可持续、合理利用资源是习近平建立新时代中国特色社会主义思想的重要组成部分。下列有关资源开发和利用的说法不正确的是
A.煤的干馏,又称为煤的焦化,属于化学变化
B.通过石油裂化和裂解可以得到乙烯等重要化工原料
C.以石油、煤、天然气为原料,可获得性能优异的高分子材料
D.从海水中提取粗盐、溴单质、镁及其化工产品的过程中均涉及氧化还原反应
5.(21-22高二下·江苏宿迁·期中)化石燃料是由古代生物的遗骸经过一系列复杂变化而形成的,是不可再生资源。下列关于化石燃料的说法不正确的是
A.甲烷是天然气的主要成分,它是一种高效而洁净的燃料
B.石油的分馏是化学变化
C.石油通过催化裂化过程可获得汽油、煤油等轻质油
D.煤的气化是把煤转化为可燃性气体的过程,该过程属于化学变化
6.(23-24高一下·全国·课后作业)化学与生产、生活和科学技术的发展有着密切的联系,对社会发展、科技进步和人类生活质量的提高有着广泛而深刻的影响。下列说法不正确的是
A.碳酸钠药片和氢氧化铝药片可用于治疗胃酸过多
B.漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂
C.生铁的含碳量比钢大,具有硬度大、抗压等优良性能,可以用于制造管道、机座、下水井盖
D.新型储氢合金材料的研究和开发为氢气能源的实际应用起到重要的推动作用
7.(23-24高一下·全国·课后作业)工业上制备下列物质的生产流程合理的是
A.制备漂白粉:NaCl溶液Cl2漂白粉
B.制备纯碱:饱和食盐水NaHCO3固体Na2CO3固体
C.制备金属镁:浓缩海水Mg(OH)2固体MgCl2溶液Mg
D.制备硫酸:SSO3H2SO4
8.(23-24高一下·全国·课后作业)工业上以铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是
A.反应①中试剂X是氢氧化钠溶液
B.试剂Y是,它与反应生成氢氧化铝
C.图中所示转化反应中包含2个氧化还原反应
D.将X与Y试剂进行对换,最终可以达到相同结果
9.(23-24高一上·广东深圳·阶段练习)下列说法不正确的是
A.氧化铁用于制作红色涂料
B.具有强氧化性,用于自来水杀菌消毒
C.可用作焙制糕点的膨松剂
D.合金熔点、硬度都低于成分金属,钢是用量最大用途最广的合金
10.(23-24高一上·贵州黔东南·期末)不锈钢是最常见的一种合金钢,它的合金元素主要是铬(Cr)和镍(Ni),下列说法正确的是
A.不锈钢的主要成分为铁 B.的质子数为52
C.不锈钢属于纯净物 D.的核外电子数与中子数相差21
11.(22-23高一上·广西柳州·期末)化学与生产、生活密切相关。下列对应关系错误的是
A.湿手不可以直接接触电源——电解质溶液能够导电
B.食物腐败——涉及氧化还原反应
C.漂白液可作消毒剂——漂白液的有效成分是
D.下水井盖由生铁铸造——生铁硬度高于纯铁
12.(23-24高一上·陕西西安·期末)《梦溪笔谈》中记载:“但取精铁,锻之百余火,每锻称之,一锻一轻,至累锻而斤两不减,则纯钢也。”下列说法错误的是
A.生铁和钢均属于合金
B.与生铁相比,钢的硬度更大,质地更脆
C.精铁煅烧的目的之一是将C转化为碳的氧化物而降低含碳量
D.钢是当今世界用量最大、用途最广的合金
13.(23-24高一上·浙江杭州·期末)下列说法不正确的是
A.储氢合金要求储氢量大,金属氢化物既容易形成,受热又不容易分解
B.二氧化硫可用于杀菌消毒,还是一种食品添加剂
C.中国华为集团自主研发的“麒麟”芯片生产时需要用到硅
D.硬铝是一种铝合金,是制造飞机和宇宙飞船的理想材料
14.(2024高一上·黑龙江·学业考试)海洋是一个巨大的化学资源宝库,其中含量较高的离子有
A. B. C. D.
二、非选择题,共4小题
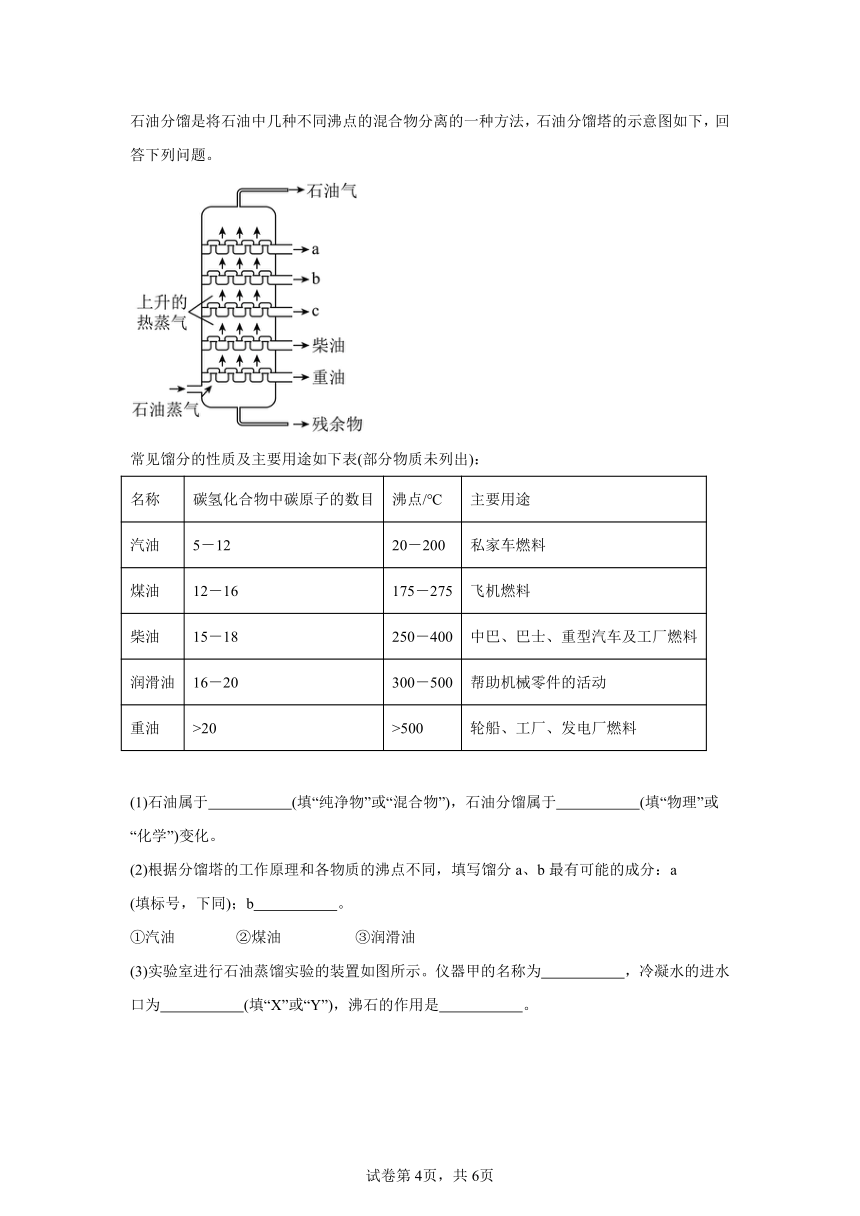
15.(23-24高一下·全国·课时练习)石油不仅是重要的能源,还是化工产品的重要原料。石油分馏是将石油中几种不同沸点的混合物分离的一种方法,石油分馏塔的示意图如下,回答下列问题。
常见馏分的性质及主要用途如下表(部分物质未列出):
名称 碳氢化合物中碳原子的数目 沸点/℃ 主要用途
汽油 5-12 20-200 私家车燃料
煤油 12-16 175-275 飞机燃料
柴油 15-18 250-400 中巴、巴士、重型汽车及工厂燃料
润滑油 16-20 300-500 帮助机械零件的活动
重油 >20 >500 轮船、工厂、发电厂燃料
(1)石油属于 (填“纯净物”或“混合物”),石油分馏属于 (填“物理”或“化学”)变化。
(2)根据分馏塔的工作原理和各物质的沸点不同,填写馏分a、b最有可能的成分:a (填标号,下同);b 。
①汽油 ②煤油 ③润滑油
(3)实验室进行石油蒸馏实验的装置如图所示。仪器甲的名称为 ,冷凝水的进水口为 (填“X”或“Y”),沸石的作用是 。
16.(22-23高一下·全国·课时练习)海洋资源的利用具有广阔前景。
(1)不需要经过化学变化就能从海水中获得的物质是___________(填字母)。
A.Cl2 B.淡水 C.烧碱 D.粗盐
(2)下图是从海水中提取镁的简单流程。
①工业上常用于沉淀Mg2+的试剂A是 ,Mg2转化为MgCl2的离子方程式是 。
②由无水MgCl2制取Mg的化学方程式是 。
17.(22-23高一·全国·课时练习)冶炼金属常用以下几种方法:
a.以C、CO或H2作还原剂还原;
b.利用铝热反应原理;
c.电解法;
d.热分解法。
(1)下列金属各采用哪种方法冶炼最佳?
①Fe、Zn、Cu等较不活泼金属 ;
②Na、Mg、Al等活泼或较活泼金属 ;
③Hg、Ag等不活泼金属 ;
④V、Cr、Mn、W等高熔点金属 。
(2)工业上生产钾不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电解效率。现生产钾是用金属钠和熔化的KCl反应制取。有关数据如下表:
熔点/℃ 沸点/℃ 密度/(g·cm-3)
Na 97.8 883 0.97
K 63.7 774 0.86
NaCl 801 1 413 2.165
KCl 770 1 500 1.984
工业上生产金属钾的化学方程式是:KCl+NaNaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数? ;其选择范围是 。
18.(20-21高一·全国·课时练习)下表列举了三种常见金属材料的一些基本性质,尝试利用表中的数据回答有关问题。
金属 密度/ 抗拉强度/ 电导率/
铝 2.70 7.0 0.38
铁 7.86 21.1 0.10
铜 8.92 13.0 0.59
(1)为什么使用铝而不是铜来生产钢芯电导线 ?
(2)为什么用铝合金而不是钢铁来制造汽车发动机的部件 ?
参考答案:
1.D
【详解】A.端石佛手砚为硅酸盐,A不符合题意;
B.玉雕的主要成分为硅酸盐,B不符合题意;
C.草纸的主要成分为纤维素,C不符合题意;
D.清外销银浮雕材料属于银,是金属,D符合题意;
答案选D。
2.C
【详解】4g氢气的物质的量==2mol,故68g金属提供的电子为2mol×2=4mol,则提供1mol电子需要金属的质量为=17g,
K在反应中表现+1价,提供1mol电子需要K的质量为39g/mol×1mol=39g;
Ca在反应中表现+2价,提供1mol电子需要Ca的质量为40g/mol×=20g;
Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g;
Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×=28g;;
Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×=9g;
Cu和硫酸反应不能生成氢气;
Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×=32.5g;
Ag和硫酸不反应;
根据题意两种提供1mol电子平均需要17g,则应该为Al和其他金属的合金;
故选C。
3.A
【详解】A.金属冶炼的本质将金属阳离子变为金属单质即将化合态的金属元素还原为金属单质的过程,故A正确;
B.锈蚀后的铁制品也可以将化合态的金属元素变为单质,因此有回收冶炼价值,故B错误;
C.像钾、钠等活泼金属可以通过电解法来冶炼,故C错误;
D.金属的冶炼方法与金属离子的氧化性有关,金属离子氧化性越强,其冶炼方法越简单,比如氧化银采用热分解法,金属离子氧化性越弱,其冶炼方法越难,比如电解熔融氯化钠得到钠,故D错误。
综上所述,答案为A。
4.D
【详解】A.煤的干馏指煤在隔绝空气条件下加热、分解,生成焦炭、煤焦油、粗苯、煤气等产物的过程,属于化学变化,A正确;
B.工业制的乙烯是石油裂解和精馏的一个产物,B正确;
C.用石油、天然气、煤作原料加工得到单体,经聚合反应可得到合成纤维高分子材料,C正确;
D.从海水中提取粗盐未涉及氧化还原反应,D不正确;
故选D。
5.B
【详解】A.天然气的主要成分是甲烷,燃烧生成二氧化碳和水并放出大量的热,无污染,故是高效、洁净的能源,A正确;
B.石油的分馏是物理变化,B错误;
C.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,C正确;
D.煤的气化是指煤与水蒸气高温下反应生成一氧化碳和氢气,一氧化碳和氢都是可燃性气体,该过程为化学变化,D正确;
故选B。
6.A
【详解】A.碳酸钠有腐蚀性,不能用于治疗胃酸过多,氢氧化铝能与盐酸反应,常用来做胃药,A错误;
B.漂白粉主要成分为CaCl2和Ca(ClO)2,有效成分为Ca(ClO)2,生效时生成HClO,具有强氧化性可以漂白剂,也可以杀菌消毒,B正确;
C.生铁的含碳量比钢大,具有硬度大、抗压等优良性能,可以用于制造管道、机座、下水井盖,C正确;
D.氢气的沸点很低,常温为气体,不便于储存和运输,所以研发新型储氢合金材料将为氢气作为能源的实际应用起到重要的推动作用,D正确;
答案选A。
7.B
【详解】A.工业上制备漂白粉时,先电解NaCl溶液制备Cl2,再将Cl2通入冷的石灰乳中制取漂白粉,而不是通入澄清石灰水中,A不符合题意;
B.工业上制备纯碱时,向饱和食盐水中先后通入NH3、CO2反应生成NaHCO3,并使溶解度较小的NaHCO3从溶液中析出,NaHCO3固体再受热分解制备Na2CO3,B符合题意;
C.工业上制备金属镁时,先向浓缩海水中加入石灰乳生成Mg(OH)2沉淀,再用盐酸将沉淀溶解,得到MgCl2溶液,再经系列操作得到无水MgCl2,最后电解熔融状态下的MgCl2得到金属镁,而不是电解MgCl2溶液,C不符合题意;
D.工业上制备硫酸时,硫铁矿或S先与O2反应生成SO2,SO2经催化氧化生成SO3,最后用浓硫酸吸收SO3制得H2SO4,S不能直接和O2反应生成SO3,D不符合题意;
故选B。
8.A
【分析】铝土矿加入足量氢氧化钠溶液,氧化铝溶解,氧化铁不溶解,过滤,向滤液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,氢氧化铝沉淀加热生成氧化铝,电解熔融氧化铝得到铝单质。
【详解】A.用强碱氢氧化钠溶液,氧化铝溶解,氧化铁不溶解,过滤而分离开,A正确;
B.试剂Y是HCl,由于Y是过量的,因此它与反应生成Al3+,B错误;
C.图中所示转化有一步是氧化还原反应:2Al2O34Al+3O2↑,C错误;
D.试剂X为氢氧化钠,滤渣C为氧化铁,滤液A为和氢氧化钠混合溶液,通入过量二氧化碳气体,发生反应:+CO2===Al(OH)3↓+NaHCO3,不能对换,D错误;
故选A。
9.D
【详解】A.氧化铁为红色固体,可用于制作红色涂料,A正确;
B.HClO具有强氧化性,能使蛋白质变性,所以Cl2可用于自来水的消毒,B正确;
C.NaHCO3不稳定,加热分解生成碳酸钠、水和二氧化碳气体,并且能与酸反应,所以用小苏打做焙制糕点的膨松剂,C正确;
D.合金熔点一般低于成分金属, 硬度一般比其组分中金属的硬度大,D错误;
故选D。
10.A
【详解】A.世界上使用最广泛的金属材料是铁合金,不锈钢是合金钢的一种,不锈钢的主要成分为铁,A正确;
B.的质量数为52,的质子数为24,B错误;
C.不锈钢属于混合物,C错误;
D.的中子数与核外电子数相差59-28-28=3, D错误;
答案选A。
11.C
【详解】A.湿手上会含有盐溶液,盐属于电解质,电解质溶液能够导电,不可以直接接触电源,故A不符合题意;
B.食物腐败是食物被氧化,涉及氧化还原反应,故B不符合题意;
C.漂白液的有效成分为NaClO,NaClO具有强氧化性,可以作消毒剂,故C符合题意;
D.一般合金的硬度大于其组成中纯金属的硬度,生铁为铁合金,因此生铁的硬度比铁大,可以铸造下水井盖,故D不符合题意。
答案选C。
12.B
【详解】A.生铁和钢均属于铁碳合金,A正确;
B.与生铁相比,钢的硬度更大,质地更韧性,B错误;
C.精铁煅烧的目的之一是将C转化为碳的氧化物而降低含碳量,C正确;
D.钢是当今世界用量最大、用途最广的合金,D正确;
故选B。
13.A
【详解】A.实用储氢合金能够吸收大量氢气后形成金属氢化物,稍稍加热又容易分解,释放氢气,A错误;
B.二氧化硫可用于杀菌消毒,且二氧化硫具有还原性,常用作葡萄酒的抗氧化剂,B正确;
C.晶体硅为半导体材料,可用于芯片的制作,C正确;
D.硬铝是一种铝合金,密度小,耐蚀性强,是制造飞机和宇宙飞船的理想材料,D正确;
故选A。
14.B
【详解】海洋是一个巨大的化学资源宝库,含有80多种元素,其中含有较高的钠和氯元素,故海洋是一个巨大的化学资源宝库,其中含量较高的离子有Na+,故答案为:B。
15.(1) 混合物 物理
(2) ① ②
(3) 直形冷凝管(或冷凝管) Y 防暴沸
【分析】石油分馏塔的示意图可知,石油蒸汽进入石油分馏塔,随着蒸汽的上升依次得到重油,柴油,根据表格可知,a为汽油,b为煤油,c为润滑油;
【详解】(1)石油是各种烷烃、环烷烃、芳香烃组成的混合物,石油分馏是利用石油中各组分的沸点不同,用蒸发和冷凝的方法将它们分开的操作,属于物理变化;
(2)石油分馏塔中,沸点高的上升,根据表格中给出的沸点范围可知,a为汽油,b为煤油,故选①②;
(3)根据仪器构造可知,甲为直形冷凝管。为充分冷凝蒸气,冷凝水应下进上出,所以进水口为Y。在加热液体混合物时,需要加沸石防止暴沸。
16.(1)BD
(2) 石灰乳 Mg(OH)2+2H+=Mg2++2H2O MgCl2(熔融)Mg+Cl2↑
【详解】(1)Cl2 和烧碱均需要通过电解饱和氯化钠溶液制得,反应过程中有新物质生成,属于化学变化,A、C项错误;用蒸馏等方法可将海水转化为淡水,属于物理变化,B项正确;海水经太阳暴晒,水分蒸发后即得粗盐,D项正确,答案BD;
(2)①工业上常用石灰乳沉淀Mg2+ ,Ca(OH)2 和Mg2+ 反应生成Mg(OH)2 ,Mg(OH)2 和盐酸反应得到氯化镁和水,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O ;
②镁是活泼金属,可通过电解熔融氯化镁冶炼镁,电解反应的化学方程式为MgCl2(熔融)Mg+Cl2↑ 。
17.(1) a c d b
(2) 熔点和沸点 801 ℃【详解】(1)①Fe、Zn、Cu等较不活泼金属以C、CO或H2作还原剂还原冶炼,故选a;
②Na、Mg、Al等活泼或较活泼金属电解法电解NaCl、MgCl2等,故选c;
③Hg、Ag等不活泼金属热分解法,例如热分解HgO,故选d;
④V、Cr、Mn、W等高熔点金属利用铝热反应原理,故选b;
(2)要进行反应Na+KCl=NaCl+K,最佳选择是使K作为气体逸出,而其他物质仍然保留在体系中,这样,根据化学平衡,反应可不断正向进行。根据表中数据可知,在801 ℃18.(1)相比于铜而言,铝的密度比较小,且价格便宜,虽抗压强度较弱,但电导率与铜差距不大,总体而言,性价比较高,所以使用铝而不是铜生产钢芯电导线
(2)铝合金密度较小,硬度大,且耐腐性性远强于钢铁,所以用铝合金而不是钢铁生产汽车发动机部件
【详解】(1)钢芯电导线要求结构简单、线路造价低、传输容量大、良好的导电性能和足够的机械强度、抗拉强度,相比于铜而言,铝的密度比较小,且价格便宜,虽抗压强度较弱,但电导率与铜差距不大,总体而言,性价比较高,所以使用铝而不是铜生产钢芯电导线,故答案为:相比于铜而言,铝的密度比较小,且价格便宜,虽抗压强度较弱,但电导率与铜差距不大,总体而言,性价比较高,所以使用铝而不是铜生产钢芯电导线;
(2)制造汽车发动机的部件要求体积小、重量轻,铝合金密度较小,硬度大,且耐腐性性远强于钢铁,所以用铝合金而不是钢铁生产汽车发动机部件,故答案为:铝合金密度较小,硬度大,且耐腐性性远强于钢铁,所以用铝合金而不是钢铁生产汽车发动机部件。
试卷第1页,共3页
试卷第1页,共3页
一、单选题,共14小题
1.(23-24高二上·广东湛江·期中)琴棋书画诗酒花是古人享受人生的七绝。下列物品的主要材料为金属的是
A.端石佛手砚 B.明玉雕凤纹笔杆 C.稻谷耕作全景图通草纸外销画 D.清外销银浮雕人物龙柄带“史溢泉、开利店”铭啤酒杯
A.A B.B C.C D.D
2.(23-24高一上·辽宁·阶段练习)有两种金属组成的合金68g与足量的硫酸溶液反应,产生氢气4g,则该合金的组成可能为
A.K、Ca B.Na、Fe C.Al、Cu D.Zn、Ag
3.(2023高一·全国·专题练习)下列关于金属冶炼的说法中,正确的是
A.金属冶炼的本质是将化合态的金属元素还原为金属单质的过程
B.锈蚀后的铁制品没有回收冶炼价值
C.像钾、钠等活泼金属可以通过热分解法来冶炼
D.金属的冶炼方法与金属离子的氧化性无关
4.(21-22高一下·云南文山·期末)科学、可持续、合理利用资源是习近平建立新时代中国特色社会主义思想的重要组成部分。下列有关资源开发和利用的说法不正确的是
A.煤的干馏,又称为煤的焦化,属于化学变化
B.通过石油裂化和裂解可以得到乙烯等重要化工原料
C.以石油、煤、天然气为原料,可获得性能优异的高分子材料
D.从海水中提取粗盐、溴单质、镁及其化工产品的过程中均涉及氧化还原反应
5.(21-22高二下·江苏宿迁·期中)化石燃料是由古代生物的遗骸经过一系列复杂变化而形成的,是不可再生资源。下列关于化石燃料的说法不正确的是
A.甲烷是天然气的主要成分,它是一种高效而洁净的燃料
B.石油的分馏是化学变化
C.石油通过催化裂化过程可获得汽油、煤油等轻质油
D.煤的气化是把煤转化为可燃性气体的过程,该过程属于化学变化
6.(23-24高一下·全国·课后作业)化学与生产、生活和科学技术的发展有着密切的联系,对社会发展、科技进步和人类生活质量的提高有着广泛而深刻的影响。下列说法不正确的是
A.碳酸钠药片和氢氧化铝药片可用于治疗胃酸过多
B.漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂
C.生铁的含碳量比钢大,具有硬度大、抗压等优良性能,可以用于制造管道、机座、下水井盖
D.新型储氢合金材料的研究和开发为氢气能源的实际应用起到重要的推动作用
7.(23-24高一下·全国·课后作业)工业上制备下列物质的生产流程合理的是
A.制备漂白粉:NaCl溶液Cl2漂白粉
B.制备纯碱:饱和食盐水NaHCO3固体Na2CO3固体
C.制备金属镁:浓缩海水Mg(OH)2固体MgCl2溶液Mg
D.制备硫酸:SSO3H2SO4
8.(23-24高一下·全国·课后作业)工业上以铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是
A.反应①中试剂X是氢氧化钠溶液
B.试剂Y是,它与反应生成氢氧化铝
C.图中所示转化反应中包含2个氧化还原反应
D.将X与Y试剂进行对换,最终可以达到相同结果
9.(23-24高一上·广东深圳·阶段练习)下列说法不正确的是
A.氧化铁用于制作红色涂料
B.具有强氧化性,用于自来水杀菌消毒
C.可用作焙制糕点的膨松剂
D.合金熔点、硬度都低于成分金属,钢是用量最大用途最广的合金
10.(23-24高一上·贵州黔东南·期末)不锈钢是最常见的一种合金钢,它的合金元素主要是铬(Cr)和镍(Ni),下列说法正确的是
A.不锈钢的主要成分为铁 B.的质子数为52
C.不锈钢属于纯净物 D.的核外电子数与中子数相差21
11.(22-23高一上·广西柳州·期末)化学与生产、生活密切相关。下列对应关系错误的是
A.湿手不可以直接接触电源——电解质溶液能够导电
B.食物腐败——涉及氧化还原反应
C.漂白液可作消毒剂——漂白液的有效成分是
D.下水井盖由生铁铸造——生铁硬度高于纯铁
12.(23-24高一上·陕西西安·期末)《梦溪笔谈》中记载:“但取精铁,锻之百余火,每锻称之,一锻一轻,至累锻而斤两不减,则纯钢也。”下列说法错误的是
A.生铁和钢均属于合金
B.与生铁相比,钢的硬度更大,质地更脆
C.精铁煅烧的目的之一是将C转化为碳的氧化物而降低含碳量
D.钢是当今世界用量最大、用途最广的合金
13.(23-24高一上·浙江杭州·期末)下列说法不正确的是
A.储氢合金要求储氢量大,金属氢化物既容易形成,受热又不容易分解
B.二氧化硫可用于杀菌消毒,还是一种食品添加剂
C.中国华为集团自主研发的“麒麟”芯片生产时需要用到硅
D.硬铝是一种铝合金,是制造飞机和宇宙飞船的理想材料
14.(2024高一上·黑龙江·学业考试)海洋是一个巨大的化学资源宝库,其中含量较高的离子有
A. B. C. D.
二、非选择题,共4小题
15.(23-24高一下·全国·课时练习)石油不仅是重要的能源,还是化工产品的重要原料。石油分馏是将石油中几种不同沸点的混合物分离的一种方法,石油分馏塔的示意图如下,回答下列问题。
常见馏分的性质及主要用途如下表(部分物质未列出):
名称 碳氢化合物中碳原子的数目 沸点/℃ 主要用途
汽油 5-12 20-200 私家车燃料
煤油 12-16 175-275 飞机燃料
柴油 15-18 250-400 中巴、巴士、重型汽车及工厂燃料
润滑油 16-20 300-500 帮助机械零件的活动
重油 >20 >500 轮船、工厂、发电厂燃料
(1)石油属于 (填“纯净物”或“混合物”),石油分馏属于 (填“物理”或“化学”)变化。
(2)根据分馏塔的工作原理和各物质的沸点不同,填写馏分a、b最有可能的成分:a (填标号,下同);b 。
①汽油 ②煤油 ③润滑油
(3)实验室进行石油蒸馏实验的装置如图所示。仪器甲的名称为 ,冷凝水的进水口为 (填“X”或“Y”),沸石的作用是 。
16.(22-23高一下·全国·课时练习)海洋资源的利用具有广阔前景。
(1)不需要经过化学变化就能从海水中获得的物质是___________(填字母)。
A.Cl2 B.淡水 C.烧碱 D.粗盐
(2)下图是从海水中提取镁的简单流程。
①工业上常用于沉淀Mg2+的试剂A是 ,Mg2转化为MgCl2的离子方程式是 。
②由无水MgCl2制取Mg的化学方程式是 。
17.(22-23高一·全国·课时练习)冶炼金属常用以下几种方法:
a.以C、CO或H2作还原剂还原;
b.利用铝热反应原理;
c.电解法;
d.热分解法。
(1)下列金属各采用哪种方法冶炼最佳?
①Fe、Zn、Cu等较不活泼金属 ;
②Na、Mg、Al等活泼或较活泼金属 ;
③Hg、Ag等不活泼金属 ;
④V、Cr、Mn、W等高熔点金属 。
(2)工业上生产钾不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电解效率。现生产钾是用金属钠和熔化的KCl反应制取。有关数据如下表:
熔点/℃ 沸点/℃ 密度/(g·cm-3)
Na 97.8 883 0.97
K 63.7 774 0.86
NaCl 801 1 413 2.165
KCl 770 1 500 1.984
工业上生产金属钾的化学方程式是:KCl+NaNaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数? ;其选择范围是 。
18.(20-21高一·全国·课时练习)下表列举了三种常见金属材料的一些基本性质,尝试利用表中的数据回答有关问题。
金属 密度/ 抗拉强度/ 电导率/
铝 2.70 7.0 0.38
铁 7.86 21.1 0.10
铜 8.92 13.0 0.59
(1)为什么使用铝而不是铜来生产钢芯电导线 ?
(2)为什么用铝合金而不是钢铁来制造汽车发动机的部件 ?
参考答案:
1.D
【详解】A.端石佛手砚为硅酸盐,A不符合题意;
B.玉雕的主要成分为硅酸盐,B不符合题意;
C.草纸的主要成分为纤维素,C不符合题意;
D.清外销银浮雕材料属于银,是金属,D符合题意;
答案选D。
2.C
【详解】4g氢气的物质的量==2mol,故68g金属提供的电子为2mol×2=4mol,则提供1mol电子需要金属的质量为=17g,
K在反应中表现+1价,提供1mol电子需要K的质量为39g/mol×1mol=39g;
Ca在反应中表现+2价,提供1mol电子需要Ca的质量为40g/mol×=20g;
Na在反应中表现+1价,提供1mol电子需要Na的质量为23g/mol×1mol=23g;
Fe在反应中表现+2价,提供1mol电子需要Fe的质量为56g/mol×=28g;;
Al在反应中表现+3价,提供1mol电子需要Al的质量为27g/mol×=9g;
Cu和硫酸反应不能生成氢气;
Zn在反应中表现+2价,提供1mol电子需要Zn的质量为65g/mol×=32.5g;
Ag和硫酸不反应;
根据题意两种提供1mol电子平均需要17g,则应该为Al和其他金属的合金;
故选C。
3.A
【详解】A.金属冶炼的本质将金属阳离子变为金属单质即将化合态的金属元素还原为金属单质的过程,故A正确;
B.锈蚀后的铁制品也可以将化合态的金属元素变为单质,因此有回收冶炼价值,故B错误;
C.像钾、钠等活泼金属可以通过电解法来冶炼,故C错误;
D.金属的冶炼方法与金属离子的氧化性有关,金属离子氧化性越强,其冶炼方法越简单,比如氧化银采用热分解法,金属离子氧化性越弱,其冶炼方法越难,比如电解熔融氯化钠得到钠,故D错误。
综上所述,答案为A。
4.D
【详解】A.煤的干馏指煤在隔绝空气条件下加热、分解,生成焦炭、煤焦油、粗苯、煤气等产物的过程,属于化学变化,A正确;
B.工业制的乙烯是石油裂解和精馏的一个产物,B正确;
C.用石油、天然气、煤作原料加工得到单体,经聚合反应可得到合成纤维高分子材料,C正确;
D.从海水中提取粗盐未涉及氧化还原反应,D不正确;
故选D。
5.B
【详解】A.天然气的主要成分是甲烷,燃烧生成二氧化碳和水并放出大量的热,无污染,故是高效、洁净的能源,A正确;
B.石油的分馏是物理变化,B错误;
C.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,C正确;
D.煤的气化是指煤与水蒸气高温下反应生成一氧化碳和氢气,一氧化碳和氢都是可燃性气体,该过程为化学变化,D正确;
故选B。
6.A
【详解】A.碳酸钠有腐蚀性,不能用于治疗胃酸过多,氢氧化铝能与盐酸反应,常用来做胃药,A错误;
B.漂白粉主要成分为CaCl2和Ca(ClO)2,有效成分为Ca(ClO)2,生效时生成HClO,具有强氧化性可以漂白剂,也可以杀菌消毒,B正确;
C.生铁的含碳量比钢大,具有硬度大、抗压等优良性能,可以用于制造管道、机座、下水井盖,C正确;
D.氢气的沸点很低,常温为气体,不便于储存和运输,所以研发新型储氢合金材料将为氢气作为能源的实际应用起到重要的推动作用,D正确;
答案选A。
7.B
【详解】A.工业上制备漂白粉时,先电解NaCl溶液制备Cl2,再将Cl2通入冷的石灰乳中制取漂白粉,而不是通入澄清石灰水中,A不符合题意;
B.工业上制备纯碱时,向饱和食盐水中先后通入NH3、CO2反应生成NaHCO3,并使溶解度较小的NaHCO3从溶液中析出,NaHCO3固体再受热分解制备Na2CO3,B符合题意;
C.工业上制备金属镁时,先向浓缩海水中加入石灰乳生成Mg(OH)2沉淀,再用盐酸将沉淀溶解,得到MgCl2溶液,再经系列操作得到无水MgCl2,最后电解熔融状态下的MgCl2得到金属镁,而不是电解MgCl2溶液,C不符合题意;
D.工业上制备硫酸时,硫铁矿或S先与O2反应生成SO2,SO2经催化氧化生成SO3,最后用浓硫酸吸收SO3制得H2SO4,S不能直接和O2反应生成SO3,D不符合题意;
故选B。
8.A
【分析】铝土矿加入足量氢氧化钠溶液,氧化铝溶解,氧化铁不溶解,过滤,向滤液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,氢氧化铝沉淀加热生成氧化铝,电解熔融氧化铝得到铝单质。
【详解】A.用强碱氢氧化钠溶液,氧化铝溶解,氧化铁不溶解,过滤而分离开,A正确;
B.试剂Y是HCl,由于Y是过量的,因此它与反应生成Al3+,B错误;
C.图中所示转化有一步是氧化还原反应:2Al2O34Al+3O2↑,C错误;
D.试剂X为氢氧化钠,滤渣C为氧化铁,滤液A为和氢氧化钠混合溶液,通入过量二氧化碳气体,发生反应:+CO2===Al(OH)3↓+NaHCO3,不能对换,D错误;
故选A。
9.D
【详解】A.氧化铁为红色固体,可用于制作红色涂料,A正确;
B.HClO具有强氧化性,能使蛋白质变性,所以Cl2可用于自来水的消毒,B正确;
C.NaHCO3不稳定,加热分解生成碳酸钠、水和二氧化碳气体,并且能与酸反应,所以用小苏打做焙制糕点的膨松剂,C正确;
D.合金熔点一般低于成分金属, 硬度一般比其组分中金属的硬度大,D错误;
故选D。
10.A
【详解】A.世界上使用最广泛的金属材料是铁合金,不锈钢是合金钢的一种,不锈钢的主要成分为铁,A正确;
B.的质量数为52,的质子数为24,B错误;
C.不锈钢属于混合物,C错误;
D.的中子数与核外电子数相差59-28-28=3, D错误;
答案选A。
11.C
【详解】A.湿手上会含有盐溶液,盐属于电解质,电解质溶液能够导电,不可以直接接触电源,故A不符合题意;
B.食物腐败是食物被氧化,涉及氧化还原反应,故B不符合题意;
C.漂白液的有效成分为NaClO,NaClO具有强氧化性,可以作消毒剂,故C符合题意;
D.一般合金的硬度大于其组成中纯金属的硬度,生铁为铁合金,因此生铁的硬度比铁大,可以铸造下水井盖,故D不符合题意。
答案选C。
12.B
【详解】A.生铁和钢均属于铁碳合金,A正确;
B.与生铁相比,钢的硬度更大,质地更韧性,B错误;
C.精铁煅烧的目的之一是将C转化为碳的氧化物而降低含碳量,C正确;
D.钢是当今世界用量最大、用途最广的合金,D正确;
故选B。
13.A
【详解】A.实用储氢合金能够吸收大量氢气后形成金属氢化物,稍稍加热又容易分解,释放氢气,A错误;
B.二氧化硫可用于杀菌消毒,且二氧化硫具有还原性,常用作葡萄酒的抗氧化剂,B正确;
C.晶体硅为半导体材料,可用于芯片的制作,C正确;
D.硬铝是一种铝合金,密度小,耐蚀性强,是制造飞机和宇宙飞船的理想材料,D正确;
故选A。
14.B
【详解】海洋是一个巨大的化学资源宝库,含有80多种元素,其中含有较高的钠和氯元素,故海洋是一个巨大的化学资源宝库,其中含量较高的离子有Na+,故答案为:B。
15.(1) 混合物 物理
(2) ① ②
(3) 直形冷凝管(或冷凝管) Y 防暴沸
【分析】石油分馏塔的示意图可知,石油蒸汽进入石油分馏塔,随着蒸汽的上升依次得到重油,柴油,根据表格可知,a为汽油,b为煤油,c为润滑油;
【详解】(1)石油是各种烷烃、环烷烃、芳香烃组成的混合物,石油分馏是利用石油中各组分的沸点不同,用蒸发和冷凝的方法将它们分开的操作,属于物理变化;
(2)石油分馏塔中,沸点高的上升,根据表格中给出的沸点范围可知,a为汽油,b为煤油,故选①②;
(3)根据仪器构造可知,甲为直形冷凝管。为充分冷凝蒸气,冷凝水应下进上出,所以进水口为Y。在加热液体混合物时,需要加沸石防止暴沸。
16.(1)BD
(2) 石灰乳 Mg(OH)2+2H+=Mg2++2H2O MgCl2(熔融)Mg+Cl2↑
【详解】(1)Cl2 和烧碱均需要通过电解饱和氯化钠溶液制得,反应过程中有新物质生成,属于化学变化,A、C项错误;用蒸馏等方法可将海水转化为淡水,属于物理变化,B项正确;海水经太阳暴晒,水分蒸发后即得粗盐,D项正确,答案BD;
(2)①工业上常用石灰乳沉淀Mg2+ ,Ca(OH)2 和Mg2+ 反应生成Mg(OH)2 ,Mg(OH)2 和盐酸反应得到氯化镁和水,反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O ;
②镁是活泼金属,可通过电解熔融氯化镁冶炼镁,电解反应的化学方程式为MgCl2(熔融)Mg+Cl2↑ 。
17.(1) a c d b
(2) 熔点和沸点 801 ℃
②Na、Mg、Al等活泼或较活泼金属电解法电解NaCl、MgCl2等,故选c;
③Hg、Ag等不活泼金属热分解法,例如热分解HgO,故选d;
④V、Cr、Mn、W等高熔点金属利用铝热反应原理,故选b;
(2)要进行反应Na+KCl=NaCl+K,最佳选择是使K作为气体逸出,而其他物质仍然保留在体系中,这样,根据化学平衡,反应可不断正向进行。根据表中数据可知,在801 ℃
(2)铝合金密度较小,硬度大,且耐腐性性远强于钢铁,所以用铝合金而不是钢铁生产汽车发动机部件
【详解】(1)钢芯电导线要求结构简单、线路造价低、传输容量大、良好的导电性能和足够的机械强度、抗拉强度,相比于铜而言,铝的密度比较小,且价格便宜,虽抗压强度较弱,但电导率与铜差距不大,总体而言,性价比较高,所以使用铝而不是铜生产钢芯电导线,故答案为:相比于铜而言,铝的密度比较小,且价格便宜,虽抗压强度较弱,但电导率与铜差距不大,总体而言,性价比较高,所以使用铝而不是铜生产钢芯电导线;
(2)制造汽车发动机的部件要求体积小、重量轻,铝合金密度较小,硬度大,且耐腐性性远强于钢铁,所以用铝合金而不是钢铁生产汽车发动机部件,故答案为:铝合金密度较小,硬度大,且耐腐性性远强于钢铁,所以用铝合金而不是钢铁生产汽车发动机部件。
试卷第1页,共3页
试卷第1页,共3页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
