北京市第十七中学2023-2024学年高一下学期期中考试化学试题(PDF版无答案)
文档属性
| 名称 | 北京市第十七中学2023-2024学年高一下学期期中考试化学试题(PDF版无答案) |

|
|
| 格式 | |||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-02 16:20:10 | ||
图片预览

文档简介
2023--2024学年高 二_年级第二学期期中考试
化学等级 _试卷 2024.05
(考试时间_90 分钟,满分_ 100 _分)
可能用到的相对原子质量:H1 C12 Na 23 S32 O16 N14
第一部分(选择题,共45分)
本部分共15题,每题3分,共45分。在每题的四个选项中,选出最符合题目要求的一项。
1. 下列设备工作时,将化学能主要转化为热能的是
甲 乙 丙 丁
A. 图甲燃气灶 B. 图乙锂离子电池
C. 图丙风力发电 D. 图丁太阳能热水器
2. 下列物质的用途不正确的是
A. 甲烷可用作燃料 B. SO2可用作纸浆的漂白
C. 浓硝酸可用作干燥剂 D. 单质硅可作半导体材料
3. 下列事实与括号中浓硫酸性质的对应关系不正确的是
A. 蔗糖中加入浓硫酸后出现发黑现象(脱水性)
B. 空气中敞口放置的浓硫酸质量变大(挥发性)
C. 浓硫酸在加热条件下与木炭反应(氧化性)
D. 浓硫酸可用来干燥某些气体(吸水性)
4. 其他条件不变时,下列措施中能减慢化学反应速率的是
A. 用煤粉代替煤块燃烧
B. 食物存放在冰箱里
C. 滴入少量FeCl3溶液催化H O2分解
D. 用 1mol·L-1H SO4代替 0.1mol·L-1H SO4与锌粒反应
高一化学 第1 页
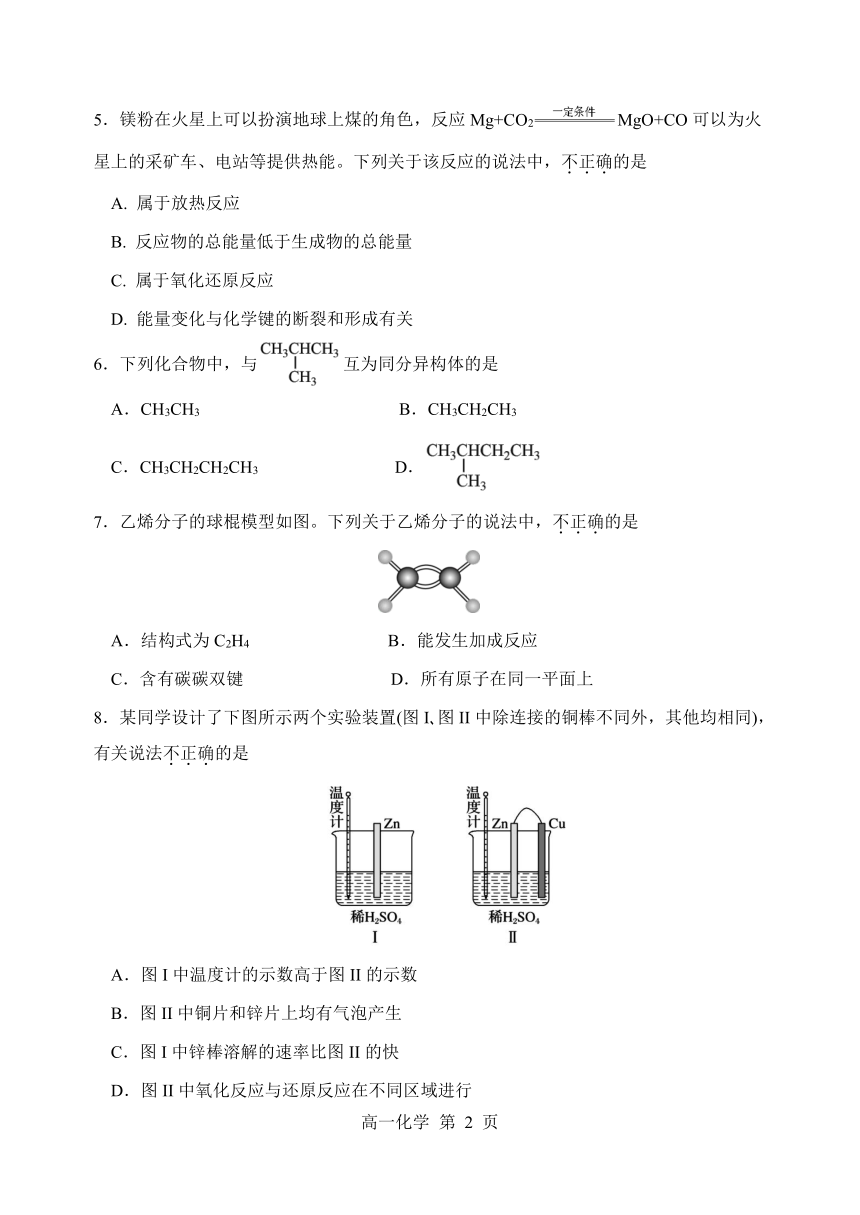
5.镁粉在火星上可以扮演地球上煤的角色,反应Mg+CO2 MgO+CO可以为火
星上的采矿车、电站等提供热能。下列关于该反应的说法中,不.正.确.的是
A. 属于放热反应
B. 反应物的总能量低于生成物的总能量
C. 属于氧化还原反应
D. 能量变化与化学键的断裂和形成有关
6.下列化合物中,与 互为同分异构体的是
A.CH3CH3 B.CH3CH2CH3
C.CH3CH2CH2CH3 D.
7.乙烯分子的球棍模型如图。下列关于乙烯分子的说法中,不.正.确.的是
A.结构式为 C2H4 B.能发生加成反应
C.含有碳碳双键 D.所有原子在同一平面上
8.某同学设计了下图所示两个实验装置(图 I 图 II中除连接的铜棒不同外,其他均相同),
有关说法不.正.确.的是
A.图 I中温度计的示数高于图 II的示数
B.图 II中铜片和锌片上均有气泡产生
C.图 I中锌棒溶解的速率比图 II的快
D.图 II中氧化反应与还原反应在不同区域进行
高一化学 第 2 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
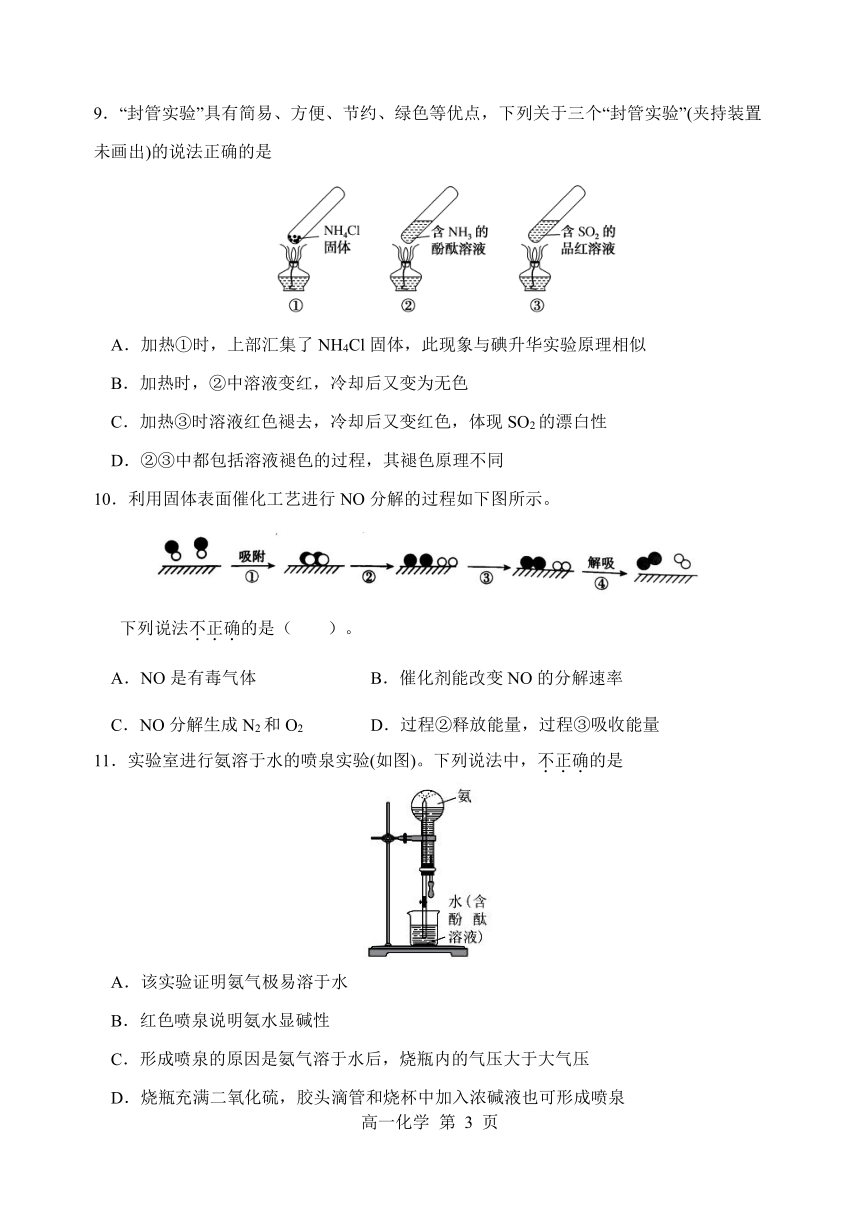
9.“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置
未画出)的说法正确的是
A.加热①时,上部汇集了 NH4Cl固体,此现象与碘升华实验原理相似
B.加热时,②中溶液变红,冷却后又变为无色
C.加热③时溶液红色褪去,冷却后又变红色,体现 SO2的漂白性
D.②③中都包括溶液褪色的过程,其褪色原理不同
10.利用固体表面催化工艺进行 NO分解的过程如下图所示。
下列说法不.正.确.的是( )。
A.NO是有毒气体 B.催化剂能改变 NO的分解速率
C.NO分解生成 N2和 O2 D.过程②释放能量,过程③吸收能量
11.实验室进行氨溶于水的喷泉实验(如图)。下列说法中,不.正.确.的是
A.该实验证明氨气极易溶于水
B.红色喷泉说明氨水显碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压大于大气压
D.烧瓶充满二氧化硫,胶头滴管和烧杯中加入浓碱液也可形成喷泉
高一化学 第 3 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
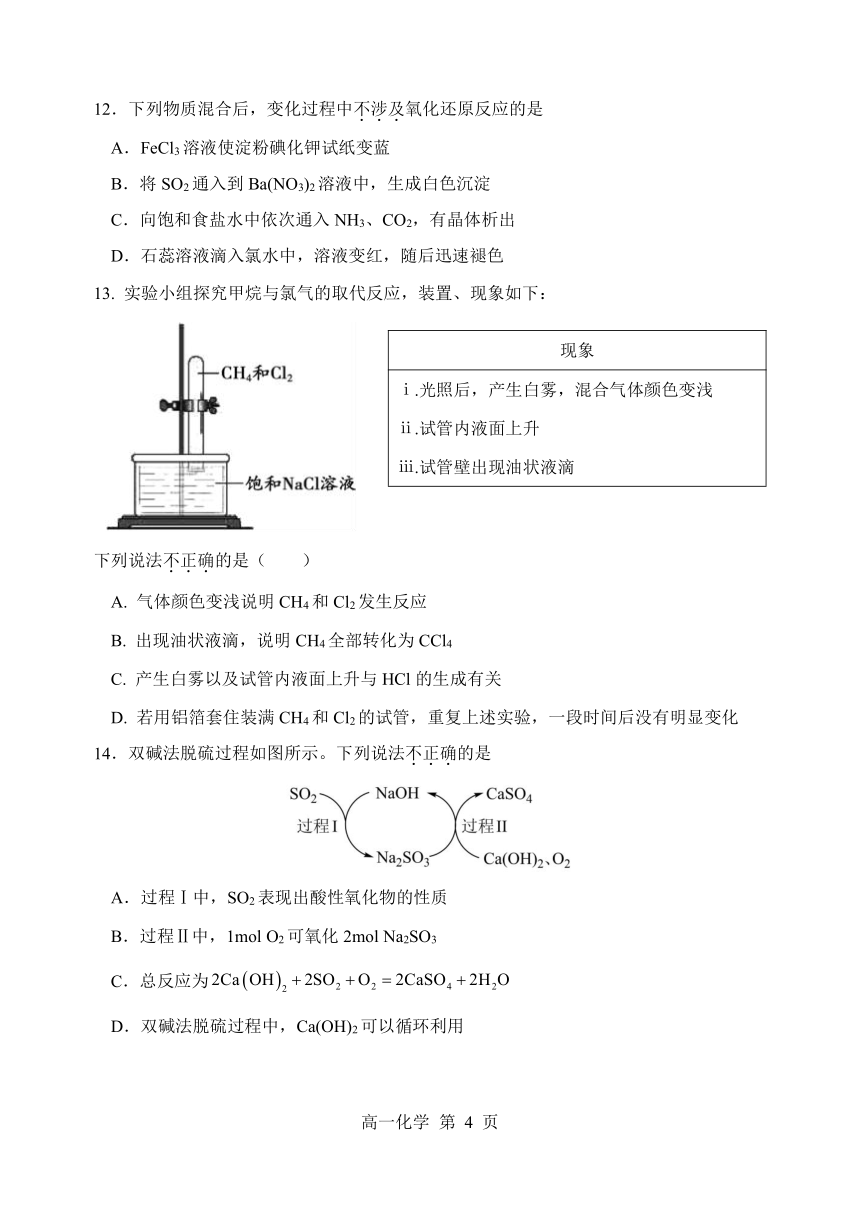
12.下列物质混合后,变化过程中不.涉.及.氧化还原反应的是
A.FeCl3溶液使淀粉碘化钾试纸变蓝
B.将 SO2通入到 Ba(NO3)2溶液中,生成白色沉淀
C.向饱和食盐水中依次通入 NH3、CO2,有晶体析出
D.石蕊溶液滴入氯水中,溶液变红,随后迅速褪色
13. 实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象
ⅰ.光照后,产生白雾,混合气体颜色变浅
ⅱ.试管内液面上升
ⅲ.试管壁出现油状液滴
下列说法不.正.确.的是( )
A. 气体颜色变浅说明 CH4和 Cl2发生反应
B. 出现油状液滴,说明 CH4全部转化为 CCl4
C. 产生白雾以及试管内液面上升与 HCl的生成有关
D. 若用铝箔套住装满 CH4和 Cl2的试管,重复上述实验,一段时间后没有明显变化
14.双碱法脱硫过程如图所示。下列说法不.正.确.的是
A.过程Ⅰ中,SO2表现出酸性氧化物的性质
B.过程Ⅱ中,1mol O2可氧化 2mol Na2SO3
C.总反应为 2Ca OH 2SO2 2 O2 2CaSO4 2H2O
D.双碱法脱硫过程中,Ca(OH)2可以循环利用
高一化学 第 4 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
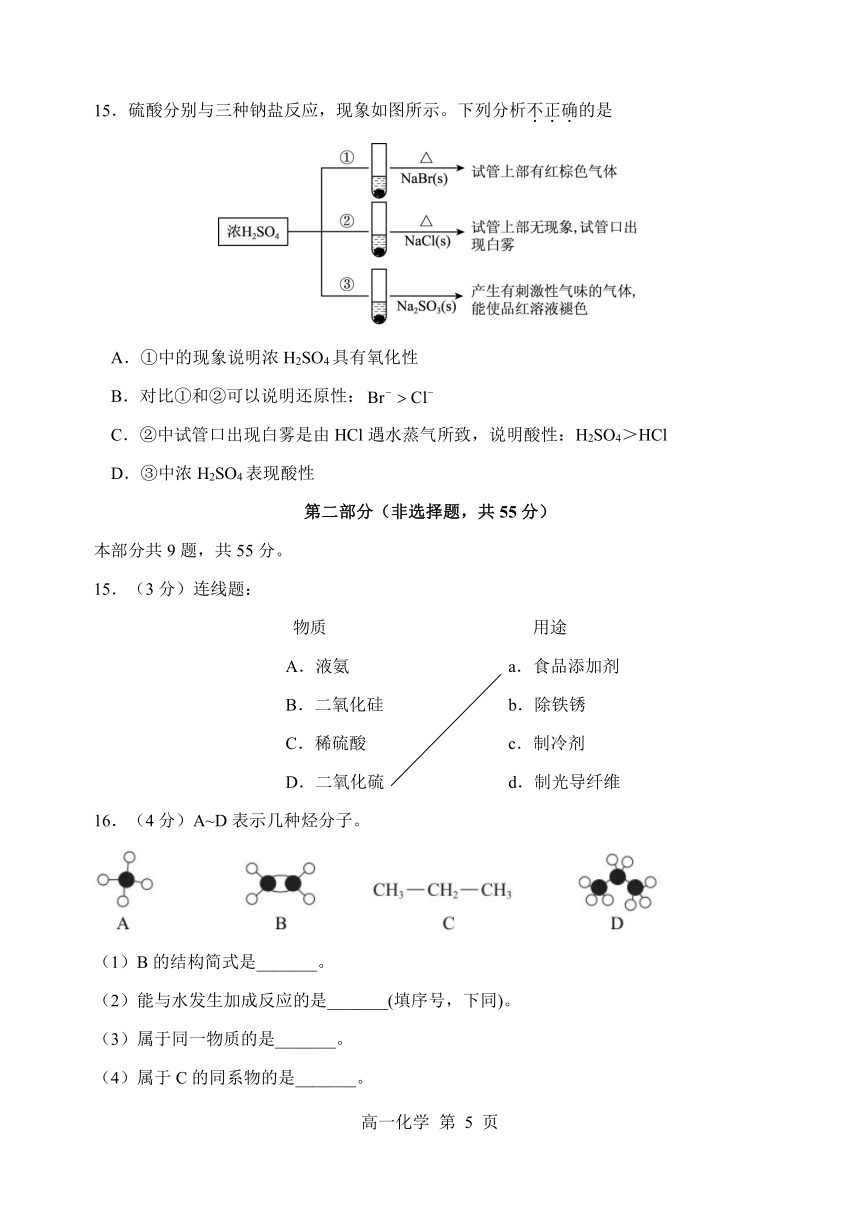
15.硫酸分别与三种钠盐反应,现象如图所示。下列分析不.正.确.的是
A.①中的现象说明浓 H2SO4具有氧化性
B.对比①和②可以说明还原性:Br Cl
C.②中试管口出现白雾是由 HCl遇水蒸气所致,说明酸性:H2SO4>HCl
D.③中浓 H2SO4表现酸性
第二部分(非选择题,共 55 分)
本部分共 9题,共 55分。
15.(3分)连线题:
物质 用途
A.液氨 a.食品添加剂
B.二氧化硅 b.除铁锈
C.稀硫酸 c.制冷剂
D.二氧化硫 d.制光导纤维
16.(4分)A~D表示几种烃分子。
(1)B的结构简式是_______。
(2)能与水发生加成反应的是_______(填序号,下同)。
(3)属于同一物质的是_______。
(4)属于 C的同系物的是_______。
高一化学 第 5 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
17.(5分)化学电池的发明,改变了人们的生活。
(1)如图所示装置中,Cu片上的电极反应式为_______________。
(2)电流的流动方向是_______;能证明化学能转化为电能的实验现象
是_______。
(3)常见的锌锰干电池构造示意图如下。
已知:电池的总反应为
Zn+2MnO2+2NH 4 =Zn2++Mn2O3+2NH3+H2O。
① 该电池属于____________(填“一次”、“二次”或“燃料”
电池。
②MnO2发生_________(填“氧化”或“还原”)反应。
18.(5分)有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
实验次数 电极材料 水果品种 电极间距/cm 电压/mV
1 锌 铜 菠萝 3 900
2 锌 铜 苹果 3 650
3 锌 铜 柑橘 3 850
4 锌 铜 西红柿 3 750
5 锌 铝 菠萝 3 650
6 锌 铝 苹果 3 450
试根据上表中的实验数据回答下列问题:
(1)实验 2中负极是______,电极反应式为:_________。
(2)实验 1和 5电流方向相反的原因是__________。
(3)由实验 1~实验 4可知影响水果电池的电压的因素有________。
(4)根据实验 2、6和实验 1、5的比较可发现水果电池的电压还与_______有关。
高一化学 第 6 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
19.(8分)探究浓度对化学反应速率的影响。
【实验原理】反应 a: ,反应过程中溶液出现乳白
色浑浊,比较浑浊现象出现时间的长短,判断反应进行的快慢。
【实验用品】0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、蒸馏水。
试管、烧杯、量筒、胶头滴管、秒表等。
【实验步骤】各组实验数据如下表。
a V2 b
(1)实验 1、2探究 Na2S2O3溶液的浓度对化学反应速率的影响。
① 已知: 。反应 a的离子方程式是_____________________。
② V1=__________。实验 2中加入 V1mL水的主要目的是_________________。
(2)实验 1、3探究 H2SO4溶液的浓度对化学反应速率的影响,则:a=_____________,
V2=____________,b=_____________。
(3)增大反应物的浓度,化学反应速率变快。得出此结论的实验依据是_______________。
20.(6分)下图装置是SO2气体的制备和性质验证装置。
(1)装置 A中发生反应的化学方程式__________________。
高一化学 第 7 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
(2)装置 B是除杂装置,B中的试剂 x是_______(填序号)。
a.饱和Na2CO3溶液 b.饱和Na 2SO3溶液 c.饱和NaHSO3溶液
2
(3)小组同学观察到 C、D中溶液均褪色。应后C中溶液含有SO4 ,反应的离子方程式
是_______。
(4)上述实验说明了或利用了SO2的_______(填序号)。
A.还原性 B.氧化性
C.酸性氧化物的性质 D.漂白性
21.(8分)工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料。
(1)反应②、③实现了官能团的转化:—OH→__________→_________。
(2)反应④的类型是______________________________。
(3)⑥的化学方程式是_________________________________________。
利用右图装置实现反应⑦。
(4)⑦的化学方程式是
_________________________________________。
(5)反应结束后,振荡试管 b,静置后的现象是
_____________________________。
高一化学 第 8 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
22.(7分)汽车尾气中含有 CO、NO等有害气体。
(1)汽车尾气中 NO生成过程的能量变化示意图如下:
该条件下,1mol N2和 1mol O2完全反应生成 NO,会_______(填“吸收”或“放
出”)_______kJ能量。
(2)利用催化技术可将汽车尾气中的 CO和 NO转化为 CO2和 N2,化学方程式:
2NO+2CO 2CO2+N2。
① 某温度下,在容积不变的密闭容器中通入 CO和 NO,测得不同时间 CO的浓度如
下表:
时间/s 0 1 2 3 ……
c(CO)/×10-3 mol·L-1 3.60 3.05 2.85 2.75 ……
用 CO的浓度变化表示 0~2 s的平均反应速率为_______mol·L-1·s-1。
② 下列可说明反应达到平衡状态的是_______。
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、CO2、N2的浓度之比为 2:2:2:1
d.相同时间内,反应消耗 2molNO 同时消耗 1molN2
③ 反应物初始浓度相同,实验温度为 280 °C和 360 °C,进行以下实验:
实验 同种催化剂的 达平衡时所
实验目的 温度(℃)
编号 比表面积(m2/g) 用的时间(s)
1 对照实验 280 80 t1
2 a 280 120 t2
研究温度对尾气
3 380 80 t3
转化速率的影响
高一化学 第 9 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
[实验分析与结论]
i.补全表格 a_______。
ii.测得 t3<t1,对比实验 1、3,可得结论:_______________________。
iii.通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的
结论,证据是对比实验 1、2,t2_______t1(填“>“<”或“=”)。
23.(9分)某同学为研究浓硝酸与 KSCN溶液的反应,进行如下实验:
实验操作 实验现象
Ⅰ.取 1支试管,加入 2 mL浓硝酸, 溶液立即变红
滴加 5滴 1 mol·L 1KSCN溶液
Ⅱ.将试管静置一段时间 突然剧烈反应,红色迅速褪去,放出大量红棕色气体
III.将Ⅱ中的气体通入 Ba(OH)2和 有白色沉淀生成
NaOH的混合溶液中
资料:SCN 能被氧化为 (SCN)2,(SCN)2迅速聚合为红色的(SCN)x。
(1)KSCN中,C、N元素的化合价分别为+4价和 3价,则 S元素的化合价为______。
(2)I中溶液立即变红是因为生成了______(填化学式)。
(3)研究 SCN 的最终转化产物。
①取少量Ⅱ中试管内的溶液,______(填操作和现象),证明 SCN 中 S 元素的转化产物
是 SO42 。
②经检验Ⅱ中“红棕色气体”含有 NO2,但不能说明 NO2一定是 SCN 中 N元素的转化产物,
原因是______。
③III中,NO2转化为 NO2 、NO3 ,离子方程式是______。
④将 III 中沉淀过滤、洗涤,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴
加少量 KMnO4溶液,不褪色。证明了红棕色气体中不含 SO2。综合上述实验,SCN 的最
终转化产物中一定有______。
(4)Ⅱ中,“静置一段时间后,突然剧烈反应”的可能原因是______(写出一条即可)。
高一化学 第 10 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
化学等级 _试卷 2024.05
(考试时间_90 分钟,满分_ 100 _分)
可能用到的相对原子质量:H1 C12 Na 23 S32 O16 N14
第一部分(选择题,共45分)
本部分共15题,每题3分,共45分。在每题的四个选项中,选出最符合题目要求的一项。
1. 下列设备工作时,将化学能主要转化为热能的是
甲 乙 丙 丁
A. 图甲燃气灶 B. 图乙锂离子电池
C. 图丙风力发电 D. 图丁太阳能热水器
2. 下列物质的用途不正确的是
A. 甲烷可用作燃料 B. SO2可用作纸浆的漂白
C. 浓硝酸可用作干燥剂 D. 单质硅可作半导体材料
3. 下列事实与括号中浓硫酸性质的对应关系不正确的是
A. 蔗糖中加入浓硫酸后出现发黑现象(脱水性)
B. 空气中敞口放置的浓硫酸质量变大(挥发性)
C. 浓硫酸在加热条件下与木炭反应(氧化性)
D. 浓硫酸可用来干燥某些气体(吸水性)
4. 其他条件不变时,下列措施中能减慢化学反应速率的是
A. 用煤粉代替煤块燃烧
B. 食物存放在冰箱里
C. 滴入少量FeCl3溶液催化H O2分解
D. 用 1mol·L-1H SO4代替 0.1mol·L-1H SO4与锌粒反应
高一化学 第1 页
5.镁粉在火星上可以扮演地球上煤的角色,反应Mg+CO2 MgO+CO可以为火
星上的采矿车、电站等提供热能。下列关于该反应的说法中,不.正.确.的是
A. 属于放热反应
B. 反应物的总能量低于生成物的总能量
C. 属于氧化还原反应
D. 能量变化与化学键的断裂和形成有关
6.下列化合物中,与 互为同分异构体的是
A.CH3CH3 B.CH3CH2CH3
C.CH3CH2CH2CH3 D.
7.乙烯分子的球棍模型如图。下列关于乙烯分子的说法中,不.正.确.的是
A.结构式为 C2H4 B.能发生加成反应
C.含有碳碳双键 D.所有原子在同一平面上
8.某同学设计了下图所示两个实验装置(图 I 图 II中除连接的铜棒不同外,其他均相同),
有关说法不.正.确.的是
A.图 I中温度计的示数高于图 II的示数
B.图 II中铜片和锌片上均有气泡产生
C.图 I中锌棒溶解的速率比图 II的快
D.图 II中氧化反应与还原反应在不同区域进行
高一化学 第 2 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
9.“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置
未画出)的说法正确的是
A.加热①时,上部汇集了 NH4Cl固体,此现象与碘升华实验原理相似
B.加热时,②中溶液变红,冷却后又变为无色
C.加热③时溶液红色褪去,冷却后又变红色,体现 SO2的漂白性
D.②③中都包括溶液褪色的过程,其褪色原理不同
10.利用固体表面催化工艺进行 NO分解的过程如下图所示。
下列说法不.正.确.的是( )。
A.NO是有毒气体 B.催化剂能改变 NO的分解速率
C.NO分解生成 N2和 O2 D.过程②释放能量,过程③吸收能量
11.实验室进行氨溶于水的喷泉实验(如图)。下列说法中,不.正.确.的是
A.该实验证明氨气极易溶于水
B.红色喷泉说明氨水显碱性
C.形成喷泉的原因是氨气溶于水后,烧瓶内的气压大于大气压
D.烧瓶充满二氧化硫,胶头滴管和烧杯中加入浓碱液也可形成喷泉
高一化学 第 3 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
12.下列物质混合后,变化过程中不.涉.及.氧化还原反应的是
A.FeCl3溶液使淀粉碘化钾试纸变蓝
B.将 SO2通入到 Ba(NO3)2溶液中,生成白色沉淀
C.向饱和食盐水中依次通入 NH3、CO2,有晶体析出
D.石蕊溶液滴入氯水中,溶液变红,随后迅速褪色
13. 实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象
ⅰ.光照后,产生白雾,混合气体颜色变浅
ⅱ.试管内液面上升
ⅲ.试管壁出现油状液滴
下列说法不.正.确.的是( )
A. 气体颜色变浅说明 CH4和 Cl2发生反应
B. 出现油状液滴,说明 CH4全部转化为 CCl4
C. 产生白雾以及试管内液面上升与 HCl的生成有关
D. 若用铝箔套住装满 CH4和 Cl2的试管,重复上述实验,一段时间后没有明显变化
14.双碱法脱硫过程如图所示。下列说法不.正.确.的是
A.过程Ⅰ中,SO2表现出酸性氧化物的性质
B.过程Ⅱ中,1mol O2可氧化 2mol Na2SO3
C.总反应为 2Ca OH 2SO2 2 O2 2CaSO4 2H2O
D.双碱法脱硫过程中,Ca(OH)2可以循环利用
高一化学 第 4 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
15.硫酸分别与三种钠盐反应,现象如图所示。下列分析不.正.确.的是
A.①中的现象说明浓 H2SO4具有氧化性
B.对比①和②可以说明还原性:Br Cl
C.②中试管口出现白雾是由 HCl遇水蒸气所致,说明酸性:H2SO4>HCl
D.③中浓 H2SO4表现酸性
第二部分(非选择题,共 55 分)
本部分共 9题,共 55分。
15.(3分)连线题:
物质 用途
A.液氨 a.食品添加剂
B.二氧化硅 b.除铁锈
C.稀硫酸 c.制冷剂
D.二氧化硫 d.制光导纤维
16.(4分)A~D表示几种烃分子。
(1)B的结构简式是_______。
(2)能与水发生加成反应的是_______(填序号,下同)。
(3)属于同一物质的是_______。
(4)属于 C的同系物的是_______。
高一化学 第 5 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
17.(5分)化学电池的发明,改变了人们的生活。
(1)如图所示装置中,Cu片上的电极反应式为_______________。
(2)电流的流动方向是_______;能证明化学能转化为电能的实验现象
是_______。
(3)常见的锌锰干电池构造示意图如下。
已知:电池的总反应为
Zn+2MnO2+2NH 4 =Zn2++Mn2O3+2NH3+H2O。
① 该电池属于____________(填“一次”、“二次”或“燃料”
电池。
②MnO2发生_________(填“氧化”或“还原”)反应。
18.(5分)有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
实验次数 电极材料 水果品种 电极间距/cm 电压/mV
1 锌 铜 菠萝 3 900
2 锌 铜 苹果 3 650
3 锌 铜 柑橘 3 850
4 锌 铜 西红柿 3 750
5 锌 铝 菠萝 3 650
6 锌 铝 苹果 3 450
试根据上表中的实验数据回答下列问题:
(1)实验 2中负极是______,电极反应式为:_________。
(2)实验 1和 5电流方向相反的原因是__________。
(3)由实验 1~实验 4可知影响水果电池的电压的因素有________。
(4)根据实验 2、6和实验 1、5的比较可发现水果电池的电压还与_______有关。
高一化学 第 6 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
19.(8分)探究浓度对化学反应速率的影响。
【实验原理】反应 a: ,反应过程中溶液出现乳白
色浑浊,比较浑浊现象出现时间的长短,判断反应进行的快慢。
【实验用品】0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、蒸馏水。
试管、烧杯、量筒、胶头滴管、秒表等。
【实验步骤】各组实验数据如下表。
a V2 b
(1)实验 1、2探究 Na2S2O3溶液的浓度对化学反应速率的影响。
① 已知: 。反应 a的离子方程式是_____________________。
② V1=__________。实验 2中加入 V1mL水的主要目的是_________________。
(2)实验 1、3探究 H2SO4溶液的浓度对化学反应速率的影响,则:a=_____________,
V2=____________,b=_____________。
(3)增大反应物的浓度,化学反应速率变快。得出此结论的实验依据是_______________。
20.(6分)下图装置是SO2气体的制备和性质验证装置。
(1)装置 A中发生反应的化学方程式__________________。
高一化学 第 7 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
(2)装置 B是除杂装置,B中的试剂 x是_______(填序号)。
a.饱和Na2CO3溶液 b.饱和Na 2SO3溶液 c.饱和NaHSO3溶液
2
(3)小组同学观察到 C、D中溶液均褪色。应后C中溶液含有SO4 ,反应的离子方程式
是_______。
(4)上述实验说明了或利用了SO2的_______(填序号)。
A.还原性 B.氧化性
C.酸性氧化物的性质 D.漂白性
21.(8分)工业上可利用地沟油作为原料制备乙醇,乙醇可再加工制备多种化工材料。
(1)反应②、③实现了官能团的转化:—OH→__________→_________。
(2)反应④的类型是______________________________。
(3)⑥的化学方程式是_________________________________________。
利用右图装置实现反应⑦。
(4)⑦的化学方程式是
_________________________________________。
(5)反应结束后,振荡试管 b,静置后的现象是
_____________________________。
高一化学 第 8 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
22.(7分)汽车尾气中含有 CO、NO等有害气体。
(1)汽车尾气中 NO生成过程的能量变化示意图如下:
该条件下,1mol N2和 1mol O2完全反应生成 NO,会_______(填“吸收”或“放
出”)_______kJ能量。
(2)利用催化技术可将汽车尾气中的 CO和 NO转化为 CO2和 N2,化学方程式:
2NO+2CO 2CO2+N2。
① 某温度下,在容积不变的密闭容器中通入 CO和 NO,测得不同时间 CO的浓度如
下表:
时间/s 0 1 2 3 ……
c(CO)/×10-3 mol·L-1 3.60 3.05 2.85 2.75 ……
用 CO的浓度变化表示 0~2 s的平均反应速率为_______mol·L-1·s-1。
② 下列可说明反应达到平衡状态的是_______。
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、CO2、N2的浓度之比为 2:2:2:1
d.相同时间内,反应消耗 2molNO 同时消耗 1molN2
③ 反应物初始浓度相同,实验温度为 280 °C和 360 °C,进行以下实验:
实验 同种催化剂的 达平衡时所
实验目的 温度(℃)
编号 比表面积(m2/g) 用的时间(s)
1 对照实验 280 80 t1
2 a 280 120 t2
研究温度对尾气
3 380 80 t3
转化速率的影响
高一化学 第 9 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
[实验分析与结论]
i.补全表格 a_______。
ii.测得 t3<t1,对比实验 1、3,可得结论:_______________________。
iii.通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的
结论,证据是对比实验 1、2,t2_______t1(填“>“<”或“=”)。
23.(9分)某同学为研究浓硝酸与 KSCN溶液的反应,进行如下实验:
实验操作 实验现象
Ⅰ.取 1支试管,加入 2 mL浓硝酸, 溶液立即变红
滴加 5滴 1 mol·L 1KSCN溶液
Ⅱ.将试管静置一段时间 突然剧烈反应,红色迅速褪去,放出大量红棕色气体
III.将Ⅱ中的气体通入 Ba(OH)2和 有白色沉淀生成
NaOH的混合溶液中
资料:SCN 能被氧化为 (SCN)2,(SCN)2迅速聚合为红色的(SCN)x。
(1)KSCN中,C、N元素的化合价分别为+4价和 3价,则 S元素的化合价为______。
(2)I中溶液立即变红是因为生成了______(填化学式)。
(3)研究 SCN 的最终转化产物。
①取少量Ⅱ中试管内的溶液,______(填操作和现象),证明 SCN 中 S 元素的转化产物
是 SO42 。
②经检验Ⅱ中“红棕色气体”含有 NO2,但不能说明 NO2一定是 SCN 中 N元素的转化产物,
原因是______。
③III中,NO2转化为 NO2 、NO3 ,离子方程式是______。
④将 III 中沉淀过滤、洗涤,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴
加少量 KMnO4溶液,不褪色。证明了红棕色气体中不含 SO2。综合上述实验,SCN 的最
终转化产物中一定有______。
(4)Ⅱ中,“静置一段时间后,突然剧烈反应”的可能原因是______(写出一条即可)。
高一化学 第 10 页
{#{QQABAQCAoggAAIJAAAhCQwmCCkOQkBEACagOAAAIoAABABNABAA=}#}
同课章节目录
