第8讲 化学方程式的意义及其书写 课件(共39张PPT) 2024年中考化学二轮专题复习(广东专版)
文档属性
| 名称 | 第8讲 化学方程式的意义及其书写 课件(共39张PPT) 2024年中考化学二轮专题复习(广东专版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-02 00:00:00 | ||
图片预览










文档简介
(共39张PPT)
第8讲 化学方程式的意义及其书写
主题二 物质的化学变化
第8讲 化学方程式的意义及其书写
考试要求 1.化学方程式的意义(知道)
2.正确书写简单的化学方程式,并能根据化学方程式描述反应事实(理解)
3.根据信息书写陌生化学方程式(应用、初高中衔接)
4.能用化学方程式描述物质的性质及其变化规律(理解)
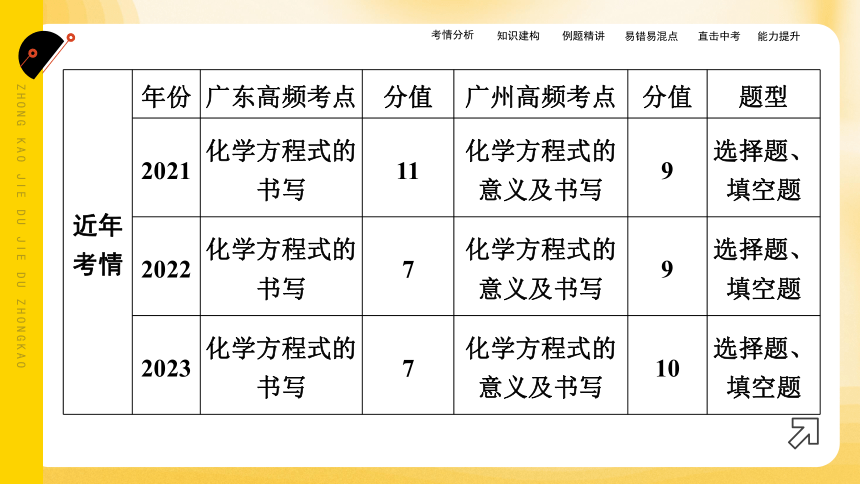
近年考情 年份 广东高频考点 分值 广州高频考点 分值 题型
2021 化学方程式的书写 11 化学方程式的意义及书写 9 选择题、填空题
2022 化学方程式的书写 7 化学方程式的意义及书写 9 选择题、填空题
2023 化学方程式的书写 7 化学方程式的意义及书写 10 选择题、填空题
化学式
化学反应
反应物
生成物
粒子
质量
客观事实
质量守恒
化学计量数
【例题】(2023年深圳市)在通电条件下,甲酸与氧气反应的微观示意图如图所示。下列说法错误的是( )
A.由此反应可知,分子是化学变化的最小粒子
B.2个氢原子和1个氧分子结合形成H2O2
C.反应的化学方程式为HCOOH+O2 H2O2+CO2
D.催化剂在反应前后的化学性质和质量不变
. .
A
点拨:由反应的微观示意图可知化学反应的本质和化学方程式的书写。此题综合考查了分子和原子的定义以及催化剂。
B
C
点拨:A.反应中的“粒子个数比”即化学方程式中化学式前面的化学计量数之比,反应中的“质量比”即物质的相对分子质量乘以前面的化学计量数之比。B.若反应物中有气体,生成物中也有气体,则无需标上“↑”号。在溶液中的反应,若有不溶性固体生成,则需在该固体后标上“↓”号;若反应物中也有不溶性固体,则生成物中的不溶性固体无需标上“↓”号。
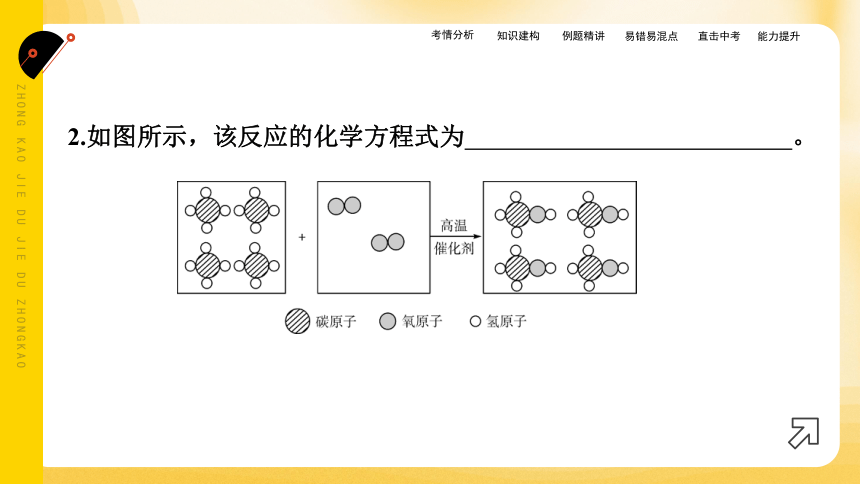
2.如图所示,该反应的化学方程式为 。
3.如图所示是氢气在氧气中燃烧的微观示意图,该反应的化学方程式为 。
点拨:化学方程式中各化学式前面的化学计量数是最简整数比。质量守恒定律指的是参加化学反应的各物质的质量总和等于生成各物质的质量总和,过量的部分不计算在内,则根据图示书写化学方程式时,如果存在过量的物质,需要先把过量的物质划掉再书写化学方程式。
1.(2023年中考题改编)化学技术驱动“碳达峰、碳中和”。CO2转化为炭黑回收利用的反应机理如图所示,依次发生过程Ⅰ、Ⅱ,“→”表示从反应物到生成物。下列说法正确的是( )
A.过程Ⅰ的化学方程式为 3FeO+CO2 Fe3O4+C
B.过程Ⅰ、Ⅱ中铁元素化合价没有发生改变
C.Fe3O4为反应的催化剂
D.总反应可表示为CO2 C+O2
D
C
D
4.(2023年中考题)建立模型是学习化学的重要方法。如图所示为某反应的微观示意图。下列说法正确的是( )
A.物质甲中氮元素的化合价为+3
B.该反应前后分子数目没有发生改变
C.该反应前后涉及的化合物有3种
D.参加反应的甲、乙的质量比等于生成的丙、丁的质量比
C
C
D
7.(2023年中考题)现有O2、Fe、CO、稀硫酸、KOH溶液、CaCO3、MgCl2溶液七种物质。选择适当的物质,按照要求书写化学方程式(每种物质只能选用一次)。
(1)化合反应: 。
(2)分解反应: 。
(3)置换反应: 。
(4)复分解反应: 。
8.(2022年白云区模拟题改编)建立“宏观-微观-符号”之间的联系是学习化学的重要方法。据此,回答下列问题。
图1
(1)镁的化学性质比较活泼,
因此常用电解熔融氯化镁
来制取镁。如图1所示是氯化
镁在熔融状态下分解的微观
示意图,请补充完整。已知
MgCl2(熔融) Mg+ Cl2↑
(2)向盛有足量H2O2溶液的试管中加入几滴盐酸酸化的浅绿色氯化亚铁溶液,溶液变成黄色,写出该反应的化学方程式:_________
_____________________________________。
图1
(3)我国将力争2060年前实现碳中和。工业上利用CO2作原料生产尿素是减少碳排放的措施之一,该反应的微观示意图如图2所示。每消耗44 g CO2涉及的B、D的质量比是 (填最简整数比)。
图2
17∶9
9.(2019年中考题整合)写出下列物质发生反应的化学方程式。
(1)我国高铁建设中用到以下反应:氧化铁和铝粉混合,在高温下反应生成熔化状态的铁,对钢轨中的缝隙进行焊接,该反应属于置换反应,该反应的化学方程式为 。
(2)打火机中燃料的主要成分是 C4H10,写出 C4H10完全燃烧的化学方程式: 。
(3)海洋中资源丰富,如碘(I2)可由海藻、海带经处理后所得到的 NaI溶液与 Cl2发生置换反应而得到,该反应的化学方程式为 _________
。
(4)小苏打常用作发酵粉。当混有小苏打的面包被加热时分解成碳酸钠、二氧化碳等物质,二氧化碳使面包膨胀起来,口感松软,该反应的化学方程式为 。
(5)溴酸钾化学式与氯酸钾类似,加热到370 ℃时分解成溴化钾和空气中含量居第二位的气体,该反应的化学方程式为_______________
。
2NaI+Cl2
2NaCl+I2
2KBrO3
2KBr+3O2↑
10.(2023年越秀区模拟题)“碳达峰”“碳中和”是我国社会发展的重大战略。用CH4转化CO2是实现“双碳”经济的有效途径,该转化的第一步反应的微观示意图如图所示。
(1)CH4也是一种温室气体,充分燃烧时有CO2生成,反应的化学方程式是 。
(2)图中反应生成的物质是 (填化学式),写出这些生成物共有的一种用途: 。
(3)在这一步反应中,消耗的 和生成的 的个数比为 ,消耗的 和生成的 的质量比为 (填最简整数比)。
CO、H2
冶炼金属(或作燃料)
1∶2
11∶14
11.(2022年中考题改编)氢氰酸,又名甲腈、氰化氢,化学式是HCN,是一种无机化合物,氢氰酸在标准状态下为液体,易在空气中均匀弥散,在空气中可燃烧,燃烧生成三种氧化物(二氧化碳、二氧化氮和一种液态氧化物),氢氰酸属于剧毒类物质。将氰化钠与硫酸直接发生反应即得氢氰酸。
(1)氢氰酸在水溶液中解离出H+和 (填化学符号)。
(2)将氰化钠与硫酸直接发生反应即得氢氰酸的反应属于__________
(填反应基本类型)。
CN-
复分解反应
(3)氢氰酸在空气中可燃烧,该反应的化学方程式为 _____________
。
(4)氰化钡[Ba(CN)2]用于制氰化物以及冶金、电镀等工业。98 t氰化钠完全转化可以生产 t氰化钡。
189
1.(经典中考题)以CO2为碳源,与电解水产生的H2经催化可转化为高附加值的有机物,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2与H2反应转化为A或B等有机物,反应原理如图所示。回答下列问题。
(1)B的化学式是 。
(2)根据催化剂的特性可知,催化剂在该反应前后,其质量和
不变。
(3)在催化剂Ⅰ中发生反应的化学方程式是 。
(4)由CO2 与H2反应生成A的总反应的化学方程式是 _____________
。
(5)如果该反应工业化生产后的重要意义是______________________
。
C6H6
化学性质
4CO2+13H2
C4H10+8H2O
减少温室气体,
减少化石能源的使用(答案合理即可)
2.(2021年越秀区模拟题)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。北斗三号卫星上采用了我国自主研发的更高稳定度、更小漂移率的新型高精度铷原子钟和氢原子钟,实现了卫星时频基准性能指标的大幅提升。
(1)常温下铷会与氧气化合,生成过氧化铷(Rb2O2),该反应的化学方程式为 。
(2)铷与水能发生置换反应,生成一种碱和一种可燃性气体,该反应的化学方程式为 。
3.(2023年白云区模拟题)锶元素(元素符号为Sr)及其所形成的化合物,在材料生产、油漆加工等领域中具有极其重要的用途。氢氧化锶是一种无色结晶或白色粉末,易潮解,在空气中易吸收二氧化碳生成碳酸盐。
(1)上述信息能推测氢氧化锶化学性质的是 (选填字母)。
A.“氢氧化锶” B. 无色结晶 C. 易潮解
A
(2)如表所示为部分物质的溶解性表。运用此溶解性表并结合你对复分解反应发生条件的理解,回答下列问题。
离子 OH- Cl- S N C
Ba2+ 溶 溶 不溶 溶 不溶
Cu2+ 不溶 溶 溶 溶 不溶
Sr2+ 溶 溶 不溶 溶 溶
①已知碳酸锶的化学性质与碳酸钠相似,检验久置的氢氧化锶固体部分变质,在待检溶液中按顺序使用的试剂是__________________ 和 。写出从部分变质的氢氧化锶中回收氢氧化锶固体的实验原理: (用化学方程式表示)。
②设计用两种不同类别的物质将氢氧化锶转化成难溶性锶盐的方案:
__________________________________________________________
(用化学方程式表示)。
过量的氯化钡溶液
无色酚酞溶液
Na2SO4+Sr(OH)2
SrSO4↓+2NaOH(答案合理即可)
4.(2022年黄埔区模拟题)某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图1所示。
图1
已知不同温度下,硫酸钾在水溶液、氨溶液中的溶解度如表所示。
温度/℃ 0 10 25
水溶液 6.815 8.496 9.937
氨(8%)溶液 1.387 1.558 2.198
氨(35%)溶液 0.442 0.742 0.813
(1)在“脱硫”反应中,将CaCO3粉碎后与水混合成悬浊液的目的是
。
(2)脱硫过程的化学方程式为2CaCO3 + 2SO2 + O2+4H2O 2CaSO4·2H2O +2___________ 。
(3)石膏与饱和(NH4)2CO3溶液混合发生反应Ⅰ,其基本反应类型为 。
(4)“操作I”的名称是 。
增大接触面积,加快反应速率,使反应充分
CO2
复分解反应
过滤
(5)你认为反应Ⅱ在常温下能实现的原因是______________________
__________________________________________________________
。
常温下,在浓氨水中
K2SO4的溶解度较小,以沉淀形式析出,符合复分解反应发生的
条件
(6)CaSO4·2H2O受热会逐步失去结晶水。取纯净CaSO4·2H2O固体3.44 g,进行加热,测定固体质量随温度的变化情况如图2所示。已知CaSO4·2H2O的相对分子质量为172。H点的固体在t2~1 400 ℃内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,写出发生反应的化学方程式: 。
图2
第8讲 化学方程式的意义及其书写
主题二 物质的化学变化
第8讲 化学方程式的意义及其书写
考试要求 1.化学方程式的意义(知道)
2.正确书写简单的化学方程式,并能根据化学方程式描述反应事实(理解)
3.根据信息书写陌生化学方程式(应用、初高中衔接)
4.能用化学方程式描述物质的性质及其变化规律(理解)
近年考情 年份 广东高频考点 分值 广州高频考点 分值 题型
2021 化学方程式的书写 11 化学方程式的意义及书写 9 选择题、填空题
2022 化学方程式的书写 7 化学方程式的意义及书写 9 选择题、填空题
2023 化学方程式的书写 7 化学方程式的意义及书写 10 选择题、填空题
化学式
化学反应
反应物
生成物
粒子
质量
客观事实
质量守恒
化学计量数
【例题】(2023年深圳市)在通电条件下,甲酸与氧气反应的微观示意图如图所示。下列说法错误的是( )
A.由此反应可知,分子是化学变化的最小粒子
B.2个氢原子和1个氧分子结合形成H2O2
C.反应的化学方程式为HCOOH+O2 H2O2+CO2
D.催化剂在反应前后的化学性质和质量不变
. .
A
点拨:由反应的微观示意图可知化学反应的本质和化学方程式的书写。此题综合考查了分子和原子的定义以及催化剂。
B
C
点拨:A.反应中的“粒子个数比”即化学方程式中化学式前面的化学计量数之比,反应中的“质量比”即物质的相对分子质量乘以前面的化学计量数之比。B.若反应物中有气体,生成物中也有气体,则无需标上“↑”号。在溶液中的反应,若有不溶性固体生成,则需在该固体后标上“↓”号;若反应物中也有不溶性固体,则生成物中的不溶性固体无需标上“↓”号。
2.如图所示,该反应的化学方程式为 。
3.如图所示是氢气在氧气中燃烧的微观示意图,该反应的化学方程式为 。
点拨:化学方程式中各化学式前面的化学计量数是最简整数比。质量守恒定律指的是参加化学反应的各物质的质量总和等于生成各物质的质量总和,过量的部分不计算在内,则根据图示书写化学方程式时,如果存在过量的物质,需要先把过量的物质划掉再书写化学方程式。
1.(2023年中考题改编)化学技术驱动“碳达峰、碳中和”。CO2转化为炭黑回收利用的反应机理如图所示,依次发生过程Ⅰ、Ⅱ,“→”表示从反应物到生成物。下列说法正确的是( )
A.过程Ⅰ的化学方程式为 3FeO+CO2 Fe3O4+C
B.过程Ⅰ、Ⅱ中铁元素化合价没有发生改变
C.Fe3O4为反应的催化剂
D.总反应可表示为CO2 C+O2
D
C
D
4.(2023年中考题)建立模型是学习化学的重要方法。如图所示为某反应的微观示意图。下列说法正确的是( )
A.物质甲中氮元素的化合价为+3
B.该反应前后分子数目没有发生改变
C.该反应前后涉及的化合物有3种
D.参加反应的甲、乙的质量比等于生成的丙、丁的质量比
C
C
D
7.(2023年中考题)现有O2、Fe、CO、稀硫酸、KOH溶液、CaCO3、MgCl2溶液七种物质。选择适当的物质,按照要求书写化学方程式(每种物质只能选用一次)。
(1)化合反应: 。
(2)分解反应: 。
(3)置换反应: 。
(4)复分解反应: 。
8.(2022年白云区模拟题改编)建立“宏观-微观-符号”之间的联系是学习化学的重要方法。据此,回答下列问题。
图1
(1)镁的化学性质比较活泼,
因此常用电解熔融氯化镁
来制取镁。如图1所示是氯化
镁在熔融状态下分解的微观
示意图,请补充完整。已知
MgCl2(熔融) Mg+ Cl2↑
(2)向盛有足量H2O2溶液的试管中加入几滴盐酸酸化的浅绿色氯化亚铁溶液,溶液变成黄色,写出该反应的化学方程式:_________
_____________________________________。
图1
(3)我国将力争2060年前实现碳中和。工业上利用CO2作原料生产尿素是减少碳排放的措施之一,该反应的微观示意图如图2所示。每消耗44 g CO2涉及的B、D的质量比是 (填最简整数比)。
图2
17∶9
9.(2019年中考题整合)写出下列物质发生反应的化学方程式。
(1)我国高铁建设中用到以下反应:氧化铁和铝粉混合,在高温下反应生成熔化状态的铁,对钢轨中的缝隙进行焊接,该反应属于置换反应,该反应的化学方程式为 。
(2)打火机中燃料的主要成分是 C4H10,写出 C4H10完全燃烧的化学方程式: 。
(3)海洋中资源丰富,如碘(I2)可由海藻、海带经处理后所得到的 NaI溶液与 Cl2发生置换反应而得到,该反应的化学方程式为 _________
。
(4)小苏打常用作发酵粉。当混有小苏打的面包被加热时分解成碳酸钠、二氧化碳等物质,二氧化碳使面包膨胀起来,口感松软,该反应的化学方程式为 。
(5)溴酸钾化学式与氯酸钾类似,加热到370 ℃时分解成溴化钾和空气中含量居第二位的气体,该反应的化学方程式为_______________
。
2NaI+Cl2
2NaCl+I2
2KBrO3
2KBr+3O2↑
10.(2023年越秀区模拟题)“碳达峰”“碳中和”是我国社会发展的重大战略。用CH4转化CO2是实现“双碳”经济的有效途径,该转化的第一步反应的微观示意图如图所示。
(1)CH4也是一种温室气体,充分燃烧时有CO2生成,反应的化学方程式是 。
(2)图中反应生成的物质是 (填化学式),写出这些生成物共有的一种用途: 。
(3)在这一步反应中,消耗的 和生成的 的个数比为 ,消耗的 和生成的 的质量比为 (填最简整数比)。
CO、H2
冶炼金属(或作燃料)
1∶2
11∶14
11.(2022年中考题改编)氢氰酸,又名甲腈、氰化氢,化学式是HCN,是一种无机化合物,氢氰酸在标准状态下为液体,易在空气中均匀弥散,在空气中可燃烧,燃烧生成三种氧化物(二氧化碳、二氧化氮和一种液态氧化物),氢氰酸属于剧毒类物质。将氰化钠与硫酸直接发生反应即得氢氰酸。
(1)氢氰酸在水溶液中解离出H+和 (填化学符号)。
(2)将氰化钠与硫酸直接发生反应即得氢氰酸的反应属于__________
(填反应基本类型)。
CN-
复分解反应
(3)氢氰酸在空气中可燃烧,该反应的化学方程式为 _____________
。
(4)氰化钡[Ba(CN)2]用于制氰化物以及冶金、电镀等工业。98 t氰化钠完全转化可以生产 t氰化钡。
189
1.(经典中考题)以CO2为碳源,与电解水产生的H2经催化可转化为高附加值的有机物,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2与H2反应转化为A或B等有机物,反应原理如图所示。回答下列问题。
(1)B的化学式是 。
(2)根据催化剂的特性可知,催化剂在该反应前后,其质量和
不变。
(3)在催化剂Ⅰ中发生反应的化学方程式是 。
(4)由CO2 与H2反应生成A的总反应的化学方程式是 _____________
。
(5)如果该反应工业化生产后的重要意义是______________________
。
C6H6
化学性质
4CO2+13H2
C4H10+8H2O
减少温室气体,
减少化石能源的使用(答案合理即可)
2.(2021年越秀区模拟题)2020年6月23日,北斗三号最后一颗全球组网卫星发射成功。北斗三号卫星上采用了我国自主研发的更高稳定度、更小漂移率的新型高精度铷原子钟和氢原子钟,实现了卫星时频基准性能指标的大幅提升。
(1)常温下铷会与氧气化合,生成过氧化铷(Rb2O2),该反应的化学方程式为 。
(2)铷与水能发生置换反应,生成一种碱和一种可燃性气体,该反应的化学方程式为 。
3.(2023年白云区模拟题)锶元素(元素符号为Sr)及其所形成的化合物,在材料生产、油漆加工等领域中具有极其重要的用途。氢氧化锶是一种无色结晶或白色粉末,易潮解,在空气中易吸收二氧化碳生成碳酸盐。
(1)上述信息能推测氢氧化锶化学性质的是 (选填字母)。
A.“氢氧化锶” B. 无色结晶 C. 易潮解
A
(2)如表所示为部分物质的溶解性表。运用此溶解性表并结合你对复分解反应发生条件的理解,回答下列问题。
离子 OH- Cl- S N C
Ba2+ 溶 溶 不溶 溶 不溶
Cu2+ 不溶 溶 溶 溶 不溶
Sr2+ 溶 溶 不溶 溶 溶
①已知碳酸锶的化学性质与碳酸钠相似,检验久置的氢氧化锶固体部分变质,在待检溶液中按顺序使用的试剂是__________________ 和 。写出从部分变质的氢氧化锶中回收氢氧化锶固体的实验原理: (用化学方程式表示)。
②设计用两种不同类别的物质将氢氧化锶转化成难溶性锶盐的方案:
__________________________________________________________
(用化学方程式表示)。
过量的氯化钡溶液
无色酚酞溶液
Na2SO4+Sr(OH)2
SrSO4↓+2NaOH(答案合理即可)
4.(2022年黄埔区模拟题)某热电厂用脱硫得到的石膏(CaSO4·2H2O)生产K2SO4肥料的流程如图1所示。
图1
已知不同温度下,硫酸钾在水溶液、氨溶液中的溶解度如表所示。
温度/℃ 0 10 25
水溶液 6.815 8.496 9.937
氨(8%)溶液 1.387 1.558 2.198
氨(35%)溶液 0.442 0.742 0.813
(1)在“脱硫”反应中,将CaCO3粉碎后与水混合成悬浊液的目的是
。
(2)脱硫过程的化学方程式为2CaCO3 + 2SO2 + O2+4H2O 2CaSO4·2H2O +2___________ 。
(3)石膏与饱和(NH4)2CO3溶液混合发生反应Ⅰ,其基本反应类型为 。
(4)“操作I”的名称是 。
增大接触面积,加快反应速率,使反应充分
CO2
复分解反应
过滤
(5)你认为反应Ⅱ在常温下能实现的原因是______________________
__________________________________________________________
。
常温下,在浓氨水中
K2SO4的溶解度较小,以沉淀形式析出,符合复分解反应发生的
条件
(6)CaSO4·2H2O受热会逐步失去结晶水。取纯净CaSO4·2H2O固体3.44 g,进行加热,测定固体质量随温度的变化情况如图2所示。已知CaSO4·2H2O的相对分子质量为172。H点的固体在t2~1 400 ℃内发生分解反应,生成一种固体和两种气体,其中一种气体有刺激性气味,写出发生反应的化学方程式: 。
图2
同课章节目录
