专题八 跨学科实践 课件(共30张PPT) 2024年中考化学二轮专题复习(广东专版)
文档属性
| 名称 | 专题八 跨学科实践 课件(共30张PPT) 2024年中考化学二轮专题复习(广东专版) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-02 21:56:26 | ||
图片预览








文档简介
(共30张PPT)
专题八 跨学科实践
第二部分 专题训练,聚焦新课标
专题八 跨学科实践
考试要求 1.社会责任、绿色应用(知道)
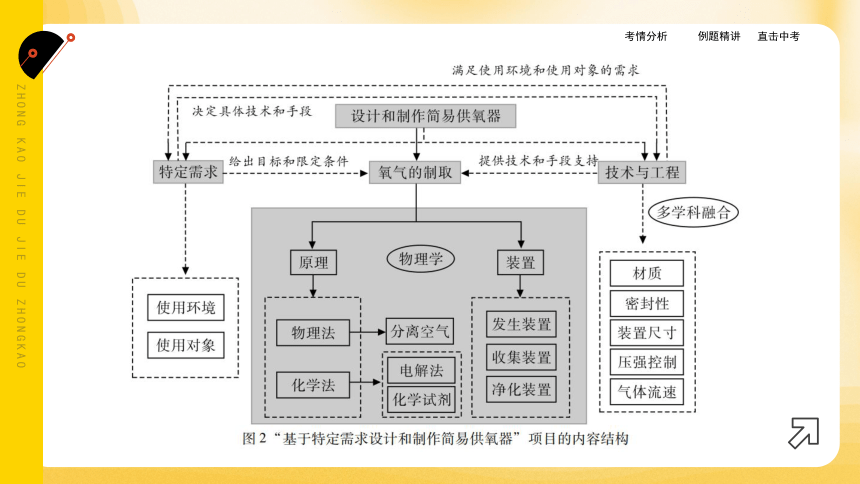
2.碳中和、碳达峰;制作简易供氧器(掌握、多学科融合)
3.化学、技术、社会、环境之间的关系;有机物对生命活动和社会生活的意义(应用)
4.实践项目
(1)基于碳中和理念设计低碳行动方案(重点)
(2)基于特定需求设计和制作简易供氧器(重点)
(3)水质检测及自制净水器
(4)微型空气质量“检测站”的组装与使用
(5)垃圾的分类与回收利用
(6)探究土壤酸碱性对植物生长的影响
(7)海洋资源的综合利用与制盐
(8)制作模型并展示科学家探索物质组成与结构的历程
(9)调查家用燃料的变迁与合理使用
(10)调查我国航天科技领域中新型材料、新型能源的应用
方法指导:以社会热点创设真实情境,培育学生社会责任、环保意识;以化学基础知识为中心,跨学科知识为辅助,解决生产、生活中的实际问题。如碳中和与碳达峰、环境污染与净化等,只要学生具有扎实的基础知识,良好的阅读素养,必能顺利过关。
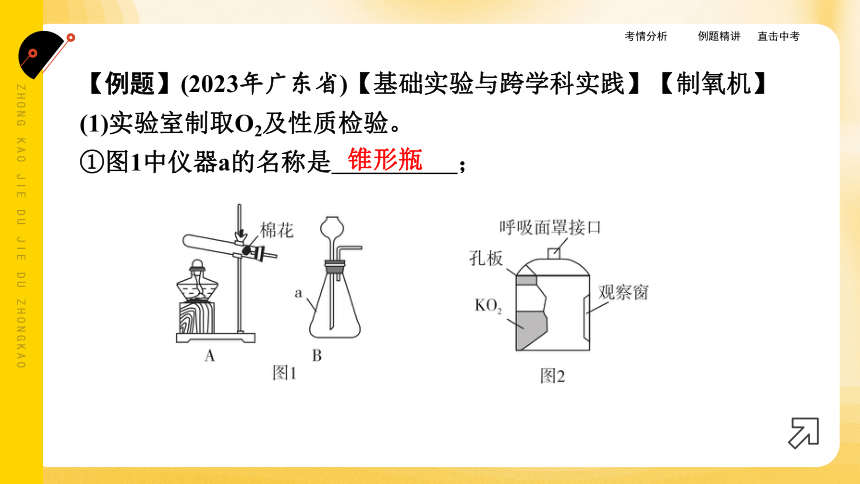
【例题】(2023年广东省)【基础实验与跨学科实践】【制氧机】
(1)实验室制取O2及性质检验。
①图1中仪器a的名称是 ;
锥形瓶
②用高锰酸钾制取O2,应选择图1中的发生装置 (选填字
母),化学方程式为 ;
A
③收集一瓶O2并进行性质检验。
操作 现象 结论
硫燃烧时, (选填字母),生成刺激性气味的气体。 a.产生大量白烟 b.生成黑色固体 c.发出蓝紫色火焰 O2只有氧化性
集气瓶中NaOH溶液的作用是
c
吸收反应生成的二氧化硫,防止其污染空气
(2)制作氧自救呼吸器。
查阅资料:超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。
原理分析:4KO2+2CO2===2K2CO3+3O2,4KO2+2H2O===4X+3O2↑,则X的化学式为 。
动手实践:设计并制作氧自救呼吸器、如图2所示。使用一段时间后,观察到生氧剂由 (填颜色变化)时,则基本失效。
KOH
黄色变为白色
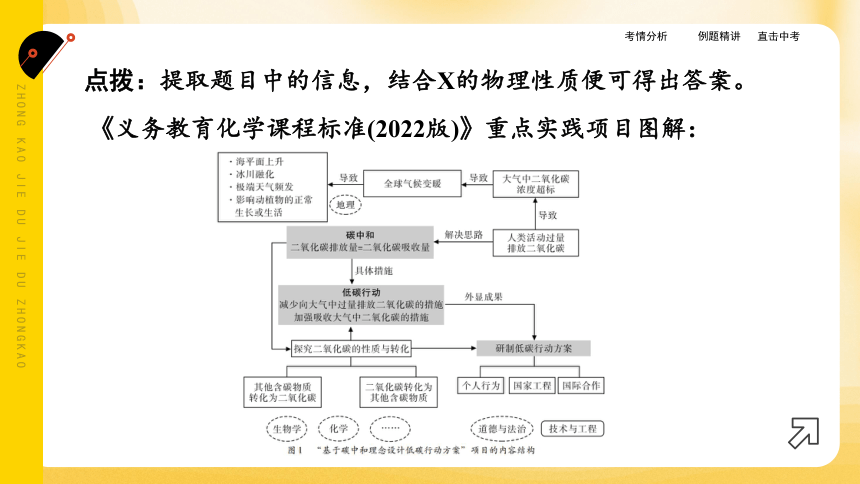
点拨:提取题目中的信息,结合X的物理性质便可得出答案。
《义务教育化学课程标准(2022版)》重点实践项目图解:
1.(经典中考题)【碳中和、家用燃料】 “二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。回答下列问题。
(1)控制CO2的排放,目的是为减缓 效应。加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度 。
(2)写出日常生活中你能做到的一种“低碳”行为:________________
。
温室
增大
随手关灯
(答案合理即可)
(3)利用天然气代替含硫煤做家庭燃料的优点是可以减少 ________的排放。做饭时,
若燃气灶的火焰呈现黄色或橙色,则需将灶具进风口 (选填“调大”或“调小”)即可恢复正常的淡蓝色火焰。
二氧化硫
调大
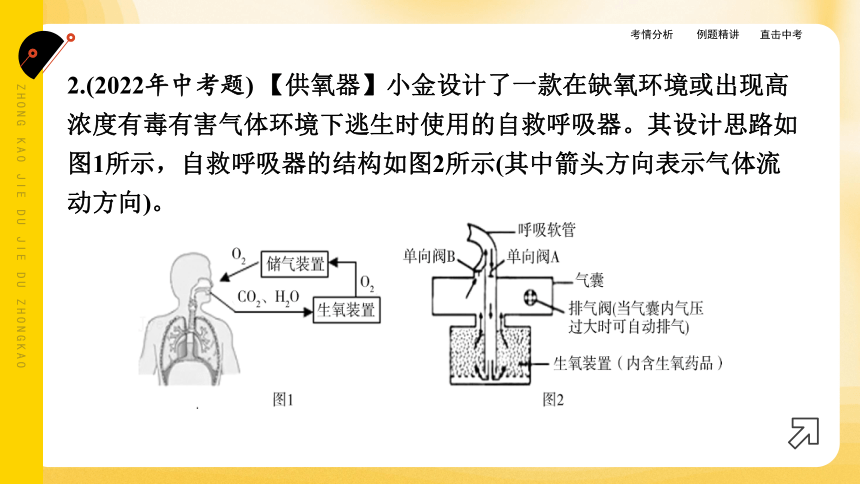
2.(2022年中考题) 【供氧器】小金设计了一款在缺氧环境或出现高浓度有毒有害气体环境下逃生时使用的自救呼吸器。其设计思路如图1所示,自救呼吸器的结构如图2所示(其中箭头方向表示气体流动方向)。
(1)生氧药品的选择:小金查阅资料发现,超氧化物(用MO2表示,其中M为+1价)可与人呼出气中的CO2、H2O反应生成O2,其反应的化学方程式:
4MO2+2H2O=== 4X+3O2↑;
4MO2+2CO2=== 2M2CO3+3O2。
X的化学式为 。500 g超氧化钾(KO2)和500 g超氧化钠(NaO2)的生氧性能如图3所示。小金依据人正常呼吸时需要生氧药品的生氧速度不低于1 L·min-1,并结合自救呼吸器的结构和生氧药品的生氧性能,选取了KO2作为生氧药品。选取KO2的优点是 ____
__________________________________________________________
(写一点)。
MOH
生氧速度波动较小(或使用时间较长或氧气浪费较少。答案合理即可)
(2)影响自救呼吸器有效防护时间的因素有 (选填序号)。
①生氧药品的质量 ②外界有毒有害气体浓度
③外界氧气浓度 ④生氧药品的种类
①④
3.(经典中考题) 【碳中和、碳捕捉】我国力争在2060年前实现碳中和,体现了中国对解决气候问题的大国担当。如图1所示,碳中和即通过植树造林、节能减排等形式,抵消自身产生的CO2排放,实现CO2“零排放”。
(1)“碳”排放。
①化石燃料的燃烧是CO2排放的主要因素,化石燃料主要包括煤、
和天然气;
②下列对节能减排的建议可行的是 (选填字母)。
A.停止使用化石燃料 B.推广使用光伏发电
C.鼓励民众公交出行 D.生活垃圾集中焚烧
石油
BC
(2)“碳”吸收。自然界有多种途径吸收CO2。
①绿色植物通过 吸收CO2;
②风化的岩石如CaCO3粉末可吸收空气中的CO2和H2O转化为Ca(HCO3)2,反应的化学方程式为 。
光合作用
CaCO3+CO2+H2O ===Ca(HCO3)2
(3)“碳”捕捉。利用NaOH捕捉CO2,得到高纯度CO2的流程如图2所示。转化中可循环使用的物质有CaO和X,则X的化学式为 。
NaOH
(4)“碳”利用。将CO2作为资源利用是实现碳中和的有效方法。以CO2和H2为原料,在一定条件可合成C2H6O,参加反应的CO2和H2的质量比为 。
22∶3
【解题思路】CO2和H2在一定条件可合成C2H6O,书写化学方程式,得知还有一种生成物是水。如果不考虑产物,就容易计算错误。
2CO2+6H2 ===C2H6O +3H2O
2×44 6×2
CO2和H2的质量比为(2×44)∶(6×2)=22∶3
4.(2022年白云区模拟题) 【水质检测、净水器】水是生命之源,生产生活中处处离不开水。
(1)某家用净水机工作原理如图1所示。 净水机中,PP棉净水原理是 。颗粒活性炭可去除异味和余氯,是因为活性炭具有良好的 性。
过滤
吸附
(2)环保部门对水质进行长期监测,将水质从“优”到“劣”分为I~V类。如图2所示,近年来某市Ⅱ~Ⅲ类优良水质百分比明显呈__________ (选填“上升”或“下降”)趋势。由此推断,某市主要水域的水质在
(选填“变好”或“变差”)。
上升
变好
(3)污水未经处理直接排入河流,会使水面上藻类物质大量繁殖,水质恶化。某藻类含化学式为C106H263O106N16P的物质,则污水中导致藻类生长过快的营养元素是 (填元素名称)。次氯酸(HClO)可除去废水中的NH3,发生的反应为2NH3+3HClO
X+3HCl+3H2O,X的化学式为 ,若废水碱性过强,NH3的去除率会显著降低,原因是 ___________________________
_________________________________________________________
。
氮、磷
N2
碱性过强会消耗HClO,
使HClO浓度降低,导致氨的去除率降低(答案合理即可)
5.(2023年中考题)【海洋资源】【制盐】海洋是巨大的资源宝库,人类应合理开发利用。如图所示为烟台市对海水综合利用的部分工艺流程图(部分过程和产物已省略)。据图,回答下列问题。
(1)海水淡化:蒸馏法淡化海水是利用海水中各成分 不同进行分离的。
(2)海水晒盐:晒盐时,采用的结晶方法是 ;海水晒盐后得到的卤水是氯化钠的 (选填“饱和”或“不饱和”)溶液。
(3)海水制镁:在用卤水制镁的过程中发生中和反应的化学方程式是
。
沸点
蒸发结晶
饱和
Mg(OH)2+2HCl ===MgCl2+2H2O
(4)海水制“碱”:在用粗盐(含MgCl2、CaCl2杂质)制纯碱过程中,除杂时,先后加入过量的NaOH溶液和Na2CO3溶液产生的沉淀是
(填物质名称);
由氯化钠制取纯碱,从元素守恒的角度看,还需要含有__________ 元素的物质参加反应。
氢氧化镁、碳酸钙
碳、氧
6.(经典中考题)【新能源】氢气是一种可持续研发的新能源和工业原料。
(1)利用太阳能将水转化为氢能是一种理想途径。某种光分解水的过程如图1所示。
①该转化中可循环利用的物质有Fe3O4和 (填化学式);
②与电解水相比,该方法的优点是 。
FeO
能耗低
(2)CH4和H2O催化重整是目前大规模制取H2的重要方法,生产过程中涉及的重要反应有CH4+H2O CO+3H2,CO+H2O
CO2+H2。
①向催化重整体系中投入一定量的CaO可提高H2的百分含量,原因是 ;
②如图2所示,投入纳米CaO时,H2的百分含量最大的原因是_____
。
吸收二氧化碳气体
增大反应物之间的接触面积,使反应更充分
(3)氢气可用于钢铁冶炼、合成氨和合成甲醇等工业。写出赤铁矿(主要成分为Fe2O3)与氢气在高温下炼铁的化学方程式:_________
。
专题八 跨学科实践
第二部分 专题训练,聚焦新课标
专题八 跨学科实践
考试要求 1.社会责任、绿色应用(知道)
2.碳中和、碳达峰;制作简易供氧器(掌握、多学科融合)
3.化学、技术、社会、环境之间的关系;有机物对生命活动和社会生活的意义(应用)
4.实践项目
(1)基于碳中和理念设计低碳行动方案(重点)
(2)基于特定需求设计和制作简易供氧器(重点)
(3)水质检测及自制净水器
(4)微型空气质量“检测站”的组装与使用
(5)垃圾的分类与回收利用
(6)探究土壤酸碱性对植物生长的影响
(7)海洋资源的综合利用与制盐
(8)制作模型并展示科学家探索物质组成与结构的历程
(9)调查家用燃料的变迁与合理使用
(10)调查我国航天科技领域中新型材料、新型能源的应用
方法指导:以社会热点创设真实情境,培育学生社会责任、环保意识;以化学基础知识为中心,跨学科知识为辅助,解决生产、生活中的实际问题。如碳中和与碳达峰、环境污染与净化等,只要学生具有扎实的基础知识,良好的阅读素养,必能顺利过关。
【例题】(2023年广东省)【基础实验与跨学科实践】【制氧机】
(1)实验室制取O2及性质检验。
①图1中仪器a的名称是 ;
锥形瓶
②用高锰酸钾制取O2,应选择图1中的发生装置 (选填字
母),化学方程式为 ;
A
③收集一瓶O2并进行性质检验。
操作 现象 结论
硫燃烧时, (选填字母),生成刺激性气味的气体。 a.产生大量白烟 b.生成黑色固体 c.发出蓝紫色火焰 O2只有氧化性
集气瓶中NaOH溶液的作用是
c
吸收反应生成的二氧化硫,防止其污染空气
(2)制作氧自救呼吸器。
查阅资料:超氧化钾(KO2)为黄色固体,可分别与CO2、H2O反应生成O2和白色固体,产氧效率高,适合作生氧剂。
原理分析:4KO2+2CO2===2K2CO3+3O2,4KO2+2H2O===4X+3O2↑,则X的化学式为 。
动手实践:设计并制作氧自救呼吸器、如图2所示。使用一段时间后,观察到生氧剂由 (填颜色变化)时,则基本失效。
KOH
黄色变为白色
点拨:提取题目中的信息,结合X的物理性质便可得出答案。
《义务教育化学课程标准(2022版)》重点实践项目图解:
1.(经典中考题)【碳中和、家用燃料】 “二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。回答下列问题。
(1)控制CO2的排放,目的是为减缓 效应。加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度 。
(2)写出日常生活中你能做到的一种“低碳”行为:________________
。
温室
增大
随手关灯
(答案合理即可)
(3)利用天然气代替含硫煤做家庭燃料的优点是可以减少 ________的排放。做饭时,
若燃气灶的火焰呈现黄色或橙色,则需将灶具进风口 (选填“调大”或“调小”)即可恢复正常的淡蓝色火焰。
二氧化硫
调大
2.(2022年中考题) 【供氧器】小金设计了一款在缺氧环境或出现高浓度有毒有害气体环境下逃生时使用的自救呼吸器。其设计思路如图1所示,自救呼吸器的结构如图2所示(其中箭头方向表示气体流动方向)。
(1)生氧药品的选择:小金查阅资料发现,超氧化物(用MO2表示,其中M为+1价)可与人呼出气中的CO2、H2O反应生成O2,其反应的化学方程式:
4MO2+2H2O=== 4X+3O2↑;
4MO2+2CO2=== 2M2CO3+3O2。
X的化学式为 。500 g超氧化钾(KO2)和500 g超氧化钠(NaO2)的生氧性能如图3所示。小金依据人正常呼吸时需要生氧药品的生氧速度不低于1 L·min-1,并结合自救呼吸器的结构和生氧药品的生氧性能,选取了KO2作为生氧药品。选取KO2的优点是 ____
__________________________________________________________
(写一点)。
MOH
生氧速度波动较小(或使用时间较长或氧气浪费较少。答案合理即可)
(2)影响自救呼吸器有效防护时间的因素有 (选填序号)。
①生氧药品的质量 ②外界有毒有害气体浓度
③外界氧气浓度 ④生氧药品的种类
①④
3.(经典中考题) 【碳中和、碳捕捉】我国力争在2060年前实现碳中和,体现了中国对解决气候问题的大国担当。如图1所示,碳中和即通过植树造林、节能减排等形式,抵消自身产生的CO2排放,实现CO2“零排放”。
(1)“碳”排放。
①化石燃料的燃烧是CO2排放的主要因素,化石燃料主要包括煤、
和天然气;
②下列对节能减排的建议可行的是 (选填字母)。
A.停止使用化石燃料 B.推广使用光伏发电
C.鼓励民众公交出行 D.生活垃圾集中焚烧
石油
BC
(2)“碳”吸收。自然界有多种途径吸收CO2。
①绿色植物通过 吸收CO2;
②风化的岩石如CaCO3粉末可吸收空气中的CO2和H2O转化为Ca(HCO3)2,反应的化学方程式为 。
光合作用
CaCO3+CO2+H2O ===Ca(HCO3)2
(3)“碳”捕捉。利用NaOH捕捉CO2,得到高纯度CO2的流程如图2所示。转化中可循环使用的物质有CaO和X,则X的化学式为 。
NaOH
(4)“碳”利用。将CO2作为资源利用是实现碳中和的有效方法。以CO2和H2为原料,在一定条件可合成C2H6O,参加反应的CO2和H2的质量比为 。
22∶3
【解题思路】CO2和H2在一定条件可合成C2H6O,书写化学方程式,得知还有一种生成物是水。如果不考虑产物,就容易计算错误。
2CO2+6H2 ===C2H6O +3H2O
2×44 6×2
CO2和H2的质量比为(2×44)∶(6×2)=22∶3
4.(2022年白云区模拟题) 【水质检测、净水器】水是生命之源,生产生活中处处离不开水。
(1)某家用净水机工作原理如图1所示。 净水机中,PP棉净水原理是 。颗粒活性炭可去除异味和余氯,是因为活性炭具有良好的 性。
过滤
吸附
(2)环保部门对水质进行长期监测,将水质从“优”到“劣”分为I~V类。如图2所示,近年来某市Ⅱ~Ⅲ类优良水质百分比明显呈__________ (选填“上升”或“下降”)趋势。由此推断,某市主要水域的水质在
(选填“变好”或“变差”)。
上升
变好
(3)污水未经处理直接排入河流,会使水面上藻类物质大量繁殖,水质恶化。某藻类含化学式为C106H263O106N16P的物质,则污水中导致藻类生长过快的营养元素是 (填元素名称)。次氯酸(HClO)可除去废水中的NH3,发生的反应为2NH3+3HClO
X+3HCl+3H2O,X的化学式为 ,若废水碱性过强,NH3的去除率会显著降低,原因是 ___________________________
_________________________________________________________
。
氮、磷
N2
碱性过强会消耗HClO,
使HClO浓度降低,导致氨的去除率降低(答案合理即可)
5.(2023年中考题)【海洋资源】【制盐】海洋是巨大的资源宝库,人类应合理开发利用。如图所示为烟台市对海水综合利用的部分工艺流程图(部分过程和产物已省略)。据图,回答下列问题。
(1)海水淡化:蒸馏法淡化海水是利用海水中各成分 不同进行分离的。
(2)海水晒盐:晒盐时,采用的结晶方法是 ;海水晒盐后得到的卤水是氯化钠的 (选填“饱和”或“不饱和”)溶液。
(3)海水制镁:在用卤水制镁的过程中发生中和反应的化学方程式是
。
沸点
蒸发结晶
饱和
Mg(OH)2+2HCl ===MgCl2+2H2O
(4)海水制“碱”:在用粗盐(含MgCl2、CaCl2杂质)制纯碱过程中,除杂时,先后加入过量的NaOH溶液和Na2CO3溶液产生的沉淀是
(填物质名称);
由氯化钠制取纯碱,从元素守恒的角度看,还需要含有__________ 元素的物质参加反应。
氢氧化镁、碳酸钙
碳、氧
6.(经典中考题)【新能源】氢气是一种可持续研发的新能源和工业原料。
(1)利用太阳能将水转化为氢能是一种理想途径。某种光分解水的过程如图1所示。
①该转化中可循环利用的物质有Fe3O4和 (填化学式);
②与电解水相比,该方法的优点是 。
FeO
能耗低
(2)CH4和H2O催化重整是目前大规模制取H2的重要方法,生产过程中涉及的重要反应有CH4+H2O CO+3H2,CO+H2O
CO2+H2。
①向催化重整体系中投入一定量的CaO可提高H2的百分含量,原因是 ;
②如图2所示,投入纳米CaO时,H2的百分含量最大的原因是_____
。
吸收二氧化碳气体
增大反应物之间的接触面积,使反应更充分
(3)氢气可用于钢铁冶炼、合成氨和合成甲醇等工业。写出赤铁矿(主要成分为Fe2O3)与氢气在高温下炼铁的化学方程式:_________
。
同课章节目录
