化学人教版(2019)选择性必修1 4.2.2电解池的应用(共37张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.2.2电解池的应用(共37张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-03 09:21:50 | ||
图片预览










文档简介
(共37张PPT)
第四章 化学反应与电能
第二节 电解池
4.2.2电解原理的应用
1、熟知电解饱和食盐水、电镀、电解精炼铜、电冶金的原理,会写其电极反应式及化学方程式
2、学会以电子守恒的观点进行电化学计算
学习目标
1、上一节课,我们学习了电解原理,知道了电解池的工作原理,也明白了,电解过程时放电的逆过程,那么电池可以用来供电,那电解池又可以用来干什么了?
思考
一、电解原理的应用
1、电解饱和食盐水
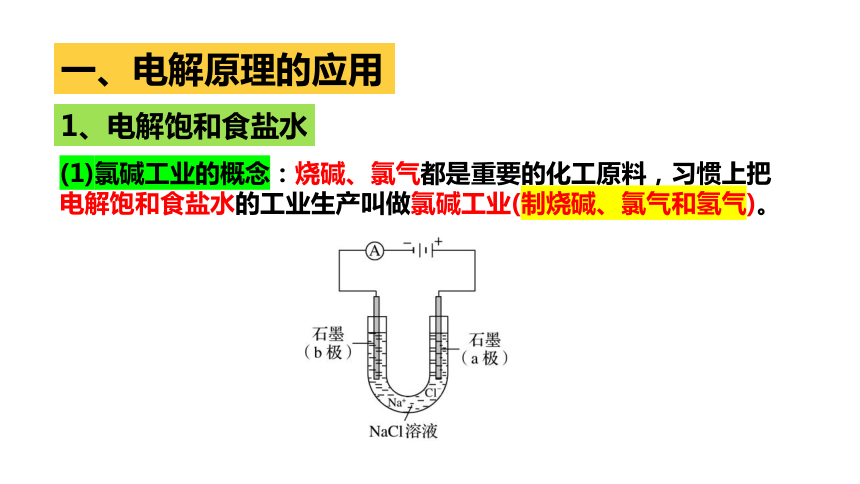
(1)氯碱工业的概念:烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做氯碱工业(制烧碱、氯气和氢气)。
(2)电解饱和食盐水的原理
原理分析 装置图
通电前 氯化钠溶液中含有的离子是
通电时 移向阳极的离子是 ,移向阴极的离子是 . 电极反应 阳极反应 阴极反应 化学方程式 离子方程式 Na+、Cl-、H+、OH-
Cl-、OH-
Na+、H+
2Cl--2e-=Cl2↑(氧化反应)
2H++2e-=H2↑(还原反应)
2H2O+2NaCl = H2↑+Cl2↑+2NaOH
电解
2H2O + 2Cl- = H2↑ + Cl2↑ + 2OH-
电解
2、若在两极附近均滴加酚酞试液,会有什么现象
思考
阴极试液变红(因H+放电,促进了水的电离,使阴极区溶液显碱性)!阳极无明显变化!
3、整个电解质溶液的PH如何变化
PH增大(生成了碱)
4、上述装置的缺点有哪些?
①H2和Cl2 混合爆炸,不安全
②Cl2会和NaOH反应,会使得到的NaOH不纯
(Cl2+2NaOH=NaCl+ NaClO+H2O)
5、装置如何改进
使用离子交换膜
(3)氯碱工业生产流程
工业生产中,电解饱和食盐水的反应在离子交换膜电解槽中进行
①阳离子交换膜电解槽
阴极材料:碳钢
阳极材料:钛(起导电作用)
②阳离子交换膜的作用
只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠溶液反应而影响氢氧化钠溶液的产量和质量
a.能传导溶液中的阳离子;b.阻止阴离子和气体分子通过。
-
+
Cl2
Cl-
H2
Na+
H+
OH-
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
阴 极
阳极室
阴极室
Na+
氯碱工业:离子交换膜法制烧碱
增强溶液导电性
①因为阳极产物Cl2和阴极产物H2会发生反应,Cl2和NaOH会发生反应,因此工业上常用特殊的电解槽电解饱和食盐水,一般用阳离子交换膜将电解槽分隔成两部分,以避免电解产物之间发生反应
②阴极室加入含少量NaOH的目的:增强溶液导电性。
③阳极区Cl-放电生成Cl2,生成的Cl2少量溶于水会使阳极区呈酸性
④离子交换膜种类有阳离子交换膜、阴离子交换膜、质子交换膜等。
离子交换膜的作用:
a.隔离某些物质,防止阴极与阳极产物之间或产物与电解质溶液发生反应;
b.用于制备某些物质:通过离子定向移动使得阴极区或阳极区得到所制备的新物质;
c.对物质进行分离、提纯等。
【几点强调】
(4)氯碱工业产品及其应用
①氯碱工业产品主要有NaOH、Cl2、H2、盐酸、含氯漂白剂
②电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中广泛应用
1、下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 ( )
D
【练一练】
2、关于电解NaCl水溶液,下列叙述正确的是( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
B
【练一练】
镀金奖杯 镀金饰品 景泰蓝
2、电镀
(1)电镀的概念:
利用电解原理在某些金属表面(镀件)镀上一薄层其他金属或合金(镀层)的加工工艺
(2)电镀的主要目:使金属增强抗腐蚀能力,增加表面硬度和美观
【注意】
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金(性质比较稳定)
(3)电镀池的构成
以在铁制钥匙上面镀铜为例
阳极材料:镀层金属Cu
电极反应:Cu-2e- =Cu2+
阴极材料:镀件铁制钥匙
阴极(镀件):Cu2++2e-=Cu
总反应:Cu + Cu2+ = Cu2++Cu
电解
现象:铁件表面镀一层红色的铜,铜片不断溶解
特点:硫酸铜溶液浓度的变化是不变(Cu2+浓度保持不变。)
阳极 镀层金属浸入电镀液中与直流电源的正极相连作阳极
阴极 待镀金属制品与直流电源的负极相连作阴极 电镀液 含有镀层金属离子的电解质溶液 特点 电镀时,电解质溶液的浓度保持不变;阳极减少的质量和阴极增加的质量相等;阳极失电子总数和阴极得电子总数相等 电镀池的结构和特点
3、回答下列问题
①a 、b哪一极为正极(铁叉是镀件)?
②若要给铁叉镀锌,a端电极选用什么材料?选择何种溶液?
e-
镀件作阴极,所以b为负极,a为正极。
锌是镀层金属,则a端电极应选用纯锌作电极材料;选择可溶性锌盐作电镀液。
【练一练】
4、若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜上发生的反应是:Ag++e—=Ag
④在银片上发生的反应是:4OH—-4e—=O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液
A、①③⑥ B、②③⑥ C、①④⑤ D、②③④⑥
B
【练一练】
6、粗铜中含锌、银、金等杂质,结合电解原理如何设计电解池进行粗铜的精炼
思考
3、电解精炼铜
(1)原理:
电解精炼粗铜时,通常把纯铜作阴极,把粗通板(含Zn、Fe、Ni、Ag、Au等)作阳极,用CuSO4溶液作电解质溶液,当通以直流电时,作为阳极的粗铜逐渐溶解,在阴极上析出纯铜,这样可得符合电气工业要求的纯度达99.95%~99.98%的铜
(2)电极反应
①阳极反应
Zn - 2e- = Zn2+
Fe - 2e- = Fe2+
Ni - 2e- = Ni2+
Cu - 2e- = Cu2+
Zn Fe Ni
Cu
Ag Au
阳极泥:相对不活泼的金属以单质的形式沉积在电解槽底,形成阳极泥
②阴极反应
以阳离子形式
留于溶液中
Cu2+ + 2e- =Cu
(3)反应特点
铜的电解精炼时,电解质溶液中的Cu2+浓度中有所减小;阳极减少的质量和阴极增加的质量不相等;阳极失电子总数和阴极得电子总数相等(得电子的金属只有铜,但是失电子的金属有铁,镍,铜)
【注意】
电解精炼中,比需要精炼的金属活泼的杂质溶解,而比需要精炼的金属不活泼的杂质会沉积(如:精炼镍时Cu就会沉积)
铜精炼阳极炉车间
镍铁精炼炉
5、用含少量铁的粗铜做阳极,纯铜片做阴极,硫酸铜溶液做电解液,电解一段时间后,阳极质量减少xg,则( )
A、电解液质量增加Xg
B、阴极质量增加Xg
D阴极质量增加ag,且a < x
C、阴极质量增加ag,且a>x
C
【练一练】
6、以硫酸铜溶液做电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼,下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2+ +2e-=Cu
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
③电路中毎通过0.5mol电子,得到精铜质量为16g
A、 ① ③
D、 ② ③
C、 ③ ④
B、 ② ④
D
【练一练】
电解池、电解精炼池、电镀池的比较
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
电解质浓度
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
视情况具体分析
浓度减小
浓度不变
①电解精炼过程中的“两不等”:
a.电解质溶液浓度在电解前后不相等;
b.阴极增加的质量和阳极减少的质量不相等。
②电镀过程中的“一多,一少,一不变”︰
a.“一多”指阴极上有镀层金属沉积;
b.“一少”指阳极上有镀层金属溶解;
c.“一不变”指电镀液(电解质溶液)的浓度不变。
【几点强调】
4、电冶金
(1)金属冶炼的本质:使矿石中的金属离子获得电子变成金属单质的过程。如Mn++ne-=M
(2)电解法适用范围:用于冶炼较活泼的金属(如钾、钠、镁、铝等),但不能电解其盐溶液,应电解其熔融态(无水环境)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
①电解熔融的氯化钠制取金属钠
电极 反应 阳极 2Cl--2e-=Cl2↑
阴极 2Na++2e-=2Na 总反应 2NaCl(熔融) = 2Na+Cl2↑ 电解
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
总反应:2NaCl = 2Na+Cl2↑
电解
阴极环绕在阳极外面,两极之间用隔膜D隔开。
②电解熔融的氯化镁制金属镁
电极反应 阳极 2Cl--2e-=Cl2↑
阴极 Mg2++2e-=Mg
总反应
MgCl2(熔融) = Mg+Cl2↑
电解
③电解熔融的氯化镁制金属镁
电极反应 阳极
阴极
总反应
微点拨 4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) = 4Al + 3O2↑
电解
冰晶石
冰晶石(Na3AlF6)作助熔剂,降低氧化铝的熔点
【注意】
①电解熔融MgCl2冶炼镁,而不能电解熔融MgO冶炼镁,因MgO的熔点很高,消耗电能大,成本高
②电解熔融Al2O3冶炼铝,而不能电解AlCl3冶炼铝,因AlCl3是共价化合物,其熔融态不导电
【练一练】
7、(双选)下列可被工业上采用的冶金方法是( )
A.电解氯化钠溶液制钠
B.电解熔融的氯化镁制镁
C.电解熔融的氯化铝制铝
D.高温下用一氧化碳还原氧化铁制铁
BD
二、电解的有关计算
1、计算类型
电解的相关计算包括两极产物的定量计算(如质量、气体的体积、某元素的化合价、溶液的pH及物质的量浓度等)
2、电解计算的依据
(1)阳极失去的电子总数=阴极得到的电子总数
(2)串联电路中通过各电解池的电子总数相等
(3)电源输出的电子总数和电解池中转移的电子总数相等
3、电解计算的方法
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路上转移的电子数相等
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算
(3)根据关系式计算:根据得失电子守恒的关系建立已知量与未知量之间的桥梁,建立计算所需的关系式
以通过4 mol e-为桥梁可构建如下关系式:(式中M为金属,n为其离子的化合价数值)
【注意】
在电化学计算中,还常利用Q=I·t 和Q=n(e-)×NA×1.60×10-19 C来计算电路中通过的电量
第四章 化学反应与电能
第二节 电解池
4.2.2电解原理的应用
1、熟知电解饱和食盐水、电镀、电解精炼铜、电冶金的原理,会写其电极反应式及化学方程式
2、学会以电子守恒的观点进行电化学计算
学习目标
1、上一节课,我们学习了电解原理,知道了电解池的工作原理,也明白了,电解过程时放电的逆过程,那么电池可以用来供电,那电解池又可以用来干什么了?
思考
一、电解原理的应用
1、电解饱和食盐水
(1)氯碱工业的概念:烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做氯碱工业(制烧碱、氯气和氢气)。
(2)电解饱和食盐水的原理
原理分析 装置图
通电前 氯化钠溶液中含有的离子是
通电时 移向阳极的离子是 ,移向阴极的离子是 . 电极反应 阳极反应 阴极反应 化学方程式 离子方程式 Na+、Cl-、H+、OH-
Cl-、OH-
Na+、H+
2Cl--2e-=Cl2↑(氧化反应)
2H++2e-=H2↑(还原反应)
2H2O+2NaCl = H2↑+Cl2↑+2NaOH
电解
2H2O + 2Cl- = H2↑ + Cl2↑ + 2OH-
电解
2、若在两极附近均滴加酚酞试液,会有什么现象
思考
阴极试液变红(因H+放电,促进了水的电离,使阴极区溶液显碱性)!阳极无明显变化!
3、整个电解质溶液的PH如何变化
PH增大(生成了碱)
4、上述装置的缺点有哪些?
①H2和Cl2 混合爆炸,不安全
②Cl2会和NaOH反应,会使得到的NaOH不纯
(Cl2+2NaOH=NaCl+ NaClO+H2O)
5、装置如何改进
使用离子交换膜
(3)氯碱工业生产流程
工业生产中,电解饱和食盐水的反应在离子交换膜电解槽中进行
①阳离子交换膜电解槽
阴极材料:碳钢
阳极材料:钛(起导电作用)
②阳离子交换膜的作用
只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠溶液反应而影响氢氧化钠溶液的产量和质量
a.能传导溶液中的阳离子;b.阻止阴离子和气体分子通过。
-
+
Cl2
Cl-
H2
Na+
H+
OH-
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
阴 极
阳极室
阴极室
Na+
氯碱工业:离子交换膜法制烧碱
增强溶液导电性
①因为阳极产物Cl2和阴极产物H2会发生反应,Cl2和NaOH会发生反应,因此工业上常用特殊的电解槽电解饱和食盐水,一般用阳离子交换膜将电解槽分隔成两部分,以避免电解产物之间发生反应
②阴极室加入含少量NaOH的目的:增强溶液导电性。
③阳极区Cl-放电生成Cl2,生成的Cl2少量溶于水会使阳极区呈酸性
④离子交换膜种类有阳离子交换膜、阴离子交换膜、质子交换膜等。
离子交换膜的作用:
a.隔离某些物质,防止阴极与阳极产物之间或产物与电解质溶液发生反应;
b.用于制备某些物质:通过离子定向移动使得阴极区或阳极区得到所制备的新物质;
c.对物质进行分离、提纯等。
【几点强调】
(4)氯碱工业产品及其应用
①氯碱工业产品主要有NaOH、Cl2、H2、盐酸、含氯漂白剂
②电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、农药、金属冶炼等领域中广泛应用
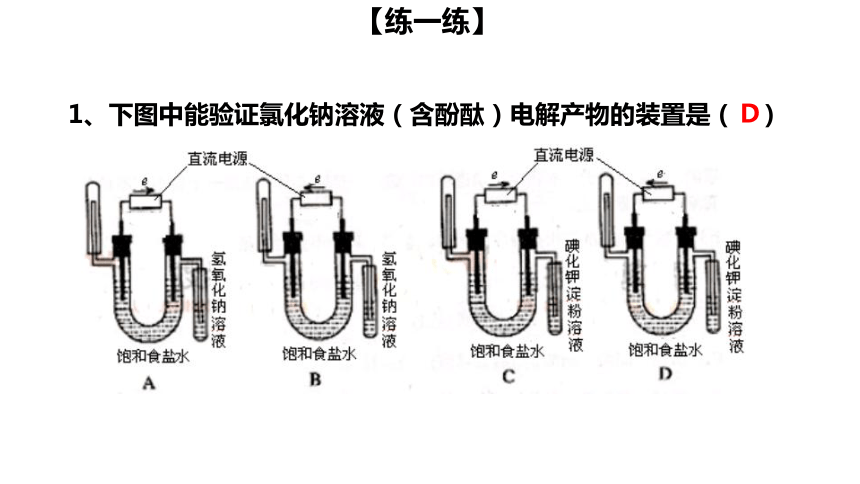
1、下图中能验证氯化钠溶液(含酚酞)电解产物的装置是 ( )
D
【练一练】
2、关于电解NaCl水溶液,下列叙述正确的是( )
A、电解时在阳极得到氯气,在阴极得到金属钠
B、若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
B
【练一练】
镀金奖杯 镀金饰品 景泰蓝
2、电镀
(1)电镀的概念:
利用电解原理在某些金属表面(镀件)镀上一薄层其他金属或合金(镀层)的加工工艺
(2)电镀的主要目:使金属增强抗腐蚀能力,增加表面硬度和美观
【注意】
镀层金属通常是一些在空气中或溶液里不易起变化的金属和合金(性质比较稳定)
(3)电镀池的构成
以在铁制钥匙上面镀铜为例
阳极材料:镀层金属Cu
电极反应:Cu-2e- =Cu2+
阴极材料:镀件铁制钥匙
阴极(镀件):Cu2++2e-=Cu
总反应:Cu + Cu2+ = Cu2++Cu
电解
现象:铁件表面镀一层红色的铜,铜片不断溶解
特点:硫酸铜溶液浓度的变化是不变(Cu2+浓度保持不变。)
阳极 镀层金属浸入电镀液中与直流电源的正极相连作阳极
阴极 待镀金属制品与直流电源的负极相连作阴极 电镀液 含有镀层金属离子的电解质溶液 特点 电镀时,电解质溶液的浓度保持不变;阳极减少的质量和阴极增加的质量相等;阳极失电子总数和阴极得电子总数相等 电镀池的结构和特点
3、回答下列问题
①a 、b哪一极为正极(铁叉是镀件)?
②若要给铁叉镀锌,a端电极选用什么材料?选择何种溶液?
e-
镀件作阴极,所以b为负极,a为正极。
锌是镀层金属,则a端电极应选用纯锌作电极材料;选择可溶性锌盐作电镀液。
【练一练】
4、若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上
②将银片接在电源的正极上
③在铜上发生的反应是:Ag++e—=Ag
④在银片上发生的反应是:4OH—-4e—=O2↑+2H2O
⑤需用硫酸铜溶液为电镀液
⑥需用硝酸银溶液为电镀液
A、①③⑥ B、②③⑥ C、①④⑤ D、②③④⑥
B
【练一练】
6、粗铜中含锌、银、金等杂质,结合电解原理如何设计电解池进行粗铜的精炼
思考
3、电解精炼铜
(1)原理:
电解精炼粗铜时,通常把纯铜作阴极,把粗通板(含Zn、Fe、Ni、Ag、Au等)作阳极,用CuSO4溶液作电解质溶液,当通以直流电时,作为阳极的粗铜逐渐溶解,在阴极上析出纯铜,这样可得符合电气工业要求的纯度达99.95%~99.98%的铜
(2)电极反应
①阳极反应
Zn - 2e- = Zn2+
Fe - 2e- = Fe2+
Ni - 2e- = Ni2+
Cu - 2e- = Cu2+
Zn Fe Ni
Cu
Ag Au
阳极泥:相对不活泼的金属以单质的形式沉积在电解槽底,形成阳极泥
②阴极反应
以阳离子形式
留于溶液中
Cu2+ + 2e- =Cu
(3)反应特点
铜的电解精炼时,电解质溶液中的Cu2+浓度中有所减小;阳极减少的质量和阴极增加的质量不相等;阳极失电子总数和阴极得电子总数相等(得电子的金属只有铜,但是失电子的金属有铁,镍,铜)
【注意】
电解精炼中,比需要精炼的金属活泼的杂质溶解,而比需要精炼的金属不活泼的杂质会沉积(如:精炼镍时Cu就会沉积)
铜精炼阳极炉车间
镍铁精炼炉
5、用含少量铁的粗铜做阳极,纯铜片做阴极,硫酸铜溶液做电解液,电解一段时间后,阳极质量减少xg,则( )
A、电解液质量增加Xg
B、阴极质量增加Xg
D阴极质量增加ag,且a < x
C、阴极质量增加ag,且a>x
C
【练一练】
6、以硫酸铜溶液做电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼,下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2+ +2e-=Cu
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
③电路中毎通过0.5mol电子,得到精铜质量为16g
A、 ① ③
D、 ② ③
C、 ③ ④
B、 ② ④
D
【练一练】
电解池、电解精炼池、电镀池的比较
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
电解质浓度
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
视情况具体分析
浓度减小
浓度不变
①电解精炼过程中的“两不等”:
a.电解质溶液浓度在电解前后不相等;
b.阴极增加的质量和阳极减少的质量不相等。
②电镀过程中的“一多,一少,一不变”︰
a.“一多”指阴极上有镀层金属沉积;
b.“一少”指阳极上有镀层金属溶解;
c.“一不变”指电镀液(电解质溶液)的浓度不变。
【几点强调】
4、电冶金
(1)金属冶炼的本质:使矿石中的金属离子获得电子变成金属单质的过程。如Mn++ne-=M
(2)电解法适用范围:用于冶炼较活泼的金属(如钾、钠、镁、铝等),但不能电解其盐溶液,应电解其熔融态(无水环境)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
加热法
物理提取法
①电解熔融的氯化钠制取金属钠
电极 反应 阳极 2Cl--2e-=Cl2↑
阴极 2Na++2e-=2Na 总反应 2NaCl(熔融) = 2Na+Cl2↑ 电解
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
总反应:2NaCl = 2Na+Cl2↑
电解
阴极环绕在阳极外面,两极之间用隔膜D隔开。
②电解熔融的氯化镁制金属镁
电极反应 阳极 2Cl--2e-=Cl2↑
阴极 Mg2++2e-=Mg
总反应
MgCl2(熔融) = Mg+Cl2↑
电解
③电解熔融的氯化镁制金属镁
电极反应 阳极
阴极
总反应
微点拨 4Al3+ + 12e- = 4Al
6O2- - 12e- = 3O2↑
2Al2O3(熔融) = 4Al + 3O2↑
电解
冰晶石
冰晶石(Na3AlF6)作助熔剂,降低氧化铝的熔点
【注意】
①电解熔融MgCl2冶炼镁,而不能电解熔融MgO冶炼镁,因MgO的熔点很高,消耗电能大,成本高
②电解熔融Al2O3冶炼铝,而不能电解AlCl3冶炼铝,因AlCl3是共价化合物,其熔融态不导电
【练一练】
7、(双选)下列可被工业上采用的冶金方法是( )
A.电解氯化钠溶液制钠
B.电解熔融的氯化镁制镁
C.电解熔融的氯化铝制铝
D.高温下用一氧化碳还原氧化铁制铁
BD
二、电解的有关计算
1、计算类型
电解的相关计算包括两极产物的定量计算(如质量、气体的体积、某元素的化合价、溶液的pH及物质的量浓度等)
2、电解计算的依据
(1)阳极失去的电子总数=阴极得到的电子总数
(2)串联电路中通过各电解池的电子总数相等
(3)电源输出的电子总数和电解池中转移的电子总数相等
3、电解计算的方法
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路上转移的电子数相等
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算
(3)根据关系式计算:根据得失电子守恒的关系建立已知量与未知量之间的桥梁,建立计算所需的关系式
以通过4 mol e-为桥梁可构建如下关系式:(式中M为金属,n为其离子的化合价数值)
【注意】
在电化学计算中,还常利用Q=I·t 和Q=n(e-)×NA×1.60×10-19 C来计算电路中通过的电量
