化学人教版(2019)选择性必修1 1.1.2反应热与焓变(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.2反应热与焓变(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-03 21:46:08 | ||
图片预览





文档简介
(共22张PPT)
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
课前训练
B
反应热与焓变
第2课时
第一节 反应热
[学习目标]
1.了解焓变的定义
2.掌握化学反应中能量变化的原因(重点)
3.掌握利用化学键断裂和形成时的能量变化数据
来计算反应热的方法(重点、难点)
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
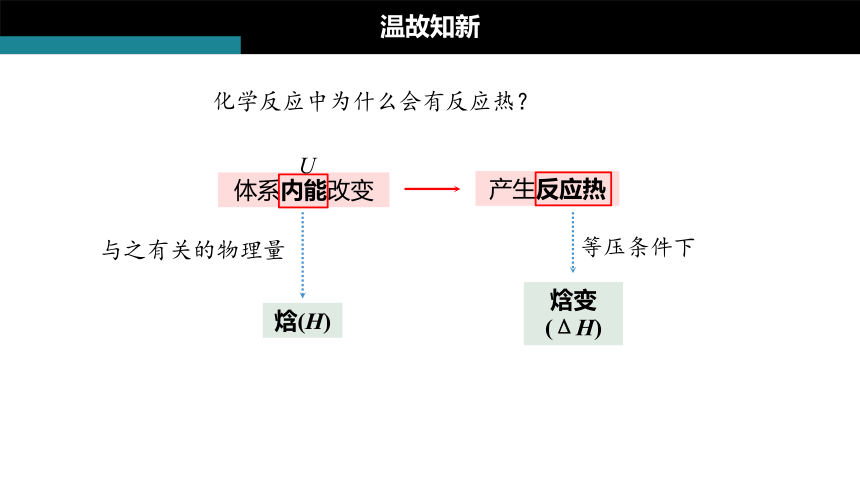
化学反应中为什么会有反应热?
产生反应热
体系内能改变
焓(H)
与之有关的物理量
焓变(ΔH)
等压条件下
U
温故知新
1. 焓和焓变
内能:
焓(H):
焓变(ΔH):
反应热:
目标一 反应热与焓变
体系内物质的各种能量的总和, 符号U。
与内能有关的物理量, 用符号H表示。
ΔH=H生成物-H反应物
中学阶段认为,等压条件下化学反应的反应热等于反应的焓变
单位:kJ/mol或kJ·mol-1。
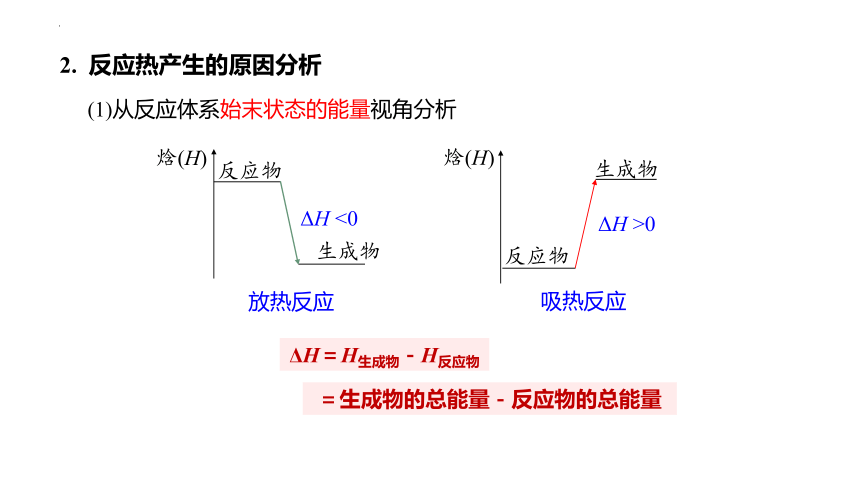
放热反应
ΔH <0
焓(H)
反应物
生成物
吸热反应
ΔH >0
焓(H)
生成物
反应物
ΔH=H生成物-H反应物
2. 反应热产生的原因分析
(1)从反应体系始末状态的能量视角分析
=生成物的总能量-反应物的总能量
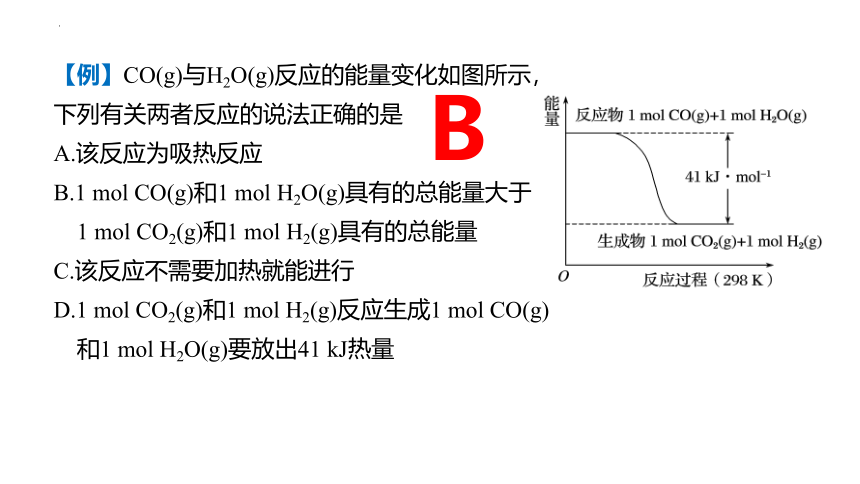
【例】CO(g)与H2O(g)反应的能量变化如图所示,
下列有关两者反应的说法正确的是
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于
1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)
和1 mol H2O(g)要放出41 kJ热量
B
1.正误判断
(1)ΔH的单位采用kJ·mol-1时,表示1 mol反应的焓变
(2)NaOH溶液与稀H2SO4反应的ΔH>0
(3)化学反应中,当反应物总能量大于生成物总能量时,反应放热, ΔH<0
(4)放热反应不需要加热就能反应,吸热反应不加热就不能反应
(5)浓硫酸溶于水是放热反应
(6)锌与稀硫酸反应导致体系温度升高,且向环境中释放热量
(7)物质发生化学变化都伴有能量的变化
√
×
√
×
×
√
√
对点训练
中和热 ΔH= -57.3kJ/mol
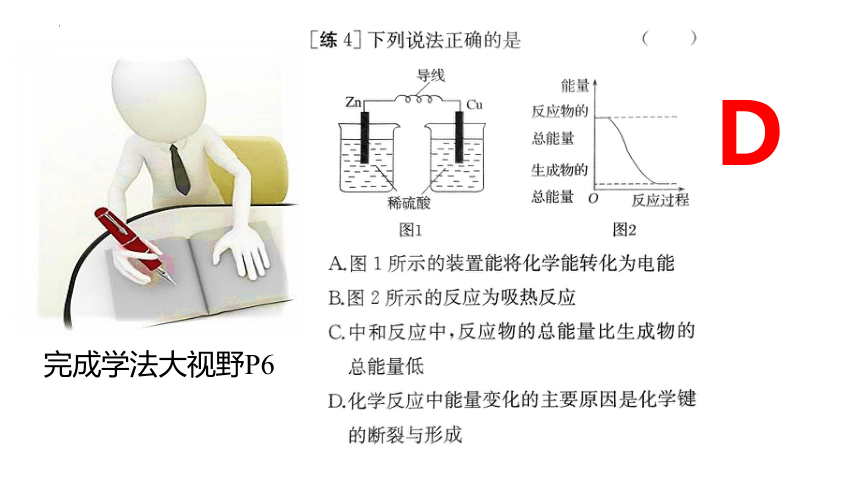
完成学法大视野P6
D
完成学法大视野P7
D
(2) 从微观化学反应过程化学键的变化视角分析
如何计算1 mol H2 与 1 mol Cl2生成2 mol HCl的反应热?
键能:气态分子中1 mol化学键解离成气态原子所吸收的能量
或气态原子结合形成1 mol化学键所释放的能量
ΔH = 断键吸收的总能量-成键释放的总能量
=反应物的总键能-生成物的总键能
= (436+243) kJ·mol -1-2×431 kJ·mol -1
= -183 kJ·mol -1
思考交流
已知:H2(g)+O2(g)===H2O(g),反应过程中的能量变化如图所示,
回答下列问题。
(1)a、b、c分别代表什么意义?
a:___________________;
b:____________________;
c:_______。
旧键断裂吸收的能量
新键形成放出的能量
反应热
(2)该反应是_____(填“放热”或“吸热”)反应,ΔH____(填“>”或“<”)0,
放热
<
ΔH= 0。
a-b
【例1】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。
下列有关叙述正确的是
A.1molA和1molB形成1molAB需吸收b kJ能量
B.该反应的ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
B
【例2】键能是气态基态原子形成1 mol化学键(或其逆过程)时释放(或吸收)的最低能量。已知H—H键、N≡N键、N—H键键能如下表所示:
则反应N2(g)+3H2(g)===2NH3(g)的ΔH=______________。
解析 ΔH=反应物的总键能-生成物的总键能
=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1
=(2 254 kJ·mol-1-2 346 kJ·mol-1)
=-92 kJ·mol-1。
-92 kJ·mol-1
化学键 H—H N≡N N—H
键能/kJ·mol-1 436 946 391
【变式训练】白磷与氧可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
【例3】
放热
436
-92kJ/mol
【变式训练】已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量_____(填“高于”或“低于”)生成物所具有的总能量。
(2)1 mol NO(g)分子中的化学键断裂时要吸收_____ kJ能量。
(3)断裂1 mol N≡N吸收的能量值x为_____。
低于
632
946
180=(x+498) -2×632
x=946
ΔH=反应物的总键能-生成物的总键能
完成学法大视野P8
C
能量
反应过程
生成物
反应物
E1
E2
反应热
H= E1-E2
反应过程
生成物
反应物
反应热
E1
E2
能量
ΔH = H生成物-H反应物
★★ΔH = 断键吸收的总能量-成键释放的总能量
= 反应物的总键能-生成物的总键能
归纳总结: ΔH的计算方法▲▲▲▲
=生成物的总能量- 反应物的总能量
看图
根据键能计算
自我测试
1.已知在25 ℃、101 kPa下,1 mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法正确的是
A.H2O(g)分解为H2(g)与O2(g)时放出热量
B.甲、乙、丙中物质所具有的总能量:乙>甲>丙
C.H2(g)具有的能量高于H2O(g)具有的能量
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
√
分解吸热
甲→乙吸收685 kJ能量,乙>甲
乙→丙释放930 kJ能量,乙>丙
无法比较
等量的H2O(g)具有的能量高于H2O(l),乙→丙若生成液态水,放出的能量大于930 kJ
2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,
断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
解析 利用ΔH=反应物的键能之和-生成物的键能之和进行计算。
ΔH=280 kJ·mol-1+3×160 kJ·mol-1-6×330 kJ·mol-1=-1 220 kJ·mol-1。
B
3.CH3—CH3(g)―→CH2==CH2(g)+H2(g) ,有关化学键的键能如下表:
化学键 C—H C==C C—C H—H
键能/ (kJ·mol-1) 414 615 347 435
则生成1 mol H2(g) (吸收/放出) kJ 的能量。
125
吸收
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
课前训练
B
反应热与焓变
第2课时
第一节 反应热
[学习目标]
1.了解焓变的定义
2.掌握化学反应中能量变化的原因(重点)
3.掌握利用化学键断裂和形成时的能量变化数据
来计算反应热的方法(重点、难点)
化学 必修第一册 人民教育出版社
化学 必修第二册 人民教育出版社
化学反应中为什么会有反应热?
产生反应热
体系内能改变
焓(H)
与之有关的物理量
焓变(ΔH)
等压条件下
U
温故知新
1. 焓和焓变
内能:
焓(H):
焓变(ΔH):
反应热:
目标一 反应热与焓变
体系内物质的各种能量的总和, 符号U。
与内能有关的物理量, 用符号H表示。
ΔH=H生成物-H反应物
中学阶段认为,等压条件下化学反应的反应热等于反应的焓变
单位:kJ/mol或kJ·mol-1。
放热反应
ΔH <0
焓(H)
反应物
生成物
吸热反应
ΔH >0
焓(H)
生成物
反应物
ΔH=H生成物-H反应物
2. 反应热产生的原因分析
(1)从反应体系始末状态的能量视角分析
=生成物的总能量-反应物的总能量
【例】CO(g)与H2O(g)反应的能量变化如图所示,
下列有关两者反应的说法正确的是
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于
1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)
和1 mol H2O(g)要放出41 kJ热量
B
1.正误判断
(1)ΔH的单位采用kJ·mol-1时,表示1 mol反应的焓变
(2)NaOH溶液与稀H2SO4反应的ΔH>0
(3)化学反应中,当反应物总能量大于生成物总能量时,反应放热, ΔH<0
(4)放热反应不需要加热就能反应,吸热反应不加热就不能反应
(5)浓硫酸溶于水是放热反应
(6)锌与稀硫酸反应导致体系温度升高,且向环境中释放热量
(7)物质发生化学变化都伴有能量的变化
√
×
√
×
×
√
√
对点训练
中和热 ΔH= -57.3kJ/mol
完成学法大视野P6
D
完成学法大视野P7
D
(2) 从微观化学反应过程化学键的变化视角分析
如何计算1 mol H2 与 1 mol Cl2生成2 mol HCl的反应热?
键能:气态分子中1 mol化学键解离成气态原子所吸收的能量
或气态原子结合形成1 mol化学键所释放的能量
ΔH = 断键吸收的总能量-成键释放的总能量
=反应物的总键能-生成物的总键能
= (436+243) kJ·mol -1-2×431 kJ·mol -1
= -183 kJ·mol -1
思考交流
已知:H2(g)+O2(g)===H2O(g),反应过程中的能量变化如图所示,
回答下列问题。
(1)a、b、c分别代表什么意义?
a:___________________;
b:____________________;
c:_______。
旧键断裂吸收的能量
新键形成放出的能量
反应热
(2)该反应是_____(填“放热”或“吸热”)反应,ΔH____(填“>”或“<”)0,
放热
<
ΔH= 0。
a-b
【例1】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。
下列有关叙述正确的是
A.1molA和1molB形成1molAB需吸收b kJ能量
B.该反应的ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
B
【例2】键能是气态基态原子形成1 mol化学键(或其逆过程)时释放(或吸收)的最低能量。已知H—H键、N≡N键、N—H键键能如下表所示:
则反应N2(g)+3H2(g)===2NH3(g)的ΔH=______________。
解析 ΔH=反应物的总键能-生成物的总键能
=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1
=(2 254 kJ·mol-1-2 346 kJ·mol-1)
=-92 kJ·mol-1。
-92 kJ·mol-1
化学键 H—H N≡N N—H
键能/kJ·mol-1 436 946 391
【变式训练】白磷与氧可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
A
【例3】
放热
436
-92kJ/mol
【变式训练】已知N2(g)和O2(g)反应生成2 mol NO(g)吸收180 kJ能量,反应过程中能量变化如图所示。
根据图示回答下列问题:
(1)该反应中反应物所具有的总能量_____(填“高于”或“低于”)生成物所具有的总能量。
(2)1 mol NO(g)分子中的化学键断裂时要吸收_____ kJ能量。
(3)断裂1 mol N≡N吸收的能量值x为_____。
低于
632
946
180=(x+498) -2×632
x=946
ΔH=反应物的总键能-生成物的总键能
完成学法大视野P8
C
能量
反应过程
生成物
反应物
E1
E2
反应热
H= E1-E2
反应过程
生成物
反应物
反应热
E1
E2
能量
ΔH = H生成物-H反应物
★★ΔH = 断键吸收的总能量-成键释放的总能量
= 反应物的总键能-生成物的总键能
归纳总结: ΔH的计算方法▲▲▲▲
=生成物的总能量- 反应物的总能量
看图
根据键能计算
自我测试
1.已知在25 ℃、101 kPa下,1 mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法正确的是
A.H2O(g)分解为H2(g)与O2(g)时放出热量
B.甲、乙、丙中物质所具有的总能量:乙>甲>丙
C.H2(g)具有的能量高于H2O(g)具有的能量
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
√
分解吸热
甲→乙吸收685 kJ能量,乙>甲
乙→丙释放930 kJ能量,乙>丙
无法比较
等量的H2O(g)具有的能量高于H2O(l),乙→丙若生成液态水,放出的能量大于930 kJ
2.SF6是一种优良的绝缘气体,分子结构中只存在S—F键。
已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,
断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。
则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
解析 利用ΔH=反应物的键能之和-生成物的键能之和进行计算。
ΔH=280 kJ·mol-1+3×160 kJ·mol-1-6×330 kJ·mol-1=-1 220 kJ·mol-1。
B
3.CH3—CH3(g)―→CH2==CH2(g)+H2(g) ,有关化学键的键能如下表:
化学键 C—H C==C C—C H—H
键能/ (kJ·mol-1) 414 615 347 435
则生成1 mol H2(g) (吸收/放出) kJ 的能量。
125
吸收
