化学人教版(2019)必修第二册7.3.1乙醇的结构及性质(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇的结构及性质(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-04 08:40:27 | ||
图片预览




文档简介
(共29张PPT)
第二节 乙醇和乙酸
第1课时 乙醇
必修第二册 第七章 有机化合物
“借问酒家何处有,牧童遥指杏花村”.
“对酒当歌,人生几何”!
“明月几时有,把酒问青天”!
“李白斗酒诗三百”……
今天酿酒基本的操作方法:甜高粱秸秆(籽粒)—压榨(粉碎)—出浆—糖液—乙醇发酵—酵母分离—蒸馏—燃料乙醇。这一生产技术实现了“草变油”的神话,乙醇俗称酒精,那么,你对乙醇的性质和用途了解吗?酒的“庐山真面目”是什么呢?
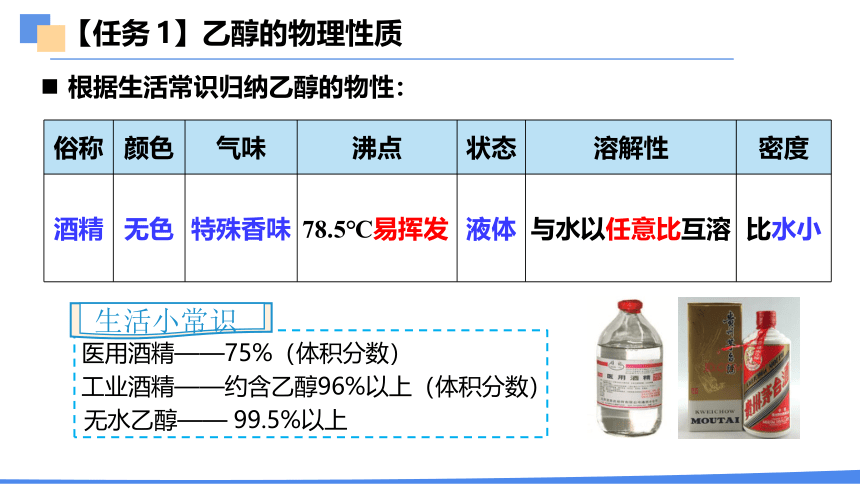
【任务 1】乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
酒精 无色 特殊香味 78.5℃易挥发 液体 与水以任意比互溶
比水小
医用酒精——75%(体积分数)
工业酒精——约含乙醇96%以上(体积分数)
无水乙醇—— 99.5%以上
生活小常识
根据生活常识归纳乙醇的物性:
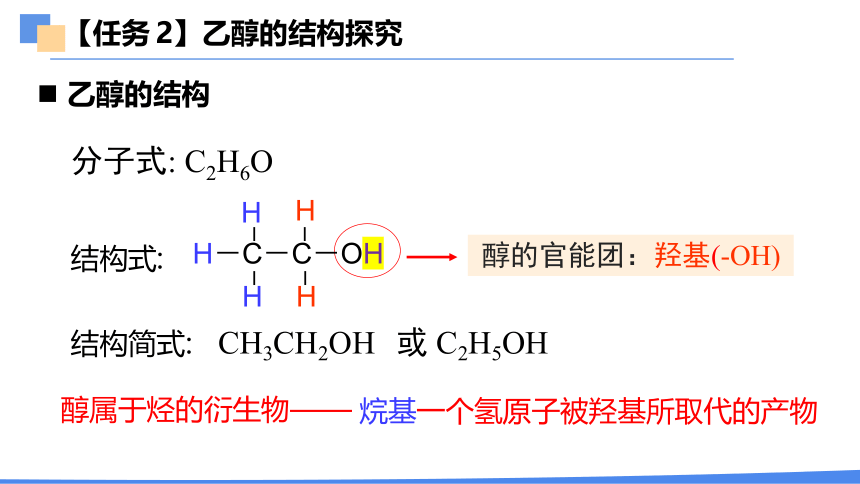
【任务 2】乙醇的结构探究
乙醇的结构
分子式: C2H6O
结构式:
结构简式:
CH3CH2OH
或 C2H5OH
醇的官能团:羟基(-OH)
H-C-C-OH
-
H
-
-
-
H
H
H
烷基一个氢原子被羟基所取代的产物
醇属于烃的衍生物——
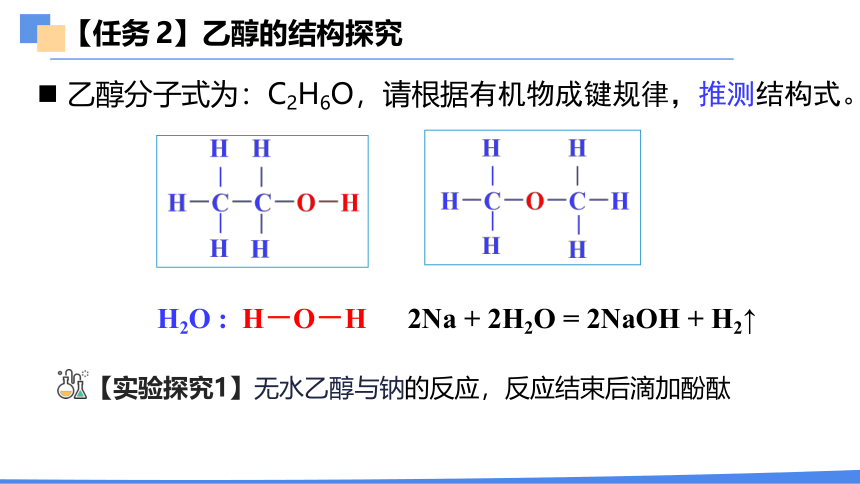
【任务 2】乙醇的结构探究
乙醇分子式为:C2H6O,请根据有机物成键规律,推测结构式。
H2O : H-O-H
2Na + 2H2O = 2NaOH + H2↑
【实验探究1】无水乙醇与钠的反应,反应结束后滴加酚酞
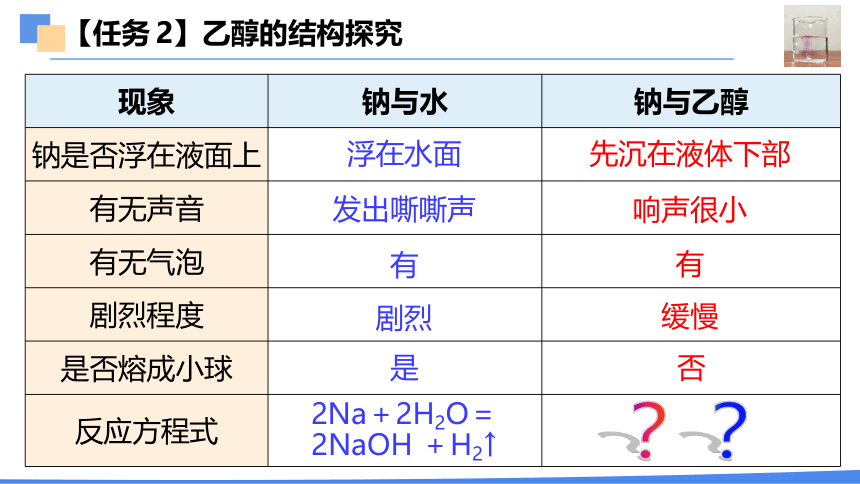
【任务 2】乙醇的结构探究
【实验现象】
1、钠下沉
2、缓慢放出气泡,钠未熔化,在底部慢慢消失
3、溶液变红
→ 钠的密度与乙醇大
→ 生成碱性物质
→ 反应比与水的缓和,放热少
【补充信息】已知1mol乙醇与足量钠反应,会放出0.5mol 氢气。
反应的化学方程式为:
2CH3CH2OH +2Na → 2CH3CH2ONa + H2↑
现象 钠与水 钠与乙醇
钠是否浮在液面上
有无声音
有无气泡
剧烈程度
是否熔成小球
反应方程式
【任务 2】乙醇的结构探究
剧烈
2Na+2H2O=
2NaOH +H2↑
浮在水面
发出嘶嘶声
有
是
缓慢
??
先沉在液体下部
响声很小
有
否
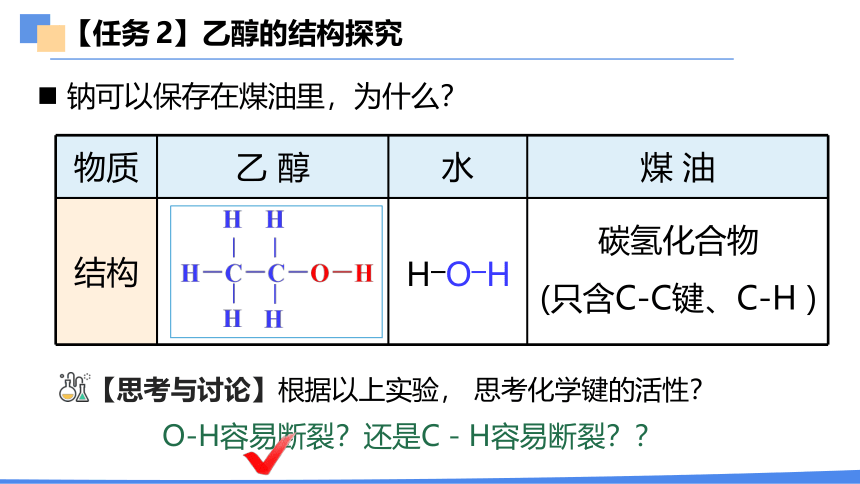
物质 乙 醇 水 煤 油
结构
【任务 2】乙醇的结构探究
钠可以保存在煤油里,为什么?
【思考与讨论】根据以上实验, 思考化学键的活性?
H―O―H
碳氢化合物
(只含C-C键、C-H )
O-H容易断裂?还是C-H容易断裂??
【任务 3】乙醇的化学性质
乙醇与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
【计算重点】 每 2 mol 乙醇与足量的Na反应生成 1 mol H2.
2—O—H ~ H2
现象比水缓和,故氢原子活泼性:水>醇
【任务 3】乙醇的化学性质
C2H5OH+3O2 2CO2+3H2O
点燃
现象:发出淡蓝色火焰,并放出大量热
氧化反应
(1)燃烧反应
①
②
③
④
⑤
【思考】燃烧反应中断裂什么化学键?
断裂所有化学键
乙醇汽油
【任务 3】乙醇的化学性质
氧化反应
加热
插入乙醇
又变红
有刺激性气味
CH3CHO
CuO
Cu
Cu
铜与银均可做催化剂
醇的催化氧化 反应方程式:
2Cu +O2
2CuO
①
②
CuO + CH3CH2OH
CH3CHO + Cu + H2O
2CH3CH2OH + O2
Cu
2CH3CHO + 2H2O
【任务 3】乙醇的化学性质
①
②
—中间产物
催化剂—
乙醛—
乙醇的催化氧化
【任务 3】乙醇的化学性质
乙醇的催化氧化
Cu
乙醇
乙醛
氧原子
水
H—C—C—O
H
H
H
H
H
H—C—C—O
H
H
H
-----
-----
反应机理
【任务 3】乙醇的化学性质
乙醇的其他氧化
乙醇与强氧化剂的反应(交警检查酒后驾车的检测原理)
【任务 3】乙醇的化学性质
乙醇被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
CH3CH2OH CH3COOH
酸性KMnO4溶液
酸性K2Cr2O7溶液
橙黄色
绿色
【重点归纳】乙醇结构与化学性质
④
⑤
②
③
①
①
⑤
①
③
H—C — C — O — H
H H
H H
②
④
结构决定性质
醇的化学性质主要由羟基决定,醇分子氧原子吸引电子能力比氢、碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移。
因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
1、 与钠反应
2、 氧化反应
C2H6O
C2H4O
C2H4O2
CO2
乙醇
乙醛
乙酸
二氧化碳
-2
-1
0
+4
2CH3CH2OH + O2
Cu
2CH3CHO + 2H2O
C2H5OH + 3O2 2CO2 + 3H2O
点燃
还原剂
氧化剂
H+/KMnO4
H+/K2Cr2O7
不同条件、
不同氧化剂,
可得到不同产物
乙醇的化学性质
(橙黄色)
Cr3+ (绿色)
乙醇
乙醛脱氢酶
(ALDH)
过量饮酒,人体肝脏一时无法使乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇将减缓大脑中信使分子的有效传递,影响判断力,而高浓度的乙醛还能致癌,并容易导致心血管病急性发作。
生活中的化学——过量饮酒的危害
长期过量饮酒,会使人发胖、损伤肝脏。
长期过量饮酒,会行动迟缓、导致三高。
肝脏中
1.判断下列说法是否正确 (正确的打“√”,错误的打“×”)
(1) 乙醇的结构简式为C2H5OH,说明乙醇分子中共有两种氢原子。( )
(2) 乙醇的分子结构中有OH-。( )
(3) 羟基的电子式为∶O∶H。( )
(4) 乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键。( )
(5) 乙醇的官能团是OH-。( )
(6) 乙醇与金属钠反应时,是乙醇分子中羟基中的O—H键断裂。( )
(7) 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水。( )
(8) 甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物。( )
×
√
√
×
×
×
×
×
【例题1】下列有关乙醇的物理性质的应用不正确的是 ( )
A. 由于乙醇的密度比水小,所以乙醇中的水可以通过
分液的方法除去
B. 由于乙醇能溶解很多有机物和无机物,所以可用乙醇
提取中药的有效成分
C. 由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑
各种浓度的酒
D. 从化学学科角度看,俗语“酒香不怕巷子深”中包含
乙醇容易挥发的性质
A
【例题2】乙醇分子中的化学键如图所示,下列关于乙醇在各种反应中断裂化学键的说法不正确的是( )
A.与金属钠反应时①断裂
B.在加热和铜做催化剂的条件下与O2反应时断裂①和③
C.在加热和铜做催化剂的条件下与O2反应时断裂①和⑤
D.在空气中完全燃烧时断裂①②③④⑤
C
2.新型冠状病毒威胁着人们的身体健康,医用酒精可以起到消毒作用,下列有关酒精的叙述错误的是( )
A.酒精的结构简式为C2H5OH
B.酒精与乙醛互为同分异构体
C.酒精与水能任意比例互溶
D.酒精完全燃烧生成二氧化碳和水
【答案】B
3.下列说法正确的是( )
A.乙醇分子是由乙基和氢氧根组成的
B.乙醇是比水轻的液体,与水混合时浮在水面上
C.含乙醇99.5%以上的酒精叫做无水乙醇
D.乙醇可作为提取碘水中碘的萃取剂
【答案】C
4.下列关于乙醇的说法正确的是( )
A.乙醇在水溶液中能电离出少量的H+,所以乙醇是酸
B.乙醇结构中有—OH,所以乙醇显碱性
C.乙醇分子中只有烃基上的氢原子可被钠置换出来
D.乙醇是一种很好的溶剂,能溶解许多无机化合物和有机化合物,人们用白酒浸泡中药制成药酒就是利用了这一性质
【答案】D
5.将一小粒金属钠投入到盛有无水乙醇的小烧杯中,以下描述合理的是( )
A.无明显现象
B.烧杯内溶液颜色逐渐变红
C.金属钠浮于液面上,四处游动
D.金属钠沉入烧杯底部,并产生气泡
【答案】D
6.下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是( )
A.乙醇能燃烧
B.1molCH3CH2OH与Na完全反应只生成0.5molH2
C.乙醇分子中含有一个氧原子
D.乙醇能溶于水
【答案】B
7.酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小
③乙醇有还原性 ④乙醇的组成中含氧元素
A.②④ B.②③ C.①③ D.①④
【答案】C
8.某化学反应过程如图所示。由图得出的判断,错误的是 ( )
A.生成物M的结构简式为CH3CHO
B.乙醇发生了还原反应
C.铜是此反应的催化剂
D.反应中有红黑交替变化的现象
【答案】B
本课结束!
第二节 乙醇和乙酸
第1课时 乙醇
必修第二册 第七章 有机化合物
“借问酒家何处有,牧童遥指杏花村”.
“对酒当歌,人生几何”!
“明月几时有,把酒问青天”!
“李白斗酒诗三百”……
今天酿酒基本的操作方法:甜高粱秸秆(籽粒)—压榨(粉碎)—出浆—糖液—乙醇发酵—酵母分离—蒸馏—燃料乙醇。这一生产技术实现了“草变油”的神话,乙醇俗称酒精,那么,你对乙醇的性质和用途了解吗?酒的“庐山真面目”是什么呢?
【任务 1】乙醇的物理性质
俗称 颜色 气味 沸点 状态 溶解性 密度
酒精 无色 特殊香味 78.5℃易挥发 液体 与水以任意比互溶
比水小
医用酒精——75%(体积分数)
工业酒精——约含乙醇96%以上(体积分数)
无水乙醇—— 99.5%以上
生活小常识
根据生活常识归纳乙醇的物性:
【任务 2】乙醇的结构探究
乙醇的结构
分子式: C2H6O
结构式:
结构简式:
CH3CH2OH
或 C2H5OH
醇的官能团:羟基(-OH)
H-C-C-OH
-
H
-
-
-
H
H
H
烷基一个氢原子被羟基所取代的产物
醇属于烃的衍生物——
【任务 2】乙醇的结构探究
乙醇分子式为:C2H6O,请根据有机物成键规律,推测结构式。
H2O : H-O-H
2Na + 2H2O = 2NaOH + H2↑
【实验探究1】无水乙醇与钠的反应,反应结束后滴加酚酞
【任务 2】乙醇的结构探究
【实验现象】
1、钠下沉
2、缓慢放出气泡,钠未熔化,在底部慢慢消失
3、溶液变红
→ 钠的密度与乙醇大
→ 生成碱性物质
→ 反应比与水的缓和,放热少
【补充信息】已知1mol乙醇与足量钠反应,会放出0.5mol 氢气。
反应的化学方程式为:
2CH3CH2OH +2Na → 2CH3CH2ONa + H2↑
现象 钠与水 钠与乙醇
钠是否浮在液面上
有无声音
有无气泡
剧烈程度
是否熔成小球
反应方程式
【任务 2】乙醇的结构探究
剧烈
2Na+2H2O=
2NaOH +H2↑
浮在水面
发出嘶嘶声
有
是
缓慢
??
先沉在液体下部
响声很小
有
否
物质 乙 醇 水 煤 油
结构
【任务 2】乙醇的结构探究
钠可以保存在煤油里,为什么?
【思考与讨论】根据以上实验, 思考化学键的活性?
H―O―H
碳氢化合物
(只含C-C键、C-H )
O-H容易断裂?还是C-H容易断裂??
【任务 3】乙醇的化学性质
乙醇与钠的反应
CH3CH2OH + Na → CH3CH2ONa + H2↑
2 2 2
【计算重点】 每 2 mol 乙醇与足量的Na反应生成 1 mol H2.
2—O—H ~ H2
现象比水缓和,故氢原子活泼性:水>醇
【任务 3】乙醇的化学性质
C2H5OH+3O2 2CO2+3H2O
点燃
现象:发出淡蓝色火焰,并放出大量热
氧化反应
(1)燃烧反应
①
②
③
④
⑤
【思考】燃烧反应中断裂什么化学键?
断裂所有化学键
乙醇汽油
【任务 3】乙醇的化学性质
氧化反应
加热
插入乙醇
又变红
有刺激性气味
CH3CHO
CuO
Cu
Cu
铜与银均可做催化剂
醇的催化氧化 反应方程式:
2Cu +O2
2CuO
①
②
CuO + CH3CH2OH
CH3CHO + Cu + H2O
2CH3CH2OH + O2
Cu
2CH3CHO + 2H2O
【任务 3】乙醇的化学性质
①
②
—中间产物
催化剂—
乙醛—
乙醇的催化氧化
【任务 3】乙醇的化学性质
乙醇的催化氧化
Cu
乙醇
乙醛
氧原子
水
H—C—C—O
H
H
H
H
H
H—C—C—O
H
H
H
-----
-----
反应机理
【任务 3】乙醇的化学性质
乙醇的其他氧化
乙醇与强氧化剂的反应(交警检查酒后驾车的检测原理)
【任务 3】乙醇的化学性质
乙醇被酸性KMnO4 、K2Cr2O7 溶液氧化为乙酸
CH3CH2OH CH3COOH
酸性KMnO4溶液
酸性K2Cr2O7溶液
橙黄色
绿色
【重点归纳】乙醇结构与化学性质
④
⑤
②
③
①
①
⑤
①
③
H—C — C — O — H
H H
H H
②
④
结构决定性质
醇的化学性质主要由羟基决定,醇分子氧原子吸引电子能力比氢、碳原子强,①O—H键和②C—O键的电子对都向氧原子偏移。
因而,醇在起反应时, ①O—H键和②C—O键容易断裂。
1、 与钠反应
2、 氧化反应
C2H6O
C2H4O
C2H4O2
CO2
乙醇
乙醛
乙酸
二氧化碳
-2
-1
0
+4
2CH3CH2OH + O2
Cu
2CH3CHO + 2H2O
C2H5OH + 3O2 2CO2 + 3H2O
点燃
还原剂
氧化剂
H+/KMnO4
H+/K2Cr2O7
不同条件、
不同氧化剂,
可得到不同产物
乙醇的化学性质
(橙黄色)
Cr3+ (绿色)
乙醇
乙醛脱氢酶
(ALDH)
过量饮酒,人体肝脏一时无法使乙醇、乙醛和乙酸等全部转化,血液中高浓度的乙醇将减缓大脑中信使分子的有效传递,影响判断力,而高浓度的乙醛还能致癌,并容易导致心血管病急性发作。
生活中的化学——过量饮酒的危害
长期过量饮酒,会使人发胖、损伤肝脏。
长期过量饮酒,会行动迟缓、导致三高。
肝脏中
1.判断下列说法是否正确 (正确的打“√”,错误的打“×”)
(1) 乙醇的结构简式为C2H5OH,说明乙醇分子中共有两种氢原子。( )
(2) 乙醇的分子结构中有OH-。( )
(3) 羟基的电子式为∶O∶H。( )
(4) 乙烯的官能团是碳碳双键,乙烷的官能团是碳碳单键。( )
(5) 乙醇的官能团是OH-。( )
(6) 乙醇与金属钠反应时,是乙醇分子中羟基中的O—H键断裂。( )
(7) 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水。( )
(8) 甲烷、乙烯、苯、乙醇都是无色不溶于水的有机化合物。( )
×
√
√
×
×
×
×
×
【例题1】下列有关乙醇的物理性质的应用不正确的是 ( )
A. 由于乙醇的密度比水小,所以乙醇中的水可以通过
分液的方法除去
B. 由于乙醇能溶解很多有机物和无机物,所以可用乙醇
提取中药的有效成分
C. 由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑
各种浓度的酒
D. 从化学学科角度看,俗语“酒香不怕巷子深”中包含
乙醇容易挥发的性质
A
【例题2】乙醇分子中的化学键如图所示,下列关于乙醇在各种反应中断裂化学键的说法不正确的是( )
A.与金属钠反应时①断裂
B.在加热和铜做催化剂的条件下与O2反应时断裂①和③
C.在加热和铜做催化剂的条件下与O2反应时断裂①和⑤
D.在空气中完全燃烧时断裂①②③④⑤
C
2.新型冠状病毒威胁着人们的身体健康,医用酒精可以起到消毒作用,下列有关酒精的叙述错误的是( )
A.酒精的结构简式为C2H5OH
B.酒精与乙醛互为同分异构体
C.酒精与水能任意比例互溶
D.酒精完全燃烧生成二氧化碳和水
【答案】B
3.下列说法正确的是( )
A.乙醇分子是由乙基和氢氧根组成的
B.乙醇是比水轻的液体,与水混合时浮在水面上
C.含乙醇99.5%以上的酒精叫做无水乙醇
D.乙醇可作为提取碘水中碘的萃取剂
【答案】C
4.下列关于乙醇的说法正确的是( )
A.乙醇在水溶液中能电离出少量的H+,所以乙醇是酸
B.乙醇结构中有—OH,所以乙醇显碱性
C.乙醇分子中只有烃基上的氢原子可被钠置换出来
D.乙醇是一种很好的溶剂,能溶解许多无机化合物和有机化合物,人们用白酒浸泡中药制成药酒就是利用了这一性质
【答案】D
5.将一小粒金属钠投入到盛有无水乙醇的小烧杯中,以下描述合理的是( )
A.无明显现象
B.烧杯内溶液颜色逐渐变红
C.金属钠浮于液面上,四处游动
D.金属钠沉入烧杯底部,并产生气泡
【答案】D
6.下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是( )
A.乙醇能燃烧
B.1molCH3CH2OH与Na完全反应只生成0.5molH2
C.乙醇分子中含有一个氧原子
D.乙醇能溶于水
【答案】B
7.酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小
③乙醇有还原性 ④乙醇的组成中含氧元素
A.②④ B.②③ C.①③ D.①④
【答案】C
8.某化学反应过程如图所示。由图得出的判断,错误的是 ( )
A.生成物M的结构简式为CH3CHO
B.乙醇发生了还原反应
C.铜是此反应的催化剂
D.反应中有红黑交替变化的现象
【答案】B
本课结束!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
