2025人教版高中化学选择性必修1同步练习题--第1课时 电解原理(含答案)
文档属性
| 名称 | 2025人教版高中化学选择性必修1同步练习题--第1课时 电解原理(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 433.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-04 10:06:54 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修1
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
基础过关练
题组一 电解池的构成与工作原理
1.(经典题)(2024福建福州月考)某同学为了使反应HCl+Ag AgCl+H2↑能进行,设计了下列四个实验,如图所示,你认为可行的方案是 ( )
2.(2024山东实验中学开学考)用石墨电极电解CuCl2溶液(如图所示)。下列分析正确的是 ( )
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应为
Cu2++2e- Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
题组二 电解规律
3.(2023北京师范大学附中期中)为探究电解过程中离子的放电规律,某研究小组进行下列实验:
序号 阳极 材料 阴极 材料 熔融电解质或 电解质溶液 阳极氧 化产物 阴极还 原产物
① 石墨 石墨 熔融NaCl Cl2 Na
② 石墨 石墨 0.1 mol·L-1 NaCl溶液 Cl2 H2
③ 石墨 石墨 0.2 mol·L-1 CuSO4溶液 O2 Cu
④ 铜 石墨 0.2 mol·L-1 CuSO4溶液 Cu2+ Cu
⑤ 石墨 石墨 0.1 mol·L-1 CuCl2溶液 Cl2 Cu
下列说法不正确的是 ( )
A.对比②⑤知,阴极上离子放电顺序:Cu2+>H+>Na+
B.对比③⑤知,阳极上离子放电顺序:Cl->OH->S
C.对比③④知,阳极是铜时,会先于溶液中的离子放电
D.对比①⑤知,电解得到金属只能用熔融态,不能用水溶液
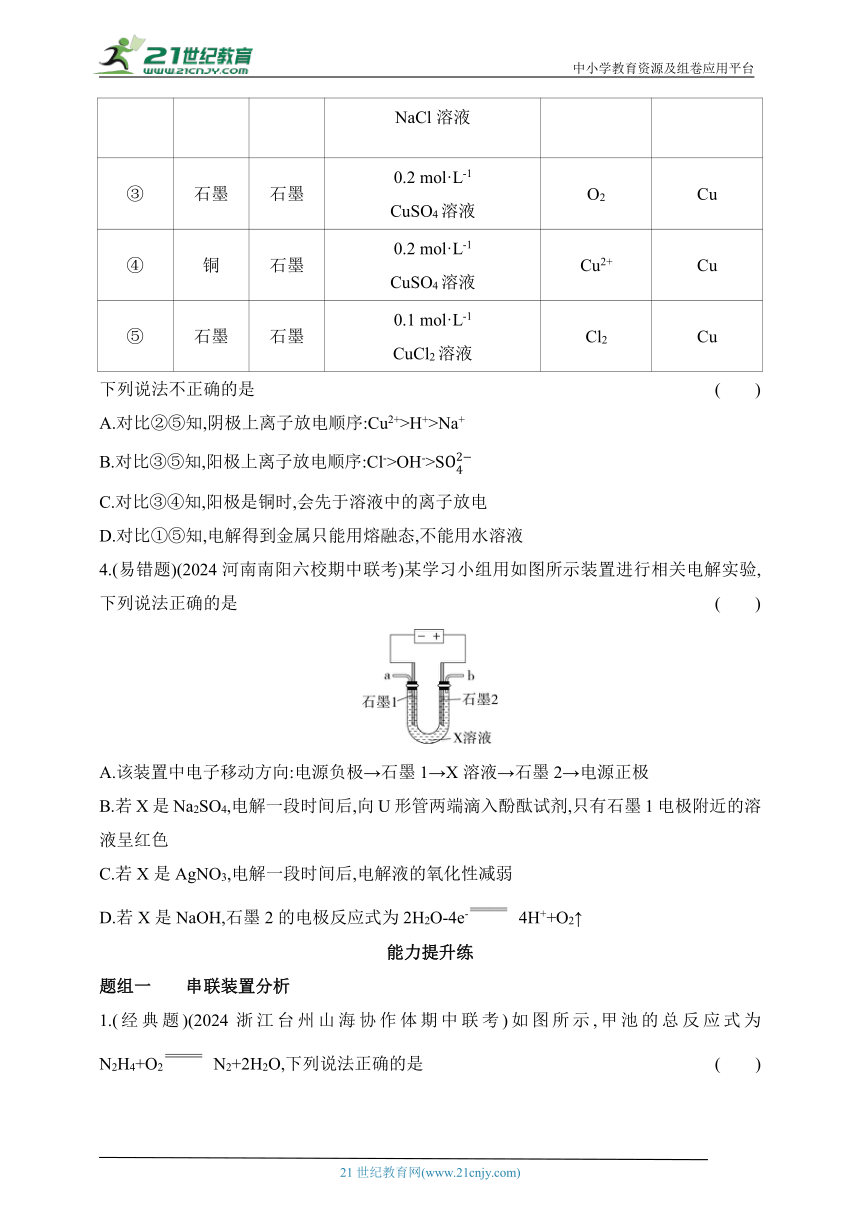
4.(易错题)(2024河南南阳六校期中联考)某学习小组用如图所示装置进行相关电解实验,下列说法正确的是 ( )
A.该装置中电子移动方向:电源负极→石墨1→X溶液→石墨2→电源正极
B.若X是Na2SO4,电解一段时间后,向U形管两端滴入酚酞试剂,只有石墨1电极附近的溶液呈红色
C.若X是AgNO3,电解一段时间后,电解液的氧化性减弱
D.若X是NaOH,石墨2的电极反应式为2H2O-4e- 4H++O2↑
能力提升练
题组一 串联装置分析
1.(经典题)(2024浙江台州山海协作体期中联考)如图所示,甲池的总反应式为N2H4+O2 N2+2H2O,下列说法正确的是 ( )
A.该装置工作时,乙池中石墨电极上有红色固体析出
B.甲池中负极反应为N2H4-4e- N2+4H+
C.甲池和乙池中溶液的pH均减小
D.当甲池中消耗0.1 mol N2H4时,乙池中理论上最多产生6.4 g固体
2.(2023重庆巴蜀中学期中)如图所示的电解装置,通电一段时间后,发现C端变为蓝色。下列说法正确的是 ( )
A.F为电源负极
B.甲池中铁电极反应:Fe-2e- Fe2+
C.电子流向:E→D→C→Fe
D.通电一段时间后,乙池中出现蓝色沉淀
题组二 与电解相关的计算
3.(2024吉林通化月考)在500 mL KNO3和Cu(NO3)2的混合溶液中,c(N)=0.8 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL。下列说法正确的是 ( )
A.上述电解过程中共转移0.2 mol电子
B.原混合溶液中c(K+)为0.4 mol/L
C.原溶液中Cu(NO3)2的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol/L
4.(2023湖北荆州期末)如图所示的装置中,若通直流电5 min时,铜电极质量增加21.6 g,试回答下列问题:
(1)若电源为碱性乙醇燃料电池,则电极X的电极反应式为 。
(2)pH变化:A ,B ,C 。(填“增大”“减小”或“不变”)
(3)若A中KCl足量且溶液的体积是200 mL,电解后,溶液中OH-的物质的量浓度为 mol·L-1(假设电解前后溶液的体积无变化)。
(4)通电5 min时,B中共收集到2 240 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为 (设电解前后溶液体积无变化);若要使B装置溶液恢复到电解前的状态,需要加入的物质以及相应的物质的量正确的是 。
A.0.05 mol CuO
B.0.05 mol CuO和0.025 mol H2O
C.0.05 mol Cu(OH)2
D.0.05 mol CuCO3和0.05 mol H2O
答案与分层梯度式解析
基础过关练
1.C 2.A 3.D 4.B
1.C Ag与盐酸不能自发反应,所以要使反应HCl+Ag AgCl+H2↑能进行,应该设计成电解池,Ag失电子发生氧化反应,Ag作阳极,氢离子得电子发生还原反应,电解质溶液中氢离子放电,则符合条件的是C。
2.A 通过图中离子的移动方向(破题关键)可判断连接a的为阴极,连接b的为阳极,故a端为直流电源的负极,b端为直流电源的正极,A项正确;CuCl2在水溶液中就能发生电离,而不是通电的结果,B项错误;阳极发生氧化反应,即2Cl--2e- Cl2↑,在阳极附近可观察到黄绿色气体,阴极发生还原反应,析出Cu,C、D项错误。
3.D 据②得H+的氧化性强于Na+,据⑤得Cu2+的氧化性强于H+,阴极上得电子能力强(氧化性强)的离子优先放电,所以对比②⑤可知,阴极上离子放电顺序是Cu2+>H+>Na+,A正确;据③得阳极上离子放电顺序是OH->S,据⑤知阳极上离子放电顺序是Cl->OH-,所以阳极上离子放电顺序是Cl->OH->S,B正确;电解池的阳极若是金属电极,则金属电极本身失电子,发生氧化反应,对比③④可知,阳极是铜时,会先于溶液中的离子放电,C正确;电解得到金属不一定只能用熔融态,电解氯化铜溶液可得到金属铜,D错误。
4.B 电子不能经过电解质溶液或熔融电解质(易错点),装置中电子移动方向:电源负极→阴极(石墨1),阳极(石墨2)→电源正极,A错误;若X是Na2SO4,则阴极(石墨1)上电极反应为4H2O+4e- 2H2↑+4OH-,阳极(石墨2)上电极反应为2H2O-4e- O2↑+4H+,电解一段时间后,向U形管两端滴入酚酞,只有石墨1电极附近的溶液呈红色,B正确;X是AgNO3,根据电解总反应4Ag++2H2O 4Ag↓+O2↑+4H+可知,电解一段时间后电解液由AgNO3溶液变为HNO3(具有强氧化性)和AgNO3的混合液,电解液的氧化性增强,C错误;若X是NaOH,石墨2为阳极,阳极上OH-放电,电极反应式为4OH--4e- 2H2O+O2↑,D错误。
能力提升练
1.C 2.D 3.B
1.C 题图中甲池为燃料电池,乙池为电解池;甲池中通氧气的一极为正极,石墨电极与正极相连,则石墨电极为阳极,阳极H2O中OH-放电生成O2,A错误;甲池中负极为通N2H4的一极,电解质溶液为KOH溶液,则电极反应为N2H4-4e-+4OH- N2+4H2O,B错误;甲池的总反应为N2H4+O2 N2+2H2O,反应生成水,使KOH溶液浓度降低,则pH减小,乙池的总反应为2CuSO4+2H2O 2H2SO4+2Cu+O2↑,生成H2SO4,溶液pH减小,C正确;当甲池中消耗0.1 mol N2H4时,转移电子0.4 mol,乙池中理论上最多产生0.2 mol Cu,质量为12.8 g,D错误。
2.D 通电一段时间后,发现C端变为蓝色,即C端电极反应为2I--2e- I2,C为阳极、D为阴极,则E为电源负极、F为电源正极,A错误;甲池中铁电极为阴极,电极反应为Ag++e- Ag,B错误;电子不能通过电解质溶液,不会沿D→C移动,C错误;乙池中铜极失电子形成Cu2+,石墨电极的电极反应式为2H2O+2e- H2↑+2OH-,故通电一段时间后,出现蓝色Cu(OH)2沉淀,D正确。
3.B 电解硝酸钾和硝酸铜混合溶液时,阳极上OH-放电生成O2,阴极上Cu2+先放电生成Cu,当Cu2+完全析出时,H+放电生成H2,通电一段时间后,两极气体的物质的量均为2.24 L÷22.4 L/mol=0.1 mol;每生成0.1 mol O2转移0.4 mol电子,每生成0.1 mol H2转移0.2 mol电子,每生成1 mol Cu转移2 mol电子,根据得失电子守恒得n(Cu2+)==0.1 mol,则原溶液中Cu(NO3)2的物质的量为0.1 mol,Cu2+的物质的量浓度为0.1 mol÷0.5 L=0.2 mol/L,根据电荷守恒得K+浓度为0.8 mol·L-1-0.2 mol·L-1×2=0.4 mol·L-1,当电解硝酸铜溶液时生成氢离子,电解硝酸钾溶液实质上是电解水,电解后H+的浓度==0.4 mol·L-1,故B正确。
反思升华 (1)首先看阳极材料,若为惰性电极,溶液中的阴离子被氧化;若为活性电极,则被氧化的是电极本身。(2)若溶液中的阴、阳离子有多种,要根据离子放电顺序判断什么离子先放电,什么离子后放电,最终确定电极产物。
4.答案 (1)C2H5OH+16OH--12e- 2C+11H2O
(2)增大 减小 不变
(3)1
(4)0.25 mol·L-1 CD
解析 C装置中铜电极质量增加21.6 g,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,所以铜为阴极,则X为负极,Y为正极。
(1)若电源为碱性乙醇燃料电池,X为负极,乙醇在负极上发生氧化反应,则电极X的电极反应式为C2H5OH+16OH--12e- 2C+11H2O。
(2)A装置是电解KCl溶液,阴极放出氢气,阳极放出氯气,溶液中氢氧根离子浓度增大,溶液pH增大;B装置是电解CuSO4和K2SO4的混合溶液,溶液中氢离子浓度增大,溶液pH减小;C装置是电解AgNO3溶液,Ag电极为阳极,Ag本身放电,阴极析出Ag单质,溶液pH不变,因此A、B、C三个装置中溶液pH分别增大、减小、不变。
(3)C装置中铜电极上生成21.6 g银单质,物质的量为0.2 mol,转移0.2 mol电子,A装置中总反应为2KCl+2H2O Cl2↑+H2↑+2KOH,根据得失电子守恒可知,转移0.2 mol电子时生成0.2 mol KOH,则n(OH-)=0.2 mol,溶液中OH-的物质的量浓度为=1 mol·L-1。
(4)通电5 min时,B中共收集到2 240 mL气体(标准状况),气体物质的量为0.1 mol,B装置中阳极上生成氧气,由(3)知转移电子的物质的量为0.2 mol,则生成氧气的物质的量为0.05 mol,阴极上得到氢气的物质的量为0.05 mol,再根据得失电子守恒,铜离子得到电子的物质的量是0.2 mol-0.05 mol×2=0.1 mol,则溶液中铜离子的物质的量为0.05 mol,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为=0.25 mol·L-1;电解过程中得到0.05 mol Cu、0.05 mol H2、0.05 mol O2,若要使B装置溶液恢复到电解前的状态,需要加入的物质以及相应的物质的量要与电解过程中从体系中析出的物质相当,加入0.05 mol Cu(OH)2相当于加入0.05 mol CuO和0.05 mol H2O,可使B装置溶液恢复到电解前的状态,C正确;加入0.05 mol CuCO3和0.05 mol H2O相当于加入0.05 mol CuO和0.05 mol H2O,可使B装置溶液恢复到电解前的状态,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修1
第四章 化学反应与电能
第二节 电解池
第1课时 电解原理
基础过关练
题组一 电解池的构成与工作原理
1.(经典题)(2024福建福州月考)某同学为了使反应HCl+Ag AgCl+H2↑能进行,设计了下列四个实验,如图所示,你认为可行的方案是 ( )
2.(2024山东实验中学开学考)用石墨电极电解CuCl2溶液(如图所示)。下列分析正确的是 ( )
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应为
Cu2++2e- Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
题组二 电解规律
3.(2023北京师范大学附中期中)为探究电解过程中离子的放电规律,某研究小组进行下列实验:
序号 阳极 材料 阴极 材料 熔融电解质或 电解质溶液 阳极氧 化产物 阴极还 原产物
① 石墨 石墨 熔融NaCl Cl2 Na
② 石墨 石墨 0.1 mol·L-1 NaCl溶液 Cl2 H2
③ 石墨 石墨 0.2 mol·L-1 CuSO4溶液 O2 Cu
④ 铜 石墨 0.2 mol·L-1 CuSO4溶液 Cu2+ Cu
⑤ 石墨 石墨 0.1 mol·L-1 CuCl2溶液 Cl2 Cu
下列说法不正确的是 ( )
A.对比②⑤知,阴极上离子放电顺序:Cu2+>H+>Na+
B.对比③⑤知,阳极上离子放电顺序:Cl->OH->S
C.对比③④知,阳极是铜时,会先于溶液中的离子放电
D.对比①⑤知,电解得到金属只能用熔融态,不能用水溶液
4.(易错题)(2024河南南阳六校期中联考)某学习小组用如图所示装置进行相关电解实验,下列说法正确的是 ( )
A.该装置中电子移动方向:电源负极→石墨1→X溶液→石墨2→电源正极
B.若X是Na2SO4,电解一段时间后,向U形管两端滴入酚酞试剂,只有石墨1电极附近的溶液呈红色
C.若X是AgNO3,电解一段时间后,电解液的氧化性减弱
D.若X是NaOH,石墨2的电极反应式为2H2O-4e- 4H++O2↑
能力提升练
题组一 串联装置分析
1.(经典题)(2024浙江台州山海协作体期中联考)如图所示,甲池的总反应式为N2H4+O2 N2+2H2O,下列说法正确的是 ( )
A.该装置工作时,乙池中石墨电极上有红色固体析出
B.甲池中负极反应为N2H4-4e- N2+4H+
C.甲池和乙池中溶液的pH均减小
D.当甲池中消耗0.1 mol N2H4时,乙池中理论上最多产生6.4 g固体
2.(2023重庆巴蜀中学期中)如图所示的电解装置,通电一段时间后,发现C端变为蓝色。下列说法正确的是 ( )
A.F为电源负极
B.甲池中铁电极反应:Fe-2e- Fe2+
C.电子流向:E→D→C→Fe
D.通电一段时间后,乙池中出现蓝色沉淀
题组二 与电解相关的计算
3.(2024吉林通化月考)在500 mL KNO3和Cu(NO3)2的混合溶液中,c(N)=0.8 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL。下列说法正确的是 ( )
A.上述电解过程中共转移0.2 mol电子
B.原混合溶液中c(K+)为0.4 mol/L
C.原溶液中Cu(NO3)2的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol/L
4.(2023湖北荆州期末)如图所示的装置中,若通直流电5 min时,铜电极质量增加21.6 g,试回答下列问题:
(1)若电源为碱性乙醇燃料电池,则电极X的电极反应式为 。
(2)pH变化:A ,B ,C 。(填“增大”“减小”或“不变”)
(3)若A中KCl足量且溶液的体积是200 mL,电解后,溶液中OH-的物质的量浓度为 mol·L-1(假设电解前后溶液的体积无变化)。
(4)通电5 min时,B中共收集到2 240 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为 (设电解前后溶液体积无变化);若要使B装置溶液恢复到电解前的状态,需要加入的物质以及相应的物质的量正确的是 。
A.0.05 mol CuO
B.0.05 mol CuO和0.025 mol H2O
C.0.05 mol Cu(OH)2
D.0.05 mol CuCO3和0.05 mol H2O
答案与分层梯度式解析
基础过关练
1.C 2.A 3.D 4.B
1.C Ag与盐酸不能自发反应,所以要使反应HCl+Ag AgCl+H2↑能进行,应该设计成电解池,Ag失电子发生氧化反应,Ag作阳极,氢离子得电子发生还原反应,电解质溶液中氢离子放电,则符合条件的是C。
2.A 通过图中离子的移动方向(破题关键)可判断连接a的为阴极,连接b的为阳极,故a端为直流电源的负极,b端为直流电源的正极,A项正确;CuCl2在水溶液中就能发生电离,而不是通电的结果,B项错误;阳极发生氧化反应,即2Cl--2e- Cl2↑,在阳极附近可观察到黄绿色气体,阴极发生还原反应,析出Cu,C、D项错误。
3.D 据②得H+的氧化性强于Na+,据⑤得Cu2+的氧化性强于H+,阴极上得电子能力强(氧化性强)的离子优先放电,所以对比②⑤可知,阴极上离子放电顺序是Cu2+>H+>Na+,A正确;据③得阳极上离子放电顺序是OH->S,据⑤知阳极上离子放电顺序是Cl->OH-,所以阳极上离子放电顺序是Cl->OH->S,B正确;电解池的阳极若是金属电极,则金属电极本身失电子,发生氧化反应,对比③④可知,阳极是铜时,会先于溶液中的离子放电,C正确;电解得到金属不一定只能用熔融态,电解氯化铜溶液可得到金属铜,D错误。
4.B 电子不能经过电解质溶液或熔融电解质(易错点),装置中电子移动方向:电源负极→阴极(石墨1),阳极(石墨2)→电源正极,A错误;若X是Na2SO4,则阴极(石墨1)上电极反应为4H2O+4e- 2H2↑+4OH-,阳极(石墨2)上电极反应为2H2O-4e- O2↑+4H+,电解一段时间后,向U形管两端滴入酚酞,只有石墨1电极附近的溶液呈红色,B正确;X是AgNO3,根据电解总反应4Ag++2H2O 4Ag↓+O2↑+4H+可知,电解一段时间后电解液由AgNO3溶液变为HNO3(具有强氧化性)和AgNO3的混合液,电解液的氧化性增强,C错误;若X是NaOH,石墨2为阳极,阳极上OH-放电,电极反应式为4OH--4e- 2H2O+O2↑,D错误。
能力提升练
1.C 2.D 3.B
1.C 题图中甲池为燃料电池,乙池为电解池;甲池中通氧气的一极为正极,石墨电极与正极相连,则石墨电极为阳极,阳极H2O中OH-放电生成O2,A错误;甲池中负极为通N2H4的一极,电解质溶液为KOH溶液,则电极反应为N2H4-4e-+4OH- N2+4H2O,B错误;甲池的总反应为N2H4+O2 N2+2H2O,反应生成水,使KOH溶液浓度降低,则pH减小,乙池的总反应为2CuSO4+2H2O 2H2SO4+2Cu+O2↑,生成H2SO4,溶液pH减小,C正确;当甲池中消耗0.1 mol N2H4时,转移电子0.4 mol,乙池中理论上最多产生0.2 mol Cu,质量为12.8 g,D错误。
2.D 通电一段时间后,发现C端变为蓝色,即C端电极反应为2I--2e- I2,C为阳极、D为阴极,则E为电源负极、F为电源正极,A错误;甲池中铁电极为阴极,电极反应为Ag++e- Ag,B错误;电子不能通过电解质溶液,不会沿D→C移动,C错误;乙池中铜极失电子形成Cu2+,石墨电极的电极反应式为2H2O+2e- H2↑+2OH-,故通电一段时间后,出现蓝色Cu(OH)2沉淀,D正确。
3.B 电解硝酸钾和硝酸铜混合溶液时,阳极上OH-放电生成O2,阴极上Cu2+先放电生成Cu,当Cu2+完全析出时,H+放电生成H2,通电一段时间后,两极气体的物质的量均为2.24 L÷22.4 L/mol=0.1 mol;每生成0.1 mol O2转移0.4 mol电子,每生成0.1 mol H2转移0.2 mol电子,每生成1 mol Cu转移2 mol电子,根据得失电子守恒得n(Cu2+)==0.1 mol,则原溶液中Cu(NO3)2的物质的量为0.1 mol,Cu2+的物质的量浓度为0.1 mol÷0.5 L=0.2 mol/L,根据电荷守恒得K+浓度为0.8 mol·L-1-0.2 mol·L-1×2=0.4 mol·L-1,当电解硝酸铜溶液时生成氢离子,电解硝酸钾溶液实质上是电解水,电解后H+的浓度==0.4 mol·L-1,故B正确。
反思升华 (1)首先看阳极材料,若为惰性电极,溶液中的阴离子被氧化;若为活性电极,则被氧化的是电极本身。(2)若溶液中的阴、阳离子有多种,要根据离子放电顺序判断什么离子先放电,什么离子后放电,最终确定电极产物。
4.答案 (1)C2H5OH+16OH--12e- 2C+11H2O
(2)增大 减小 不变
(3)1
(4)0.25 mol·L-1 CD
解析 C装置中铜电极质量增加21.6 g,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,所以铜为阴极,则X为负极,Y为正极。
(1)若电源为碱性乙醇燃料电池,X为负极,乙醇在负极上发生氧化反应,则电极X的电极反应式为C2H5OH+16OH--12e- 2C+11H2O。
(2)A装置是电解KCl溶液,阴极放出氢气,阳极放出氯气,溶液中氢氧根离子浓度增大,溶液pH增大;B装置是电解CuSO4和K2SO4的混合溶液,溶液中氢离子浓度增大,溶液pH减小;C装置是电解AgNO3溶液,Ag电极为阳极,Ag本身放电,阴极析出Ag单质,溶液pH不变,因此A、B、C三个装置中溶液pH分别增大、减小、不变。
(3)C装置中铜电极上生成21.6 g银单质,物质的量为0.2 mol,转移0.2 mol电子,A装置中总反应为2KCl+2H2O Cl2↑+H2↑+2KOH,根据得失电子守恒可知,转移0.2 mol电子时生成0.2 mol KOH,则n(OH-)=0.2 mol,溶液中OH-的物质的量浓度为=1 mol·L-1。
(4)通电5 min时,B中共收集到2 240 mL气体(标准状况),气体物质的量为0.1 mol,B装置中阳极上生成氧气,由(3)知转移电子的物质的量为0.2 mol,则生成氧气的物质的量为0.05 mol,阴极上得到氢气的物质的量为0.05 mol,再根据得失电子守恒,铜离子得到电子的物质的量是0.2 mol-0.05 mol×2=0.1 mol,则溶液中铜离子的物质的量为0.05 mol,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为=0.25 mol·L-1;电解过程中得到0.05 mol Cu、0.05 mol H2、0.05 mol O2,若要使B装置溶液恢复到电解前的状态,需要加入的物质以及相应的物质的量要与电解过程中从体系中析出的物质相当,加入0.05 mol Cu(OH)2相当于加入0.05 mol CuO和0.05 mol H2O,可使B装置溶液恢复到电解前的状态,C正确;加入0.05 mol CuCO3和0.05 mol H2O相当于加入0.05 mol CuO和0.05 mol H2O,可使B装置溶液恢复到电解前的状态,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
