2025人教版高中化学选择性必修1同步练习题--第2课时 电解原理的应用(含解析)
文档属性
| 名称 | 2025人教版高中化学选择性必修1同步练习题--第2课时 电解原理的应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 832.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-05 08:49:45 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025人教版高中化学选择性必修1
第四章 化学反应与电能
第二节 电解池
第2课时 电解原理的应用
基础过关练
题组一 氯碱工业
1.(2024重庆第七中学月考)氯碱工业能耗大,通过如图改进的设计可大幅降低能耗,下列说法不正确的是 ( )
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为2H2O+2e- H2↑+2OH-
C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
2.(2023福建南平建阳二中月考)回答下列问题:
(1)请用下图所示仪器设计一个电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
①所选仪器在连接时,各接口的顺序是(填各接口的字母):A→ ,F→ ;B→ ,E→ 。
②实验时,装置中的石墨电极接电源的 极,电极反应式为 ;铁电极接电源的 极,电极反应式为 ;此电解过程的总化学方程式为 。
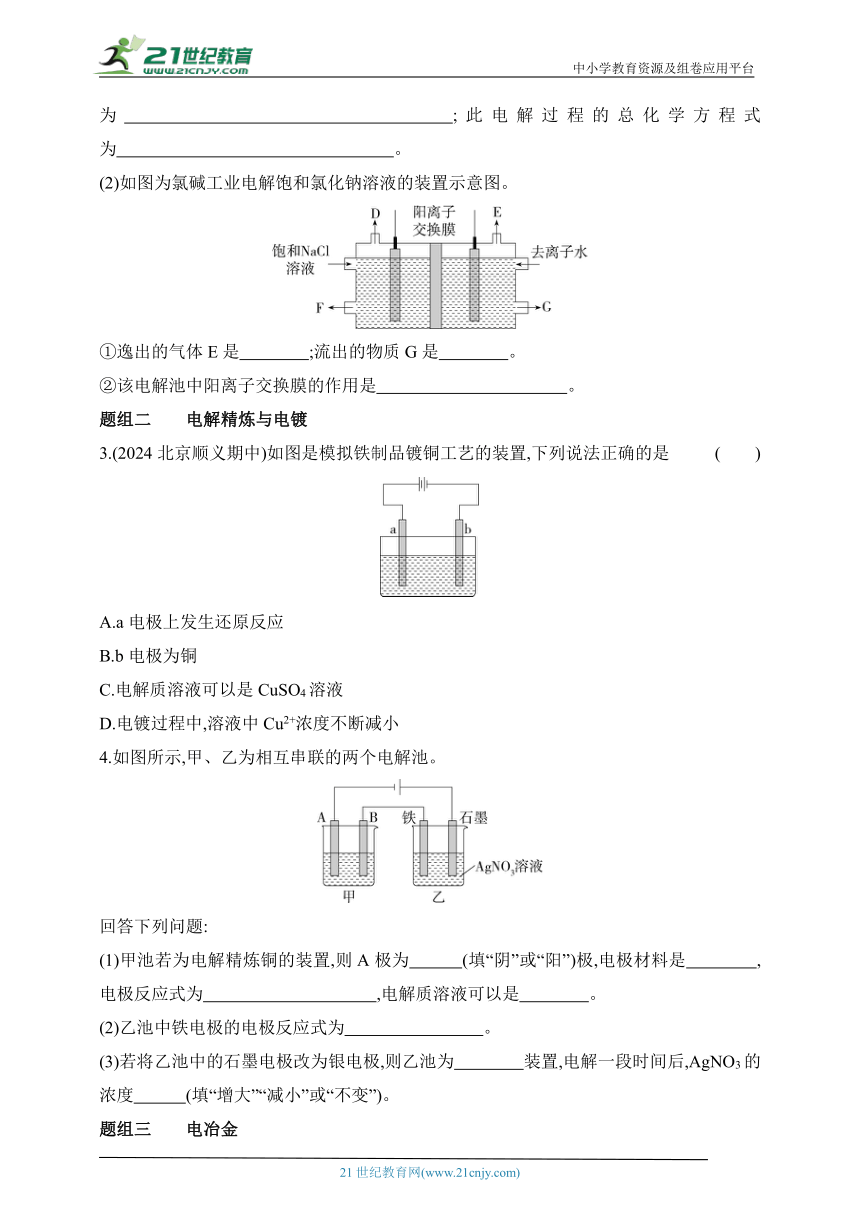
(2)如图为氯碱工业电解饱和氯化钠溶液的装置示意图。
①逸出的气体E是 ;流出的物质G是 。
②该电解池中阳离子交换膜的作用是 。
题组二 电解精炼与电镀
3.(2024北京顺义期中)如图是模拟铁制品镀铜工艺的装置,下列说法正确的是 ( )
A.a电极上发生还原反应
B.b电极为铜
C.电解质溶液可以是CuSO4溶液
D.电镀过程中,溶液中Cu2+浓度不断减小
4.如图所示,甲、乙为相互串联的两个电解池。
回答下列问题:
(1)甲池若为电解精炼铜的装置,则A极为 (填“阴”或“阳”)极,电极材料是 ,电极反应式为 ,电解质溶液可以是 。
(2)乙池中铁电极的电极反应式为 。
(3)若将乙池中的石墨电极改为银电极,则乙池为 装置,电解一段时间后,AgNO3的浓度 (填“增大”“减小”或“不变”)。
题组三 电冶金
5.(2024安徽安庆第一中学月考)用石墨作阳极,钛网作阴极,熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原TiO2制备金属Ti。下列叙述正确的是 ( )
A.该电池工作过程中,O2-向阴极移动
B.将熔融CaF2-CaO换成Ca(NO3)2溶液也可以达到相同目的
C.TiO2在阴极放电
D.制备金属钛前后CaO的量不变
6.(2024河南南阳统考)工业上采用电解的方法来制备活泼金属铝。纯净的氧化铝熔点很高(约为2 045 ℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)的方法,使Al2O3在1 000 ℃左右就可与冰晶石形成熔融体。以下说法正确的是 ( )
A.电解过程中阳极反应式为Al3++3e- Al
B.电解过程中每产生6.4 g O2,反应所转移电子的物质的量为0.6 mol
C.若生产9 g铝时,阳极损失3.6 g石墨,则石墨被氧化为CO、CO2的物质的量之比为1∶2
D.加入冰晶石Na3AlF6目的是增强电解质的导电性
7.(经典题)(2024河北保定六校联考)某研究性学习小组用如图所示装置进行实验,探究原电池、电解池和电解制备钴的工作原理。一段时间后装置甲的两极均有气体产生,且X极处溶液逐渐变成紫红色;停止实验,观察到铁电极明显变细,电解液仍然澄清。
查阅资料:高铁酸根离子(Fe)在溶液中呈紫红色。
请根据实验现象及所查资料,回答下列问题:
(1)上述装置中,发生还原反应的电极有 (填字母)。
A.X(Fe) B.Y(C) C.Co D.Zn
(2)丙池中的S (填“从左向右”“从右向左”或“不”)移动。
(3)反应过程中,X极处发生的电极反应为4OH--4e- 2H2O+O2↑和 。
(4)一段时间后,若X极质量减小1.12 g,Y电极收集到2.24 L气体(标准状况下),则在标准状况下X极收集到气体为 mL。
(5)乙池是电解制备金属钴的装置,理论上Ⅰ室中n(H+) (填“变大”“变小”或“不变”),该电解池总反应的化学方程式是 。
能力提升练
题组一 利用电解原理制备物质
1.(2024山东滨州期中)一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法错误的是 ( )
A.第一步中阳极的电极反应式为Na0.44MnO2-xe- Na0.44-xMnO2+xNa+
B.与传统氯碱工艺相比,该方法不需要使用离子交换膜
C.第二步中正极质量每增加4.6 g,负极质量减少21.6 g
D.理论上每消耗0.1 mol O2,产生4.48 L Cl2(标准状况下)
2.(教材深研拓展)2,5-呋喃二甲酸(FDCA)是一种重要的化工原料,可用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是 ( )
A.a为电源正极
B.双极膜中间层中H2O解离的OH-在外电场的作用下移向铅电极
C.制得1 mol FDCA,理论上消耗2 mol
D.阴极区的电极反应为-6e-+2H2O+6H+
题组二 利用电解原理减少污染
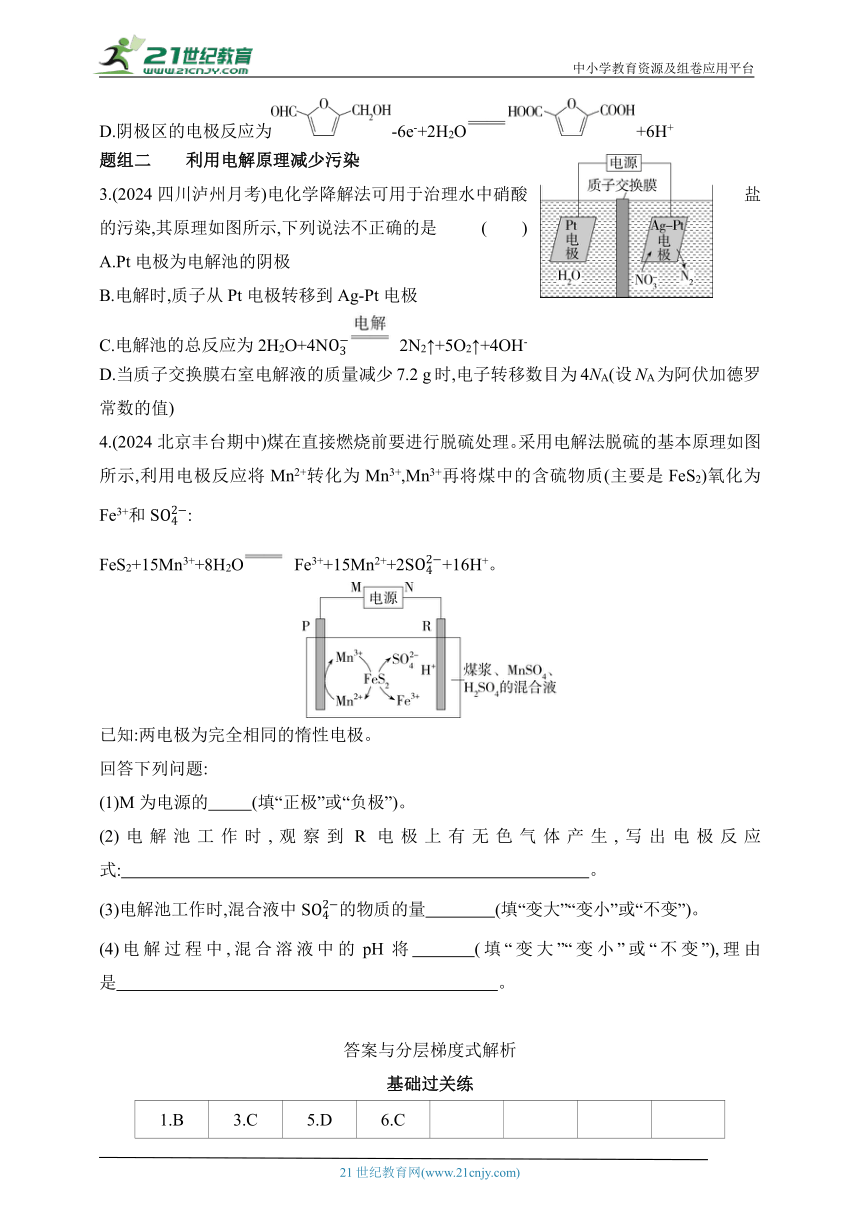
3.(2024四川泸州月考)电化学降解法可用于治理水中硝酸盐的污染,其原理如图所示,下列说法不正确的是 ( )
A.Pt电极为电解池的阴极
B.电解时,质子从Pt电极转移到Ag-Pt电极
C.电解池的总反应为2H2O+4N 2N2↑+5O2↑+4OH-
D.当质子交换膜右室电解液的质量减少7.2 g时,电子转移数目为4NA(设NA为阿伏加德罗常数的值)
4.(2024北京丰台期中)煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示,利用电极反应将Mn2+转化为Mn3+,Mn3+再将煤中的含硫物质(主要是FeS2)氧化为Fe3+和S:
FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+。
已知:两电极为完全相同的惰性电极。
回答下列问题:
(1)M为电源的 (填“正极”或“负极”)。
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式: 。
(3)电解池工作时,混合液中S的物质的量 (填“变大”“变小”或“不变”)。
(4)电解过程中,混合溶液中的pH将 (填“变大”“变小”或“不变”),理由是 。
答案与分层梯度式解析
基础过关练
1.B 3.C 5.D 6.C
1.B 电极A上是氯离子变为氯气,氯元素化合价升高,电极A是电解池的阳极,因此电极A接电源正极,发生氧化反应,A正确;电极B为阴极,通入氧气,氧气得电子,其电极反应式为O2+2H2O+4e- 4OH-,B错误;溶液呈电中性,阳极区的Na+通过阳离子交换膜进入阴极区,在右室获得浓度较高的NaOH溶液,C正确;氧气的氧化性比水电离出的H+的氧化性强,在阴极较容易得电子,可降低电解电压,减少能耗,D正确。
2.答案 (1)①G H D C ②正 2Cl--2e- Cl2↑ 负 2H++2e- H2↑ 2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(2)①H2 NaOH溶液 ②避免阳极产物Cl2与阴极产物H2、NaOH发生反应
解析 (1)①所选用的各仪器接口顺序为A接G,F接H,用量筒测量排出的水量,以测定产生氢气的体积;B接D,E接C,生成的Cl2在洗气瓶里氧化KI,以证明其氧化性,剩余的Cl2通入烧杯中,借助NaOH溶液吸收,防止污染大气。②根据电解饱和食盐水阳极所发生的反应:2Cl--2e- Cl2↑,为防止电极被腐蚀,实验中一般选用石墨作阳极,故石墨电极接电源的正极;阴极是水电离出的H+被还原:2H++2e- H2↑,阴极通常使用铁电极,电解的总化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
3.C 题图装置为模拟铁制品镀铜工艺的装置,与直流电源正极相连的a电极为铜,与负极相连的b电极为铁制品,电解质溶液为可溶性铜盐溶液,电镀过程中,溶液中铜离子浓度不变。
4.答案 (1)阴 纯铜 Cu2++2e- Cu CuSO4溶液(答案合理即可) (2)Ag++e- Ag (3)电镀 不变
解析 (1)由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A为纯铜,电极反应式为Cu2++2e- Cu;电解质溶液应为含有Cu2+的可溶性盐溶液,如CuSO4溶液。(2)由题图可知,乙池中铁作阴极,石墨作阳极,故铁电极的电极反应式为Ag++e- Ag。(3)若将乙池中的石墨电极改为银电极,则乙池为电镀装置,且电镀过程中AgNO3的浓度不变。
5.D 由题图可知,石墨为阳极,电极反应式为C+2-4e- CO2↑,O2-向阳极移动,钛网作阴极,电极反应式为2Ca2++4e- 2Ca,然后发生反应2Ca+TiO2 Ti+2CaO,则制备金属钛前后CaO的总量不变,A、C错误,D正确;将熔融CaF2-CaO换成Ca(NO3)2溶液,阴极上H+放电(易错点),无法得到金属Ca,B错误。
6.C 在电解池中,阳极发生氧化反应,电极反应式为2O2--4e- O2↑,A错误;6.4 g O2的物质的量为=0.2 mol,转移0.8 mol电子,B错误;9 g铝的物质的量为= mol,阴极反应式为Al3++3e- Al,则生产9 g铝转移电子1 mol,设生成CO、CO2的物质的量分别为x、y,3.6 g石墨的物质的量为=0.3 mol,根据原子守恒得x+y=0.3 mol,根据得失电子守恒得2x+4y=1 mol,解得x=0.1 mol,y=0.2 mol,即石墨被氧化为CO、CO2的物质的量之比为1∶2,C正确;加入冰晶石(Na3AlF6)的主要目的是降低氧化铝的熔点,D错误。
7.答案 (1)BC (2)从右向左 (3)Fe-6e-+8OH- Fe+4H2O (4)448 (5)不变 2CoCl2+2H2O 2Co+O2↑+4HCl
解析 结合题图,首先确定丙池为原电池。
(2)在原电池中,阴离子向负极移动,S会向Zn电极方向移动,即从右向左移动。
(3)X极为阳极,发生氧化反应,由“铁电极明显变细”“X极处溶液逐渐变成紫红色”可知,Fe参与电极反应,有Fe生成,电极反应为Fe-6e-+8OH- Fe+4H2O。
(4)根据题意可知,消耗的n(Fe)==0.02 mol,n(H2)==0.1 mol,在整个电路中电子转移数目相等,4n(O2)+6n(Fe)=2n(H2),即4n(O2)+6×0.02 mol=2×0.1 mol,解得n(O2)=0.02 mol,标准状况下V(O2)=0.02 mol×22.4 L/mol=0.448 L=448 mL。
(5)乙池中石墨为阳极,阳极的电极反应式为2H2O-4e- 4H++O2↑,氢离子经过阳离子交换膜由Ⅰ室进入Ⅱ室,所以理论上Ⅰ室中n(H+)不变;该电解池的阳极反应式为2H2O-4e- 4H++O2↑,阴极反应式为Co2++2e- Co,则总反应为2CoCl2+2H2O 2Co+O2↑+4HCl。
能力提升练
1.C 2.C 3.A
1.C 第一步中阳极发生氧化反应,其电极反应式为Na0.44MnO2-xe- Na0.44-xMnO2+xNa+,A正确;该方法不需要使用离子交换膜,传统氯碱工艺需要,B正确;第二步为原电池,根据题图中的物质转化可知,Na0.44-xMnO2为正极,正极发生还原反应,正极的电极反应式为Na0.44-xMnO2+xNa++xe- Na0.44MnO2,Ag为负极,负极发生氧化反应,负极的电极反应式为Ag+Cl--e- AgCl↓,负极质量增加,C错误;第一步阴极消耗氧气,电极反应式为O2+4e-+2H2O 4OH-,理论上每消耗0.1 mol O2转移0.4 mol e-,第三步产生Cl2,其阳极的电极反应式为2Cl--2e- Cl2↑,转移0.4 mol e-生成氯气的物质的量为0.2 mol,即标准状况下产生4.48 L Cl2,D正确。
2.C 铅电极附近醛基被还原为羟基,发生还原反应,为阴极,因此a为电源的负极,A项错误;双极膜中间层中H2O解离的OH-在外电场的作用下移向阳极(催化电极),B项错误;制得1 mol FDCA,阳极消耗1 mol ,阴极也消耗1 mol ,共消耗2 mol ,C项正确;电解池中与电源负极相连的为阴极,阴极发生得电子的还原反应,D项错误。
教材溯源
电有机合成
许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。与其他有机合成相比,电有机合成的优点是反应条件温和、反应试剂纯净和生产效率高等。
3.A Ag-Pt电极上N被还原为N2,则Ag-Pt电极为阴极,Pt电极为阳极,A错误;电解时,阳离子从阳极移向阴极,所以质子从Pt电极转移到Ag-Pt电极,B正确;电解池的总反应为2H2O+4N 2N2↑+5O2↑+4OH-,C正确;每生成2 mol N2(质量为56 g)转移20 mol电子,同时有20 mol H+(质量为20 g)进入阴极室,即右室电解液质量减少56 g-20 g=36 g,右室电解液的质量减少7.2 g时,转移电子的物质的量为 mol=4 mol,数目为4NA,D正确。
4.答案 (1)正极 (2)2H++2e- H2↑ (3)变大 (4)变小 根据反应FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+可知,生成1 mol Fe3+时,消耗15 mol Mn3+,生成16 mol H+,Mn3+由阳极电极反应Mn2+-e- Mn3+生成,根据得失电子守恒,阳极生成15 mol Mn3+时阴极消耗15 mol H+,因此总体来看,电解过程中H+浓度增大,混合溶液pH变小
解析 (1)根据题图可知,电解时P电极上Mn2+失去电子变为Mn3+,则P电极为阳极,与P相连的M为电源正极。
(2)R为电解池的阴极,阴极发生得电子的还原反应,电极反应式为2H++2e- H2↑。
(3)根据反应FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+可知,电解过程中S的物质的量不断增大。
题型解读 电解原理及应用是高频考点,该类试题往往与生产、生活及新科技等相联系,常以流程图为载体呈现,一般主要考查阴、阳极的判断、电极反应式的书写、溶液离子浓度变化及相关计算等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025人教版高中化学选择性必修1
第四章 化学反应与电能
第二节 电解池
第2课时 电解原理的应用
基础过关练
题组一 氯碱工业
1.(2024重庆第七中学月考)氯碱工业能耗大,通过如图改进的设计可大幅降低能耗,下列说法不正确的是 ( )
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为2H2O+2e- H2↑+2OH-
C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
2.(2023福建南平建阳二中月考)回答下列问题:
(1)请用下图所示仪器设计一个电解饱和食盐水并测定电解时产生的氢气的体积和检验氯气的氧化性的实验装置。
①所选仪器在连接时,各接口的顺序是(填各接口的字母):A→ ,F→ ;B→ ,E→ 。
②实验时,装置中的石墨电极接电源的 极,电极反应式为 ;铁电极接电源的 极,电极反应式为 ;此电解过程的总化学方程式为 。
(2)如图为氯碱工业电解饱和氯化钠溶液的装置示意图。
①逸出的气体E是 ;流出的物质G是 。
②该电解池中阳离子交换膜的作用是 。
题组二 电解精炼与电镀
3.(2024北京顺义期中)如图是模拟铁制品镀铜工艺的装置,下列说法正确的是 ( )
A.a电极上发生还原反应
B.b电极为铜
C.电解质溶液可以是CuSO4溶液
D.电镀过程中,溶液中Cu2+浓度不断减小
4.如图所示,甲、乙为相互串联的两个电解池。
回答下列问题:
(1)甲池若为电解精炼铜的装置,则A极为 (填“阴”或“阳”)极,电极材料是 ,电极反应式为 ,电解质溶液可以是 。
(2)乙池中铁电极的电极反应式为 。
(3)若将乙池中的石墨电极改为银电极,则乙池为 装置,电解一段时间后,AgNO3的浓度 (填“增大”“减小”或“不变”)。
题组三 电冶金
5.(2024安徽安庆第一中学月考)用石墨作阳极,钛网作阴极,熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原TiO2制备金属Ti。下列叙述正确的是 ( )
A.该电池工作过程中,O2-向阴极移动
B.将熔融CaF2-CaO换成Ca(NO3)2溶液也可以达到相同目的
C.TiO2在阴极放电
D.制备金属钛前后CaO的量不变
6.(2024河南南阳统考)工业上采用电解的方法来制备活泼金属铝。纯净的氧化铝熔点很高(约为2 045 ℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)的方法,使Al2O3在1 000 ℃左右就可与冰晶石形成熔融体。以下说法正确的是 ( )
A.电解过程中阳极反应式为Al3++3e- Al
B.电解过程中每产生6.4 g O2,反应所转移电子的物质的量为0.6 mol
C.若生产9 g铝时,阳极损失3.6 g石墨,则石墨被氧化为CO、CO2的物质的量之比为1∶2
D.加入冰晶石Na3AlF6目的是增强电解质的导电性
7.(经典题)(2024河北保定六校联考)某研究性学习小组用如图所示装置进行实验,探究原电池、电解池和电解制备钴的工作原理。一段时间后装置甲的两极均有气体产生,且X极处溶液逐渐变成紫红色;停止实验,观察到铁电极明显变细,电解液仍然澄清。
查阅资料:高铁酸根离子(Fe)在溶液中呈紫红色。
请根据实验现象及所查资料,回答下列问题:
(1)上述装置中,发生还原反应的电极有 (填字母)。
A.X(Fe) B.Y(C) C.Co D.Zn
(2)丙池中的S (填“从左向右”“从右向左”或“不”)移动。
(3)反应过程中,X极处发生的电极反应为4OH--4e- 2H2O+O2↑和 。
(4)一段时间后,若X极质量减小1.12 g,Y电极收集到2.24 L气体(标准状况下),则在标准状况下X极收集到气体为 mL。
(5)乙池是电解制备金属钴的装置,理论上Ⅰ室中n(H+) (填“变大”“变小”或“不变”),该电解池总反应的化学方程式是 。
能力提升练
题组一 利用电解原理制备物质
1.(2024山东滨州期中)一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法错误的是 ( )
A.第一步中阳极的电极反应式为Na0.44MnO2-xe- Na0.44-xMnO2+xNa+
B.与传统氯碱工艺相比,该方法不需要使用离子交换膜
C.第二步中正极质量每增加4.6 g,负极质量减少21.6 g
D.理论上每消耗0.1 mol O2,产生4.48 L Cl2(标准状况下)
2.(教材深研拓展)2,5-呋喃二甲酸(FDCA)是一种重要的化工原料,可用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是 ( )
A.a为电源正极
B.双极膜中间层中H2O解离的OH-在外电场的作用下移向铅电极
C.制得1 mol FDCA,理论上消耗2 mol
D.阴极区的电极反应为-6e-+2H2O+6H+
题组二 利用电解原理减少污染
3.(2024四川泸州月考)电化学降解法可用于治理水中硝酸盐的污染,其原理如图所示,下列说法不正确的是 ( )
A.Pt电极为电解池的阴极
B.电解时,质子从Pt电极转移到Ag-Pt电极
C.电解池的总反应为2H2O+4N 2N2↑+5O2↑+4OH-
D.当质子交换膜右室电解液的质量减少7.2 g时,电子转移数目为4NA(设NA为阿伏加德罗常数的值)
4.(2024北京丰台期中)煤在直接燃烧前要进行脱硫处理。采用电解法脱硫的基本原理如图所示,利用电极反应将Mn2+转化为Mn3+,Mn3+再将煤中的含硫物质(主要是FeS2)氧化为Fe3+和S:
FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+。
已知:两电极为完全相同的惰性电极。
回答下列问题:
(1)M为电源的 (填“正极”或“负极”)。
(2)电解池工作时,观察到R电极上有无色气体产生,写出电极反应式: 。
(3)电解池工作时,混合液中S的物质的量 (填“变大”“变小”或“不变”)。
(4)电解过程中,混合溶液中的pH将 (填“变大”“变小”或“不变”),理由是 。
答案与分层梯度式解析
基础过关练
1.B 3.C 5.D 6.C
1.B 电极A上是氯离子变为氯气,氯元素化合价升高,电极A是电解池的阳极,因此电极A接电源正极,发生氧化反应,A正确;电极B为阴极,通入氧气,氧气得电子,其电极反应式为O2+2H2O+4e- 4OH-,B错误;溶液呈电中性,阳极区的Na+通过阳离子交换膜进入阴极区,在右室获得浓度较高的NaOH溶液,C正确;氧气的氧化性比水电离出的H+的氧化性强,在阴极较容易得电子,可降低电解电压,减少能耗,D正确。
2.答案 (1)①G H D C ②正 2Cl--2e- Cl2↑ 负 2H++2e- H2↑ 2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(2)①H2 NaOH溶液 ②避免阳极产物Cl2与阴极产物H2、NaOH发生反应
解析 (1)①所选用的各仪器接口顺序为A接G,F接H,用量筒测量排出的水量,以测定产生氢气的体积;B接D,E接C,生成的Cl2在洗气瓶里氧化KI,以证明其氧化性,剩余的Cl2通入烧杯中,借助NaOH溶液吸收,防止污染大气。②根据电解饱和食盐水阳极所发生的反应:2Cl--2e- Cl2↑,为防止电极被腐蚀,实验中一般选用石墨作阳极,故石墨电极接电源的正极;阴极是水电离出的H+被还原:2H++2e- H2↑,阴极通常使用铁电极,电解的总化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
3.C 题图装置为模拟铁制品镀铜工艺的装置,与直流电源正极相连的a电极为铜,与负极相连的b电极为铁制品,电解质溶液为可溶性铜盐溶液,电镀过程中,溶液中铜离子浓度不变。
4.答案 (1)阴 纯铜 Cu2++2e- Cu CuSO4溶液(答案合理即可) (2)Ag++e- Ag (3)电镀 不变
解析 (1)由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A为纯铜,电极反应式为Cu2++2e- Cu;电解质溶液应为含有Cu2+的可溶性盐溶液,如CuSO4溶液。(2)由题图可知,乙池中铁作阴极,石墨作阳极,故铁电极的电极反应式为Ag++e- Ag。(3)若将乙池中的石墨电极改为银电极,则乙池为电镀装置,且电镀过程中AgNO3的浓度不变。
5.D 由题图可知,石墨为阳极,电极反应式为C+2-4e- CO2↑,O2-向阳极移动,钛网作阴极,电极反应式为2Ca2++4e- 2Ca,然后发生反应2Ca+TiO2 Ti+2CaO,则制备金属钛前后CaO的总量不变,A、C错误,D正确;将熔融CaF2-CaO换成Ca(NO3)2溶液,阴极上H+放电(易错点),无法得到金属Ca,B错误。
6.C 在电解池中,阳极发生氧化反应,电极反应式为2O2--4e- O2↑,A错误;6.4 g O2的物质的量为=0.2 mol,转移0.8 mol电子,B错误;9 g铝的物质的量为= mol,阴极反应式为Al3++3e- Al,则生产9 g铝转移电子1 mol,设生成CO、CO2的物质的量分别为x、y,3.6 g石墨的物质的量为=0.3 mol,根据原子守恒得x+y=0.3 mol,根据得失电子守恒得2x+4y=1 mol,解得x=0.1 mol,y=0.2 mol,即石墨被氧化为CO、CO2的物质的量之比为1∶2,C正确;加入冰晶石(Na3AlF6)的主要目的是降低氧化铝的熔点,D错误。
7.答案 (1)BC (2)从右向左 (3)Fe-6e-+8OH- Fe+4H2O (4)448 (5)不变 2CoCl2+2H2O 2Co+O2↑+4HCl
解析 结合题图,首先确定丙池为原电池。
(2)在原电池中,阴离子向负极移动,S会向Zn电极方向移动,即从右向左移动。
(3)X极为阳极,发生氧化反应,由“铁电极明显变细”“X极处溶液逐渐变成紫红色”可知,Fe参与电极反应,有Fe生成,电极反应为Fe-6e-+8OH- Fe+4H2O。
(4)根据题意可知,消耗的n(Fe)==0.02 mol,n(H2)==0.1 mol,在整个电路中电子转移数目相等,4n(O2)+6n(Fe)=2n(H2),即4n(O2)+6×0.02 mol=2×0.1 mol,解得n(O2)=0.02 mol,标准状况下V(O2)=0.02 mol×22.4 L/mol=0.448 L=448 mL。
(5)乙池中石墨为阳极,阳极的电极反应式为2H2O-4e- 4H++O2↑,氢离子经过阳离子交换膜由Ⅰ室进入Ⅱ室,所以理论上Ⅰ室中n(H+)不变;该电解池的阳极反应式为2H2O-4e- 4H++O2↑,阴极反应式为Co2++2e- Co,则总反应为2CoCl2+2H2O 2Co+O2↑+4HCl。
能力提升练
1.C 2.C 3.A
1.C 第一步中阳极发生氧化反应,其电极反应式为Na0.44MnO2-xe- Na0.44-xMnO2+xNa+,A正确;该方法不需要使用离子交换膜,传统氯碱工艺需要,B正确;第二步为原电池,根据题图中的物质转化可知,Na0.44-xMnO2为正极,正极发生还原反应,正极的电极反应式为Na0.44-xMnO2+xNa++xe- Na0.44MnO2,Ag为负极,负极发生氧化反应,负极的电极反应式为Ag+Cl--e- AgCl↓,负极质量增加,C错误;第一步阴极消耗氧气,电极反应式为O2+4e-+2H2O 4OH-,理论上每消耗0.1 mol O2转移0.4 mol e-,第三步产生Cl2,其阳极的电极反应式为2Cl--2e- Cl2↑,转移0.4 mol e-生成氯气的物质的量为0.2 mol,即标准状况下产生4.48 L Cl2,D正确。
2.C 铅电极附近醛基被还原为羟基,发生还原反应,为阴极,因此a为电源的负极,A项错误;双极膜中间层中H2O解离的OH-在外电场的作用下移向阳极(催化电极),B项错误;制得1 mol FDCA,阳极消耗1 mol ,阴极也消耗1 mol ,共消耗2 mol ,C项正确;电解池中与电源负极相连的为阴极,阴极发生得电子的还原反应,D项错误。
教材溯源
电有机合成
许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。与其他有机合成相比,电有机合成的优点是反应条件温和、反应试剂纯净和生产效率高等。
3.A Ag-Pt电极上N被还原为N2,则Ag-Pt电极为阴极,Pt电极为阳极,A错误;电解时,阳离子从阳极移向阴极,所以质子从Pt电极转移到Ag-Pt电极,B正确;电解池的总反应为2H2O+4N 2N2↑+5O2↑+4OH-,C正确;每生成2 mol N2(质量为56 g)转移20 mol电子,同时有20 mol H+(质量为20 g)进入阴极室,即右室电解液质量减少56 g-20 g=36 g,右室电解液的质量减少7.2 g时,转移电子的物质的量为 mol=4 mol,数目为4NA,D正确。
4.答案 (1)正极 (2)2H++2e- H2↑ (3)变大 (4)变小 根据反应FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+可知,生成1 mol Fe3+时,消耗15 mol Mn3+,生成16 mol H+,Mn3+由阳极电极反应Mn2+-e- Mn3+生成,根据得失电子守恒,阳极生成15 mol Mn3+时阴极消耗15 mol H+,因此总体来看,电解过程中H+浓度增大,混合溶液pH变小
解析 (1)根据题图可知,电解时P电极上Mn2+失去电子变为Mn3+,则P电极为阳极,与P相连的M为电源正极。
(2)R为电解池的阴极,阴极发生得电子的还原反应,电极反应式为2H++2e- H2↑。
(3)根据反应FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+可知,电解过程中S的物质的量不断增大。
题型解读 电解原理及应用是高频考点,该类试题往往与生产、生活及新科技等相联系,常以流程图为载体呈现,一般主要考查阴、阳极的判断、电极反应式的书写、溶液离子浓度变化及相关计算等。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
