福建省“德化一中、永安一中、漳平一中”三校协作2023-2024学年高一下学期5月联考化学试题(PDF版含答案)
文档属性
| 名称 | 福建省“德化一中、永安一中、漳平一中”三校协作2023-2024学年高一下学期5月联考化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 796.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-04 11:07:49 | ||
图片预览


文档简介
“德化一中、永安一中、漳平一中”三校协作
2023—2024 学年第二学期联考
高一化学试题
(考试时间:90 分钟 总分:100 分)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷(选择题,共 48分)
一、选择题(本大题共 16 小题,每小题 3 分,共 48 分。)
1.化学与社会、生活及工业生产密切相关。下列有关说法不正确的是( )
A.航天器使用的太阳能电池阵和锂离子电池组工作时,均可将化学能转化成电能
B.载人飞船航天器的操纵杆采用的碳纤维属于新型无机非金属材料
C.火箭的整流罩前锥段材料——聚甲基丙烯酰亚胺属于有机高分子材料
D.华为公司自主研发的“麒麟 9000 芯片”需要以高纯度的硅为原料
2.下列化学用语正确的是( )
A.乙基的结构简式:CH3CH2— B.乙炔的结构简式:CHCH
C.丙烷的填充模型: D.氨分子的电子式:
3.下列各组中每种物质都既有离子键又有共价键的一组是( )
A.HCl、Al2O3、MgCl2 B.Na2O2、KOH、Na3PO4
C.MgO、Na2SO4、HNO3 D.NaOH、H2SO4、(NH4)2SO4
4.阿伏加德罗常数的值为 NA,下列说法正确的是( )
A.1mol 丙烯(CH3CH=CH2)分子中共面的原子数最多 6NA
B.常温常压下,4.6g 乙醇中 C—H 键的数目为 0.6NA
C.标况下,11.2LCCl4含共用电子对的数目为 2NA
D.0.25molCH4和 0.25molCl2充分反应后的分子总数等于 0.5NA
5.下列离子方程式书写正确的是( )
2+ 3+ -
A.向 FeI2溶液中加入少量氯水:2Fe +Cl2=2Fe +2Cl
2
B.FeO 固体中加入少量稀硝酸:FeO 2H =Fe H2O
C.Fe3O4和稀盐酸反应:Fe3O4+8H
+ = Fe2++2Fe3++4H2O
D.向氯化铁溶液中滴入过量氨水,产生红褐色沉淀:Fe3++3OH-=Fe(OH)3↓
2023—2024 学年第二学期联考高一化学试题 第 1页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
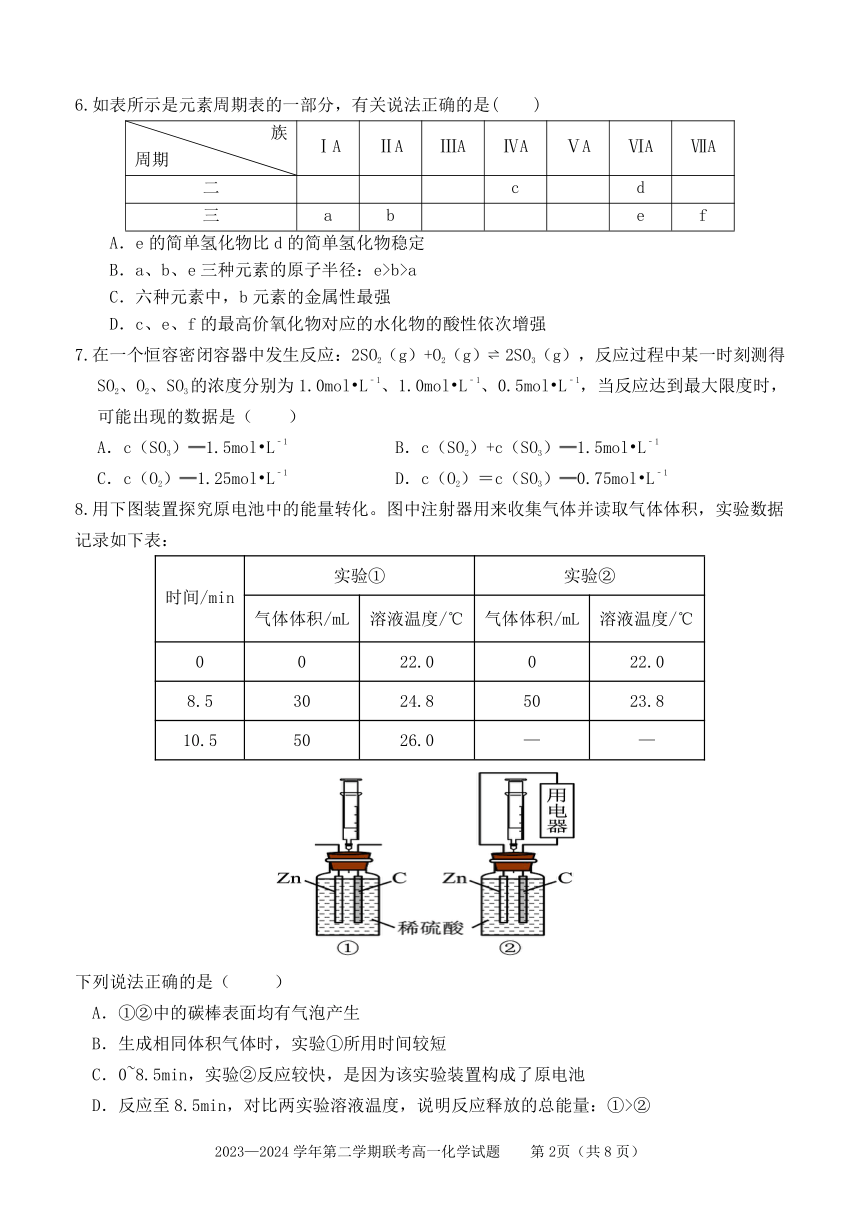
6.如表所示是元素周期表的一部分,有关说法正确的是( )
族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
周期
二 c d
三 a b e f
A.e 的简单氢化物比 d 的简单氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,b 元素的金属性最强
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
7.在一个恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),反应过程中某一时刻测得
﹣1 ﹣1 ﹣1
SO2、O2、SO3的浓度分别为 1.0mol L 、1.0mol L 、0.5mol L ,当反应达到最大限度时,
可能出现的数据是( )
﹣1 ﹣1
A.c(SO3)═1.5mol L B.c(SO2)+c(SO3)═1.5mol L
﹣1 ﹣1
C.c(O2)═1.25mol L D.c(O2)=c(SO3)═0.75mol L
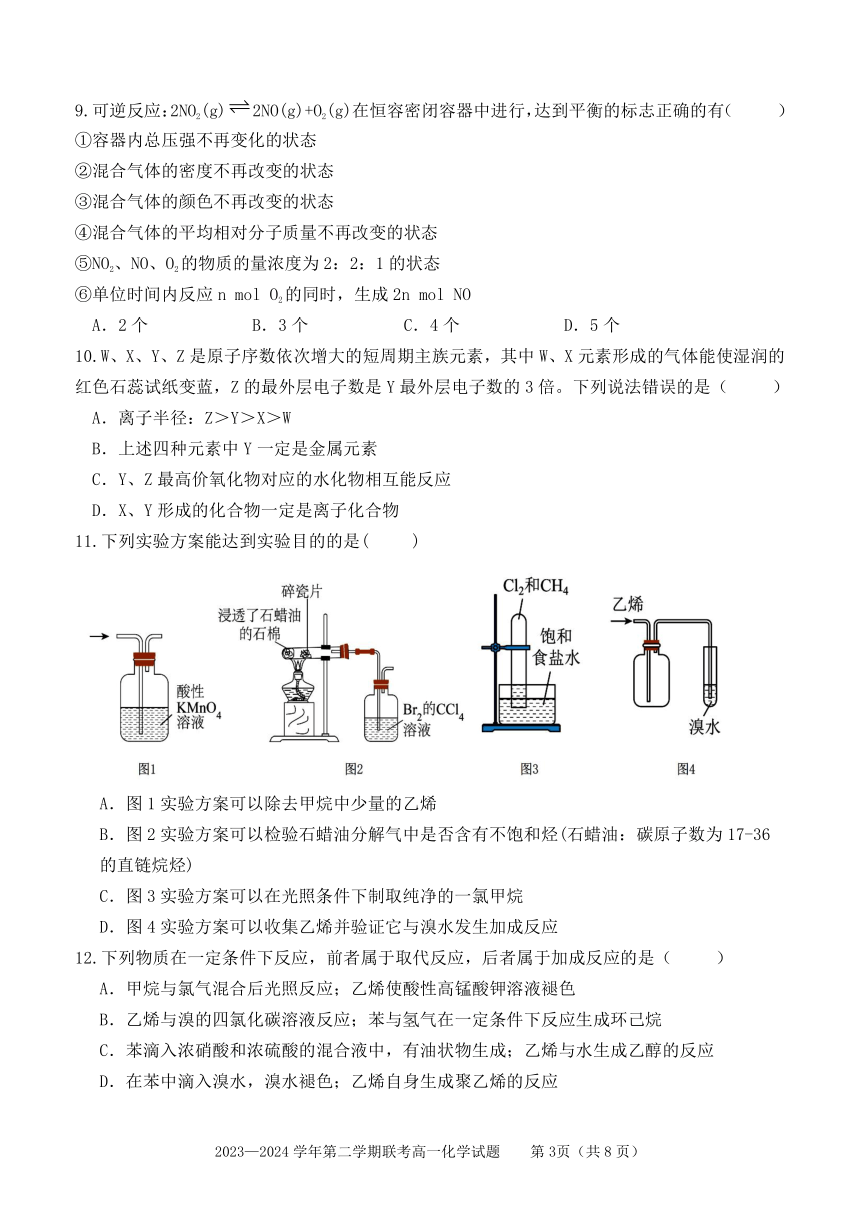
8.用下图装置探究原电池中的能量转化。图中注射器用来收集气体并读取气体体积,实验数据
记录如下表:
实验① 实验②
时间/min
气体体积/mL 溶液温度/℃ 气体体积/mL 溶液温度/℃
0 0 22.0 0 22.0
8.5 30 24.8 50 23.8
10.5 50 26.0 — —
下列说法正确的是( )
A.①②中的碳棒表面均有气泡产生
B.生成相同体积气体时,实验①所用时间较短
C.0~8.5min,实验②反应较快,是因为该实验装置构成了原电池
D.反应至 8.5min,对比两实验溶液温度,说明反应释放的总能量:①>②
2023—2024 学年第二学期联考高一化学试题 第 2页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
9.可逆反应:2NO 2(g) 2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡的标志正确的有( )
①容器内总压强不再变化的状态
②混合气体的密度不再改变的状态
③混合气体的颜色不再改变的状态
④混合气体的平均相对分子质量不再改变的状态
⑤NO2、NO、O2的物质的量浓度为 2:2:1 的状态
⑥单位时间内反应 n mol O2的同时,生成 2n mol NO
A.2 个 B.3 个 C.4个 D.5 个
10.W、X、Y、Z 是原子序数依次增大的短周期主族元素,其中 W、X 元素形成的气体能使湿润的
红色石蕊试纸变蓝,Z 的最外层电子数是 Y最外层电子数的 3倍。下列说法错误的是( )
A.离子半径:Z>Y>X>W
B.上述四种元素中 Y 一定是金属元素
C.Y、Z最高价氧化物对应的水化物相互能反应
D.X、Y形成的化合物一定是离子化合物
11.下列实验方案能达到实验目的的是( )
A.图 1 实验方案可以除去甲烷中少量的乙烯
B.图 2 实验方案可以检验石蜡油分解气中是否含有不饱和烃(石蜡油:碳原子数为 17-36
的直链烷烃)
C.图 3 实验方案可以在光照条件下制取纯净的一氯甲烷
D.图 4 实验方案可以收集乙烯并验证它与溴水发生加成反应
12.下列物质在一定条件下反应,前者属于取代反应,后者属于加成反应的是( )
A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色
B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷
C.苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成;乙烯与水生成乙醇的反应
D.在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应
2023—2024 学年第二学期联考高一化学试题 第 3页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
13.键能是指 1mol 化学键断裂形成气态基态原子所需要的最低能量。已知 CH4与 O2反应能生成
CO2和水蒸气,该反应过程中的能量变化如图所示。下列有关说法正确的是( )
A.CO2 (g) 2H2O(g) CH4 (g) 2O2 (g)为放热反应
B.若 C-H 键的键能为 415 kJ mol 1 ,则 O2中化学键的键能为 493 kJ mol 1
C.若该反应过程中转化的化学能为 200kJ,则有 0.25molC=O 键生成
D.若将 1mol CO2(g)和 2mol H2O(1)的总能量标在图中,则其位置在①、②之间
14.一定条件下,合成氨反应:N2+3H2 2NH3。图 1 表示在该反应过程中能量的变化,图 2表
示在 2L 的密闭容器中反应时 N2的物质的量随时间的变化曲线,图 3表示在不同温度下,改变
起始物 H2的体积对该反应平衡的影响。已知:其他条件不变情况下,①增大反应物的浓度,原
平衡被破坏,反应正向进行直至达到新的平衡;②升高温度,原平衡被破坏,反应向吸热反应
方向进行直至达到新的平衡。下列说法不正确的是
A.升高温度,正、逆反应速率均加快
1 1
B.由图 2 信息,10 min 内该反应速率为 v(NH 3)=0.03mol·L ·min
C.由图 2 信息,从 11min 起其他条件不变,增加 N2的量,则 n
N 2 的变化曲线为 b
D.由图 3 信息,反应温度 T1>T2
-1
15.为探究 FeCl3溶液和 KI 溶液的反应是否存在一定的限度,取 5 mL 0.5 mol L KI 溶液,滴
-1
加 0.1 mol L FeCl3溶液 5~6 滴,充分反应。下列实验操作能验证该反应存在限度的是( )
A.再加入 CCl4振荡后,观察下层液体颜色是否变为紫红色
B.再滴加 AgNO3溶液,观察是否有黄色沉淀产生
C.再加入 CCl4振荡后,取上层液体,滴加 KSCN 溶液,观察溶液是否变血红色
D.再加入 CCl4振荡后,取上层液体,滴加 AgNO3溶液,观察有否白色沉淀产生
2023—2024 学年第二学期联考高一化学试题 第 4页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
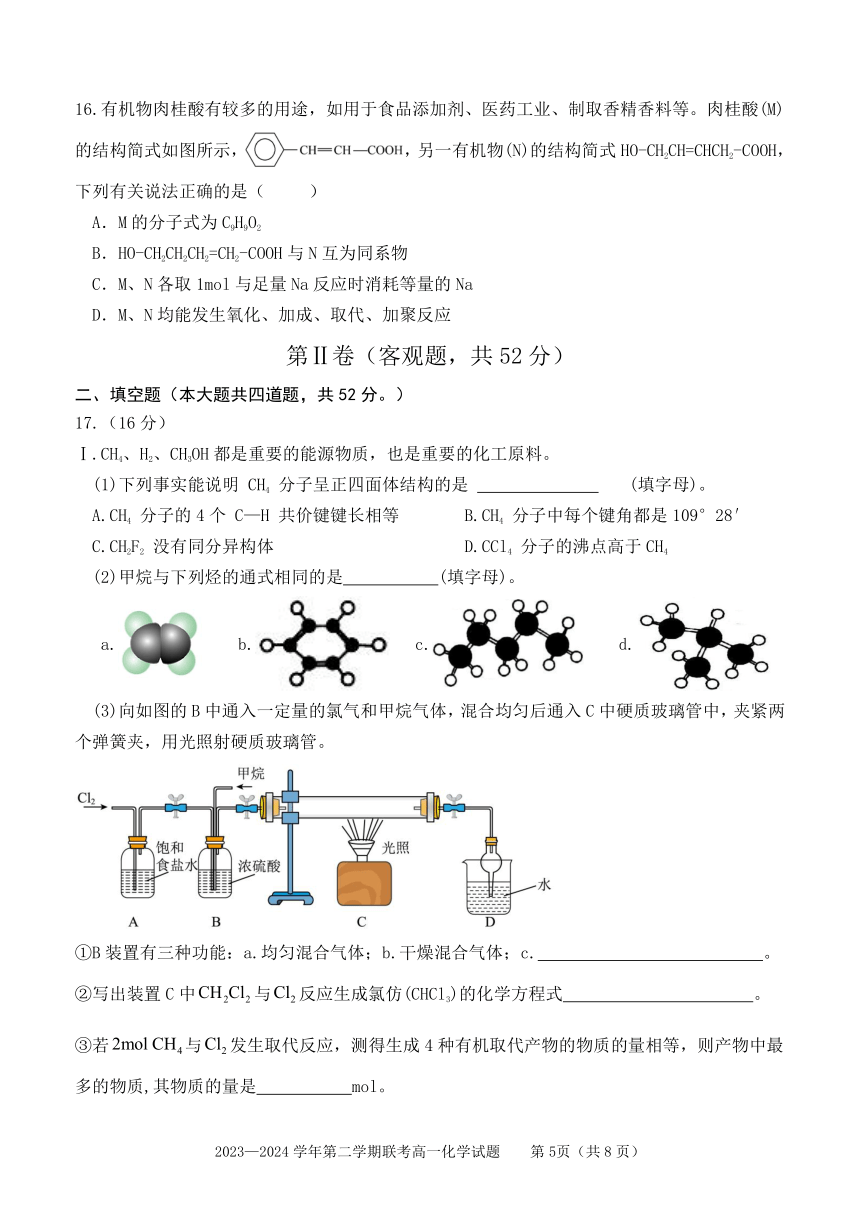
16.有机物肉桂酸有较多的用途,如用于食品添加剂、医药工业、制取香精香料等。肉桂酸(M)
的结构简式如图所示, ,另一有机物(N)的结构简式 HO-CH2CH=CHCH2-COOH,
下列有关说法正确的是( )
A.M的分子式为 C9H9O2
B.HO-CH2CH2CH2=CH2-COOH 与 N 互为同系物
C.M、N各取 1mol 与足量 Na 反应时消耗等量的 Na
D.M、N均能发生氧化、加成、取代、加聚反应
第Ⅱ卷(客观题,共 52分)
二、填空题(本大题共四道题,共 52 分。)
17.(16 分)
Ⅰ.CH4、H2、CH3OH 都是重要的能源物质,也是重要的化工原料。
(1)下列事实能说明 CH4 分子呈正四面体结构的是 (填字母)。
A.CH4 分子的 4 个 C—H 共价键键长相等 B.CH4 分子中每个键角都是 109°28′
C.CH2F2 没有同分异构体 D.CCl4 分子的沸点高于 CH4
(2)甲烷与下列烃的通式相同的是 (填字母)。
a. b. c. d.
(3)向如图的 B 中通入一定量的氯气和甲烷气体,混合均匀后通入 C 中硬质玻璃管中,夹紧两
个弹簧夹,用光照射硬质玻璃管。
①B 装置有三种功能:a.均匀混合气体;b.干燥混合气体;c. 。
②写出装置 C 中CH2Cl2 与Cl2 反应生成氯仿(CHCl3)的化学方程式 。
③若 2mol CH4与Cl2 发生取代反应,测得生成 4 种有机取代产物的物质的量相等,则产物中最
多的物质,其物质的量是 mol。
2023—2024 学年第二学期联考高一化学试题 第 5页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
Ⅱ.用H2 还原CO2能有效促进“碳中和”,反应的化学方程式为
CO2(g) 3H 2(g) CH3OH(g) H 2O(g) 。
(1)反应过程中的能量变化如图所示:
若生成 9gH2O(g),该反应会 (填“放出”或“吸收”)
KJ 热量。(用含有 E1、E2的式子表示)
(2)300℃时,向容积为 2L 的恒容密闭容器中,充入 2molCO2 g 和 2molH2 g ,反应过程中测
得各物质的物质的量浓度随时间变化如图所示。回答下列问题:
①CO2的浓度随时间变化曲线为 (填“a”、“b”或“c”);
在 M 点,v v正 逆 (填“>”、“=”或“<”)。
②2min 时,反应速率改变的原因可能是 。
A.升高温度 B.降低温度
C.充入一定量的H2 D.加入催化剂
18.(14 分)Ⅰ.已知 A、B、C、D、E、F、G、H 是原子序数依次增大的短周期主族元素,已知 A
的某种原子核内没有中子,A和 D,C 和 G 分别为同一主族元素,B原子的最外层电子数比次外
层多 3,F 的最高价氧化物的水化物既可以和强酸反应也可以和强碱溶液反应,G 的单质常出现
在火山口。
(1)C、D分别形成的简单离子中,半径较大的是 (填离子符号),G 和 H 的最高
价氧化物的水化物酸性较强的是 (填化学式)。
(2)由 A、C、D 形成的化合物中化学键的类型为 ,由 A、B 形成 18 电子化合物的
结构式为 。
(3)D、F的最高价氧化物的水化物相互反应的离子方程式为 。
(4)由 B、H 形成的化合物分子中,B和 H原子的最外层均达到 8电子稳定结构,该化合物遇
水可反应生成一种具有漂白性的化合物,写出反应的化学方程式: 。
Ⅱ.下图为铁元素的价类二维图,其中箭头表示部分物质间的转化关系,回答下列问题。
(5)E→F反应的化学方程式是 ,
该反应过程的现象为 。
(6)电子工业需要用 30%的 FeCl3溶液腐蚀敷在绝缘
板上的铜来制造印刷电路,请写出该反应的
离子方程式: 。
2023—2024 学年第二学期联考高一化学试题 第 6页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
19.(12 分)化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。利用反应
“Cu 2Ag 2Ag Cu2 ”设计成一个化学电池,该电池的负极发生 (填“氧化”
或“还原”)反应,电解质溶液是 溶液。
(2)某同学利用原电池反应检测金属的活动性顺序,设计相同条件下如图 1、图 2 的两个实验。
①图 1中放电时H+ 向 (填“镁片”或“铝片”)移动。
②图 2中铝片为 极,其电极反应式为: 。
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气(其中 O2体积分数为 20%)
燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,工作原理如图所示。
回答下列问题:
①该燃料电池负极的电极反应式为 。
②电池工作时,下列说法正确的是( )
A. 电流方向为:a 电极→负载→b电极
B. 电子移动方向为:a 电极→KOH 溶液→b电极
C. 电解质溶液的 pH 减小
D. 若在标况下消耗 22.4L 空气,则外电路转移的电子数目为 0.8NA
2023—2024 学年第二学期联考高一化学试题 第 7页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
20.(12 分)丙烯是一种重要的化工原料,以丙烯为原料衍生出部分化工产品的反应如下(部
分反应条件已略去)。
请回答下列问题:
(1)A的结构简式为 ,E 中官能团的名称为 。
(2)反应①②③④中,属于取代反应的是 (填序号)。
(3)聚丙烯(英文缩写:PP)具有机械强度高、耐化学腐蚀等特性,可用于制作薄膜、管道等,
写出聚丙烯的结构简式: 。
(4)写出下列反应的化学方程式:
①C→D: 。
②B+E→F: 。
(5)写出 C 的同分异构体 、 。
2023—2024 学年第二学期联考高一化学试题 第 8页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
“德化一中、永安一中、漳平一中”三校协作
2023—2024 学年第二学期联考
高一化学试题参考答案及评分说明
【总说明】
1.本答案及评分说明供阅卷时参考使用,考生若写出其他正确答案,可参照本评分细则给分。
2.化学方程式(包括离子方程式)中的化学式、离子符号写错,不得分;化学式、离子符号
书写正确,但未配平、“↑”“↓”未标、必须书写的反应条件未写(或写错)等化学用语书写规范
错误的,每个化学方程式累计扣 1 分。
3.化学专用名词书写错误均不得分
一、选择题(本大题共 16 小题,每小题 3 分,共 48 分。)
1 2 3 4 5 6 7 8
A A B D C D B C
9 10 11 12 13 14 15 16
C A B C B D C D
二、填空题(除标注外,其余每空 2 分。多选题,漏选得 1 分,错选不得分。)
17.(16 分)
Ⅰ.(1) BC (2) cd (若写 CD 不得分)
(3)① 控制气体流速(1 分) ② ③ 5
Ⅱ.(1) 放出 (1 分) (2)① a (1 分) > (1 分) ② AD
18.(14 分)
(1)O2- (1 分) HClO4(1 分)
(2)离子键和(极性)共价键 (1 分)
(3)Al(OH) OH Al(OH) 或 Al(OH) +OH—3 4 3 = AlO —2 + 2H2O
(4) NCl3 3H2O NH3 3HClO 或 NCl3 3H2O NH4ClO 2HClO
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3 白色沉淀迅速变为灰绿色最后生成红褐色沉淀(1 分)
+
(6)2Fe3 +Cu=Cu2++2Fe2+
2023—2024 学年第二学期联考高一化学试题 第 9页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
19.(10 分)
(1)氧化 (1 分) AgNO3 (1 分)
(2)铝片 (1 分) 负 (1 分)
Al 3e 4OH Al(OH) 4 或 Al—3e— +4 OH— = AlO —2 + 2H2O
(3) N 2H4 4OH 4e
N2 4H2O CD
20.(12 分)
(1)CH3CHBrCH2Br (1 分) 羧基 (1 分)
(2)③④
(3)
(4)2CH CH CH OH+O 催 化剂3 2 2 2 2CH3CH2CHO+2H2OΔ
+2CH3CH2COOH
浓
硫酸
+2H2O
加热
(5) (1 分) CH3OCH2CH3(1 分)
2023—2024 学年第二学期联考高一化学试题 第 10页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
2023—2024 学年第二学期联考
高一化学试题
(考试时间:90 分钟 总分:100 分)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷(选择题,共 48分)
一、选择题(本大题共 16 小题,每小题 3 分,共 48 分。)
1.化学与社会、生活及工业生产密切相关。下列有关说法不正确的是( )
A.航天器使用的太阳能电池阵和锂离子电池组工作时,均可将化学能转化成电能
B.载人飞船航天器的操纵杆采用的碳纤维属于新型无机非金属材料
C.火箭的整流罩前锥段材料——聚甲基丙烯酰亚胺属于有机高分子材料
D.华为公司自主研发的“麒麟 9000 芯片”需要以高纯度的硅为原料
2.下列化学用语正确的是( )
A.乙基的结构简式:CH3CH2— B.乙炔的结构简式:CHCH
C.丙烷的填充模型: D.氨分子的电子式:
3.下列各组中每种物质都既有离子键又有共价键的一组是( )
A.HCl、Al2O3、MgCl2 B.Na2O2、KOH、Na3PO4
C.MgO、Na2SO4、HNO3 D.NaOH、H2SO4、(NH4)2SO4
4.阿伏加德罗常数的值为 NA,下列说法正确的是( )
A.1mol 丙烯(CH3CH=CH2)分子中共面的原子数最多 6NA
B.常温常压下,4.6g 乙醇中 C—H 键的数目为 0.6NA
C.标况下,11.2LCCl4含共用电子对的数目为 2NA
D.0.25molCH4和 0.25molCl2充分反应后的分子总数等于 0.5NA
5.下列离子方程式书写正确的是( )
2+ 3+ -
A.向 FeI2溶液中加入少量氯水:2Fe +Cl2=2Fe +2Cl
2
B.FeO 固体中加入少量稀硝酸:FeO 2H =Fe H2O
C.Fe3O4和稀盐酸反应:Fe3O4+8H
+ = Fe2++2Fe3++4H2O
D.向氯化铁溶液中滴入过量氨水,产生红褐色沉淀:Fe3++3OH-=Fe(OH)3↓
2023—2024 学年第二学期联考高一化学试题 第 1页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
6.如表所示是元素周期表的一部分,有关说法正确的是( )
族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
周期
二 c d
三 a b e f
A.e 的简单氢化物比 d 的简单氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,b 元素的金属性最强
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
7.在一个恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),反应过程中某一时刻测得
﹣1 ﹣1 ﹣1
SO2、O2、SO3的浓度分别为 1.0mol L 、1.0mol L 、0.5mol L ,当反应达到最大限度时,
可能出现的数据是( )
﹣1 ﹣1
A.c(SO3)═1.5mol L B.c(SO2)+c(SO3)═1.5mol L
﹣1 ﹣1
C.c(O2)═1.25mol L D.c(O2)=c(SO3)═0.75mol L
8.用下图装置探究原电池中的能量转化。图中注射器用来收集气体并读取气体体积,实验数据
记录如下表:
实验① 实验②
时间/min
气体体积/mL 溶液温度/℃ 气体体积/mL 溶液温度/℃
0 0 22.0 0 22.0
8.5 30 24.8 50 23.8
10.5 50 26.0 — —
下列说法正确的是( )
A.①②中的碳棒表面均有气泡产生
B.生成相同体积气体时,实验①所用时间较短
C.0~8.5min,实验②反应较快,是因为该实验装置构成了原电池
D.反应至 8.5min,对比两实验溶液温度,说明反应释放的总能量:①>②
2023—2024 学年第二学期联考高一化学试题 第 2页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
9.可逆反应:2NO 2(g) 2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡的标志正确的有( )
①容器内总压强不再变化的状态
②混合气体的密度不再改变的状态
③混合气体的颜色不再改变的状态
④混合气体的平均相对分子质量不再改变的状态
⑤NO2、NO、O2的物质的量浓度为 2:2:1 的状态
⑥单位时间内反应 n mol O2的同时,生成 2n mol NO
A.2 个 B.3 个 C.4个 D.5 个
10.W、X、Y、Z 是原子序数依次增大的短周期主族元素,其中 W、X 元素形成的气体能使湿润的
红色石蕊试纸变蓝,Z 的最外层电子数是 Y最外层电子数的 3倍。下列说法错误的是( )
A.离子半径:Z>Y>X>W
B.上述四种元素中 Y 一定是金属元素
C.Y、Z最高价氧化物对应的水化物相互能反应
D.X、Y形成的化合物一定是离子化合物
11.下列实验方案能达到实验目的的是( )
A.图 1 实验方案可以除去甲烷中少量的乙烯
B.图 2 实验方案可以检验石蜡油分解气中是否含有不饱和烃(石蜡油:碳原子数为 17-36
的直链烷烃)
C.图 3 实验方案可以在光照条件下制取纯净的一氯甲烷
D.图 4 实验方案可以收集乙烯并验证它与溴水发生加成反应
12.下列物质在一定条件下反应,前者属于取代反应,后者属于加成反应的是( )
A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色
B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷
C.苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成;乙烯与水生成乙醇的反应
D.在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应
2023—2024 学年第二学期联考高一化学试题 第 3页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
13.键能是指 1mol 化学键断裂形成气态基态原子所需要的最低能量。已知 CH4与 O2反应能生成
CO2和水蒸气,该反应过程中的能量变化如图所示。下列有关说法正确的是( )
A.CO2 (g) 2H2O(g) CH4 (g) 2O2 (g)为放热反应
B.若 C-H 键的键能为 415 kJ mol 1 ,则 O2中化学键的键能为 493 kJ mol 1
C.若该反应过程中转化的化学能为 200kJ,则有 0.25molC=O 键生成
D.若将 1mol CO2(g)和 2mol H2O(1)的总能量标在图中,则其位置在①、②之间
14.一定条件下,合成氨反应:N2+3H2 2NH3。图 1 表示在该反应过程中能量的变化,图 2表
示在 2L 的密闭容器中反应时 N2的物质的量随时间的变化曲线,图 3表示在不同温度下,改变
起始物 H2的体积对该反应平衡的影响。已知:其他条件不变情况下,①增大反应物的浓度,原
平衡被破坏,反应正向进行直至达到新的平衡;②升高温度,原平衡被破坏,反应向吸热反应
方向进行直至达到新的平衡。下列说法不正确的是
A.升高温度,正、逆反应速率均加快
1 1
B.由图 2 信息,10 min 内该反应速率为 v(NH 3)=0.03mol·L ·min
C.由图 2 信息,从 11min 起其他条件不变,增加 N2的量,则 n
N 2 的变化曲线为 b
D.由图 3 信息,反应温度 T1>T2
-1
15.为探究 FeCl3溶液和 KI 溶液的反应是否存在一定的限度,取 5 mL 0.5 mol L KI 溶液,滴
-1
加 0.1 mol L FeCl3溶液 5~6 滴,充分反应。下列实验操作能验证该反应存在限度的是( )
A.再加入 CCl4振荡后,观察下层液体颜色是否变为紫红色
B.再滴加 AgNO3溶液,观察是否有黄色沉淀产生
C.再加入 CCl4振荡后,取上层液体,滴加 KSCN 溶液,观察溶液是否变血红色
D.再加入 CCl4振荡后,取上层液体,滴加 AgNO3溶液,观察有否白色沉淀产生
2023—2024 学年第二学期联考高一化学试题 第 4页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
16.有机物肉桂酸有较多的用途,如用于食品添加剂、医药工业、制取香精香料等。肉桂酸(M)
的结构简式如图所示, ,另一有机物(N)的结构简式 HO-CH2CH=CHCH2-COOH,
下列有关说法正确的是( )
A.M的分子式为 C9H9O2
B.HO-CH2CH2CH2=CH2-COOH 与 N 互为同系物
C.M、N各取 1mol 与足量 Na 反应时消耗等量的 Na
D.M、N均能发生氧化、加成、取代、加聚反应
第Ⅱ卷(客观题,共 52分)
二、填空题(本大题共四道题,共 52 分。)
17.(16 分)
Ⅰ.CH4、H2、CH3OH 都是重要的能源物质,也是重要的化工原料。
(1)下列事实能说明 CH4 分子呈正四面体结构的是 (填字母)。
A.CH4 分子的 4 个 C—H 共价键键长相等 B.CH4 分子中每个键角都是 109°28′
C.CH2F2 没有同分异构体 D.CCl4 分子的沸点高于 CH4
(2)甲烷与下列烃的通式相同的是 (填字母)。
a. b. c. d.
(3)向如图的 B 中通入一定量的氯气和甲烷气体,混合均匀后通入 C 中硬质玻璃管中,夹紧两
个弹簧夹,用光照射硬质玻璃管。
①B 装置有三种功能:a.均匀混合气体;b.干燥混合气体;c. 。
②写出装置 C 中CH2Cl2 与Cl2 反应生成氯仿(CHCl3)的化学方程式 。
③若 2mol CH4与Cl2 发生取代反应,测得生成 4 种有机取代产物的物质的量相等,则产物中最
多的物质,其物质的量是 mol。
2023—2024 学年第二学期联考高一化学试题 第 5页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
Ⅱ.用H2 还原CO2能有效促进“碳中和”,反应的化学方程式为
CO2(g) 3H 2(g) CH3OH(g) H 2O(g) 。
(1)反应过程中的能量变化如图所示:
若生成 9gH2O(g),该反应会 (填“放出”或“吸收”)
KJ 热量。(用含有 E1、E2的式子表示)
(2)300℃时,向容积为 2L 的恒容密闭容器中,充入 2molCO2 g 和 2molH2 g ,反应过程中测
得各物质的物质的量浓度随时间变化如图所示。回答下列问题:
①CO2的浓度随时间变化曲线为 (填“a”、“b”或“c”);
在 M 点,v v正 逆 (填“>”、“=”或“<”)。
②2min 时,反应速率改变的原因可能是 。
A.升高温度 B.降低温度
C.充入一定量的H2 D.加入催化剂
18.(14 分)Ⅰ.已知 A、B、C、D、E、F、G、H 是原子序数依次增大的短周期主族元素,已知 A
的某种原子核内没有中子,A和 D,C 和 G 分别为同一主族元素,B原子的最外层电子数比次外
层多 3,F 的最高价氧化物的水化物既可以和强酸反应也可以和强碱溶液反应,G 的单质常出现
在火山口。
(1)C、D分别形成的简单离子中,半径较大的是 (填离子符号),G 和 H 的最高
价氧化物的水化物酸性较强的是 (填化学式)。
(2)由 A、C、D 形成的化合物中化学键的类型为 ,由 A、B 形成 18 电子化合物的
结构式为 。
(3)D、F的最高价氧化物的水化物相互反应的离子方程式为 。
(4)由 B、H 形成的化合物分子中,B和 H原子的最外层均达到 8电子稳定结构,该化合物遇
水可反应生成一种具有漂白性的化合物,写出反应的化学方程式: 。
Ⅱ.下图为铁元素的价类二维图,其中箭头表示部分物质间的转化关系,回答下列问题。
(5)E→F反应的化学方程式是 ,
该反应过程的现象为 。
(6)电子工业需要用 30%的 FeCl3溶液腐蚀敷在绝缘
板上的铜来制造印刷电路,请写出该反应的
离子方程式: 。
2023—2024 学年第二学期联考高一化学试题 第 6页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
19.(12 分)化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。利用反应
“Cu 2Ag 2Ag Cu2 ”设计成一个化学电池,该电池的负极发生 (填“氧化”
或“还原”)反应,电解质溶液是 溶液。
(2)某同学利用原电池反应检测金属的活动性顺序,设计相同条件下如图 1、图 2 的两个实验。
①图 1中放电时H+ 向 (填“镁片”或“铝片”)移动。
②图 2中铝片为 极,其电极反应式为: 。
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气(其中 O2体积分数为 20%)
燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,工作原理如图所示。
回答下列问题:
①该燃料电池负极的电极反应式为 。
②电池工作时,下列说法正确的是( )
A. 电流方向为:a 电极→负载→b电极
B. 电子移动方向为:a 电极→KOH 溶液→b电极
C. 电解质溶液的 pH 减小
D. 若在标况下消耗 22.4L 空气,则外电路转移的电子数目为 0.8NA
2023—2024 学年第二学期联考高一化学试题 第 7页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
20.(12 分)丙烯是一种重要的化工原料,以丙烯为原料衍生出部分化工产品的反应如下(部
分反应条件已略去)。
请回答下列问题:
(1)A的结构简式为 ,E 中官能团的名称为 。
(2)反应①②③④中,属于取代反应的是 (填序号)。
(3)聚丙烯(英文缩写:PP)具有机械强度高、耐化学腐蚀等特性,可用于制作薄膜、管道等,
写出聚丙烯的结构简式: 。
(4)写出下列反应的化学方程式:
①C→D: 。
②B+E→F: 。
(5)写出 C 的同分异构体 、 。
2023—2024 学年第二学期联考高一化学试题 第 8页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
“德化一中、永安一中、漳平一中”三校协作
2023—2024 学年第二学期联考
高一化学试题参考答案及评分说明
【总说明】
1.本答案及评分说明供阅卷时参考使用,考生若写出其他正确答案,可参照本评分细则给分。
2.化学方程式(包括离子方程式)中的化学式、离子符号写错,不得分;化学式、离子符号
书写正确,但未配平、“↑”“↓”未标、必须书写的反应条件未写(或写错)等化学用语书写规范
错误的,每个化学方程式累计扣 1 分。
3.化学专用名词书写错误均不得分
一、选择题(本大题共 16 小题,每小题 3 分,共 48 分。)
1 2 3 4 5 6 7 8
A A B D C D B C
9 10 11 12 13 14 15 16
C A B C B D C D
二、填空题(除标注外,其余每空 2 分。多选题,漏选得 1 分,错选不得分。)
17.(16 分)
Ⅰ.(1) BC (2) cd (若写 CD 不得分)
(3)① 控制气体流速(1 分) ② ③ 5
Ⅱ.(1) 放出 (1 分) (2)① a (1 分) > (1 分) ② AD
18.(14 分)
(1)O2- (1 分) HClO4(1 分)
(2)离子键和(极性)共价键 (1 分)
(3)Al(OH) OH Al(OH) 或 Al(OH) +OH—3 4 3 = AlO —2 + 2H2O
(4) NCl3 3H2O NH3 3HClO 或 NCl3 3H2O NH4ClO 2HClO
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3 白色沉淀迅速变为灰绿色最后生成红褐色沉淀(1 分)
+
(6)2Fe3 +Cu=Cu2++2Fe2+
2023—2024 学年第二学期联考高一化学试题 第 9页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
19.(10 分)
(1)氧化 (1 分) AgNO3 (1 分)
(2)铝片 (1 分) 负 (1 分)
Al 3e 4OH Al(OH) 4 或 Al—3e— +4 OH— = AlO —2 + 2H2O
(3) N 2H4 4OH 4e
N2 4H2O CD
20.(12 分)
(1)CH3CHBrCH2Br (1 分) 羧基 (1 分)
(2)③④
(3)
(4)2CH CH CH OH+O 催 化剂3 2 2 2 2CH3CH2CHO+2H2OΔ
+2CH3CH2COOH
浓
硫酸
+2H2O
加热
(5) (1 分) CH3OCH2CH3(1 分)
2023—2024 学年第二学期联考高一化学试题 第 10页(共 8页)
{#{QQABBQCAggCAAIIAAQgCQwlQCkIQkBGACQgOgFAEsAABARNABAA=}#}
同课章节目录
