2024年湖北省武汉市硚口区、经开区九年级六月质量检测化学试卷(图片版,无答案)
文档属性
| 名称 | 2024年湖北省武汉市硚口区、经开区九年级六月质量检测化学试卷(图片版,无答案) |  | |
| 格式 | |||
| 文件大小 | 424.6KB | ||
| 资源类型 | 教案 | ||
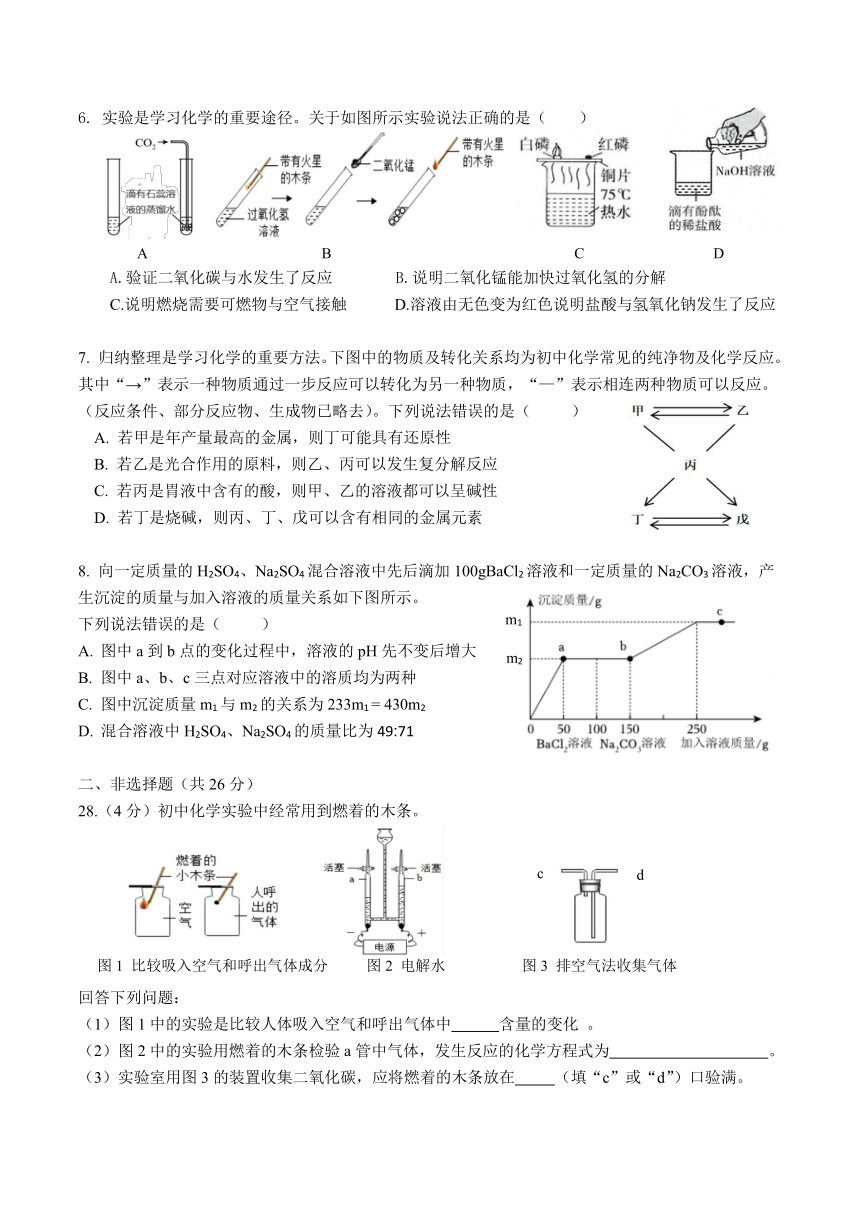
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-04 18:39:51 | ||
图片预览

文档简介
2024 年六月质量检测九年级化学试卷
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Ba-137 Na-23 Cl-35.5 Zn-65 Cu-64 K-39
班级: 姓名:
一、选择题(每小题 3分,共 24分)
1. 水是重要的资源,城市里的生活用水是经自来水厂净化处理过的。下列水处理过程中一定发生化学
变化的是( )
A. 静置沉降 B. 过滤 C. 活性炭吸附 D. 杀菌消毒
2. 实验操作应严谨规范。下列实验操作正确的是( )
A. 取用固体粉末 B. 添加酒精 C.控制气体的产生与停止 D. 稀释浓硫酸
3. 硝酸铵是一种常用的氮肥,可以用来配制绿萝生长的营养液。下列说法正确的是( )
A. 2-硝酸铵中阴离子的符号为 NO3 B. 硝酸铵中含有一种金属元素
C. 氮原子的结构示意图为 D. 硝酸铵中氮元素的化合价为+1 价
4. 劳动创造美好生活。下列与劳动项目相关的解释错误的是( )
选项 劳动项目 解释
C. C D. D
A 用铅笔芯制作电极 石墨有导电性
B 在阳光下晾晒湿衣服 温度升高,水分子变大
C 在铁栏杆上刷漆 防止铁生锈
D 回收各种废弃塑料 减轻“白色污染”,节约资源
5. 载人航天器中利用下图所示的“氧再生系统”处理航天员排出的 H2O 和 CO2。下列说法不正确的是
( )
A.排到舱外的物质是甲烷
B.反应器 1中消耗 和生成 的分子个数比为 2:1
C.反应器 2中生成 和 的质量比为 9:8
D.该系统的反应共涉及两种氧化物
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
6. 实验是学习化学的重要途径。关于如图所示实验说法正确的是( )
A B C D
A.验证二氧化碳与水发生了反应 B.说明二氧化锰能加快过氧化氢的分解
C.说明燃烧需要可燃物与空气接触 D.溶液由无色变为红色说明盐酸与氢氧化钠发生了反应
7. 归纳整理是学习化学的重要方法。下图中的物质及转化关系均为初中化学常见的纯净物及化学反应。
其中“→”表示一种物质通过一步反应可以转化为另一种物质,“—”表示相连两种物质可以反应。
(反应条件、部分反应物、生成物已略去)。下列说法错误的是( )
A. 若甲是年产量最高的金属,则丁可能具有还原性
B. 若乙是光合作用的原料,则乙、丙可以发生复分解反应
C. 若丙是胃液中含有的酸,则甲、乙的溶液都可以呈碱性
D. 若丁是烧碱,则丙、丁、戊可以含有相同的金属元素
8. 向一定质量的 H2SO4、Na2SO4 混合溶液中先后滴加 100gBaCl2溶液和一定质量的 Na2CO3 溶液,产
生沉淀的质量与加入溶液的质量关系如下图所示。
下列说法错误的是( ) m1
A. 图中 a到 b点的变化过程中,溶液的 pH先不变后增大 m2
B. 图中 a、b、c三点对应溶液中的溶质均为两种
C. 图中沉淀质量 m1 与 m2 的关系为 233m1= 430m2
D. 混合溶液中 H2SO4、Na2SO4 的质量比为 49:71
二、非选择题(共 26分)
28.(4分)初中化学实验中经常用到燃着的木条。
c d
图 1 比较吸入空气和呼出气体成分 图 2 电解水 图 3 排空气法收集气体
回答下列问题:
(1)图 1中的实验是比较人体吸入空气和呼出气体中 含量的变化 。
(2)图 2中的实验用燃着的木条检验 a管中气体,发生反应的化学方程式为 。
(3)实验室用图 3的装置收集二氧化碳,应将燃着的木条放在 (填“c”或“d”)口验满。
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
29.(4分)食盐加碘可以补充人体碘元素,所加物质一般为碘酸钾。氯化钠和碘酸钾在水中的溶解度
如下表所示。
回答下列问题:
(1)40℃时,碘酸钾的溶解度是 。
(2)将 60℃上述两种物质的饱和溶液各 mg分别降温 40℃,析出固体质量更大的是 。
(3)20℃时,取饱和氯化钠溶液稀释成 100g质量分数为 9%的氯化钠溶液,需加水的质量
是 。
(4)20℃时,将碘酸钾和氯化钠各 ng分别放入装有 50g水的烧杯中,充分搅拌。
下列说法正确的是
A.若两只烧杯中均无固体剩余,则所得碘酸钾溶液可能是饱和溶液
B.若 n=8.1,则所得溶液溶质质量分数:氯化钠=碘酸钾
C.若 n=18,将上述两个烧杯中的物质重新混合充分搅拌后,可能没有固体剩余
D.若所得溶液中只有一种是饱和溶液,则 4.05≤n<18
30.(6分)锌及锌的化合物具有众多有益的生物学特性。活性氧化锌广泛用于橡胶、涂料、印染、医
药等工业。工业上用粗氧化锌(含少量 FeO)制取活性氧化锌,其流程如图所示︰
【查阅资料】①H2O2能使 Fe2+转化为 Fe3+。
②一些金属阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的 pH,见表。
【问题探究】
(1)粗氧化锌在加入“溶解池”前要粉碎,其目的是 。
(2)写出“溶解池”中发生的化学反应方程式 (写一个即可)。
“溶解池”中得到的溶液中含有的阳离子有 (填离子符号)。
(3)“除铁池”加入氨水是为了控制溶液的 pH,溶液的 pH是 x,则 x的范围是 。
(4)“沉淀池"中的沉淀经:过滤洗涤等操作得到纯净固体M,其组成为:ZnCO3·2Zn (OH) 2·2H2O。为
确认固体M已经洗涤干净,进行以下操作:取最后一次洗涤液,最好选择下列哪种试剂 (填标号),
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
向其中滴入无现象,则已经洗干净。
A.紫色石蕊试液 B.少量稀盐酸 C.硝酸钡溶液
31. 为测定 CuSO4溶液的溶质质量分数,某同学设计了如下实验方案。回答下列问题:
实验步骤:
①按如图安装装置(夹持仪器略去)
②……
③在仪器 A、B、C、D、E中加入图示的试剂
④调整 D、E中两液面相平,使 D中液面保持在 0刻度位置
⑤将 CuSO4溶液滴入 A中搅拌,反应完成后,再滴加稀硫酸
至体系不再有气体产生
⑥待体系恢复到室温,移动 E管,保持 D、E中两液面相平,
读数并记录
⑦处理数据
(1)步骤②为 。
(2) 仪器 A中发生反应的化学方程式为 (写一个即可)。
(3)仪器 B、仪器 C的支管在实验中所起到的作用是 (填标号)。
a.使仪器 A、B、C内的气压保持一致,便于滴加液体
b.实验中测定的气体体积更准确
c.生成的气体通过仪器 C的支管进入导管
(4)若 CuSO4溶液的质量为 m g,Zn粉的质量为 m1 g,测定 H2的体积换算为质量 m2 g,则 CuSO4
溶液的溶质质量分数为_____________(用代数式表示)。
(5)下列因素会导致所测定 CuSO4溶液的溶质质量分数偏大的是 (填标号)。
A.步骤⑤加入的稀硫酸量不足
B.测定气体体积读数时未恢复到室温
C.测定气体体积读数时,E中液面高于 D中液面
D.测定气体体积读数时气体在仪器 A中仍有滞留
32. 实验室有氯酸钾、氯化钾和二氧化锰的混合物 27.7g。某兴趣小组利用该药品制取氧气,实验数据
如下图:
(1)上述实验制取氧气的质量为 。
(2)计算 27.7g混合物中氯化钾的质量。
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Ba-137 Na-23 Cl-35.5 Zn-65 Cu-64 K-39
班级: 姓名:
一、选择题(每小题 3分,共 24分)
1. 水是重要的资源,城市里的生活用水是经自来水厂净化处理过的。下列水处理过程中一定发生化学
变化的是( )
A. 静置沉降 B. 过滤 C. 活性炭吸附 D. 杀菌消毒
2. 实验操作应严谨规范。下列实验操作正确的是( )
A. 取用固体粉末 B. 添加酒精 C.控制气体的产生与停止 D. 稀释浓硫酸
3. 硝酸铵是一种常用的氮肥,可以用来配制绿萝生长的营养液。下列说法正确的是( )
A. 2-硝酸铵中阴离子的符号为 NO3 B. 硝酸铵中含有一种金属元素
C. 氮原子的结构示意图为 D. 硝酸铵中氮元素的化合价为+1 价
4. 劳动创造美好生活。下列与劳动项目相关的解释错误的是( )
选项 劳动项目 解释
C. C D. D
A 用铅笔芯制作电极 石墨有导电性
B 在阳光下晾晒湿衣服 温度升高,水分子变大
C 在铁栏杆上刷漆 防止铁生锈
D 回收各种废弃塑料 减轻“白色污染”,节约资源
5. 载人航天器中利用下图所示的“氧再生系统”处理航天员排出的 H2O 和 CO2。下列说法不正确的是
( )
A.排到舱外的物质是甲烷
B.反应器 1中消耗 和生成 的分子个数比为 2:1
C.反应器 2中生成 和 的质量比为 9:8
D.该系统的反应共涉及两种氧化物
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
6. 实验是学习化学的重要途径。关于如图所示实验说法正确的是( )
A B C D
A.验证二氧化碳与水发生了反应 B.说明二氧化锰能加快过氧化氢的分解
C.说明燃烧需要可燃物与空气接触 D.溶液由无色变为红色说明盐酸与氢氧化钠发生了反应
7. 归纳整理是学习化学的重要方法。下图中的物质及转化关系均为初中化学常见的纯净物及化学反应。
其中“→”表示一种物质通过一步反应可以转化为另一种物质,“—”表示相连两种物质可以反应。
(反应条件、部分反应物、生成物已略去)。下列说法错误的是( )
A. 若甲是年产量最高的金属,则丁可能具有还原性
B. 若乙是光合作用的原料,则乙、丙可以发生复分解反应
C. 若丙是胃液中含有的酸,则甲、乙的溶液都可以呈碱性
D. 若丁是烧碱,则丙、丁、戊可以含有相同的金属元素
8. 向一定质量的 H2SO4、Na2SO4 混合溶液中先后滴加 100gBaCl2溶液和一定质量的 Na2CO3 溶液,产
生沉淀的质量与加入溶液的质量关系如下图所示。
下列说法错误的是( ) m1
A. 图中 a到 b点的变化过程中,溶液的 pH先不变后增大 m2
B. 图中 a、b、c三点对应溶液中的溶质均为两种
C. 图中沉淀质量 m1 与 m2 的关系为 233m1= 430m2
D. 混合溶液中 H2SO4、Na2SO4 的质量比为 49:71
二、非选择题(共 26分)
28.(4分)初中化学实验中经常用到燃着的木条。
c d
图 1 比较吸入空气和呼出气体成分 图 2 电解水 图 3 排空气法收集气体
回答下列问题:
(1)图 1中的实验是比较人体吸入空气和呼出气体中 含量的变化 。
(2)图 2中的实验用燃着的木条检验 a管中气体,发生反应的化学方程式为 。
(3)实验室用图 3的装置收集二氧化碳,应将燃着的木条放在 (填“c”或“d”)口验满。
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
29.(4分)食盐加碘可以补充人体碘元素,所加物质一般为碘酸钾。氯化钠和碘酸钾在水中的溶解度
如下表所示。
回答下列问题:
(1)40℃时,碘酸钾的溶解度是 。
(2)将 60℃上述两种物质的饱和溶液各 mg分别降温 40℃,析出固体质量更大的是 。
(3)20℃时,取饱和氯化钠溶液稀释成 100g质量分数为 9%的氯化钠溶液,需加水的质量
是 。
(4)20℃时,将碘酸钾和氯化钠各 ng分别放入装有 50g水的烧杯中,充分搅拌。
下列说法正确的是
A.若两只烧杯中均无固体剩余,则所得碘酸钾溶液可能是饱和溶液
B.若 n=8.1,则所得溶液溶质质量分数:氯化钠=碘酸钾
C.若 n=18,将上述两个烧杯中的物质重新混合充分搅拌后,可能没有固体剩余
D.若所得溶液中只有一种是饱和溶液,则 4.05≤n<18
30.(6分)锌及锌的化合物具有众多有益的生物学特性。活性氧化锌广泛用于橡胶、涂料、印染、医
药等工业。工业上用粗氧化锌(含少量 FeO)制取活性氧化锌,其流程如图所示︰
【查阅资料】①H2O2能使 Fe2+转化为 Fe3+。
②一些金属阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的 pH,见表。
【问题探究】
(1)粗氧化锌在加入“溶解池”前要粉碎,其目的是 。
(2)写出“溶解池”中发生的化学反应方程式 (写一个即可)。
“溶解池”中得到的溶液中含有的阳离子有 (填离子符号)。
(3)“除铁池”加入氨水是为了控制溶液的 pH,溶液的 pH是 x,则 x的范围是 。
(4)“沉淀池"中的沉淀经:过滤洗涤等操作得到纯净固体M,其组成为:ZnCO3·2Zn (OH) 2·2H2O。为
确认固体M已经洗涤干净,进行以下操作:取最后一次洗涤液,最好选择下列哪种试剂 (填标号),
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
向其中滴入无现象,则已经洗干净。
A.紫色石蕊试液 B.少量稀盐酸 C.硝酸钡溶液
31. 为测定 CuSO4溶液的溶质质量分数,某同学设计了如下实验方案。回答下列问题:
实验步骤:
①按如图安装装置(夹持仪器略去)
②……
③在仪器 A、B、C、D、E中加入图示的试剂
④调整 D、E中两液面相平,使 D中液面保持在 0刻度位置
⑤将 CuSO4溶液滴入 A中搅拌,反应完成后,再滴加稀硫酸
至体系不再有气体产生
⑥待体系恢复到室温,移动 E管,保持 D、E中两液面相平,
读数并记录
⑦处理数据
(1)步骤②为 。
(2) 仪器 A中发生反应的化学方程式为 (写一个即可)。
(3)仪器 B、仪器 C的支管在实验中所起到的作用是 (填标号)。
a.使仪器 A、B、C内的气压保持一致,便于滴加液体
b.实验中测定的气体体积更准确
c.生成的气体通过仪器 C的支管进入导管
(4)若 CuSO4溶液的质量为 m g,Zn粉的质量为 m1 g,测定 H2的体积换算为质量 m2 g,则 CuSO4
溶液的溶质质量分数为_____________(用代数式表示)。
(5)下列因素会导致所测定 CuSO4溶液的溶质质量分数偏大的是 (填标号)。
A.步骤⑤加入的稀硫酸量不足
B.测定气体体积读数时未恢复到室温
C.测定气体体积读数时,E中液面高于 D中液面
D.测定气体体积读数时气体在仪器 A中仍有滞留
32. 实验室有氯酸钾、氯化钾和二氧化锰的混合物 27.7g。某兴趣小组利用该药品制取氧气,实验数据
如下图:
(1)上述实验制取氧气的质量为 。
(2)计算 27.7g混合物中氯化钾的质量。
{#{QQABQQYAoggAQJIAAQhCQwEyCAMQkACACYgGwBAIIAABQBFABAA=}#}
同课章节目录
