3.2.1分子晶体课件(共41张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.1分子晶体课件(共41张ppt)化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 41.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-06 10:27:06 | ||
图片预览







文档简介
(共41张PPT)
第二节 分子晶体和共价晶体
第三章 晶体结构和性质
第一课时
分子晶体
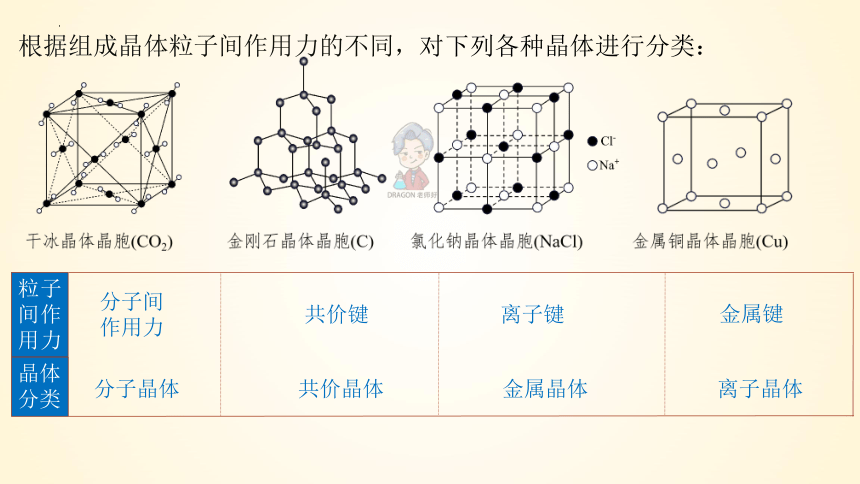
分子晶体 共价晶体 金属晶体 离子晶体
分子间作用力
金属键
共价键
离子键
根据组成晶体粒子间作用力的不同,对下列各种晶体进行分类:
粒子间作用力
晶体分类
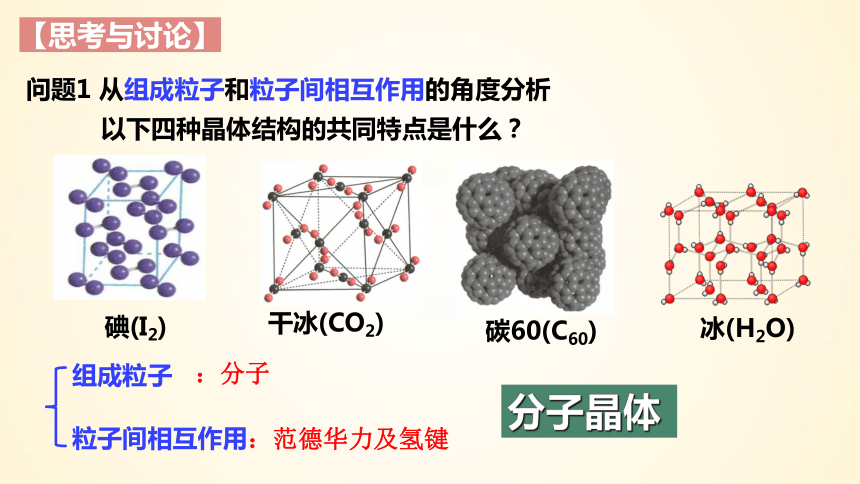
问题1 从组成粒子和粒子间相互作用的角度分析
以下四种晶体结构的共同特点是什么?
【思考与讨论】
碘(I2)
干冰(CO2)
碳60(C60)
冰(H2O)
组成粒子
粒子间相互作用
:分子
:范德华力及氢键
分子晶体
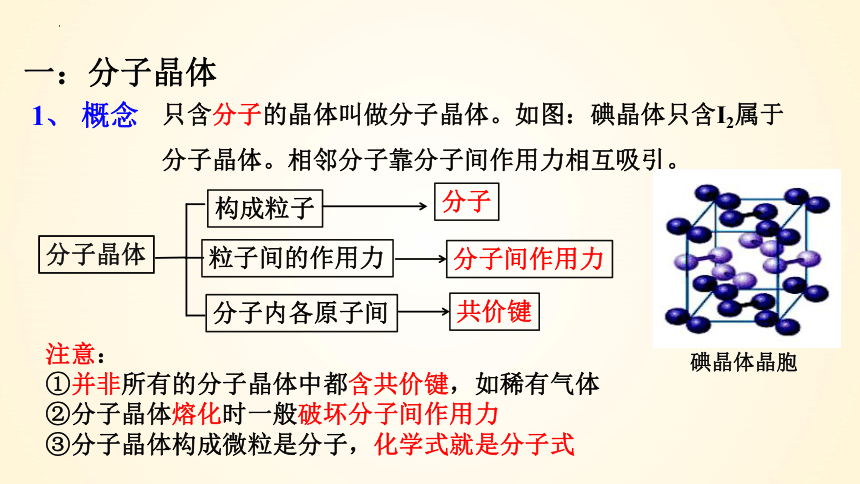
一:分子晶体
1、 概念
只含分子的晶体叫做分子晶体。如图:碘晶体只含I2属于分子晶体。相邻分子靠分子间作用力相互吸引。
构成粒子
分子晶体
分子
粒子间的作用力
分子间作用力
分子内各原子间
共价键
注意:
①并非所有的分子晶体中都含共价键,如稀有气体
②分子晶体熔化时一般破坏分子间作用力
③分子晶体构成微粒是分子,化学式就是分子式
碘晶体晶胞
(1)部分非金属单质:X2、O2、H2、 S8、P4、C60
(4)部分非金属氧化物: CO2、SO2、NO2……
(5)几乎所有的酸: H2SO4、HNO3、H3PO4
(6)绝大多数有机物:乙醇、冰醋酸、蔗糖……
(2)稀有气体:
(除 SiO2 等)
(除B、Si、Ge等的单质、金刚石等)
大部分共价单质和共价化合物
2、 常见的分子晶体
(3)所有非金属氢化物:H2O、H2S、NH3、CH4、HX……
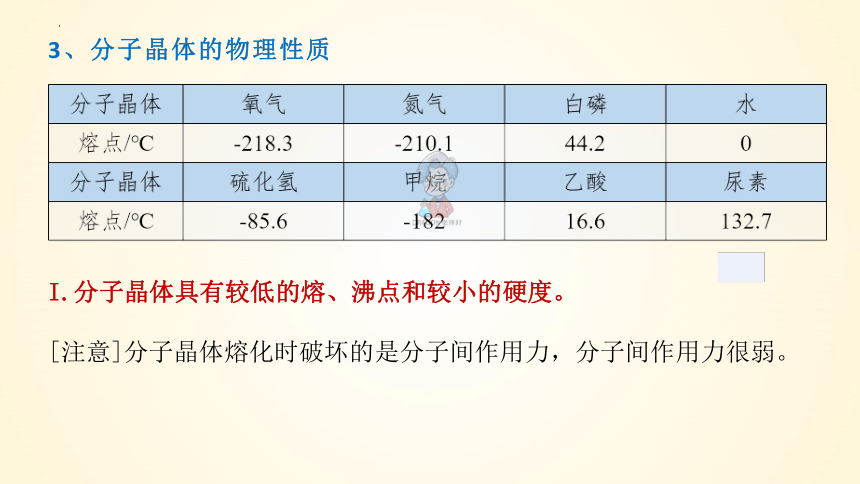
3、分子晶体的物理性质
I.分子晶体具有较低的熔、沸点和较小的硬度。
[注意]分子晶体熔化时破坏的是分子间作用力,分子间作用力很弱。
II.分子晶体不导电。
[提示]分子晶体在固态和熔融状态下均不存在自由移动的离子。有些分子晶体的水溶液能导电,如HI、CH3COOH等。
III.分子晶体的溶解性一般符合“相似相溶”规律。
[举例]H2O(极性溶剂)—溶解度:SO2(极性分子)>N2(非极性分子)
CCl4(非极性溶剂)—溶解度:I2(非极性分子)>水(极性分子)
原因:分子间作用力很弱
①组成和结构相似的物质(且不含氢键的分子晶体),相对分子质量越大,范德华力越大,熔沸点越高。
②相对分子质量相等或相近,极性分子的范德华力大,熔沸点高。
分子晶体熔沸点的比较规律
如:HI>HBr>HCl。
如:CO>N2
③含有分子间氢键的分子晶体,熔沸点较高。
如:H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
⑤在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。
如沸点:正戊烷>异戊烷>新戊烷;
分子晶体熔沸点的比较规律
④烃、卤代烃、醇、醛、羧酸等有机物一般随分子中碳原子数的增加,熔、沸点升高
如:C2H6> CH4, C2H5CI>CH3CI, CH3COOH> HCOOH。
⑥芳香烃及其衍生物苯环上的同分异构体一般按照“邻位>间位>对位”的顺序。
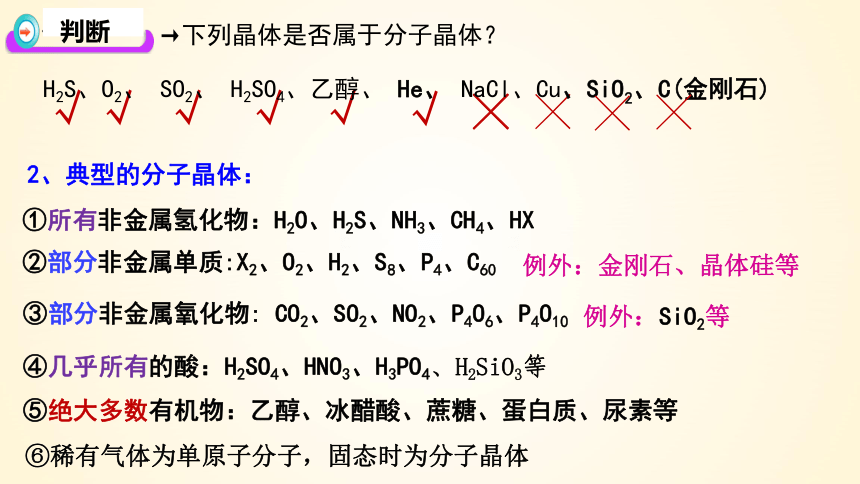
→下列晶体是否属于分子晶体?
√
√
√
√
√
╳
╳
H2S、O2、 SO2、 H2SO4、乙醇、 He、 NaCl、Cu、SiO2、C(金刚石)
判断
√
╳
╳
①所有非金属氢化物:H2O、H2S、NH3、CH4、HX
②部分非金属单质:X2、O2、H2、S8、P4、C60
③部分非金属氧化物: CO2、SO2、NO2、P4O6、P4O10
④几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等
⑤绝大多数有机物:乙醇、冰醋酸、蔗糖、蛋白质、尿素等
2、典型的分子晶体:
例外:金刚石、晶体硅等
例外:SiO2等
⑥稀有气体为单原子分子,固态时为分子晶体
课堂练习1:判断正误
(1)组成分子晶体的微粒是分子,在分子晶体中一定存在共价键和分子间作用力( )
(2)分子晶体熔化时一定破坏范德华力,有些分子晶体还会破坏氢键( )
(3)分子晶体熔化或溶于水均不导电( )
(4)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大( )
(5)水分子间存在着氢键,故水分子较稳定( )
(6)H2SO4为强电解质,硫酸晶体是能导电的( )
(7)SiCl4晶体是分子晶体,熔点高于CCl4( )
×
√
×
×
×
×
√
课堂练习2:比较下列化合物的熔、沸点的高低(填“>”或“<”)
①CO2 SO2; ②NH3 PH3;
③O3 O2; ④Ne Ar;
⑤CH3CH2OH CH3OH; ⑥CO N2;
<
>
>
<
>
>
课堂练习3:已知AlCl3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。
若验证一种化合物是共价化合物还是离子化合物,可测其在熔融状态下是否可导电,若不导电,则是共价化合物,若导电,则是离子化合物。
密堆积——
密堆积指的是晶体中原子或分子的排列方式
一维堆积 球成线
二维堆积 线成面
三维堆积 面成体
密堆积方式
心对心
心对空
非最密堆积
最密堆积
资料链接
(分子间空隙更小)
→微观粒子总是趋向于能充分利用空间的堆积密度最大的那些结构。
√
4、 分子晶体的结构特征
特点:分子间作用力都只是范德华力,在立方体的顶角各有一个分子,6个面的中心又各有一个分子,这种堆积称为分子密堆积。
(1)、分子密堆积
碳60的晶胞
——大多数分子晶体的结构特征
碘晶体晶胞
干冰晶胞
面心立方最密堆积
认识CO2晶体
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
以干冰晶体结构为例分析:分子密堆积的结构
干冰的晶体结构图
中心
CO2分子
①干冰中的CO2分子间只存在 ,不存在 。
②干冰晶胞是一种面心立方结构,每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
氢键
用途:干冰在常压下极易升华,在工业上广泛用作制冷剂。
3.分子晶体的结构特征
总结:干冰晶体的结构特征
④观察分析,有___种取向不同的CO2分子。
顶角一种取向,三对平行面分别为三种取向,所以共有4种取向。
4
二氧化碳与镁的反应
(2Mg+CO2 2MgO+C)。
块状的干冰与镁粉接触面积不大,为什么镁粉可以继续燃烧呢?
现象:镁粉在干冰内继续燃烧,像冰灯中装进一个电灯泡一样,发出耀眼的白光。(切勿用手接触干冰,以免冻伤!)
干冰在常压下极易升华
舞台烟雾特效
装饰菜品
食品冷藏保鲜
二氧化碳与镁的反应
(2Mg+CO2 2MgO+C)。
通常用作制冷剂
只有范德华力→分子密堆积
氧(O2)的晶体结构
碳60的晶胞
→是否所有分子晶体的分子周围与其紧邻且等距的分子都是12个?
Δ
均为面心立方晶胞
碘晶体晶胞
分子周围与其紧邻且等距的分子都是12个
心对空
否
[典例2]冰—非密堆积
冰
氢键具有方向性和饱和性
认识冰晶体
冰的晶体结构
冰晶体中有氢键→分子非密堆积
0-4℃时,当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
水在4℃时的密度最大
①水分子之间的作用力有 ,且主要是 。
②由于氢键具有 ,使四面体中心的每个水分子与 个相邻的水分子相互吸引。
4
范德华力、氢键
氢键
方向性
→冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
总结:冰晶体的结构特征
③水分子以氢键相连接,含1 mol H2O的冰中,最多可形成__ mol“氢键”
2
[思考讨论5]硫化氢和水分子结构相似,但一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,这是为什么?
H2S分子中不存在氢键,晶体堆积方式为最密堆积。
H2O分子中存在氢键,晶体堆积方式为非最密堆积。
①分子间只有范德华力
→分子非密堆积(每个分子周围紧邻的分子少于12个)
②分子间存在范德华力和氢键
总结:分子晶体的结构特征
→分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、O2
如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
③分子晶体中存在单个分子,化学式代表真实的分子组成。
课堂练习5:甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子有12个紧邻的CH4分子C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
B
课堂练习6:医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2熔融状态下不导电;③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是( )
A.HgCl2晶体属于分子晶体
B.HgCl2属于离子化合物
C.HgCl2属于电解质,且属于强电解质
D.HgCl2属于非电解质
A
7.如图为冰晶体的结构模型,大球代表O,小球代表H,下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,不是分子晶体
C.水分子间通过H—O形成冰晶体
D.冰晶体融化时,水分子之间的空隙增大
A
解析 B项,冰晶体属于分子晶体;
C项,水分子间通过分子间作用力、氢键形成晶体;
D项,冰融化,氢键部分断裂,空隙减小。
天然气水合物 ——一种潜在的能源
20世纪末,科学家发现海底存在大量天然气水合物晶体。其主要气体成分是甲烷,称甲烷水合物,外形像冰,在常温常压下会迅速分解释放出甲烷又称“可燃冰”。
P80页“科学·技术·社会”
理想可燃冰化学式8CH4.46H2O,水分子通过氢键形成四边形、五边形或六边形,进而形成笼状多面体。
一种甲烷水合物晶体中,平均每46个水分子构成8个水分子笼,每个水分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,这种可燃冰的平均组成可表示为
A. CH4·5H2O B. CH4·6H2O
C. CH4·7H2O D. CH4·8H2O
迁移练习
D
相当于分子数之比 CH4 : H2O = 6:(46+2) = 1:8
分子
晶体
冰
性质
熔点低
硬度小
不导电
分子
分子间作用力
影响因素
有分子间氢键
只有范德华力
类型
分子密堆积
分子非密堆积
干冰、碘、C60
【课堂小结】
(每个分子周围有12个紧邻的分子)
A、依据物质的类别判断
B、依据组成晶体的粒子及粒子间作用判断
C、依据物质的性质判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
分子晶体硬度小,熔、沸点低,在熔融状态或固体时均不导电。
小结:分子晶体的判断方法
1、下列关于分子晶体的说法正确的是( )
A. 分子内均存在共价键 B. 分子间一定存在范德华力
C. 分子间一定存在氢键 D. 晶体的熔、沸点一般较高
2、下列各组物质都属于分子晶体的是( )
A.碘、二氧化碳、白磷、C60
B.NaCl、二氧化碳、白磷、二氧化硫
C.SO2、金刚石、N2、铜
D.醋酸、甲烷、石墨、氧化钠
B
A
3. 已知氯化铝易溶于苯和乙醚,其熔点为190 ℃,则下列说法不正确的是( )
A.氯化铝是电解质 B.固态氯化铝是分子晶体
C.氯化铝是极性分子 D.氯化铝是非极性分子
C
解析 由“相似相溶”规律可推知AlCl3为非极性分子
4.某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60结构。下列对该分子的叙述中正确的是( )
A.分子中Si60被包裹在C60里面
B.形成的晶体属于分子晶体
C.其摩尔质量为2 400
D.熔点高、硬度大
硅的原子半径比碳大,
所以化合物C60Si60,外层球壳为Si60
该晶体是由分子构成的,属于分子晶体
2 400 g·mol-1
该物质是分子晶体,熔点低,硬度小
D
5.正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。下列有关说法正确的是
A.正硼酸晶体属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
AD
1个H3BO3分子对应6个氢键,
1个氢键被2个H3BO3分子拥有,
因此,含1 mol H3BO3的晶体中有6×1/2=3 mol氢键
√
√
∴每个H3BO3分子拥有该氢键的1/2
(2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。请回答:①AlCl3固体是_______晶体。
②设计一个可靠的实验,判断AlCl3是离子化合物还是共价化合物。
你设计的实验是_______________________________________。
7.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2________SO2 ②NH3________PH3 ③O3________O2
④Ne________Ar ⑤CH3CH2OH______CH3OH ⑥CO_____N2
<
<
>
>
>
>
分子
在熔融状态下,试验其是否导电,
若不导电是共价化合物,若导电是离子化合物
【课堂练习】
(1)N60分子组成的晶体为_____晶体,其熔、沸点比N2____(填“高”或“低”),原因是________________________________________________。
8.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;②N—N的键能为167 kJ·mol-1。
请回答下列问题:
分子
高
N60、N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
注意:回答问题的严谨性和逻辑性
8.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;②N—N的键能为167 kJ·mol-1。
请回答下列问题:
(2)1mol N60分解成N2时_____(填“吸收”或“放出”)的热量是______kJ
(已知N≡N的键能为942 kJ·mol-1),表明稳定性N60 N2。
放出
13230
<
(填“>”“<”或“=”)
(3)由(2)列举N60的用途(举一种):_____________________________。
N60可作高能炸药(答案合理即可)
一个N60分子中,每个N原子均摊到1.5个N-N键
1molN60分子中,含有60×1.5=90mol N-N键
N60 =30 N2
N60分解:
第二节 分子晶体和共价晶体
第三章 晶体结构和性质
第一课时
分子晶体
分子晶体 共价晶体 金属晶体 离子晶体
分子间作用力
金属键
共价键
离子键
根据组成晶体粒子间作用力的不同,对下列各种晶体进行分类:
粒子间作用力
晶体分类
问题1 从组成粒子和粒子间相互作用的角度分析
以下四种晶体结构的共同特点是什么?
【思考与讨论】
碘(I2)
干冰(CO2)
碳60(C60)
冰(H2O)
组成粒子
粒子间相互作用
:分子
:范德华力及氢键
分子晶体
一:分子晶体
1、 概念
只含分子的晶体叫做分子晶体。如图:碘晶体只含I2属于分子晶体。相邻分子靠分子间作用力相互吸引。
构成粒子
分子晶体
分子
粒子间的作用力
分子间作用力
分子内各原子间
共价键
注意:
①并非所有的分子晶体中都含共价键,如稀有气体
②分子晶体熔化时一般破坏分子间作用力
③分子晶体构成微粒是分子,化学式就是分子式
碘晶体晶胞
(1)部分非金属单质:X2、O2、H2、 S8、P4、C60
(4)部分非金属氧化物: CO2、SO2、NO2……
(5)几乎所有的酸: H2SO4、HNO3、H3PO4
(6)绝大多数有机物:乙醇、冰醋酸、蔗糖……
(2)稀有气体:
(除 SiO2 等)
(除B、Si、Ge等的单质、金刚石等)
大部分共价单质和共价化合物
2、 常见的分子晶体
(3)所有非金属氢化物:H2O、H2S、NH3、CH4、HX……
3、分子晶体的物理性质
I.分子晶体具有较低的熔、沸点和较小的硬度。
[注意]分子晶体熔化时破坏的是分子间作用力,分子间作用力很弱。
II.分子晶体不导电。
[提示]分子晶体在固态和熔融状态下均不存在自由移动的离子。有些分子晶体的水溶液能导电,如HI、CH3COOH等。
III.分子晶体的溶解性一般符合“相似相溶”规律。
[举例]H2O(极性溶剂)—溶解度:SO2(极性分子)>N2(非极性分子)
CCl4(非极性溶剂)—溶解度:I2(非极性分子)>水(极性分子)
原因:分子间作用力很弱
①组成和结构相似的物质(且不含氢键的分子晶体),相对分子质量越大,范德华力越大,熔沸点越高。
②相对分子质量相等或相近,极性分子的范德华力大,熔沸点高。
分子晶体熔沸点的比较规律
如:HI>HBr>HCl。
如:CO>N2
③含有分子间氢键的分子晶体,熔沸点较高。
如:H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
⑤在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。
如沸点:正戊烷>异戊烷>新戊烷;
分子晶体熔沸点的比较规律
④烃、卤代烃、醇、醛、羧酸等有机物一般随分子中碳原子数的增加,熔、沸点升高
如:C2H6> CH4, C2H5CI>CH3CI, CH3COOH> HCOOH。
⑥芳香烃及其衍生物苯环上的同分异构体一般按照“邻位>间位>对位”的顺序。
→下列晶体是否属于分子晶体?
√
√
√
√
√
╳
╳
H2S、O2、 SO2、 H2SO4、乙醇、 He、 NaCl、Cu、SiO2、C(金刚石)
判断
√
╳
╳
①所有非金属氢化物:H2O、H2S、NH3、CH4、HX
②部分非金属单质:X2、O2、H2、S8、P4、C60
③部分非金属氧化物: CO2、SO2、NO2、P4O6、P4O10
④几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等
⑤绝大多数有机物:乙醇、冰醋酸、蔗糖、蛋白质、尿素等
2、典型的分子晶体:
例外:金刚石、晶体硅等
例外:SiO2等
⑥稀有气体为单原子分子,固态时为分子晶体
课堂练习1:判断正误
(1)组成分子晶体的微粒是分子,在分子晶体中一定存在共价键和分子间作用力( )
(2)分子晶体熔化时一定破坏范德华力,有些分子晶体还会破坏氢键( )
(3)分子晶体熔化或溶于水均不导电( )
(4)分子晶体的熔、沸点越高,分子晶体中共价键的键能越大( )
(5)水分子间存在着氢键,故水分子较稳定( )
(6)H2SO4为强电解质,硫酸晶体是能导电的( )
(7)SiCl4晶体是分子晶体,熔点高于CCl4( )
×
√
×
×
×
×
√
课堂练习2:比较下列化合物的熔、沸点的高低(填“>”或“<”)
①CO2 SO2; ②NH3 PH3;
③O3 O2; ④Ne Ar;
⑤CH3CH2OH CH3OH; ⑥CO N2;
<
>
>
<
>
>
课堂练习3:已知AlCl3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。
若验证一种化合物是共价化合物还是离子化合物,可测其在熔融状态下是否可导电,若不导电,则是共价化合物,若导电,则是离子化合物。
密堆积——
密堆积指的是晶体中原子或分子的排列方式
一维堆积 球成线
二维堆积 线成面
三维堆积 面成体
密堆积方式
心对心
心对空
非最密堆积
最密堆积
资料链接
(分子间空隙更小)
→微观粒子总是趋向于能充分利用空间的堆积密度最大的那些结构。
√
4、 分子晶体的结构特征
特点:分子间作用力都只是范德华力,在立方体的顶角各有一个分子,6个面的中心又各有一个分子,这种堆积称为分子密堆积。
(1)、分子密堆积
碳60的晶胞
——大多数分子晶体的结构特征
碘晶体晶胞
干冰晶胞
面心立方最密堆积
认识CO2晶体
→分析干冰晶体结构中每个CO2分子周围距离最近紧密相邻的CO2分子共有 个?
分子抽象成质点
干冰的晶胞
面心立方最密堆积
以干冰晶体结构为例分析:分子密堆积的结构
干冰的晶体结构图
中心
CO2分子
①干冰中的CO2分子间只存在 ,不存在 。
②干冰晶胞是一种面心立方结构,每个晶胞中均摊 个CO2分子
③每个CO2分子周围等距离紧邻的CO2分子数为 个。
4
12
范德华力
氢键
用途:干冰在常压下极易升华,在工业上广泛用作制冷剂。
3.分子晶体的结构特征
总结:干冰晶体的结构特征
④观察分析,有___种取向不同的CO2分子。
顶角一种取向,三对平行面分别为三种取向,所以共有4种取向。
4
二氧化碳与镁的反应
(2Mg+CO2 2MgO+C)。
块状的干冰与镁粉接触面积不大,为什么镁粉可以继续燃烧呢?
现象:镁粉在干冰内继续燃烧,像冰灯中装进一个电灯泡一样,发出耀眼的白光。(切勿用手接触干冰,以免冻伤!)
干冰在常压下极易升华
舞台烟雾特效
装饰菜品
食品冷藏保鲜
二氧化碳与镁的反应
(2Mg+CO2 2MgO+C)。
通常用作制冷剂
只有范德华力→分子密堆积
氧(O2)的晶体结构
碳60的晶胞
→是否所有分子晶体的分子周围与其紧邻且等距的分子都是12个?
Δ
均为面心立方晶胞
碘晶体晶胞
分子周围与其紧邻且等距的分子都是12个
心对空
否
[典例2]冰—非密堆积
冰
氢键具有方向性和饱和性
认识冰晶体
冰的晶体结构
冰晶体中有氢键→分子非密堆积
0-4℃时,当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
水在4℃时的密度最大
①水分子之间的作用力有 ,且主要是 。
②由于氢键具有 ,使四面体中心的每个水分子与 个相邻的水分子相互吸引。
4
范德华力、氢键
氢键
方向性
→冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
总结:冰晶体的结构特征
③水分子以氢键相连接,含1 mol H2O的冰中,最多可形成__ mol“氢键”
2
[思考讨论5]硫化氢和水分子结构相似,但一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,这是为什么?
H2S分子中不存在氢键,晶体堆积方式为最密堆积。
H2O分子中存在氢键,晶体堆积方式为非最密堆积。
①分子间只有范德华力
→分子非密堆积(每个分子周围紧邻的分子少于12个)
②分子间存在范德华力和氢键
总结:分子晶体的结构特征
→分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、O2
如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
③分子晶体中存在单个分子,化学式代表真实的分子组成。
课堂练习5:甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子有12个紧邻的CH4分子C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
B
课堂练习6:医院在进行外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2熔融状态下不导电;③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述中正确的是( )
A.HgCl2晶体属于分子晶体
B.HgCl2属于离子化合物
C.HgCl2属于电解质,且属于强电解质
D.HgCl2属于非电解质
A
7.如图为冰晶体的结构模型,大球代表O,小球代表H,下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,不是分子晶体
C.水分子间通过H—O形成冰晶体
D.冰晶体融化时,水分子之间的空隙增大
A
解析 B项,冰晶体属于分子晶体;
C项,水分子间通过分子间作用力、氢键形成晶体;
D项,冰融化,氢键部分断裂,空隙减小。
天然气水合物 ——一种潜在的能源
20世纪末,科学家发现海底存在大量天然气水合物晶体。其主要气体成分是甲烷,称甲烷水合物,外形像冰,在常温常压下会迅速分解释放出甲烷又称“可燃冰”。
P80页“科学·技术·社会”
理想可燃冰化学式8CH4.46H2O,水分子通过氢键形成四边形、五边形或六边形,进而形成笼状多面体。
一种甲烷水合物晶体中,平均每46个水分子构成8个水分子笼,每个水分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,这种可燃冰的平均组成可表示为
A. CH4·5H2O B. CH4·6H2O
C. CH4·7H2O D. CH4·8H2O
迁移练习
D
相当于分子数之比 CH4 : H2O = 6:(46+2) = 1:8
分子
晶体
冰
性质
熔点低
硬度小
不导电
分子
分子间作用力
影响因素
有分子间氢键
只有范德华力
类型
分子密堆积
分子非密堆积
干冰、碘、C60
【课堂小结】
(每个分子周围有12个紧邻的分子)
A、依据物质的类别判断
B、依据组成晶体的粒子及粒子间作用判断
C、依据物质的性质判断
部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物都是分子晶体。
组成分子晶体的微粒是分子,粒子间的作用力是分子间作用力。
分子晶体硬度小,熔、沸点低,在熔融状态或固体时均不导电。
小结:分子晶体的判断方法
1、下列关于分子晶体的说法正确的是( )
A. 分子内均存在共价键 B. 分子间一定存在范德华力
C. 分子间一定存在氢键 D. 晶体的熔、沸点一般较高
2、下列各组物质都属于分子晶体的是( )
A.碘、二氧化碳、白磷、C60
B.NaCl、二氧化碳、白磷、二氧化硫
C.SO2、金刚石、N2、铜
D.醋酸、甲烷、石墨、氧化钠
B
A
3. 已知氯化铝易溶于苯和乙醚,其熔点为190 ℃,则下列说法不正确的是( )
A.氯化铝是电解质 B.固态氯化铝是分子晶体
C.氯化铝是极性分子 D.氯化铝是非极性分子
C
解析 由“相似相溶”规律可推知AlCl3为非极性分子
4.某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60结构。下列对该分子的叙述中正确的是( )
A.分子中Si60被包裹在C60里面
B.形成的晶体属于分子晶体
C.其摩尔质量为2 400
D.熔点高、硬度大
硅的原子半径比碳大,
所以化合物C60Si60,外层球壳为Si60
该晶体是由分子构成的,属于分子晶体
2 400 g·mol-1
该物质是分子晶体,熔点低,硬度小
D
5.正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。下列有关说法正确的是
A.正硼酸晶体属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
AD
1个H3BO3分子对应6个氢键,
1个氢键被2个H3BO3分子拥有,
因此,含1 mol H3BO3的晶体中有6×1/2=3 mol氢键
√
√
∴每个H3BO3分子拥有该氢键的1/2
(2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。请回答:①AlCl3固体是_______晶体。
②设计一个可靠的实验,判断AlCl3是离子化合物还是共价化合物。
你设计的实验是_______________________________________。
7.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2________SO2 ②NH3________PH3 ③O3________O2
④Ne________Ar ⑤CH3CH2OH______CH3OH ⑥CO_____N2
<
<
>
>
>
>
分子
在熔融状态下,试验其是否导电,
若不导电是共价化合物,若导电是离子化合物
【课堂练习】
(1)N60分子组成的晶体为_____晶体,其熔、沸点比N2____(填“高”或“低”),原因是________________________________________________。
8.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;②N—N的键能为167 kJ·mol-1。
请回答下列问题:
分子
高
N60、N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
注意:回答问题的严谨性和逻辑性
8.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N结合三个N原子而形成8电子稳定结构;②N—N的键能为167 kJ·mol-1。
请回答下列问题:
(2)1mol N60分解成N2时_____(填“吸收”或“放出”)的热量是______kJ
(已知N≡N的键能为942 kJ·mol-1),表明稳定性N60 N2。
放出
13230
<
(填“>”“<”或“=”)
(3)由(2)列举N60的用途(举一种):_____________________________。
N60可作高能炸药(答案合理即可)
一个N60分子中,每个N原子均摊到1.5个N-N键
1molN60分子中,含有60×1.5=90mol N-N键
N60 =30 N2
N60分解:
