2.1.1共价键的类型-σ键和π键课件(共64张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.1.1共价键的类型-σ键和π键课件(共64张ppt)化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 13.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-06 00:00:00 | ||
图片预览







文档简介
(共64张PPT)
第一节 共价键
第二章 分子结构和性质
第一课时
共价键
化学键:
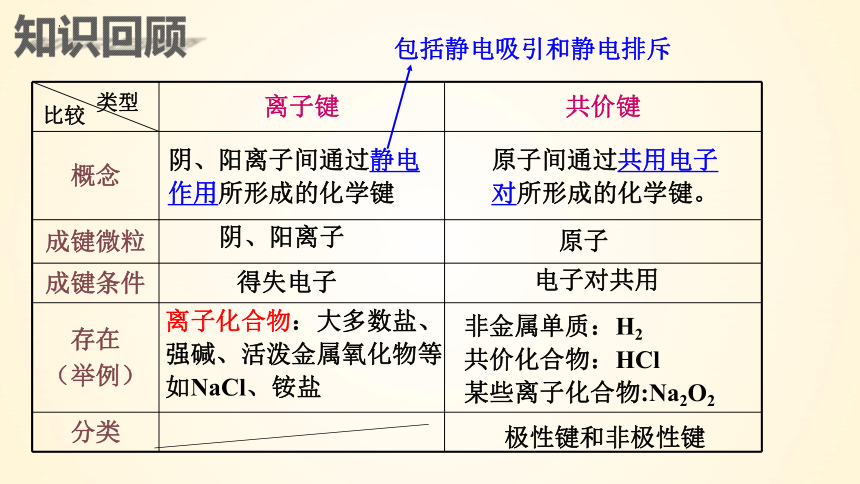
知识回顾
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
离子键 共价键
概念
成键微粒
成键条件
存在 (举例)
分类
类型
比较
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物:大多数盐、强碱、活泼金属氧化物等如NaCl、铵盐
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物:Na2O2
极性键和非极性键
知识回顾
包括静电吸引和静电排斥
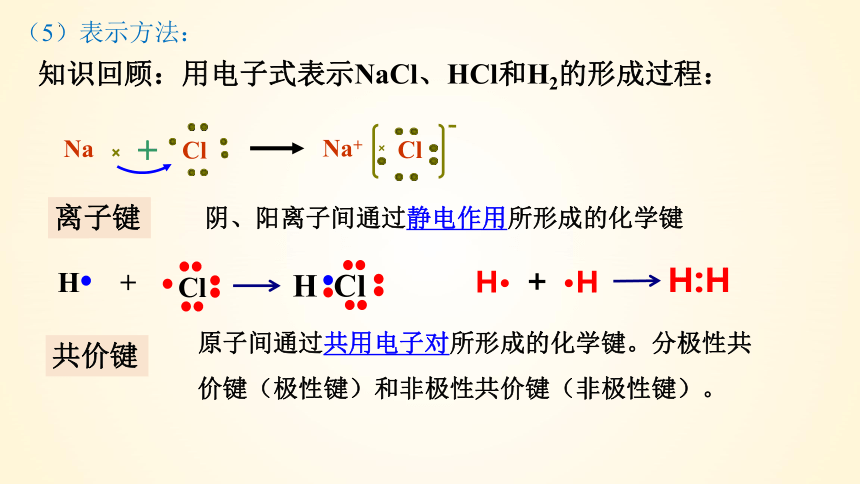
知识回顾:用电子式表示NaCl、HCl和H2的形成过程:
Na+
Cl
Na
Cl
H Cl
H
+
Cl
离子键
共价键
阴、阳离子间通过静电作用所形成的化学键
原子间通过共用电子对所形成的化学键。分极性共价键(极性键)和非极性共价键(非极性键)。
H·
·H
+
H:H
(5)表示方法:
一、共价键
(1)成键粒子:
(2)成键实质:
(3)形成条件:
原子
共用电子对
一般由电负性相同或相差不大的非金属元素的原子结合
(4)共价键的分类
按共用电子对是否发生偏移分类
极性共价键:不同种原子,电子对偏移
非极性共价键:同种原子,电子对不偏移
A-A 型
A-B 型
[练习]书写H2、HCl、Cl2的电子式及形成过程。
H
+
H
H
H
H
+
Cl
Cl
H
Cl
+
Cl
Cl
Cl
氢气(H2)、氯化氢(HCl)、氯气(Cl2)的化学式为什么不是H3、H2Cl、Cl3?
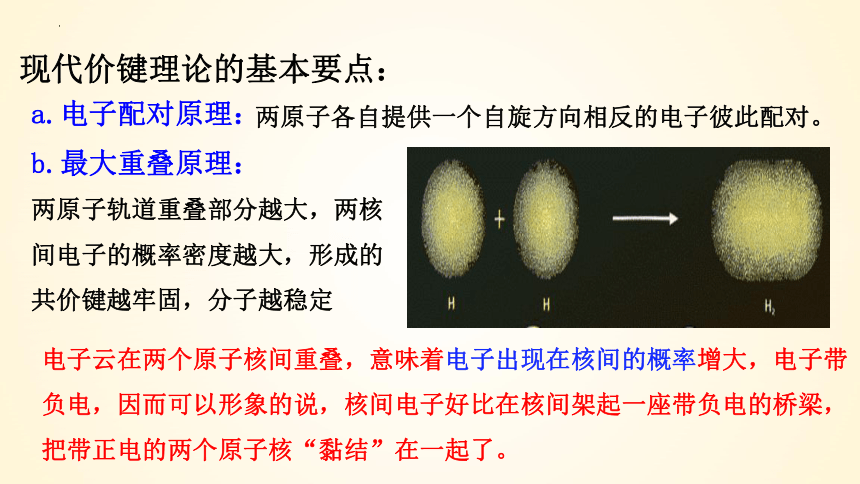
现代价键理论的基本要点:
a.电子配对原理:
b.最大重叠原理:
两原子各自提供一个自旋方向相反的电子彼此配对。
两原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
注意:重叠也不能无限制的重叠,
因核与核之间、电子与电子之间还存在排斥力。
2.最大重叠原理:
要使两个原子轨道重叠部分最大,原子轨道必须按一定的方向进行重叠,这就是共价键的方向性。
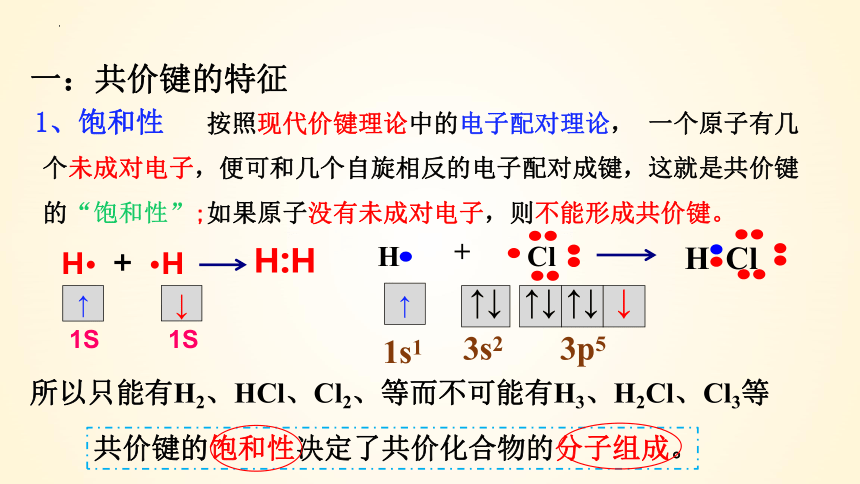
一:共价键的特征
按照现代价键理论中的电子配对理论, 一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”;如果原子没有未成对电子,则不能形成共价键。
1、饱和性
H·
·H
+
H:H
↑
1S
↓
1S
↑↓
↑↓
↑↓
↓
3s2
3p5
H Cl
H
+
Cl
所以只能有H2、HCl、Cl2、等而不可能有H3、H2Cl、Cl3等
1s1
↑
共价键的饱和性决定了共价化合物的分子组成。
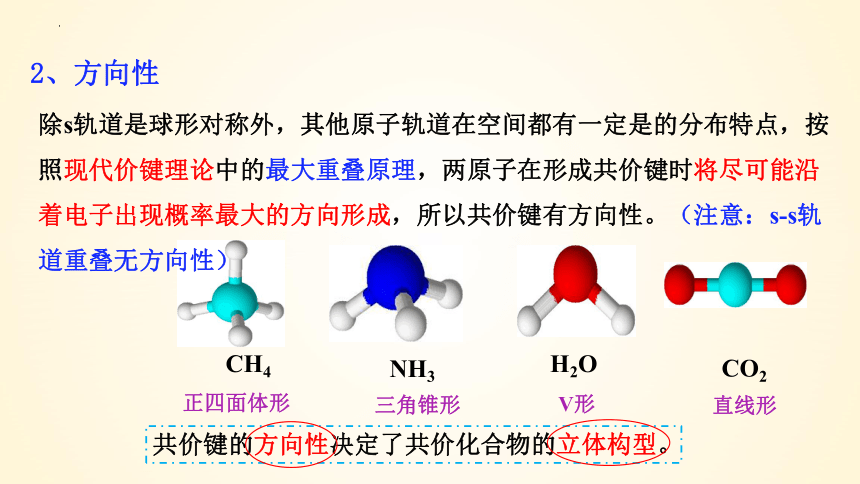
2、方向性
共价键的方向性决定了共价化合物的立体构型。
CH4
NH3
H2O
CO2
正四面体形
三角锥形
V形
直线形
除s轨道是球形对称外,其他原子轨道在空间都有一定是的分布特点,按照现代价键理论中的最大重叠原理,两原子在形成共价键时将尽可能沿着电子出现概率最大的方向形成,所以共价键有方向性。(注意:s-s轨道重叠无方向性)
【思考】
H·
二、共价键的类型
H
H
↑
1S
↑
1S
H
H
↑
1S
↓
1S
╳
H
:
H
·H
+
2.任意两个氢原子一定能形成H2分子吗?
1.两个氢原子为何能成键形成分子?
√
二:共价键的类型
—— σ键和π键
1、 σ键
氢分子、氯化氢分子和氯分子的形成过程
二、共价键的类型
H原子形成H2分子的电子云描述(两个s轨道重叠)
—— σ键和π键
2. σ键的类型:
① s-s σ键
s-s σ键
相互靠拢
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,可以形象地说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
“头碰头”的方式重叠成键
用橡皮泥制作H-H电子云模型
靠 拢
s-s轨道都是球形,从任何方向发生电子云重叠(成键)时,重叠程度相同,因此s-s σ键无方向性。
二、共价键的类型
—— σ键和π键
2. σ键的类型:
② s-p σ键
(一个s轨道与一个p轨道重叠)
HCl分子的形成过程
H
Cl
↑
1s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
H-Cl
Cl
H
3pz
HCl中的共价键是由H原子提供的未成对电子的1s原子轨道和Cl原子提供的未成对电子的3p原子轨道以“头碰头”的方式重叠形成的。
二、共价键的类型
—— σ键和π键
2. σ键的类型:
② s-p σ键
(一个s轨道与一个p轨道重叠)
HCl分子的形成过程
形成H—Cl共价键
s-p σ键
未成对电子的
电子云相互靠拢
电子云相互重叠
情景1
靠 拢
“头碰头”的方式重叠成键
靠 拢
重叠 成键
s-p σ键是有方向性的
用橡皮泥制作H-Cl电子云模型
情景2
原子轨道最大重叠原理
√
╳
二、共价键的类型
—— σ键和π键
2. σ键的类型:
③ p-p σ键
(两个p轨道重叠)
Cl2分子的形成过程
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
Cl
Cl
Cl
Cl
Cl
p-p σ键
二、共价键的类型
—— σ键和π键
2. σ键的类型:
③ p-p σ键
(两个p轨道重叠)
Cl2分子的形成过程
形成Cl—Cl共价键
p-p σ键
未成对电子的
电子云相互靠拢
电子云相互重叠
Cl2中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。
靠 拢
“头碰头”的方式重叠成键
用橡皮泥制作Cl-Cl电子云模型
共价键的深入认识一
H-Cl
H-H
Cl-Cl
请归纳H-H、H-Cl和Cl-Cl的特点。
原子轨道以“头碰头”的方式重叠形成的共价键
小结:
σ键
概念:两原子在成键时,原子轨道以“头碰头”的方式重叠形成的共价键。
①特征:电子云的对称方式:
轴对称
H-Cl
H-H
Cl-Cl
σ键的特征:以形成化学键的两原子核的连线为轴旋转,共价键电子云的图形不变,这种特征称为轴对称。
①特征:电子云的对称方式:
轴对称
③稳定性:形成σ键的原子轨道重叠程度较大,
故σ键有较强稳定性。
②旋转:以形成σ键的两原子核的连线为轴,
任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
④存在:单键均为σ键,双键、三键均有σ键,
任何两个原子形成的共价键且只有一个σ键
概念:两原子在成键时,原子轨道以“头碰头”的方式重叠形成的共价键。
小结:
σ键
⑤σ键的分类
s-s型
s-p型
p-p型
H—H
H—Cl
Cl—Cl
小结:
σ键
课堂练习2:σ键的常见类型有(1)s-s, (2)s-p, (3)p-p, 请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2
s-p
s-p
p-p
s-s
4.σ键的常见类型有(1)s-s, (2)s-p, (3)p-p,
请指出下列分子σ键所属类型:
A、HBr B、NH3 C、F2 D、H2
s-p
s-p
p-p
s-s
3.下列各组物质中,所有化学键都是共价键的是
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和NaCl
C
p轨道与p轨道除了能形成σ键外,还能形成π键。
π键的特征是两个原子轨道以平行或“肩并肩”方式重叠;
原子重叠的部分分别位于两原子核构成平面的两侧。
每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
3.π键
①概念:
二、共价键的类型
—— σ键和π键
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
主要类型为p-p π键
②形成过程可以表示为下图:
成键时,原子轨道以“肩并肩”的方式重叠形成的共价键。
相互靠拢
“肩并肩”
用橡皮泥制作π键的电子云模型。
“肩并肩”的方式重叠成键
靠拢
p-p π键
如果将π键沿着键轴旋转,会发生什么情况呢?
π键的特征:
共价键的深入认识二
①电子云为镜面对称:
每个π键的电子云由两块组成,互为镜像
③π键不能旋转
②π键不如σ键牢固,较易断裂
形成π键时,原子轨道重叠程度比σ键的小,通常情况下,π键没有σ键牢固。
以形成π键的两个原子核的连线为轴,任意一个原子不能单独旋转,若单独旋转则会破坏π键。
2、 π键
氮原子形成氮分子的过程
p-pσ键
p-pπ键
p-pπ键
↑ ↑ ↑
2p3轨道
氮分子的形成过程
↓ ↓ ↓
2p3轨道
x
y
z
x
y
z
N2中共价三键的形成过程
“头碰头”
σ键
x
y
z
x
y
z
N2中共价三键的形成过程
σ键
“头碰头”
“肩并肩”
π键
“肩并肩”
π键
N≡N
z
z
y
y
x
π
π
σ
O2 中 p-p σ键和 p-p π键的形成过程
p-p σ键
p-p π键
两对孤电子对电子云
↑↓ ↑ ↑
2P4轨道
↑↓ ↓ ↓
2P4轨道
3、σ键和 π键的成键规律
②共价单键是σ键;共价双键中一个σ键,另一个π键;共价三键由一个σ键和两个π键
H-H
O=O
N≡N
Cl-C-Cl
O
∣
∣
①s-s电子、s-p电子只形成σ键;p-p电子既形成σ键,又形成π键;且 p-p电子先形成σ键,后形成π键。
1个σ键,1个π键
1个σ键
1个σ键,2个π键
3个σ键,1个π键
注意:σ键能单独存在,π键不能单独存在
课堂练习3:下列关于σ键和π键的说法错误的是( )
含有π键的分子在反应时,π键是化学反应的积极参与者
B. 当原子形成分子时,首先形成σ键,可能形成π键
C. 有些原子在与其它原子形成分子时只能形成σ键,不能形成π键
D. 在分子中,化学键可能只有π键而没有σ键
D
提示: 稀有气体的单质分子中不含化学键;多原子分子中一定含有σ键,可能含有π键。
共价键的类型 σ键 π键
原子轨道重叠方式
原子轨道重叠程度
对称类型
键的强度
旋转情况
成键情况 “头碰头”
“肩并肩”
大
小
轴对称
镜面对称
键的强度大,键牢固
键的强度小,易断裂
单键可以绕键轴任意旋转,不破坏σ键
不能旋转,否则破坏π键
单键都是σ键,双键含一个σ键和一个π键,三键含一个σ键和二个π键
4、σ键和 π键的比较
小 结
双键
单键
三键
1个σ键、1个π键
σ键
1个σ键、2个π键
探究——共价键 课本P36
【问题和预测】(1)观察乙烷、乙烯和乙炔的分子结构,分析分子中的共价键分别由几个σ键和几个π键构成?
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
(1)NH3
(2)C2H4
(3)H2O2
(4)C4H10
3个σ键
5个σ键和1个π键
3个σ键
13个σ键
指出下列共价分子中所含的σ键和π键的数目:
共价键的类型
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C==C键
三键:如N≡N键
(2)按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
(3)按原子轨道的重叠方式
σ键
π键
【课堂小结】
σ键和π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式
原子轨道重叠部位
原子轨道重叠程度
键的强度
成键规律判断 沿键轴方向轴对称,可旋转
(“头碰头”)重叠
沿键轴方向镜面对称,不旋转
(“肩并肩”)重叠
两原子核之间,在键轴处
键轴上方和下方
大
小
σ键强度大,不易断裂,不活泼
π键强度较小,易断裂,活泼
共价单键是σ键;共价双键中一个是σ键,另一个是π键;
共价三键中一个是σ键,另两个是π键
(1)共价化合物。如SO2、CO2、CH4、H2O2、CS2、H2SO4等。
(2)多原子非金属单质分子中。如O2、F2、H2、C60、单质硫、白磷(P4)等,
共价键存在的范围
含有共价键的化合物不一定是共价化合物。
(3)含根的离子化合物 :如NaOH、 Na2O2、 NH4Cl、NH4NO3等。
电子所在的原子轨道都具有一定的形状,原子轨道要取得最大重叠决定了共价键必然具有方向性(s-s 轨道重叠形成的共价键无方向性,例外)。
共价键的特征
——决定原子形成分子时相互结合的数量关系
---决定分子的空间结构
——共价键具有饱和性和方向性。
(1)共价键的饱和性
按照共用电子对理论,一个原子有几个未成对电子,便可以与几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
(2)共价键的方向性
所有的共价键都有饱和性,
但并不是所有的共价键都有方向性
一般:共价键数=单电子数
对于原子之间能否形成π键可依据原子的价电子数确定。
若达到稳定结构只差一个电子,如H、Cl,则只能形成σ键;
若达到稳定结构差两个及两个以上电子;
【规律总结 】
另外需要注意,分子中存在π键,则一定存在σ键,
H2O分子中氧原子只形成σ键,而O2分子中既有σ键,又有π键。
则既能形成σ键,又能形成π键,
但若存在σ键,则不一定存在π键。
如O、N等,
【问题与讨论】钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从原子的电负性差别来理解吗?
原子 Na Cl H Cl C O
电负性
电负性之差(绝对值)
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。 0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
课堂练习4:已知:元素 的电负性为2.5,元素 的电负性为3.5,元素 的电负性为1.2,元素 的电负性为2.4。你认为上述四种元素中,最容易形成共价键的是( @47@ )。
A. 与 B. 与 C. 与 D. 与
B
5、在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有s-s σ键的是:
(5)分子中含有s-p σ 键的是:
(6)分子中含有p-p σ键的是:
② ④ ⑤ ⑦ ⑧
① ② ③ ⑥ ⑦
④ ⑤ ⑧
② ④ ⑤
⑥
① ③ ⑦ ⑧
(H—C≡N)
4、二氯化二硫 是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下 是种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误 的是( @63@ )。
A.电负性:
B.
C.
D.
C
3、下列说法正确的是( )。
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C.一般 键比 键重叠程度大,形成的共价键强
D.气体单质中,一定有 键,可能有 键
C
(1)σ键和π键都只存在于共价分子中( )
(2)两个原子间可以只形成σ键,但不能只形成π键( )
(3)H原子只能形成π键,N原子可以形成σ键和π键( )
判断正误
×
√
×
1.下列说法对σ键和π键的认识不正确的是
A.分子中只要含有共价键,则至少含有一个σ键
B.s-s σ键、p-p σ键与s-p σ键都是轴对称的
C.p-p σ键和p-p π键的重叠方式是相同的
D.含有π键的分子在反应时,π键是化学反应的积极参与者
C
2.丁烯二酸(HOOCCH=CHCOOH)分子结构中含有σ键、π键的个数分别是
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
A
3.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是
A.CH4与NH3 B.C2H6与C2H4
C.H2与Cl2 D.Cl2与N2
A
4.具有下列电子排布式的原子中,不能形成π键的是
A.1s22s22p63s23p4 B.1s22s22p3
C.1s22s22p63s1 D.1s22s22p2
C
四种原子分别是S、N、Na、C
5.下列分子既不存在s-p σ键,也不存在p-p π键的是
A.HCl B.HF
C.CO2 D.SCl2
D
s-p σ键
p-p σ键和p-p π键
s-p σ键
只存在p-p σ键
6.下列物质的化学式和结构式中,从成键情况看不合理的是
A.CH3N: B.CH4S:
C.CH2SeO: D.CH4Si:
D
根据价键理论,C、Si需要形成四个价键,N、P形成三个价键,O、Se形成两个价键,H、Cl、F、Br形成一个价键
7.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A.仅有一个σ键 B.仅有一个π键
C.一个σ键,一个π键 D.一个σ键,两个π键
C
F—N==N—F
N2F2分子结构:
(1)写出A、B、C、D四种元素的元素符号:A___、B____、C___、D___。
8.有A、B、C、D四种元素。已知:①它们均为元素周期表中前20号元素,C、D在同一周期,A、B在同一主族;②它们可以组成化合物B2C2、A2C、DC2等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应产生气体A2,A2与气体C2按体积之比为2∶1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下)。请回答下列问题:
H
Na
O
C
(2)在B2C2、A2C和DC2中,属于离子化合物的是________,
属于共价化合物的是__________,其结构式是____________________。
Na2O2
H2O、CO2
、O=C=O
9.分析下列化学式中画有横线的元素,选出符合要求的物质,填空。
A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2
(1)所有的价电子都参与形成共价键的是_______。
(2)只有一个价电子参与形成共价键的是___。
(3)最外层有未参与成键的电子对的是_____________。
(4)既有σ键又有π键的是___。
D、E
C
A、B、C、F
F
10.(1) 分子中σ键和π键的比例为______。
9∶1
(2)已知反应N2O4(l)+2N2H4(l)=3N2(g)+4H2O(l),若该反应中有4 mol N—H断裂,则形成的π键的数目为______。
3NA
第一节 共价键
第二章 分子结构和性质
第一课时
共价键
化学键:
知识回顾
化学键的类型:离子键、共价键(极性键和非极性键)、金属键。
化学键的存在范围:
分子间不存在化学键。
离子键
共价键
金属键
构成离子化合物
构成共价型分子或原子团
构成金属单质和合金
组成丰富多彩
的物质世界
使离子相结合或原子相结合的强烈相互作用通称为化学键。
只存在于相邻的原子或离子之间。
离子键 共价键
概念
成键微粒
成键条件
存在 (举例)
分类
类型
比较
阴、阳离子间通过静电
作用所形成的化学键
阴、阳离子
得失电子
离子化合物:大多数盐、强碱、活泼金属氧化物等如NaCl、铵盐
原子间通过共用电子对所形成的化学键。
原子
电子对共用
非金属单质:H2
共价化合物:HCl
某些离子化合物:Na2O2
极性键和非极性键
知识回顾
包括静电吸引和静电排斥
知识回顾:用电子式表示NaCl、HCl和H2的形成过程:
Na+
Cl
Na
Cl
H Cl
H
+
Cl
离子键
共价键
阴、阳离子间通过静电作用所形成的化学键
原子间通过共用电子对所形成的化学键。分极性共价键(极性键)和非极性共价键(非极性键)。
H·
·H
+
H:H
(5)表示方法:
一、共价键
(1)成键粒子:
(2)成键实质:
(3)形成条件:
原子
共用电子对
一般由电负性相同或相差不大的非金属元素的原子结合
(4)共价键的分类
按共用电子对是否发生偏移分类
极性共价键:不同种原子,电子对偏移
非极性共价键:同种原子,电子对不偏移
A-A 型
A-B 型
[练习]书写H2、HCl、Cl2的电子式及形成过程。
H
+
H
H
H
H
+
Cl
Cl
H
Cl
+
Cl
Cl
Cl
氢气(H2)、氯化氢(HCl)、氯气(Cl2)的化学式为什么不是H3、H2Cl、Cl3?
现代价键理论的基本要点:
a.电子配对原理:
b.最大重叠原理:
两原子各自提供一个自旋方向相反的电子彼此配对。
两原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
注意:重叠也不能无限制的重叠,
因核与核之间、电子与电子之间还存在排斥力。
2.最大重叠原理:
要使两个原子轨道重叠部分最大,原子轨道必须按一定的方向进行重叠,这就是共价键的方向性。
一:共价键的特征
按照现代价键理论中的电子配对理论, 一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”;如果原子没有未成对电子,则不能形成共价键。
1、饱和性
H·
·H
+
H:H
↑
1S
↓
1S
↑↓
↑↓
↑↓
↓
3s2
3p5
H Cl
H
+
Cl
所以只能有H2、HCl、Cl2、等而不可能有H3、H2Cl、Cl3等
1s1
↑
共价键的饱和性决定了共价化合物的分子组成。
2、方向性
共价键的方向性决定了共价化合物的立体构型。
CH4
NH3
H2O
CO2
正四面体形
三角锥形
V形
直线形
除s轨道是球形对称外,其他原子轨道在空间都有一定是的分布特点,按照现代价键理论中的最大重叠原理,两原子在形成共价键时将尽可能沿着电子出现概率最大的方向形成,所以共价键有方向性。(注意:s-s轨道重叠无方向性)
【思考】
H·
二、共价键的类型
H
H
↑
1S
↑
1S
H
H
↑
1S
↓
1S
╳
H
:
H
·H
+
2.任意两个氢原子一定能形成H2分子吗?
1.两个氢原子为何能成键形成分子?
√
二:共价键的类型
—— σ键和π键
1、 σ键
氢分子、氯化氢分子和氯分子的形成过程
二、共价键的类型
H原子形成H2分子的电子云描述(两个s轨道重叠)
—— σ键和π键
2. σ键的类型:
① s-s σ键
s-s σ键
相互靠拢
原子轨道在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,可以形象地说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
“头碰头”的方式重叠成键
用橡皮泥制作H-H电子云模型
靠 拢
s-s轨道都是球形,从任何方向发生电子云重叠(成键)时,重叠程度相同,因此s-s σ键无方向性。
二、共价键的类型
—— σ键和π键
2. σ键的类型:
② s-p σ键
(一个s轨道与一个p轨道重叠)
HCl分子的形成过程
H
Cl
↑
1s
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
H-Cl
Cl
H
3pz
HCl中的共价键是由H原子提供的未成对电子的1s原子轨道和Cl原子提供的未成对电子的3p原子轨道以“头碰头”的方式重叠形成的。
二、共价键的类型
—— σ键和π键
2. σ键的类型:
② s-p σ键
(一个s轨道与一个p轨道重叠)
HCl分子的形成过程
形成H—Cl共价键
s-p σ键
未成对电子的
电子云相互靠拢
电子云相互重叠
情景1
靠 拢
“头碰头”的方式重叠成键
靠 拢
重叠 成键
s-p σ键是有方向性的
用橡皮泥制作H-Cl电子云模型
情景2
原子轨道最大重叠原理
√
╳
二、共价键的类型
—— σ键和π键
2. σ键的类型:
③ p-p σ键
(两个p轨道重叠)
Cl2分子的形成过程
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s
2s
2p
3s
3p
Cl
Cl
Cl
Cl
Cl
p-p σ键
二、共价键的类型
—— σ键和π键
2. σ键的类型:
③ p-p σ键
(两个p轨道重叠)
Cl2分子的形成过程
形成Cl—Cl共价键
p-p σ键
未成对电子的
电子云相互靠拢
电子云相互重叠
Cl2中的共价键是由2个氯原子各提供1个未成对电子的3p原子轨道重叠形成的。
靠 拢
“头碰头”的方式重叠成键
用橡皮泥制作Cl-Cl电子云模型
共价键的深入认识一
H-Cl
H-H
Cl-Cl
请归纳H-H、H-Cl和Cl-Cl的特点。
原子轨道以“头碰头”的方式重叠形成的共价键
小结:
σ键
概念:两原子在成键时,原子轨道以“头碰头”的方式重叠形成的共价键。
①特征:电子云的对称方式:
轴对称
H-Cl
H-H
Cl-Cl
σ键的特征:以形成化学键的两原子核的连线为轴旋转,共价键电子云的图形不变,这种特征称为轴对称。
①特征:电子云的对称方式:
轴对称
③稳定性:形成σ键的原子轨道重叠程度较大,
故σ键有较强稳定性。
②旋转:以形成σ键的两原子核的连线为轴,
任何一个原子均可以旋转,旋转时并不破坏σ键的结构。
④存在:单键均为σ键,双键、三键均有σ键,
任何两个原子形成的共价键且只有一个σ键
概念:两原子在成键时,原子轨道以“头碰头”的方式重叠形成的共价键。
小结:
σ键
⑤σ键的分类
s-s型
s-p型
p-p型
H—H
H—Cl
Cl—Cl
小结:
σ键
课堂练习2:σ键的常见类型有(1)s-s, (2)s-p, (3)p-p, 请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2
s-p
s-p
p-p
s-s
4.σ键的常见类型有(1)s-s, (2)s-p, (3)p-p,
请指出下列分子σ键所属类型:
A、HBr B、NH3 C、F2 D、H2
s-p
s-p
p-p
s-s
3.下列各组物质中,所有化学键都是共价键的是
A.H2S和Na2O2 B.H2O2和CaF2
C.NH3和N2 D.HNO3和NaCl
C
p轨道与p轨道除了能形成σ键外,还能形成π键。
π键的特征是两个原子轨道以平行或“肩并肩”方式重叠;
原子重叠的部分分别位于两原子核构成平面的两侧。
每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称。
3.π键
①概念:
二、共价键的类型
—— σ键和π键
未成对电子的原子轨道相互靠拢
原子轨道相互重叠
形成的π键
主要类型为p-p π键
②形成过程可以表示为下图:
成键时,原子轨道以“肩并肩”的方式重叠形成的共价键。
相互靠拢
“肩并肩”
用橡皮泥制作π键的电子云模型。
“肩并肩”的方式重叠成键
靠拢
p-p π键
如果将π键沿着键轴旋转,会发生什么情况呢?
π键的特征:
共价键的深入认识二
①电子云为镜面对称:
每个π键的电子云由两块组成,互为镜像
③π键不能旋转
②π键不如σ键牢固,较易断裂
形成π键时,原子轨道重叠程度比σ键的小,通常情况下,π键没有σ键牢固。
以形成π键的两个原子核的连线为轴,任意一个原子不能单独旋转,若单独旋转则会破坏π键。
2、 π键
氮原子形成氮分子的过程
p-pσ键
p-pπ键
p-pπ键
↑ ↑ ↑
2p3轨道
氮分子的形成过程
↓ ↓ ↓
2p3轨道
x
y
z
x
y
z
N2中共价三键的形成过程
“头碰头”
σ键
x
y
z
x
y
z
N2中共价三键的形成过程
σ键
“头碰头”
“肩并肩”
π键
“肩并肩”
π键
N≡N
z
z
y
y
x
π
π
σ
O2 中 p-p σ键和 p-p π键的形成过程
p-p σ键
p-p π键
两对孤电子对电子云
↑↓ ↑ ↑
2P4轨道
↑↓ ↓ ↓
2P4轨道
3、σ键和 π键的成键规律
②共价单键是σ键;共价双键中一个σ键,另一个π键;共价三键由一个σ键和两个π键
H-H
O=O
N≡N
Cl-C-Cl
O
∣
∣
①s-s电子、s-p电子只形成σ键;p-p电子既形成σ键,又形成π键;且 p-p电子先形成σ键,后形成π键。
1个σ键,1个π键
1个σ键
1个σ键,2个π键
3个σ键,1个π键
注意:σ键能单独存在,π键不能单独存在
课堂练习3:下列关于σ键和π键的说法错误的是( )
含有π键的分子在反应时,π键是化学反应的积极参与者
B. 当原子形成分子时,首先形成σ键,可能形成π键
C. 有些原子在与其它原子形成分子时只能形成σ键,不能形成π键
D. 在分子中,化学键可能只有π键而没有σ键
D
提示: 稀有气体的单质分子中不含化学键;多原子分子中一定含有σ键,可能含有π键。
共价键的类型 σ键 π键
原子轨道重叠方式
原子轨道重叠程度
对称类型
键的强度
旋转情况
成键情况 “头碰头”
“肩并肩”
大
小
轴对称
镜面对称
键的强度大,键牢固
键的强度小,易断裂
单键可以绕键轴任意旋转,不破坏σ键
不能旋转,否则破坏π键
单键都是σ键,双键含一个σ键和一个π键,三键含一个σ键和二个π键
4、σ键和 π键的比较
小 结
双键
单键
三键
1个σ键、1个π键
σ键
1个σ键、2个π键
探究——共价键 课本P36
【问题和预测】(1)观察乙烷、乙烯和乙炔的分子结构,分析分子中的共价键分别由几个σ键和几个π键构成?
①乙烷中含有1个C-C键和6个C-H键,所以乙烷中含有7个σ键;
②乙烯中含有1个C=C键和4个C-H键,即含有5个σ键和1个π键;
③乙炔中含有1个三键和2个C-H键,即含有3个σ键和2个π键;
(1)NH3
(2)C2H4
(3)H2O2
(4)C4H10
3个σ键
5个σ键和1个π键
3个σ键
13个σ键
指出下列共价分子中所含的σ键和π键的数目:
共价键的类型
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C==C键
三键:如N≡N键
(2)按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
(3)按原子轨道的重叠方式
σ键
π键
【课堂小结】
σ键和π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式
原子轨道重叠部位
原子轨道重叠程度
键的强度
成键规律判断 沿键轴方向轴对称,可旋转
(“头碰头”)重叠
沿键轴方向镜面对称,不旋转
(“肩并肩”)重叠
两原子核之间,在键轴处
键轴上方和下方
大
小
σ键强度大,不易断裂,不活泼
π键强度较小,易断裂,活泼
共价单键是σ键;共价双键中一个是σ键,另一个是π键;
共价三键中一个是σ键,另两个是π键
(1)共价化合物。如SO2、CO2、CH4、H2O2、CS2、H2SO4等。
(2)多原子非金属单质分子中。如O2、F2、H2、C60、单质硫、白磷(P4)等,
共价键存在的范围
含有共价键的化合物不一定是共价化合物。
(3)含根的离子化合物 :如NaOH、 Na2O2、 NH4Cl、NH4NO3等。
电子所在的原子轨道都具有一定的形状,原子轨道要取得最大重叠决定了共价键必然具有方向性(s-s 轨道重叠形成的共价键无方向性,例外)。
共价键的特征
——决定原子形成分子时相互结合的数量关系
---决定分子的空间结构
——共价键具有饱和性和方向性。
(1)共价键的饱和性
按照共用电子对理论,一个原子有几个未成对电子,便可以与几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
(2)共价键的方向性
所有的共价键都有饱和性,
但并不是所有的共价键都有方向性
一般:共价键数=单电子数
对于原子之间能否形成π键可依据原子的价电子数确定。
若达到稳定结构只差一个电子,如H、Cl,则只能形成σ键;
若达到稳定结构差两个及两个以上电子;
【规律总结 】
另外需要注意,分子中存在π键,则一定存在σ键,
H2O分子中氧原子只形成σ键,而O2分子中既有σ键,又有π键。
则既能形成σ键,又能形成π键,
但若存在σ键,则不一定存在π键。
如O、N等,
【问题与讨论】钠和氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键呢?你能从原子的电负性差别来理解吗?
原子 Na Cl H Cl C O
电负性
电负性之差(绝对值)
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是电负性相差不大的原子之间形成的化学键。 0.9 3.0
2.1 3.0
2.5 3.5
2.1
0.9
1.0
离子
共价
课堂练习4:已知:元素 的电负性为2.5,元素 的电负性为3.5,元素 的电负性为1.2,元素 的电负性为2.4。你认为上述四种元素中,最容易形成共价键的是( @47@ )。
A. 与 B. 与 C. 与 D. 与
B
5、在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧HCN
(1)分子中只有σ 键的是:
(2)分子中含有π键的是:
(3)分子中所有原子均满足最外层8电子结构的是:
(4)分子中含有s-s σ键的是:
(5)分子中含有s-p σ 键的是:
(6)分子中含有p-p σ键的是:
② ④ ⑤ ⑦ ⑧
① ② ③ ⑥ ⑦
④ ⑤ ⑧
② ④ ⑤
⑥
① ③ ⑦ ⑧
(H—C≡N)
4、二氯化二硫 是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下 是种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法
A.电负性:
B.
C.
D.
C
3、下列说法正确的是( )。
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键的电子云图形是镜面对称的,而π键的电子云图形是轴对称的
C.一般 键比 键重叠程度大,形成的共价键强
D.气体单质中,一定有 键,可能有 键
C
(1)σ键和π键都只存在于共价分子中( )
(2)两个原子间可以只形成σ键,但不能只形成π键( )
(3)H原子只能形成π键,N原子可以形成σ键和π键( )
判断正误
×
√
×
1.下列说法对σ键和π键的认识不正确的是
A.分子中只要含有共价键,则至少含有一个σ键
B.s-s σ键、p-p σ键与s-p σ键都是轴对称的
C.p-p σ键和p-p π键的重叠方式是相同的
D.含有π键的分子在反应时,π键是化学反应的积极参与者
C
2.丁烯二酸(HOOCCH=CHCOOH)分子结构中含有σ键、π键的个数分别是
A.4个σ键,1个π键 B.11个σ键,3个π键
C.4个σ键,3个π键 D.9个σ键,5个π键
A
3.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是
A.CH4与NH3 B.C2H6与C2H4
C.H2与Cl2 D.Cl2与N2
A
4.具有下列电子排布式的原子中,不能形成π键的是
A.1s22s22p63s23p4 B.1s22s22p3
C.1s22s22p63s1 D.1s22s22p2
C
四种原子分别是S、N、Na、C
5.下列分子既不存在s-p σ键,也不存在p-p π键的是
A.HCl B.HF
C.CO2 D.SCl2
D
s-p σ键
p-p σ键和p-p π键
s-p σ键
只存在p-p σ键
6.下列物质的化学式和结构式中,从成键情况看不合理的是
A.CH3N: B.CH4S:
C.CH2SeO: D.CH4Si:
D
根据价键理论,C、Si需要形成四个价键,N、P形成三个价键,O、Se形成两个价键,H、Cl、F、Br形成一个价键
7.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是( )
A.仅有一个σ键 B.仅有一个π键
C.一个σ键,一个π键 D.一个σ键,两个π键
C
F—N==N—F
N2F2分子结构:
(1)写出A、B、C、D四种元素的元素符号:A___、B____、C___、D___。
8.有A、B、C、D四种元素。已知:①它们均为元素周期表中前20号元素,C、D在同一周期,A、B在同一主族;②它们可以组成化合物B2C2、A2C、DC2等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应产生气体A2,A2与气体C2按体积之比为2∶1混合后点燃能发生爆炸,其产物是一种无色无味的液体(在常温下)。请回答下列问题:
H
Na
O
C
(2)在B2C2、A2C和DC2中,属于离子化合物的是________,
属于共价化合物的是__________,其结构式是____________________。
Na2O2
H2O、CO2
、O=C=O
9.分析下列化学式中画有横线的元素,选出符合要求的物质,填空。
A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2
(1)所有的价电子都参与形成共价键的是_______。
(2)只有一个价电子参与形成共价键的是___。
(3)最外层有未参与成键的电子对的是_____________。
(4)既有σ键又有π键的是___。
D、E
C
A、B、C、F
F
10.(1) 分子中σ键和π键的比例为______。
9∶1
(2)已知反应N2O4(l)+2N2H4(l)=3N2(g)+4H2O(l),若该反应中有4 mol N—H断裂,则形成的π键的数目为______。
3NA
