6.1.2化学能与电能--2023~2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.2化学能与电能--2023~2024学年高一下学期化学人教版(2019)必修第二册 |
|
|
| 格式 | docx | ||
| 文件大小 | 618.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-07 00:00:00 | ||
图片预览



文档简介
6.1.2化学能与电能 2023~2024学年高一下学期化学人教版(2019)必修第二册
一、单选题,共15小题
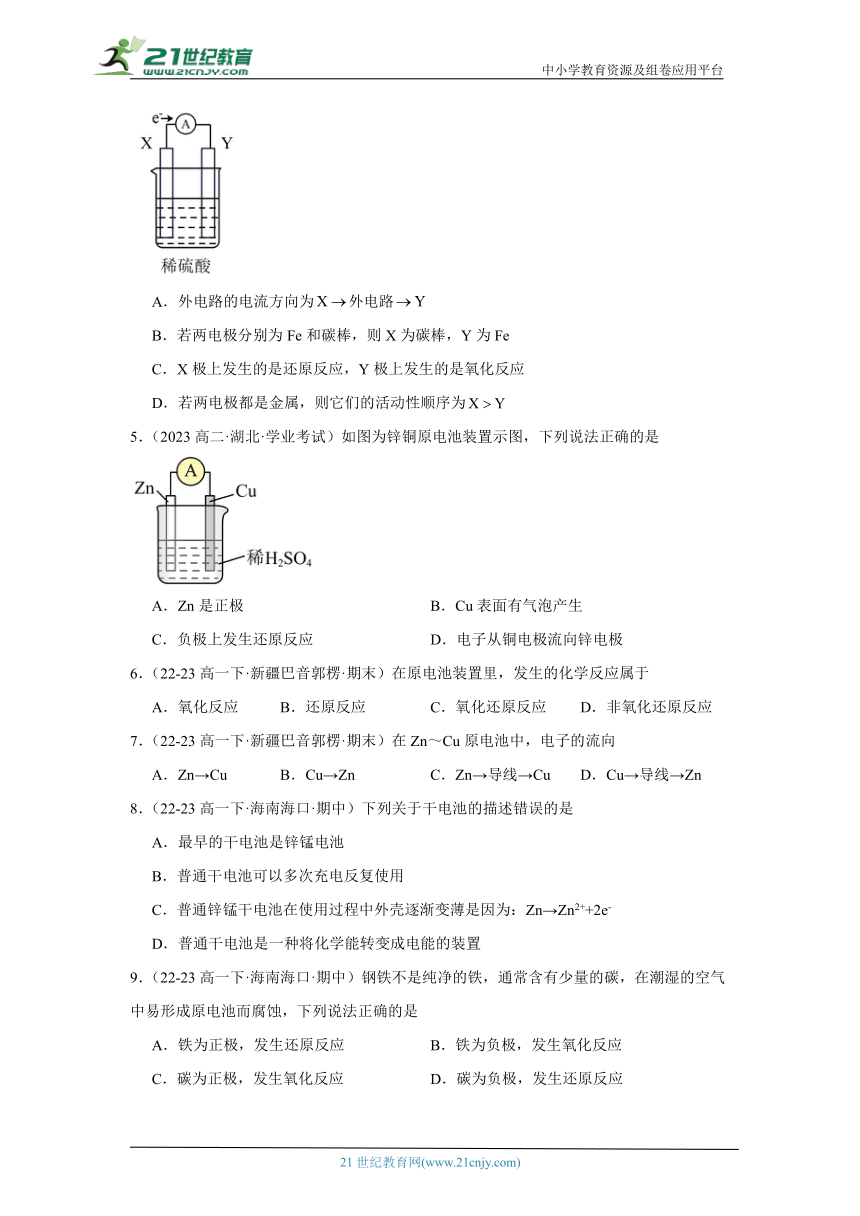
1.(22-23高一下·江苏徐州·阶段练习)下列装置中,能形成原电池的是
A. B.
C. D.
2.(15-16高二上·河北衡水·阶段练习)把 a、b、c、d四种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a,b相连,a为负极;c、d相连,d上有气泡溢出;a,c相连,a质量减少;b,d相连,b为正极。则四种金属的活动性顺序由大到小为
A.a>c>b>d B.a>c>d>b C.b>d>c>a D.a>b>c>d
3.(22-23高一下·福建南平·阶段练习)一种简单的原电池装置如图所示,下列有关说法不正确的是
A.锌作电池的负极,铜作正极
B.电子从锌片流向铜片
C.用石墨电极代替铜片后,石墨电极无明显现象
D.用稀H2SO4代替CuSO4溶液,电流计指针也发生偏转
4.(9-10高一下·辽宁沈阳·期末)如图,在盛有稀的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
A.外电路的电流方向为外电路
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为
5.(2023高二·湖北·学业考试)如图为锌铜原电池装置示图,下列说法正确的是
A.Zn是正极 B.Cu表面有气泡产生
C.负极上发生还原反应 D.电子从铜电极流向锌电极
6.(22-23高一下·新疆巴音郭楞·期末)在原电池装置里,发生的化学反应属于
A.氧化反应 B.还原反应 C.氧化还原反应 D.非氧化还原反应
7.(22-23高一下·新疆巴音郭楞·期末)在Zn~Cu原电池中,电子的流向
A.Zn→Cu B.Cu→Zn C.Zn→导线→Cu D.Cu→导线→Zn
8.(22-23高一下·海南海口·期中)下列关于干电池的描述错误的是
A.最早的干电池是锌锰电池
B.普通干电池可以多次充电反复使用
C.普通锌锰干电池在使用过程中外壳逐渐变薄是因为:Zn→Zn2++2e-
D.普通干电池是一种将化学能转变成电能的装置
9.(22-23高一下·海南海口·期中)钢铁不是纯净的铁,通常含有少量的碳,在潮湿的空气中易形成原电池而腐蚀,下列说法正确的是
A.铁为正极,发生还原反应 B.铁为负极,发生氧化反应
C.碳为正极,发生氧化反应 D.碳为负极,发生还原反应
10.(18-19高一下·湖南张家界·期中)下列图示的装置(电解质溶液为稀硫酸)不能形成原电池的是
A. B.
C. D.
11.(23-24高一下·全国·课后作业)碱性电池具有容量大、放电时电流大等特点。碱性锌锰干电池以氢氧化钾为电解质,电池总反应式为Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,理论上锌的质量减小6.5g
12.(22-23高一下·全国·课后作业)实验探究是提高学习效果的有力手段。某同学用如图所示装置研究原电池原理,下列说法错误的是
A.若将图1装置的Zn、Cu下端接触,Zn片逐渐溶解,Cu片上能看到气泡产生
B.图2中H+向Zn片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中,Zn片减轻的质量相等时,正极产物的质量比为1∶32
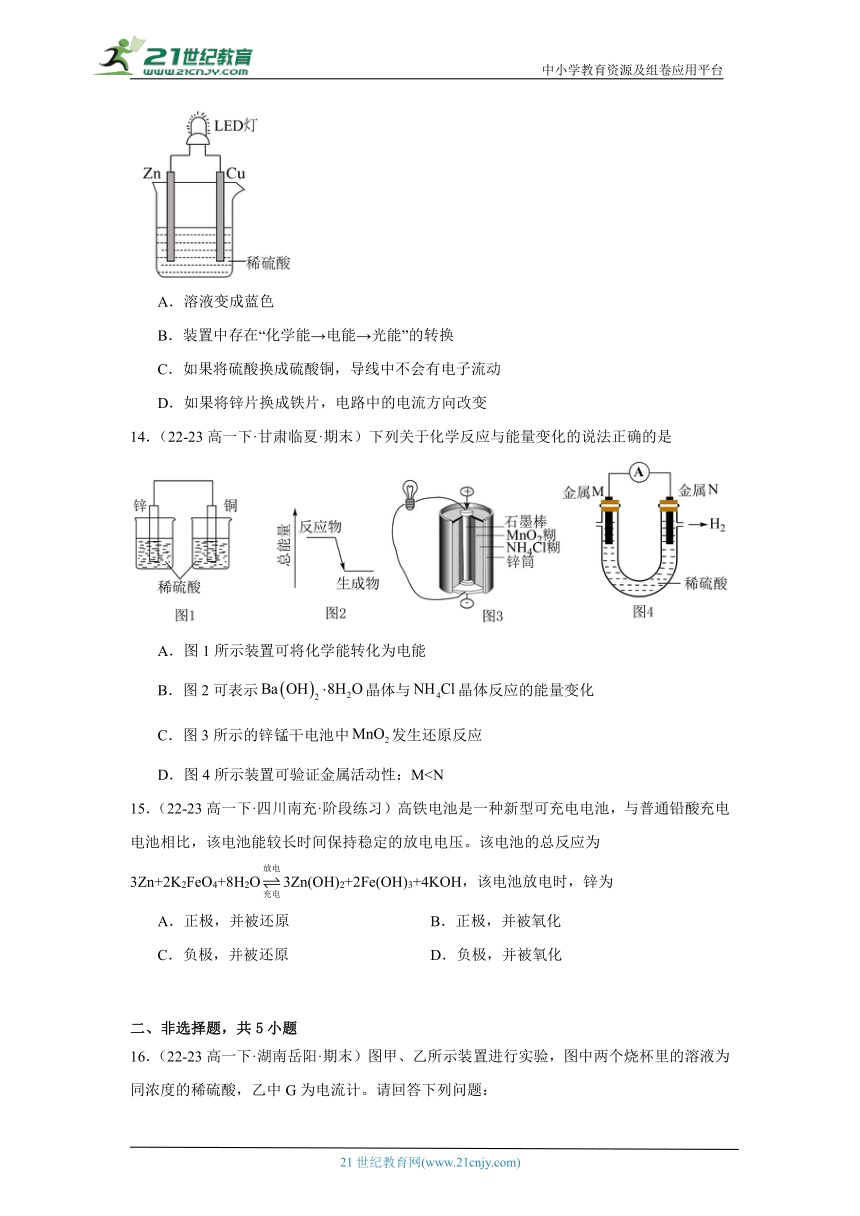
13.(22-23高一下·江苏徐州·期中)如图是课外活动小组设计用化学电源使LED灯发光的装置。下列说法正确的是
A.溶液变成蓝色
B.装置中存在“化学能→电能→光能”的转换
C.如果将硫酸换成硫酸铜,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向改变
14.(22-23高一下·甘肃临夏·期末)下列关于化学反应与能量变化的说法正确的是
A.图1所示装置可将化学能转化为电能
B.图2可表示晶体与晶体反应的能量变化
C.图3所示的锌锰干电池中发生还原反应
D.图4所示装置可验证金属活动性:M15.(22-23高一下·四川南充·阶段练习)高铁电池是一种新型可充电电池,与普通铅酸充电电池相比,该电池能较长时间保持稳定的放电电压。该电池的总反应为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,锌为
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
二、非选择题,共5小题
16.(22-23高一下·湖南岳阳·期末)图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是 。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的均增大
D.乙中电子从铜片经导线流向锌片
E.乙溶液中向锌片方向移动
(2)变化过程中能量转化的形式主要是:甲为 (填写选项字母);乙为 (同前)。
A.将化学能转化成热能 B.将电能转化成为化学能 C.将化学能转化成电能
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为 ;溶液质量增加 g。
(4)下列反应可以作为原电池工作时发生的反应的是:_________。
A.
B.
C.
D.
(5)乙中负极电极反应方程式为: 。
17.(23-24高一下·全国·课时练习)我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。可用作灯塔所需的电池。已知:海水呈弱碱性。
(1)铝板在该电池中作 极,电极反应式为 。
(2)铂电极作 极,电极反应式为 。
18.(23-24高一下·全国·课后作业)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑。判断上述两个反应中能设计成原电池的是 (填“A”或“B”)。
(2)将纯锌片和纯铜片按图中方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲 乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式: 。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,试确定原稀硫酸的物质的量浓度为 。
19.(22-23高一下·上海浦东新·期末)能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,水分解断裂的化学键是 (填“离子键”或“共价键”)。
(2)下列化学反应在理论上可以设计成原电池的是_______(填字母)。
A. B.
C. D.
(3)如图为某燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。回答下列问题:
若该燃料电池为氢氧燃料电池。
①a极通入的物质为 (填物质名称),电解质溶液中的OH-移向 (“负”或“正”)。
②写出此氢氧燃料电池工作时总反应方程式: 。
20.(22-23高一下·上海·课时练习)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,如2Fe3++Cu = 2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- = Cu2+,还原反应式:2Fe3++2e- = 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题。
(1)将反应Zn+2H+= Zn2++H2↑拆写为两个“半反应式”,氧化反应式为: ,还原反应式为: 。
(2)由题(1)反应,设计成原电池如图所示:
若电极a为Zn,电极b可选择材料: (只填一种);电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2+O22H2O,设计出以稀硫酸为电解质溶液的原电池电极反应式:负极 ,正极: 。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.D
【分析】构成原电池的条件有:活泼性不同的两个电极;电解质溶液;形成闭合回路;自发的氧化还原反应。
【详解】A.乙醇是非电解质,不能构成原电池,故A不选;
B.蔗糖是非电解质,不能构成原电池,故B不选;
C.没有形成闭合回路,不能构成原电池,故C不选;
D.有活泼性不同的两个电极,稀硫酸作电解质溶液,构成闭合回路,铁和稀硫酸的反应属于自发的氧化还原反应,能形成原电池,故D选;
故选D。
2.B
【详解】把 a、b、c、d四种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a,b相连,a为负极,说明金属活动性:a>b;若c、d相连,d上有气泡溢出,说明金属活动性;c>d;若a,c相连,a质量减少,说明a为负极,则金属活动性:a>c;若b,d相连,b为正极,则金属活动性:d>b,故四种金属活动性由强到弱的顺序为:a>c>d>b,故合理选项是B。
3.C
【详解】A.锌的活泼性大于铜,锌失电子发生氧化反应,锌作电池的负极,铜作正极,故A正确;
B.锌作电池的负极、铜作正极,电子从锌片经导线流向铜片,故B正确;
C.用石墨电极代替铜片后,石墨为正极,石墨电极反应式为Cu2++2e-=Cu,石墨表面由红色金属铜析出,故C错误;
D.用稀H2SO4代替CuSO4溶液,构成原电池,电流计指针也发生偏转,故D正确;
选C。
4.D
【详解】A.根据图中信息外电路的电子方向为外电路,电路的电流方向为外电路,故A错误;
B.若两电极分别为Fe和碳棒,X为负极,活泼金属,则X为Fe,Y为碳棒,故B错误;
C.X极为负极,发生的是氧化反应,Y极为正极,发生的是还原反应,故C错误;
D.若两电极都是金属,X为负极,一般负极活泼性强,则它们的活动性顺序为,故D正确。
综上所述,答案为D。
5.B
【分析】Zn、Cu、稀硫酸构成原电池,Zn比Cu活泼,Zn作负极,Cu作正极,据此分析解答;
【详解】A.较活泼金属锌为该电池的负极,故A错误;
B.正极铜电极发生还原反应:2H++2e-=H2↑,Cu表面有气泡产生,故B正确;
C.负极锌极失电子发生氧化反应:Zn-2e- =Zn2+,故C错误;
D.电子由负极Zn电极经外电路流向正极Cu电极,故D错误;
故选:B。
6.C
【详解】只有氧化还原反应反应才能设计成原电池,非氧化还原反应没有电子转移,不能设计成原电池,故在原电池装置里,发生的化学反应属于氧化还原反应。
答案选C。
7.C
【详解】在Zn~Cu原电池中,Zn为负极、Cu为正极,则该原电池中电子的流向为Zn→导线→Cu。
答案选C。
8.B
【详解】A.锌锰电池是最早的干电池,故A正确;
B.普通干电池是一次性电池,不像二次电池那样可以多次充电反复使用,故B错误;
C.干电池中的电解质溶液易与锌反应,消耗电解质的量和电极材料,Zn在负极失电子,逐渐溶解导致锌锰干电池在使用过程中外壳逐渐变薄,故C正确;
D.普通干电池属于原电池是化学能转化为电能的装置,故D正确;
故选:B。
9.B
【分析】钢铁在潮湿的空气中易形成原电池而发生吸氧腐蚀。在钢铁发生吸氧腐蚀时,铁作负极发生氧化反应,碳作正极,氧气在正极发生还原反应。
【详解】A.铁为负极,发生氧化反应,故A错误;
B.铁为负极,发生氧化反应,故B正确;
C.碳为正极,发生还原反应,故C错误;
D.碳为负极,发生还原反应,故D错误;
故答案为:B。
10.C
【详解】原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,A、B和D都符合原电池的构成条件,所以能形成原电池,C中不能进行自发的氧化还原反应,所以不能构成原电池;
故选C。
11.C
【分析】由电池总反应式为Zn+2MnO2+H2O=ZnO+2MnOOH可知,Zn在反应中失去电子,发生氧化反应,作负极,MnO2作正极。
【详解】A.根据题意可知,锌作负极失电子,电极反应式为Zn+2OH-+2e-=ZnO+H2O,A正确;
B.正极电极反应式为MnO2+H2O+e-=MnOOH+OH-,B正确;
C.原电池工作时,电子由负极通过外电路流向正极,C错误;
D.根据锌电极反应式Zn+2OH--2e-=ZnO+H2O可知,外电路中每通过0.2mol电子,有0.1mol锌参加反应,其质量为6.5g,D正确。
故选C。
12.B
【详解】A.Zn、Cu直接接触就能构成闭合回路而形成原电池,Zn片逐渐溶解,Cu片上可看到有气泡产生,A正确;
B.图2中原电池工作时,Zn作负极,Cu作正极,H+带正电荷,应该向正极Cu片移动,B错误;
C.由于Mg的失电子能力强于Zn,所以将Zn片改为Mg片后,电子转移速率加快,生成H2的速率也加快,C正确;
D.图2中假设负极消耗65 g Zn,则转移2 mol电子,正极产生2 g H2,而图3中负极消耗65 g Zn,也转移2 mol电子,则正极析出64 g Cu,正极产物的质量比为1∶32,D正确;
故选B。
13.B
【详解】A.该装置组成锌铜原电池,锌作负极失去电子变成锌离子,铜作正极,铜本身不参与反应,溶液不会变成蓝色,A项错误;
B.原电池是化学能转化为电能的装置,原电池产生的电能在电路中转化为LED灯的光能,所以装置中存在“化学能→电能→光能”的转换,B项正确;
C.如果将硫酸换成硫酸铜,仍能形成原电池,导线中会有电子流动,C项错误;
D.如果将锌片换成铁片,铁比铜活泼,铁仍旧作负极,电路中的电流方向不改变,D项错误;
故选B。
14.C
【详解】A.图1没有形成闭合电路,需要盐桥,所示装置不能构成原电池,不能将化学能转化为电能,故A错误;
B.图2所示,为放热反应,Ba(OH)2 8H2O晶体与NH4Cl反应为吸热反应,故B错误;
C.锌锰干电池中,锌失电子发生氧化反应,锌筒作负极,MnO2做正极,发生还原反应,故C正确;
D.图4所示装置为原电池,正极发生还原反应,产物为H2,负极发生氧化反应,负极金属活动性强,活动性 M>N,D错误;
故答案为:C。
15.D
【详解】根据电池总方程式3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH可知,放电时锌失去电子作负极,被氧化;
故选D。
16.(1)CE
(2) A C
(3) 63
(4)AD
(5)
【详解】(1)A.甲中锌铜没有形成闭合电路,没有构成原电池,故A错误;
B.甲中锌铜没有形成闭合电路,甲中铜片表面没有气泡产生,故B错误;
C.两烧杯中均发生反应Zn+H2SO4=ZnSO4+H2,氢离子浓度降低,溶液的均增大,故C正确;
D.乙构成原电池,锌是负极、铜是正极,电子从锌片经导线流向铜片,故D错误;
E.乙构成原电池,锌是负极、铜是正极,乙溶液中向锌片方向移动,故E正确;
选CE。
(2)甲没有构成原电池,将化学能转化成热能,选A;乙为原电池,将化学能转化成电能,选C。
(3)根据Zn+H2SO4=ZnSO4+H2,Zn元素化合价由0升高为+2,氢元素化合价由+1降低为0,若反应过程中有电子发生转移,反应消耗1molZn、生成1mol氢气,则生成的氢气在标况下的体积为22.4L;溶液质量增加65g-2g=63g。
(4)A. 是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选A;
B. 不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选B;
C. 不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选C;
D. 是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选D;
选AD。
(5)锌的活泼性大于铜,乙中锌为负极,负极电极反应方程式为。
17.(1) 负 4Al-12e-+12OH-=4Al(OH)3
(2) 正 3O2+6H2O+12e-=12OH-
【分析】根据电池总反应为4Al+3O2+6H2O=4Al(OH)3可知,Al失电子,做负极,氧气得电子,在正极发生反应。
【详解】(1)Al失电子发生氧化反应,则Al作负极,电极反应式为4Al-12e-+12OH-=4Al(OH)3。
(2)铂电极作正极,发生还原反应,电极反应式为3O2+6H2O+12e-=12OH-。
18.(1)B
(2) BD > Zn-2e-=Zn2+ 1 mol/L
【详解】(1)自发的氧化还原反应可以设计为原电池,故选B;
(2)①由图可知,甲装置是原电池,是将化学能转化为电能的装置,锌为负极,反应为Zn-2e-=Zn2+,铜为正极,反应为2H++2e-=H2↑,铜片质量不变,反应中消耗稀硫酸,溶液的c(H+)减小,溶液pH增大;乙装置没有形成闭合回路,不是原电池装置,乙池中反应为Zn+2H+=Zn2++H2↑,锌片溶解,表面产生气泡,铜片表面无明显变化,消耗稀硫酸,溶液的c(H+)减小,故答案选BD;
②甲装置为原电池装置,加快反应速率,则甲烧杯中产生气泡的速度快;
③甲装置中锌为负极,电极反应式为Zn-2e-=Zn2+;
④乙池中产生标准状况下1.12L氢气,则消耗硫酸为,烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L,则剩余硫酸的物质的量为,故原稀硫酸的物质的量浓度为。
19.(1)共价键
(2)A
(3) 氢气 负
【详解】(1)水是共价化合物,分子中只存在共价键,则水分解时断裂的化学键是共价键;
(2)根据原电池的形成条件可知,必须是自发进行的氧化还原反应才可能从理论上将其设计为原电池;
A.Fe+2FeCl3=3FeCl2是一个自发进行的氧化还原反应,可以设计为原电池,A符合题意;
B.是一个自发进行的非氧化还原反应,不可以设计成原电池,B错误;
C.是一个非自发进行的氧化还原反应,不可以设计为原电池,C错误;
D.是一个自发进行的非氧化还原反应,不可以设计成原电池, D错误;
故选A;
(3)①由电子流向可知,a极为负极,通入的物质为氢气,氢气失去电子发生氧化反应;原电池中阴离子向负极迁移,故电解质溶液中的OH-移向负极。
②氢氧燃料电池工作时总反应方程式:。
20.(1) Zn-2e-=Zn2+ 2H++2e-=H2↑
(2) Cu ZnSO4 2H++2e-=H2↑
(3) 2H2-4e-=4H+ O2+4H++4e-=2H2O
【详解】(1)将反应Zn+2H+= Zn2++H2↑拆写为两个“半反应式”,氧化反应是指失电子的反应,反应中锌失电子,所以氧化反应式为:Zn-2e-=Zn2+,还原反应是指得电子的反应,反应中氢离子得电子,所以还原反应式为:2H++2e-=H2↑,故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)由题(1)反应,即Zn+2H+= Zn2++H2↑,反应实质是锌与稀硫酸反应,装置是有盐桥的原电池,盐桥的存在可以避免电极与电解质溶液直接反应,若电极a为Zn,电极b应该是可以导电而且活泼性比锌弱的电极,可选择材料铜等,电极a为锌,所以电解质溶液甲是ZnSO4,由反应实质得电解质溶液乙是稀硫酸,电极b处的电极反应式为2H++2e-=H2↑,故答案为:Cu;ZnSO4;2H++2e-=H2↑;
(3)以稀硫酸为电解质溶液的氢氧燃料电池,氢气在负极发生氧化反应,电极反应式为2H2-4e-=4H+,氧气在正极发生还原反应,酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:2H2-4e-=4H+;O2+4H++4e-=2H2O。
答案第1页,共2页
答案第1页,共2页
一、单选题,共15小题
1.(22-23高一下·江苏徐州·阶段练习)下列装置中,能形成原电池的是
A. B.
C. D.
2.(15-16高二上·河北衡水·阶段练习)把 a、b、c、d四种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a,b相连,a为负极;c、d相连,d上有气泡溢出;a,c相连,a质量减少;b,d相连,b为正极。则四种金属的活动性顺序由大到小为
A.a>c>b>d B.a>c>d>b C.b>d>c>a D.a>b>c>d
3.(22-23高一下·福建南平·阶段练习)一种简单的原电池装置如图所示,下列有关说法不正确的是
A.锌作电池的负极,铜作正极
B.电子从锌片流向铜片
C.用石墨电极代替铜片后,石墨电极无明显现象
D.用稀H2SO4代替CuSO4溶液,电流计指针也发生偏转
4.(9-10高一下·辽宁沈阳·期末)如图,在盛有稀的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
A.外电路的电流方向为外电路
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为
5.(2023高二·湖北·学业考试)如图为锌铜原电池装置示图,下列说法正确的是
A.Zn是正极 B.Cu表面有气泡产生
C.负极上发生还原反应 D.电子从铜电极流向锌电极
6.(22-23高一下·新疆巴音郭楞·期末)在原电池装置里,发生的化学反应属于
A.氧化反应 B.还原反应 C.氧化还原反应 D.非氧化还原反应
7.(22-23高一下·新疆巴音郭楞·期末)在Zn~Cu原电池中,电子的流向
A.Zn→Cu B.Cu→Zn C.Zn→导线→Cu D.Cu→导线→Zn
8.(22-23高一下·海南海口·期中)下列关于干电池的描述错误的是
A.最早的干电池是锌锰电池
B.普通干电池可以多次充电反复使用
C.普通锌锰干电池在使用过程中外壳逐渐变薄是因为:Zn→Zn2++2e-
D.普通干电池是一种将化学能转变成电能的装置
9.(22-23高一下·海南海口·期中)钢铁不是纯净的铁,通常含有少量的碳,在潮湿的空气中易形成原电池而腐蚀,下列说法正确的是
A.铁为正极,发生还原反应 B.铁为负极,发生氧化反应
C.碳为正极,发生氧化反应 D.碳为负极,发生还原反应
10.(18-19高一下·湖南张家界·期中)下列图示的装置(电解质溶液为稀硫酸)不能形成原电池的是
A. B.
C. D.
11.(23-24高一下·全国·课后作业)碱性电池具有容量大、放电时电流大等特点。碱性锌锰干电池以氢氧化钾为电解质,电池总反应式为Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,理论上锌的质量减小6.5g
12.(22-23高一下·全国·课后作业)实验探究是提高学习效果的有力手段。某同学用如图所示装置研究原电池原理,下列说法错误的是
A.若将图1装置的Zn、Cu下端接触,Zn片逐渐溶解,Cu片上能看到气泡产生
B.图2中H+向Zn片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中,Zn片减轻的质量相等时,正极产物的质量比为1∶32
13.(22-23高一下·江苏徐州·期中)如图是课外活动小组设计用化学电源使LED灯发光的装置。下列说法正确的是
A.溶液变成蓝色
B.装置中存在“化学能→电能→光能”的转换
C.如果将硫酸换成硫酸铜,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向改变
14.(22-23高一下·甘肃临夏·期末)下列关于化学反应与能量变化的说法正确的是
A.图1所示装置可将化学能转化为电能
B.图2可表示晶体与晶体反应的能量变化
C.图3所示的锌锰干电池中发生还原反应
D.图4所示装置可验证金属活动性:M
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
二、非选择题,共5小题
16.(22-23高一下·湖南岳阳·期末)图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是 。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的均增大
D.乙中电子从铜片经导线流向锌片
E.乙溶液中向锌片方向移动
(2)变化过程中能量转化的形式主要是:甲为 (填写选项字母);乙为 (同前)。
A.将化学能转化成热能 B.将电能转化成为化学能 C.将化学能转化成电能
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为 ;溶液质量增加 g。
(4)下列反应可以作为原电池工作时发生的反应的是:_________。
A.
B.
C.
D.
(5)乙中负极电极反应方程式为: 。
17.(23-24高一下·全国·课时练习)我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。可用作灯塔所需的电池。已知:海水呈弱碱性。
(1)铝板在该电池中作 极,电极反应式为 。
(2)铂电极作 极,电极反应式为 。
18.(23-24高一下·全国·课后作业)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑。判断上述两个反应中能设计成原电池的是 (填“A”或“B”)。
(2)将纯锌片和纯铜片按图中方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲 乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式: 。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,试确定原稀硫酸的物质的量浓度为 。
19.(22-23高一下·上海浦东新·期末)能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,水分解断裂的化学键是 (填“离子键”或“共价键”)。
(2)下列化学反应在理论上可以设计成原电池的是_______(填字母)。
A. B.
C. D.
(3)如图为某燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。回答下列问题:
若该燃料电池为氢氧燃料电池。
①a极通入的物质为 (填物质名称),电解质溶液中的OH-移向 (“负”或“正”)。
②写出此氢氧燃料电池工作时总反应方程式: 。
20.(22-23高一下·上海·课时练习)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,如2Fe3++Cu = 2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- = Cu2+,还原反应式:2Fe3++2e- = 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题。
(1)将反应Zn+2H+= Zn2++H2↑拆写为两个“半反应式”,氧化反应式为: ,还原反应式为: 。
(2)由题(1)反应,设计成原电池如图所示:
若电极a为Zn,电极b可选择材料: (只填一种);电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2+O22H2O,设计出以稀硫酸为电解质溶液的原电池电极反应式:负极 ,正极: 。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.D
【分析】构成原电池的条件有:活泼性不同的两个电极;电解质溶液;形成闭合回路;自发的氧化还原反应。
【详解】A.乙醇是非电解质,不能构成原电池,故A不选;
B.蔗糖是非电解质,不能构成原电池,故B不选;
C.没有形成闭合回路,不能构成原电池,故C不选;
D.有活泼性不同的两个电极,稀硫酸作电解质溶液,构成闭合回路,铁和稀硫酸的反应属于自发的氧化还原反应,能形成原电池,故D选;
故选D。
2.B
【详解】把 a、b、c、d四种金属浸入稀硫酸中,用导线两两相连可以组成各种原电池。若a,b相连,a为负极,说明金属活动性:a>b;若c、d相连,d上有气泡溢出,说明金属活动性;c>d;若a,c相连,a质量减少,说明a为负极,则金属活动性:a>c;若b,d相连,b为正极,则金属活动性:d>b,故四种金属活动性由强到弱的顺序为:a>c>d>b,故合理选项是B。
3.C
【详解】A.锌的活泼性大于铜,锌失电子发生氧化反应,锌作电池的负极,铜作正极,故A正确;
B.锌作电池的负极、铜作正极,电子从锌片经导线流向铜片,故B正确;
C.用石墨电极代替铜片后,石墨为正极,石墨电极反应式为Cu2++2e-=Cu,石墨表面由红色金属铜析出,故C错误;
D.用稀H2SO4代替CuSO4溶液,构成原电池,电流计指针也发生偏转,故D正确;
选C。
4.D
【详解】A.根据图中信息外电路的电子方向为外电路,电路的电流方向为外电路,故A错误;
B.若两电极分别为Fe和碳棒,X为负极,活泼金属,则X为Fe,Y为碳棒,故B错误;
C.X极为负极,发生的是氧化反应,Y极为正极,发生的是还原反应,故C错误;
D.若两电极都是金属,X为负极,一般负极活泼性强,则它们的活动性顺序为,故D正确。
综上所述,答案为D。
5.B
【分析】Zn、Cu、稀硫酸构成原电池,Zn比Cu活泼,Zn作负极,Cu作正极,据此分析解答;
【详解】A.较活泼金属锌为该电池的负极,故A错误;
B.正极铜电极发生还原反应:2H++2e-=H2↑,Cu表面有气泡产生,故B正确;
C.负极锌极失电子发生氧化反应:Zn-2e- =Zn2+,故C错误;
D.电子由负极Zn电极经外电路流向正极Cu电极,故D错误;
故选:B。
6.C
【详解】只有氧化还原反应反应才能设计成原电池,非氧化还原反应没有电子转移,不能设计成原电池,故在原电池装置里,发生的化学反应属于氧化还原反应。
答案选C。
7.C
【详解】在Zn~Cu原电池中,Zn为负极、Cu为正极,则该原电池中电子的流向为Zn→导线→Cu。
答案选C。
8.B
【详解】A.锌锰电池是最早的干电池,故A正确;
B.普通干电池是一次性电池,不像二次电池那样可以多次充电反复使用,故B错误;
C.干电池中的电解质溶液易与锌反应,消耗电解质的量和电极材料,Zn在负极失电子,逐渐溶解导致锌锰干电池在使用过程中外壳逐渐变薄,故C正确;
D.普通干电池属于原电池是化学能转化为电能的装置,故D正确;
故选:B。
9.B
【分析】钢铁在潮湿的空气中易形成原电池而发生吸氧腐蚀。在钢铁发生吸氧腐蚀时,铁作负极发生氧化反应,碳作正极,氧气在正极发生还原反应。
【详解】A.铁为负极,发生氧化反应,故A错误;
B.铁为负极,发生氧化反应,故B正确;
C.碳为正极,发生还原反应,故C错误;
D.碳为负极,发生还原反应,故D错误;
故答案为:B。
10.C
【详解】原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,A、B和D都符合原电池的构成条件,所以能形成原电池,C中不能进行自发的氧化还原反应,所以不能构成原电池;
故选C。
11.C
【分析】由电池总反应式为Zn+2MnO2+H2O=ZnO+2MnOOH可知,Zn在反应中失去电子,发生氧化反应,作负极,MnO2作正极。
【详解】A.根据题意可知,锌作负极失电子,电极反应式为Zn+2OH-+2e-=ZnO+H2O,A正确;
B.正极电极反应式为MnO2+H2O+e-=MnOOH+OH-,B正确;
C.原电池工作时,电子由负极通过外电路流向正极,C错误;
D.根据锌电极反应式Zn+2OH--2e-=ZnO+H2O可知,外电路中每通过0.2mol电子,有0.1mol锌参加反应,其质量为6.5g,D正确。
故选C。
12.B
【详解】A.Zn、Cu直接接触就能构成闭合回路而形成原电池,Zn片逐渐溶解,Cu片上可看到有气泡产生,A正确;
B.图2中原电池工作时,Zn作负极,Cu作正极,H+带正电荷,应该向正极Cu片移动,B错误;
C.由于Mg的失电子能力强于Zn,所以将Zn片改为Mg片后,电子转移速率加快,生成H2的速率也加快,C正确;
D.图2中假设负极消耗65 g Zn,则转移2 mol电子,正极产生2 g H2,而图3中负极消耗65 g Zn,也转移2 mol电子,则正极析出64 g Cu,正极产物的质量比为1∶32,D正确;
故选B。
13.B
【详解】A.该装置组成锌铜原电池,锌作负极失去电子变成锌离子,铜作正极,铜本身不参与反应,溶液不会变成蓝色,A项错误;
B.原电池是化学能转化为电能的装置,原电池产生的电能在电路中转化为LED灯的光能,所以装置中存在“化学能→电能→光能”的转换,B项正确;
C.如果将硫酸换成硫酸铜,仍能形成原电池,导线中会有电子流动,C项错误;
D.如果将锌片换成铁片,铁比铜活泼,铁仍旧作负极,电路中的电流方向不改变,D项错误;
故选B。
14.C
【详解】A.图1没有形成闭合电路,需要盐桥,所示装置不能构成原电池,不能将化学能转化为电能,故A错误;
B.图2所示,为放热反应,Ba(OH)2 8H2O晶体与NH4Cl反应为吸热反应,故B错误;
C.锌锰干电池中,锌失电子发生氧化反应,锌筒作负极,MnO2做正极,发生还原反应,故C正确;
D.图4所示装置为原电池,正极发生还原反应,产物为H2,负极发生氧化反应,负极金属活动性强,活动性 M>N,D错误;
故答案为:C。
15.D
【详解】根据电池总方程式3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH可知,放电时锌失去电子作负极,被氧化;
故选D。
16.(1)CE
(2) A C
(3) 63
(4)AD
(5)
【详解】(1)A.甲中锌铜没有形成闭合电路,没有构成原电池,故A错误;
B.甲中锌铜没有形成闭合电路,甲中铜片表面没有气泡产生,故B错误;
C.两烧杯中均发生反应Zn+H2SO4=ZnSO4+H2,氢离子浓度降低,溶液的均增大,故C正确;
D.乙构成原电池,锌是负极、铜是正极,电子从锌片经导线流向铜片,故D错误;
E.乙构成原电池,锌是负极、铜是正极,乙溶液中向锌片方向移动,故E正确;
选CE。
(2)甲没有构成原电池,将化学能转化成热能,选A;乙为原电池,将化学能转化成电能,选C。
(3)根据Zn+H2SO4=ZnSO4+H2,Zn元素化合价由0升高为+2,氢元素化合价由+1降低为0,若反应过程中有电子发生转移,反应消耗1molZn、生成1mol氢气,则生成的氢气在标况下的体积为22.4L;溶液质量增加65g-2g=63g。
(4)A. 是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选A;
B. 不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选B;
C. 不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选C;
D. 是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选D;
选AD。
(5)锌的活泼性大于铜,乙中锌为负极,负极电极反应方程式为。
17.(1) 负 4Al-12e-+12OH-=4Al(OH)3
(2) 正 3O2+6H2O+12e-=12OH-
【分析】根据电池总反应为4Al+3O2+6H2O=4Al(OH)3可知,Al失电子,做负极,氧气得电子,在正极发生反应。
【详解】(1)Al失电子发生氧化反应,则Al作负极,电极反应式为4Al-12e-+12OH-=4Al(OH)3。
(2)铂电极作正极,发生还原反应,电极反应式为3O2+6H2O+12e-=12OH-。
18.(1)B
(2) BD > Zn-2e-=Zn2+ 1 mol/L
【详解】(1)自发的氧化还原反应可以设计为原电池,故选B;
(2)①由图可知,甲装置是原电池,是将化学能转化为电能的装置,锌为负极,反应为Zn-2e-=Zn2+,铜为正极,反应为2H++2e-=H2↑,铜片质量不变,反应中消耗稀硫酸,溶液的c(H+)减小,溶液pH增大;乙装置没有形成闭合回路,不是原电池装置,乙池中反应为Zn+2H+=Zn2++H2↑,锌片溶解,表面产生气泡,铜片表面无明显变化,消耗稀硫酸,溶液的c(H+)减小,故答案选BD;
②甲装置为原电池装置,加快反应速率,则甲烧杯中产生气泡的速度快;
③甲装置中锌为负极,电极反应式为Zn-2e-=Zn2+;
④乙池中产生标准状况下1.12L氢气,则消耗硫酸为,烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L,则剩余硫酸的物质的量为,故原稀硫酸的物质的量浓度为。
19.(1)共价键
(2)A
(3) 氢气 负
【详解】(1)水是共价化合物,分子中只存在共价键,则水分解时断裂的化学键是共价键;
(2)根据原电池的形成条件可知,必须是自发进行的氧化还原反应才可能从理论上将其设计为原电池;
A.Fe+2FeCl3=3FeCl2是一个自发进行的氧化还原反应,可以设计为原电池,A符合题意;
B.是一个自发进行的非氧化还原反应,不可以设计成原电池,B错误;
C.是一个非自发进行的氧化还原反应,不可以设计为原电池,C错误;
D.是一个自发进行的非氧化还原反应,不可以设计成原电池, D错误;
故选A;
(3)①由电子流向可知,a极为负极,通入的物质为氢气,氢气失去电子发生氧化反应;原电池中阴离子向负极迁移,故电解质溶液中的OH-移向负极。
②氢氧燃料电池工作时总反应方程式:。
20.(1) Zn-2e-=Zn2+ 2H++2e-=H2↑
(2) Cu ZnSO4 2H++2e-=H2↑
(3) 2H2-4e-=4H+ O2+4H++4e-=2H2O
【详解】(1)将反应Zn+2H+= Zn2++H2↑拆写为两个“半反应式”,氧化反应是指失电子的反应,反应中锌失电子,所以氧化反应式为:Zn-2e-=Zn2+,还原反应是指得电子的反应,反应中氢离子得电子,所以还原反应式为:2H++2e-=H2↑,故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)由题(1)反应,即Zn+2H+= Zn2++H2↑,反应实质是锌与稀硫酸反应,装置是有盐桥的原电池,盐桥的存在可以避免电极与电解质溶液直接反应,若电极a为Zn,电极b应该是可以导电而且活泼性比锌弱的电极,可选择材料铜等,电极a为锌,所以电解质溶液甲是ZnSO4,由反应实质得电解质溶液乙是稀硫酸,电极b处的电极反应式为2H++2e-=H2↑,故答案为:Cu;ZnSO4;2H++2e-=H2↑;
(3)以稀硫酸为电解质溶液的氢氧燃料电池,氢气在负极发生氧化反应,电极反应式为2H2-4e-=4H+,氧气在正极发生还原反应,酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:2H2-4e-=4H+;O2+4H++4e-=2H2O。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
