2024年中考化学二轮题型突破限时精练 化学计算 (含解析)
文档属性
| 名称 | 2024年中考化学二轮题型突破限时精练 化学计算 (含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 324.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-06 00:00:00 | ||
图片预览




文档简介
2024年中考化学二轮题型突破限时精练 化学计算
知识点回顾(时间:5分钟)
知识点一、根据化学式的相关计算
以化合物AaBb为例,可推导出下列计算公式
1.相对分子质量:相对分子质量=A的相对原子质量×a+B的相对原子质量×b;
2.A、B原子个数比==
3.A、B元素质量比==
4.A元素的质量分数=A元素的质量分数=×100%
5.A元素的质量=化合物(AaBb)质量×A元素的质量分数
知识点二、有关溶液的计算
1.溶液质量=溶质质量+溶剂质量
溶质质量分数=×100% 变形后为:溶质质量=溶液质量×溶质质量分数
2.溶液稀释计算主要是根据稀释前后溶质质量相等列式:若浓溶液的质量为m浓,质量分数为a%,加m水稀释后质量分数为b%,则可列式为:m浓·a%=(m浓+m水)·b%
3.化学方程式反映的是纯净物间的质量关系,涉及到的一般都是溶液中的溶质的质量,常要用到的公式:
m溶质=m溶液×a%,然后把得到的溶质的质量代入方程式计算。
知识点三、能根据化学方程式进行纯净物质间的计算
1.知道反应物(或生成物)的质量求生成物(或反应物)的质量。
2.根据质量守恒定律的化学方程式的计算
此内容是本课时的拓展,一类习题可根据质量守恒定律的定义或实质,利用反应物前后物质或元素质量守恒进行计算。另一类习题还可根据反应前后物质质量之差,算出气体或沉淀物的质量,再进行化学方程式的计算。
解题步骤:
(1)设未知量,用x、y等字母表示(不带单位);
(2)正确写出有关的化学方程式(注意配平);
(3)找出相关物质间的质量关系,写在对应化学式的下面;
(4)列出比例式,求出未知量;
(5)简明写出答案。
注意事项:
①根据化学方程式计算要注意解题格式化,准确列出有关反应物或生成物质量比,特别是相对分子质量的计算;
②题设中未知数没有单位,求出的未知数应带单位;
③计算中已知量每步都要带单位。
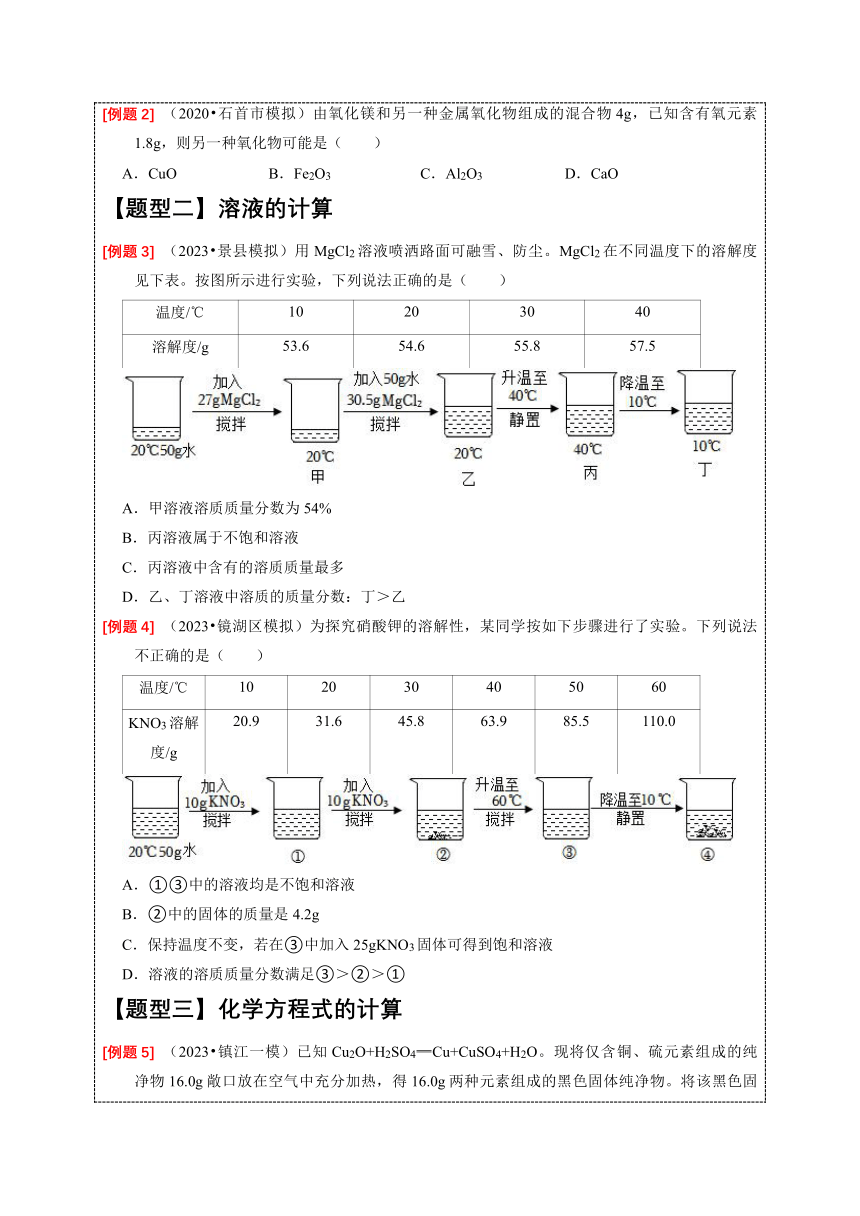
【题型一】化学式的计算 (2022 滨湖区一模)技术人员对甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)的混合水溶液进行测定,发现其中氧元素的质量分数为64%,则该溶液中溶剂水的质量分数为( ) A.30% B.36% C.64% D.72% (2020 石首市模拟)由氧化镁和另一种金属氧化物组成的混合物4g,已知含有氧元素1.8g,则另一种氧化物可能是( ) A.CuO B.Fe2O3 C.Al2O3 D.CaO 【题型二】溶液的计算 (2023 景县模拟)用MgCl2溶液喷洒路面可融雪、防尘。MgCl2在不同温度下的溶解度见下表。按图所示进行实验,下列说法正确的是( ) 温度/℃10203040溶解度/g53.654.655.857.5
A.甲溶液溶质质量分数为54% B.丙溶液属于不饱和溶液 C.丙溶液中含有的溶质质量最多 D.乙、丁溶液中溶质的质量分数:丁>乙 (2023 镜湖区模拟)为探究硝酸钾的溶解性,某同学按如下步骤进行了实验。下列说法不正确的是( ) 温度/℃102030405060KNO3溶解度/g20.931.645.863.985.5110.0
A.①③中的溶液均是不饱和溶液 B.②中的固体的质量是4.2g C.保持温度不变,若在③中加入25gKNO3固体可得到饱和溶液 D.溶液的溶质质量分数满足③>②>① 【题型三】化学方程式的计算 (2023 镇江一模)已知Cu2O+H2SO4═Cu+CuSO4+H2O。现将仅含铜、硫元素组成的纯净物16.0g敞口放在空气中充分加热,得16.0g两种元素组成的黑色固体纯净物。将该黑色固体纯净物放在密闭容器中继续加热至t℃,固体全部变红,冷却得13.6g Cu与Cu2O的固体混合物。将此混合物放入96.0g足量稀H2SO4中,充分反应,得蓝色溶液和红色固体。下列说法正确的是( ) A.灼烧过程中产生3.2g SO2 B.铜、硫元素组成的化合物的化学式为CuS C.充分反应后所得蓝色溶液溶质质量分数为8% D.若将13.6g固体混合物与足量的CO高温充分反应,可生成3.2g CO2 (2023 巴南区模拟)甲醛(HCHO)是一种防腐剂,同时也是一种有毒物质。为了测定溶液中甲醛的含量。某同学取含甲醛的溶液10.0g,滴加过量酸性KMnO4溶液11.1g,(反应的方程式为:4KMnO4+5HCHO+6H2SO4═2K2SO4+4MnSO4+5CO2↑+11H2O );整个过程中无沉淀产生。将产生的气体用40.0g10%NaOH溶液恰好完全吸收,吸收后溶液的总质量为41.1g;试计算。(已知MnSO4的相对分子质量为151) (1)甲醛中碳、氢元素的质量比 。 (2)若用20%的溶液配制40.0g10%的NaOH,需要加入水的质量。 (3)所得溶液中MnSO4的质量分数。
难度:★★★ 建议时间:25分钟
(2021 广元模拟)取一定质量的碳酸钙,高温加热一段时间后,得到碳酸钙和氧化钙的固体混合物,其中碳、氧元素质量比为1:5,那么该固体混合物中碳酸钙和氧化钙的质量比为( )
A.7:25 B.50:21 C.21:50 D.25:14
(2023 东莞市校级二模)高铁酸钾[K2FeO4]能溶于水,是高效、多功能水处理剂.K2FeO4中铁元素的化合价为( )
A.﹣1 B.+2 C.+3 D.+6
(2023 双流区校级模拟)甲原子与乙原子的质量比为a:b,而乙原子与碳原子的质量比为c:d,则甲原子的相对原子质量为( )
A. B. C. D.
(2023 临汾一模)氮元素对地球上的生命极其重要,它不仅是组成蛋白质必不可少的元素,还是核酸等生命物质的重要成分。下列五种物质:NH3、N2、NO、X、HNO3,均含有氮元素,且氮元素的化合价按照一定顺序排列,则物质X是( )
A.NaNO3 B.N2O C.N2O5 D.NO2
(2023 衡阳县模拟)在C2H4、C2H5OH的混合物中,已知氧元素的质量分数为y,则碳元素的质量分数为( )
A.(1) B.(1) C.(1) D.(1)
(2023 古交市校级一模)笑气是人类最早应用于医疗的麻醉剂之一,如果长期过量吸入笑气,就会对人体造成不可逆的伤害。笑气是氮的一种氧化物,该氧化物中氮元素的化合价为+1,笑气的化学式是( )
A.N2 B.N2O C.N2O4 D.NO2
(2023 丰台区二模)如图是KNO3的溶解度曲线,下列说法正确的是( )
A.20℃时,向100g水中加入40gKNO3,得到140g溶液
B.40℃时,KNO3饱和溶液的溶质质量分数为63.9%
C.60℃时,KNO3饱和溶液中溶质与溶剂的质量比为11:10
D.将60℃的KNO3饱和溶液降温至40℃,溶液质量不变
(2023 民权县一模)固体硝酸钾、硝酸钠的溶解度曲线如图所示。下列说法正确的是( )
A.在t1℃时,硝酸钾、硝酸钠溶液的溶质质量分数相等
B.硝酸钾、硝酸钠的溶液从t2℃降温至t1℃一定有晶体析出
C.t2℃时,向30 g硝酸钾的饱和溶液中加10 g水可得到20%的溶液
D.将t1℃时两固体的饱和溶液分别升温至t2℃,两溶液的溶质质量分数相等
(2023 南山区校级三模)t1℃时,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示;升温到t2℃时(忽略水分蒸发),现象如图乙所示;图丙是a、b两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.图丙中曲线N表示b物质的溶解度曲线
B.图甲中两烧杯内a、b溶液的溶质质量分数相等
C.图乙中烧杯内b溶液的溶质质量分数为25%
D.可用降温结晶的方法从饱和a溶液中得到固体a
(2023 桐柏县三模)Mg、Al、Fe的固体混合物21.4g加入一定量的H2SO4恰好完全反应,反应后的溶液质量增加了21.2g,将反应后溶液蒸干得到固体的质量为( )
A.21.6g B.31.0g C.38.5g D.42.4g
(2023 东莞市二模)从微观上看,化学反应是微观粒子按一定的数目关系进行的。某碳氢化合物(化学式为CxHy)在密闭容器内充分燃烧,生成二氧化碳和水。部分物质的分子数随反应过程的变化如图所示。下列说法正确的是( )
A.该反应前后分子数目不变
B.t时刻,容器中O2和CO2的质量相等
C.该碳氢化合物的化学式为C3H8
D.该反应生成的二氧化碳和水的质量之比为22:9
(2023 蕲春县模拟)氧化亚铜(Cu2O)是鲜红色粉末状固体,可用作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂等。现将Cu2O和Cu的固体混合物6.8g放入烧杯中,加入足量的稀硫酸,充分反应后,过滤、洗涤、干燥,得到4.8g固体。(已知Cu2O+H2SO4=CuSO4+Cu+H2O)。则原混合物中的Cu2O和Cu质量比为( )
A.9:8 B.17:12 C.1:1 D.9:4
(2023 天宁区校级模拟)“天宫课堂”中宇航员将维生素C泡腾片[含维生素C、柠檬酸( C6H8O7)和碳酸氢钠]塞入一个水球,水球里立即产生很多气泡,其中一个反应为:C6H8O7+xNaHCO3═NaxC6H8﹣xO7+xH2O+xCO2↑。为测定柠檬酸钠(NaxC6H8﹣xO7)化学式中的x,用4套相同装置加等量的水后,分别装入如表所示质量的柠檬酸和碳酸氢钠固体进行实验测得该条件下数据如表,推测x的数值为( )
实验组别 柠檬酸/g 碳酸氢钠/g 气体体积/mL
1 1.92 0.84 224
2 1.92 1.68 448
3 1.92 2.52 672
4 1.92 3.36 672
A.4 B.3 C.2 D.1
(2023 临沂一模)习近平总书记用“文明其精神,野蛮其体魄”来激励青少年多运动,重视强身健体。因为运动时,身体可以产生多巴胺,让人心情舒畅,缓解焦虑,提高身体免疫力。多巴胺的化学式为C8H11NO2。
(1)在多巴胺中,氮元素和氧元素的质量比为 (填最简整数比);
(2)多巴胺中碳元素的质量分数 (精确到0.1%)。
(2023 河西区一模)条形码的黏性主要来源于合成胶黏剂丙烯酸,化学式为C3H4O2。计算:
(1)丙烯酸的相对分子质量为 ;
(2)丙烯酸中碳、氧元素的质量比为 (填最简比);
(3)丙烯酸中碳元素的质量分数为 ;
(4)3.6g丙烯酸中含有的碳元素的质量是 g。
(2023 嘉禾县校级二模)山西老陈醋是中国四大名醋之一可促进胃液分泌,抑制血糖升高,降低血脂。陈醋中含有乙酸(化学式CH3COOH),如图是某品牌陈醋的部分标签。
(1)乙酸的相对分子质量为 。
(2)乙酸中氢、氧元素的质量比是 。
(3)一瓶陈醋中至少含有碳元素的质量是多少(写出计算过程)
(2023 魏县一模)在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
(1)该温度下,实验①所得溶液是 溶液(填“饱和”或“不饱和”)。
(2)实验③所得溶液中溶质的质量分数是 (写出计算过程)
(3)现有溶质质量分数为10%的KCl的溶液300g,若配制成溶质质量分数为3%的KCl的溶液,问需要加水的质量是多少。(写出计算过程)
(2023 邹平市二模)化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有50g废液的锥形瓶中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)该反应是 (填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为 ℃。
(3)计算废液中硫酸的质量分数。(写出计算过程)
(2023 唐山模拟)医学上常用过氧化氢溶液来清洗创口和局部抗菌,玲玲同学取68.0g某医用过氧化氢溶液放入锥形瓶中,然后加入2.0g二氧化锰,每隔一分钟观察并记录一次锥形瓶及物质的质量(如表),直到实验结束。
时间/分钟 0 1 2 3 4 5
锥形瓶及物质质量/g 100 99.3 98.9 98.6 98.4 98.4
请计算:
(1)共生成氧气 g。
(2)过氧化氢溶液中溶质的质量分数。
(2023 重庆模拟)新冠疫情中常用84消毒液进行环境消毒,其主要成分是次氯酸钠(NaClO)。制备次氯酸钠的发生器中发生反应的总化学方程式为:NaCl+H2ONaClO+H2↑。现电解600g溶质的质量分数为26%的氯化钠溶液一段时间,溶液质量减少4g(假设不考虑其他副产物)。请计算:
(1)NaCl中氯元素的质量分数 (填“>”、“=”或“<”)NaClO中氯元素的质量分数。
(2)电解所得溶液中次氯酸钠的质量分数。
(3)用于电解的600g26%的氯化钠溶液是通过在10%的氯化钠溶液中加入氯化钠固体的方式配制的,计算需要加入NaCl固体的质量。(计算结果保留一位小数)
参考答案与详细解析
知识点回顾(时间:5分钟)
知识点一、根据化学式的相关计算
以化合物AaBb为例,可推导出下列计算公式
1.相对分子质量:相对分子质量=A的相对原子质量×a+B的相对原子质量×b;
2.A、B原子个数比==
3.A、B元素质量比==
4.A元素的质量分数=A元素的质量分数=×100%
5.A元素的质量=化合物(AaBb)质量×A元素的质量分数
知识点二、有关溶液的计算
1.溶液质量=溶质质量+溶剂质量
溶质质量分数=×100% 变形后为:溶质质量=溶液质量×溶质质量分数
2.溶液稀释计算主要是根据稀释前后溶质质量相等列式:若浓溶液的质量为m浓,质量分数为a%,加m水稀释后质量分数为b%,则可列式为:m浓·a%=(m浓+m水)·b%
3.化学方程式反映的是纯净物间的质量关系,涉及到的一般都是溶液中的溶质的质量,常要用到的公式:
m溶质=m溶液×a%,然后把得到的溶质的质量代入方程式计算。
知识点三、能根据化学方程式进行纯净物质间的计算
1.知道反应物(或生成物)的质量求生成物(或反应物)的质量。
2.根据质量守恒定律的化学方程式的计算
此内容是本课时的拓展,一类习题可根据质量守恒定律的定义或实质,利用反应物前后物质或元素质量守恒进行计算。另一类习题还可根据反应前后物质质量之差,算出气体或沉淀物的质量,再进行化学方程式的计算。
解题步骤:
(1)设未知量,用x、y等字母表示(不带单位);
(2)正确写出有关的化学方程式(注意配平);
(3)找出相关物质间的质量关系,写在对应化学式的下面;
(4)列出比例式,求出未知量;
(5)简明写出答案。
注意事项:
①根据化学方程式计算要注意解题格式化,准确列出有关反应物或生成物质量比,特别是相对分子质量的计算;
②题设中未知数没有单位,求出的未知数应带单位;
③计算中已知量每步都要带单位。
【题型一】化学式的计算 (2022 滨湖区一模)技术人员对甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)的混合水溶液进行测定,发现其中氧元素的质量分数为64%,则该溶液中溶剂水的质量分数为( ) A.30% B.36% C.64% D.72% 【解答】解:根据甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)和水的分子式,可以发现四种物质中,H和O的原子个数比均为2:1,则该混合物中氢元素和氧元素的质量比为(1×2):(16×1)=1:8,其中氧元素的质量分数为64%,则氢元素质量分数为8%,故碳元素的质量分数为1﹣64%﹣8%=28%,对甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)三种物质的化学式可以改写成CH2O、(CH2O)2、(CH2O)3,因此可以将混合物看出是分子式为CH2O的有机物与H2O的结合,碳元素的质量分数为28%,则CH2O的质量分数为,故水的质量分数为1﹣70%=30%。 故选:A。 (2020 石首市模拟)由氧化镁和另一种金属氧化物组成的混合物4g,已知含有氧元素1.8g,则另一种氧化物可能是( ) A.CuO B.Fe2O3 C.Al2O3 D.CaO 【解答】解:混合物中氧元素的质量分数为100%=45%; 氧化镁(MgO)中氧元素的质量分数为:; 所以要达到混合物中氧元素的质量分数为45%,另一种金属氧化物中氧元素的质量分数需大于45%; A、CuO中氧元素的质量分数为:100%=20%<45%,故A不适合。 B、Fe2O3中氧元素的质量分数为:100%=30%<45%,故B不适合。 C、Al2O3中氧元素的质量分数为:100%≈47.1%>45%,故C适合。 D、CaO中氧元素的质量分数为:100%≈28.6%<45%,故D不适合。 故选:C。 【题型二】溶液的计算 (2023 景县模拟)用MgCl2溶液喷洒路面可融雪、防尘。MgCl2在不同温度下的溶解度见下表。按图所示进行实验,下列说法正确的是( ) 温度/℃10203040溶解度/g53.654.655.857.5
A.甲溶液溶质质量分数为54% B.丙溶液属于不饱和溶液 C.丙溶液中含有的溶质质量最多 D.乙、丁溶液中溶质的质量分数:丁>乙 【解答】解:A、由表格数据可知:20℃时氯化镁的溶解度为54.6g,故此时50g水最多溶解54.6g÷2=27.3g氯化镁,故甲溶液为该温度下该物质的不饱和溶液,其中溶质质量分数为,说法错误,不符合题意; B、由表格数据可知:40℃时氯化镁的溶解度为57.5g,丙体系中有50g+50=100g水和27g+30.5g=57.5g氯化镁,此时氯化镁恰好完全溶解,丙溶液属于饱和溶液,说法错误,不符合题意; C、丙溶液中溶剂质量为100g、溶质质量为57.5g,而氯化镁溶解度随温度的升高而增大,丙溶液温度为40℃,其温度最大,故丙溶液中含有的溶质质量最多,说法正确,符合题意; D、由表格数据可知:20℃时氯化镁的溶解度为54.6g,乙溶液的溶质质量分数为,10℃时氯化镁的溶解度为53.6g,丁溶液的溶质质量分数为,乙、丁溶液中溶质的质量分数:丁<乙,说法错误,不符合题意; 故选:C。 (2023 镜湖区模拟)为探究硝酸钾的溶解性,某同学按如下步骤进行了实验。下列说法不正确的是( ) 温度/℃102030405060KNO3溶解度/g20.931.645.863.985.5110.0
A.①③中的溶液均是不饱和溶液 B.②中的固体的质量是4.2g C.保持温度不变,若在③中加入25gKNO3固体可得到饱和溶液 D.溶液的溶质质量分数满足③>②>① 【解答】解:A、由表格中的信息可知:硝酸钾在20℃时的溶解度是31.6g,则20℃中,50g水中最多能溶解硝酸钾15.8g,因此①为不饱和溶液;60℃时,硝酸钾的溶解度为110g,50g水中最多能溶解硝酸钾55g,③中只有硝酸钾20g,故③为不饱和溶液,故A说法正确; B、由以上分析可知,20℃中,50g水中最多能溶解硝酸钾15.8g,②中未溶解的固体的质量是 10g+10g﹣15.8 g=4.2g,故B说法正确; C、由以上分析可知,60℃时,硝酸钾的溶解度为110g,50g水中最多能溶解硝酸钾55g,③中只有硝酸钾20g,保持温度不变,若在③中加入55g﹣20g=35g,硝酸钾固体可得到饱和溶液,故C说法错误; D、②中硝酸钾的溶质质量分数是,③中硝酸钾的溶质质量分数是 ,②③溶液的溶质质量分数:③>②,①②溶液中的溶剂的质量相等,②中溶质的质量比①中的多,故①②溶液的溶质质量分数:②>①,故D说法正确。 故选:C。 【题型三】化学方程式的计算 (2023 镇江一模)已知Cu2O+H2SO4═Cu+CuSO4+H2O。现将仅含铜、硫元素组成的纯净物16.0g敞口放在空气中充分加热,得16.0g两种元素组成的黑色固体纯净物。将该黑色固体纯净物放在密闭容器中继续加热至t℃,固体全部变红,冷却得13.6g Cu与Cu2O的固体混合物。将此混合物放入96.0g足量稀H2SO4中,充分反应,得蓝色溶液和红色固体。下列说法正确的是( ) A.灼烧过程中产生3.2g SO2 B.铜、硫元素组成的化合物的化学式为CuS C.充分反应后所得蓝色溶液溶质质量分数为8% D.若将13.6g固体混合物与足量的CO高温充分反应,可生成3.2g CO2 【解答】解:依据题意可知,燃烧后得16.0g两种元素组成的黑色固体纯净物为CuO,则铜元素的质量为16.0g100%=12.8g,铜、硫元素组成的纯净物中硫元素的质量为16.0g﹣12.8g=3.2g。 A.分析S+O2SO2反应可知,3.2g硫元素燃烧生成SO2的质量为6.4g,故A错误; B.通过上述分析可知,铜、硫元素组成的化合物中铜、硫元素的个数比为:2:1,则化学式为Cu2S,故B错误; C.设13.6g固体混合物中铜的质量为x x+(13.6g﹣x)100%=12.8g x=6.4g,则Cu2O的质量为7.2g, 设生成硫酸铜的质量为z,生成Cu的质量为y Cu2O+H2SO4═Cu+CuSO4+H2O 144 64 160 7.2g y z z=8.0g y=3.2g x=1.6g 充分反应后所得蓝色溶液溶质质量分数为100%=8%, 故C正确; D.设将13.6g固体混合物与足量的CO高温充分反应,生成CO2的质量为A Cu2O+CO2Cu+CO2 144 44 7.2g A A=2.2g 故D错误; 故选:C。 (2023 巴南区模拟)甲醛(HCHO)是一种防腐剂,同时也是一种有毒物质。为了测定溶液中甲醛的含量。某同学取含甲醛的溶液10.0g,滴加过量酸性KMnO4溶液11.1g,(反应的方程式为:4KMnO4+5HCHO+6H2SO4═2K2SO4+4MnSO4+5CO2↑+11H2O );整个过程中无沉淀产生。将产生的气体用40.0g10%NaOH溶液恰好完全吸收,吸收后溶液的总质量为41.1g;试计算。(已知MnSO4的相对分子质量为151) (1)甲醛中碳、氢元素的质量比 。 (2)若用20%的溶液配制40.0g10%的NaOH,需要加入水的质量。 (3)所得溶液中MnSO4的质量分数。 【解答】解:(1)甲醛中碳、氢元素的质量比12:2=6:1; (2)若用20%的溶液配制40.0g10%的NaOH,需要加入水的质量为:40g20g; 答:需要加入水的质量为20g (3)设所得溶液中MnSO4的质量分数为x。 4KMnO4+5HCHO+6H2SO4═2K2SO4+4MnSO4+5CO2↑+11H2O 604 220 x 41.1g﹣40.0g=1.1g 解得:x=3.02g 所得溶液中MnSO4的质量分数:15.1%。 答:所得溶液中MnSO4的质量分数为15.1%。 故答案为:(1)6:1; (2)20g; (3)15.1%。
难度:★★★ 建议时间:25分钟
(2021 广元模拟)取一定质量的碳酸钙,高温加热一段时间后,得到碳酸钙和氧化钙的固体混合物,其中碳、氧元素质量比为1:5,那么该固体混合物中碳酸钙和氧化钙的质量比为( )
A.7:25 B.50:21 C.21:50 D.25:14
【解答】解:碳酸钙高温分解生成氧化钙和二氧化碳,反应后的碳元素全部存在于碳酸钙中,碳酸钙中碳元素和氧元素的质量比为:12:(16×3)=3:12,假设碳元素的质量为3份质量,则由碳、氧元素质量比为1:5=3:15可知,氧化钙中氧元素的质量为3份质量,因此碳酸钙的质量为:325,氧化钙的质量为:3,故该固体混合物中碳酸钙和氧化钙的质量比为:25:50:21;
由以上计算可知,B符合题意
故选:B。
(2023 东莞市校级二模)高铁酸钾[K2FeO4]能溶于水,是高效、多功能水处理剂.K2FeO4中铁元素的化合价为( )
A.﹣1 B.+2 C.+3 D.+6
【解答】解:钾元素显+1价,氧元素显﹣2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(﹣2)×4=0,则x=+6价。
故选:D。
(2023 双流区校级模拟)甲原子与乙原子的质量比为a:b,而乙原子与碳原子的质量比为c:d,则甲原子的相对原子质量为( )
A. B. C. D.
【解答】解:因为甲:乙=a:b,甲=(a 乙):b
又因 乙:碳原子=c:d,乙=(碳原子 c):d
甲=(a c 碳原子):(b d)
所以甲原子的相对原子质量为(12ac):(bd),
即
故选:A。
(2023 临汾一模)氮元素对地球上的生命极其重要,它不仅是组成蛋白质必不可少的元素,还是核酸等生命物质的重要成分。下列五种物质:NH3、N2、NO、X、HNO3,均含有氮元素,且氮元素的化合价按照一定顺序排列,则物质X是( )
A.NaNO3 B.N2O C.N2O5 D.NO2
【解答】解:已知氢元素的化合价为+1价,氧元素的化合价为﹣2价,根据化合价的原则(在化合物中正、负化合价的代数和为零),则:NH3中氮元素的化合价为:﹣3价;N2中氮元素的化合价为0;NO中氮元素的化合价为+2价;HNO3中氮元素的化合价为+5价。则X中氮元素的化合价为+3或+4。
A、NaNO3中氮元素的化合价为:+5价,故A不符合题意。
B、N2O中氮元素的化合价为:+1价,故B不符合题意;
C、N2O5中氮元素的化合价为:+5价,故C不符合题意;
D、NO2中氮元素的化合价为:+4价,故D符合题意;
故选:D。
(2023 衡阳县模拟)在C2H4、C2H5OH的混合物中,已知氧元素的质量分数为y,则碳元素的质量分数为( )
A.(1) B.(1) C.(1) D.(1)
【解答】解:C2H5OH可以变形为C2H4 H2O,所以C2H4、C2H5OH可以视为C2H4、H2O组成的混合物,因为氧元素的质量分数为y,故H2O的质量分数为:,所以C2H4的质量分数为:(1y),其中碳元素的质量分数为:(1y)(1y);
故选:B。
(2023 古交市校级一模)笑气是人类最早应用于医疗的麻醉剂之一,如果长期过量吸入笑气,就会对人体造成不可逆的伤害。笑气是氮的一种氧化物,该氧化物中氮元素的化合价为+1,笑气的化学式是( )
A.N2 B.N2O C.N2O4 D.NO2
【解答】解:笑气是氮的一种氧化物,该氧化物中氮元素的化合价为+1,氧元素的化合价为﹣2价,化合价数值约到最简交叉写在元素右下角,其化学式为N2O。
故选:B。
(2023 丰台区二模)如图是KNO3的溶解度曲线,下列说法正确的是( )
A.20℃时,向100g水中加入40gKNO3,得到140g溶液
B.40℃时,KNO3饱和溶液的溶质质量分数为63.9%
C.60℃时,KNO3饱和溶液中溶质与溶剂的质量比为11:10
D.将60℃的KNO3饱和溶液降温至40℃,溶液质量不变
【解答】解:A、20℃时,硝酸钾的溶解度为31.6g,20℃时,向100g水中加入40gKNO3,最多能溶解31.6g,得到131.6g饱和溶液,故选项说法错误。
B、40℃时,硝酸钾的溶解度为63.9g,KNO3饱和溶液的溶质质量分数为100%<63.9%,故选项说法错误。
C、60℃时,硝酸钾的溶解度为110g,60℃时,KNO3饱和溶液中溶质与溶剂的质量比为110g:100g=11:10,故选项说法正确。
D、硝酸钾的溶解度随着温度的降低而减小,将60℃的KNO3饱和溶液降温至40℃,有晶体析出,溶液质量减少,故选项说法错误。
故选:C。
(2023 民权县一模)固体硝酸钾、硝酸钠的溶解度曲线如图所示。下列说法正确的是( )
A.在t1℃时,硝酸钾、硝酸钠溶液的溶质质量分数相等
B.硝酸钾、硝酸钠的溶液从t2℃降温至t1℃一定有晶体析出
C.t2℃时,向30 g硝酸钾的饱和溶液中加10 g水可得到20%的溶液
D.将t1℃时两固体的饱和溶液分别升温至t2℃,两溶液的溶质质量分数相等
【解答】解:A.在t1℃时,硝酸钾、硝酸钠的溶解度曲线相交于一点,即该温度下,硝酸钾、硝酸钠的溶解度相等,但硝酸钾、硝酸钠溶液不一定是饱和溶液,所以溶质质量分数无法确定是否相等,故A不正确;
B.硝酸钾、硝酸钠的溶液不一定饱和,所以从t2℃降温至t1℃不一定有晶体析出,故B不正确;
C.t2℃时,硝酸钾的溶解度为200g,向30 g硝酸钾的饱和溶液中加10 g水得到溶液的溶质质量分数为:50%,故C不正确;
D.t1℃时,硝酸钾、硝酸钠的溶解度曲线相交于一点,溶解度相等,溶质质量分数相等,将t1℃时两固体的饱和溶液分别升温至t2℃,两固体的溶解度增大,溶液由饱和变为不饱和溶液,溶液的溶质质量分数不变,所以两溶液的溶质质量分数相等,故D正确。
故选:D。
(2023 南山区校级三模)t1℃时,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示;升温到t2℃时(忽略水分蒸发),现象如图乙所示;图丙是a、b两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.图丙中曲线N表示b物质的溶解度曲线
B.图甲中两烧杯内a、b溶液的溶质质量分数相等
C.图乙中烧杯内b溶液的溶质质量分数为25%
D.可用降温结晶的方法从饱和a溶液中得到固体a
【解答】解:A、结合图甲、图乙可知,b物质的溶解度随着温度升高而增大,故图丙中曲线M表示b物质的溶解度曲线,则曲线N表示a物质的溶解度曲线,故A错误;
B、由图甲可知,t1℃时,a、b均是饱和饱和溶液,结合图丙可知,t1℃时a、b两物质溶解度相等,故图甲中两烧杯内a、b溶液的溶质质量分数相等,故B正确;
C、图乙中烧杯b内固体全部溶解,b溶液的溶质质量分数为100%=20%,故C错误;
D、a物质的溶解度随温度降低而增大,降低温度,a的溶解度增大,饱和溶液变成不饱和溶液,故不能用降温结晶的方法从饱和a溶液中得到固体a,故D错误。
故选:B。
(2023 桐柏县三模)Mg、Al、Fe的固体混合物21.4g加入一定量的H2SO4恰好完全反应,反应后的溶液质量增加了21.2g,将反应后溶液蒸干得到固体的质量为( )
A.21.6g B.31.0g C.38.5g D.42.4g
【解答】解:Mg、Al、Fe的固体混合物21.4g加入一定量的硫酸恰好完全反应,反应后的溶液质量增加了21.2g,则生成H2的质量为21.4g﹣21.2g=0.2g,根据反应前后元素的质量相等,产生氢气中的氢元素的质量等于反应掉的硫酸中氢元素的质量,则硫酸中氢元素的质量为0.2g,且硫酸中氢元素的质量与硫酸根离子的质量的质量比为2:96=1:48,则硫酸根离子的质量为:0.2g×48=9.6g,将反应后溶液蒸发结晶、干燥,Mg、Al、Fe完全反应完后转化为MgSO4、Al2(SO4)3、FeSO4,故获得固体质量为9.6g+21.4g=31.0g。
故选:B。
(2023 东莞市二模)从微观上看,化学反应是微观粒子按一定的数目关系进行的。某碳氢化合物(化学式为CxHy)在密闭容器内充分燃烧,生成二氧化碳和水。部分物质的分子数随反应过程的变化如图所示。下列说法正确的是( )
A.该反应前后分子数目不变
B.t时刻,容器中O2和CO2的质量相等
C.该碳氢化合物的化学式为C3H8
D.该反应生成的二氧化碳和水的质量之比为22:9
【解答】解:由图可知,参加反应的有机物、氧气,生成的二氧化碳的分子个数比为:n:(6n﹣n):3n=1:5:3,设化学方程式中水前面的化学计量数为m,则化学方程式为nCxHy+5nO23nCO2+mH2O;根据质量守恒定律,化学反应前后,元素的种类不变,原子的种类、总个数不变;根据氧原子个数守恒,反应物中有10n个氧原子,生成物二氧化碳中只含有6n个氧原子,因此化学方程式中水前面的化学计量数为4n,即生成水分子个数为4n,故化学方程式为CxHy+5O23CO2+4H2O,根据质量守恒定律,则x=3,y=8,即有机物的化学式为C3H8;
A、由反应的化学方程式可知,反应前的分子个数发生变化,故错误;
B、t时刻,O2和CO2的分子数相等,质量不相等,故错误;
C、反应的氧原子个数是10n,生成的二氧化碳中的氧原子是6n,则生成的水分子中氧原子是10n﹣6n=4n,该反应生成的水分子数目为4n,由质量守恒定律可知,CxHy+5O23CO2+4H2O,即x=3,y=8,碳氢化合物的化学式是C3H8,故正确;
D、该反应生成的二氧化碳和水的质量之比为:(3n×44):(4n×18)=11:6,故错误;
故选:C。
(2023 蕲春县模拟)氧化亚铜(Cu2O)是鲜红色粉末状固体,可用作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂等。现将Cu2O和Cu的固体混合物6.8g放入烧杯中,加入足量的稀硫酸,充分反应后,过滤、洗涤、干燥,得到4.8g固体。(已知Cu2O+H2SO4=CuSO4+Cu+H2O)。则原混合物中的Cu2O和Cu质量比为( )
A.9:8 B.17:12 C.1:1 D.9:4
【解答】解:设原混合物中的Cu2O的质量为x,生成铜的质量为y,
Cu2O+H2SO4=CuSO4+Cu+H2O,
144 64
x y
,
y,
根据题意有:6.8g﹣x4.8g,
x=3.6g,
原混合物中的Cu的质量为:6.8g﹣3.6g=3.2g,
则原混合物中的Cu2O和Cu质量比为:3.6g:3.2g=9:8,
故选:A。
(2023 天宁区校级模拟)“天宫课堂”中宇航员将维生素C泡腾片[含维生素C、柠檬酸( C6H8O7)和碳酸氢钠]塞入一个水球,水球里立即产生很多气泡,其中一个反应为:C6H8O7+xNaHCO3═NaxC6H8﹣xO7+xH2O+xCO2↑。为测定柠檬酸钠(NaxC6H8﹣xO7)化学式中的x,用4套相同装置加等量的水后,分别装入如表所示质量的柠檬酸和碳酸氢钠固体进行实验测得该条件下数据如表,推测x的数值为( )
实验组别 柠檬酸/g 碳酸氢钠/g 气体体积/mL
1 1.92 0.84 224
2 1.92 1.68 448
3 1.92 2.52 672
4 1.92 3.36 672
A.4 B.3 C.2 D.1
【解答】解:由表格中的数据可知,加入0.84g碳酸氢钠产生气体的体积为224mL,加入1.68g碳酸氢钠产生气体的体积为448mL,即每0.84g碳酸氢钠产生气体的体积为224mL,而加入2.52g、3.36g碳酸氢钠产生气体的体积为672mL,说明在实验组别3中,1.92g柠檬酸和2.52g碳酸氢钠恰好完全反应;
C6H8O7+xNaHCO3═NaxC6H8﹣xO7+xH2O+xCO2↑
192 84x
1.92g 2.52g
x=3
故选:B。
(2023 临沂一模)习近平总书记用“文明其精神,野蛮其体魄”来激励青少年多运动,重视强身健体。因为运动时,身体可以产生多巴胺,让人心情舒畅,缓解焦虑,提高身体免疫力。多巴胺的化学式为C8H11NO2。
(1)在多巴胺中,氮元素和氧元素的质量比为 (填最简整数比);
(2)多巴胺中碳元素的质量分数 (精确到0.1%)。
【解答】解:(1)在多巴胺中,氮元素和氧元素的质量比=14:(16×2)=7:16。
(2)多巴胺中碳元素的质量分数62.7%。
故答案为:(1)7:16;
(2)62.7%。
(2023 河西区一模)条形码的黏性主要来源于合成胶黏剂丙烯酸,化学式为C3H4O2。计算:
(1)丙烯酸的相对分子质量为 ;
(2)丙烯酸中碳、氧元素的质量比为 (填最简比);
(3)丙烯酸中碳元素的质量分数为 ;
(4)3.6g丙烯酸中含有的碳元素的质量是 g。
【解答】解:(1)丙烯酸(C3H4O2)的相对分子质量为12×3+1×4+16×2=72;故答案为:72;
(2)丙烯酸中碳元素与氧元素的质量比为(12×3):(16×2)=9:8,故答案为:9:8;
(3)丙烯酸中碳元素的质量分数为50%;故答案为:50%;
(4)3.6g丙烯酸中含有的碳元素的质量是3.6g×50%=1.8g;故答案为:1.8。
(2023 嘉禾县校级二模)山西老陈醋是中国四大名醋之一可促进胃液分泌,抑制血糖升高,降低血脂。陈醋中含有乙酸(化学式CH3COOH),如图是某品牌陈醋的部分标签。
(1)乙酸的相对分子质量为 。
(2)乙酸中氢、氧元素的质量比是 。
(3)一瓶陈醋中至少含有碳元素的质量是多少(写出计算过程)
【解答】解:(1)乙酸的相对分子质量为12×2+1×4+16×2=60;
故填:60;
(2)乙酸中氢、氧两种元素的质量比(1×4):(16×2)=1:8;
故填:1:8;
(3)一瓶陈醋中至少含有碳元素的质量是500mL×4g/100mL100%=8g。
答:一瓶陈醋中至少含有碳元素的质量是8g。
故答案为:(1)60;(2)1:8;(3)8g。
(2023 魏县一模)在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
(1)该温度下,实验①所得溶液是 溶液(填“饱和”或“不饱和”)。
(2)实验③所得溶液中溶质的质量分数是 (写出计算过程)
(3)现有溶质质量分数为10%的KCl的溶液300g,若配制成溶质质量分数为3%的KCl的溶液,问需要加水的质量是多少。(写出计算过程)
【解答】解:(1)饱和溶液是指一定温度下不能继续溶解某种溶质的溶液,还能继续溶解该溶质的溶液是不饱和溶液。①能继续溶解这种溶质,所以是不饱和溶液;故答案为:不饱和;
(2)根据图示可知100g水中加入60g氯化钾所得溶液质量为140g,说明只溶解了40g,所以该温度下的溶解度是40g;实验③溶液的质量分数为100%≈28.6%;故答案为:28.6%;
(3)设需要加水的质量是x,根据题意可得:
300g×10%=(300g+x)×3%
解得:x=700g
答:需要加水的质量是700g。
(2023 邹平市二模)化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有50g废液的锥形瓶中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)该反应是 (填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为 ℃。
(3)计算废液中硫酸的质量分数。(写出计算过程)
【解答】解:(1)由图像可知,溶液的温度升高,说明该反应是放热反应。
(2)该反应是放热反应,恰好完全反应时溶液温度最高,由图像可知,恰好完全反应时溶液的温度为t3℃。
(3)设50g废液中硫酸的质量为x。
2NaOH+H2SO4=Na2SO4+2H2O
80 98
40g×20% x
解得:x=9.8g
废液中硫酸的质量分数为:
答:废液中硫酸的质量分数19.6%。
故答案为:(1)放热;
(2)t3;
(3)19.6%。
(2023 唐山模拟)医学上常用过氧化氢溶液来清洗创口和局部抗菌,玲玲同学取68.0g某医用过氧化氢溶液放入锥形瓶中,然后加入2.0g二氧化锰,每隔一分钟观察并记录一次锥形瓶及物质的质量(如表),直到实验结束。
时间/分钟 0 1 2 3 4 5
锥形瓶及物质质量/g 100 99.3 98.9 98.6 98.4 98.4
请计算:
(1)共生成氧气 g。
(2)过氧化氢溶液中溶质的质量分数。
【解答】解:(1)根据质量守恒定律,反应前后物质的总质量不变,则共生成氧气的质量为:100g﹣98.4g=1.6g。
(2)设过氧化氢溶液中溶质的质量为x。
2H2O22H2O+O2↑
68 32
x 1.6g
x=3.4g
则过氧化氢溶液中溶质的质量分数为:100%=5%。
答:过氧化氢溶液中溶质的质量分数为5%。
(2023 重庆模拟)新冠疫情中常用84消毒液进行环境消毒,其主要成分是次氯酸钠(NaClO)。制备次氯酸钠的发生器中发生反应的总化学方程式为:NaCl+H2ONaClO+H2↑。现电解600g溶质的质量分数为26%的氯化钠溶液一段时间,溶液质量减少4g(假设不考虑其他副产物)。请计算:
(1)NaCl中氯元素的质量分数 (填“>”、“=”或“<”)NaClO中氯元素的质量分数。
(2)电解所得溶液中次氯酸钠的质量分数。
(3)用于电解的600g26%的氯化钠溶液是通过在10%的氯化钠溶液中加入氯化钠固体的方式配制的,计算需要加入NaCl固体的质量。(计算结果保留一位小数)
【解答】解:(1)NaCl和 NaClO中都是含有1个氯原子,但NaClO比NaCl多一个氧原子,相对分子质量更大,所以NaCl中氯元素的质量分数>NaClO中氯元素的质量分数。
(2)根据质量守恒定律,氢气的质量为4g,
设生成的次氯酸钠的质量为x。
NaCl+H2ONaClO+H2↑
74.5 2
x 4g
x=149g
电解所得溶液中次氯酸钠的质量分数100%=25%
答:电解所得溶液中次氯酸钠的质量分数25%。
(3)设需要加入NaCl固体的质量为y。
(600g﹣y)×10%+y=600g×26%
解得y≈106.7g。
知识点回顾(时间:5分钟)
知识点一、根据化学式的相关计算
以化合物AaBb为例,可推导出下列计算公式
1.相对分子质量:相对分子质量=A的相对原子质量×a+B的相对原子质量×b;
2.A、B原子个数比==
3.A、B元素质量比==
4.A元素的质量分数=A元素的质量分数=×100%
5.A元素的质量=化合物(AaBb)质量×A元素的质量分数
知识点二、有关溶液的计算
1.溶液质量=溶质质量+溶剂质量
溶质质量分数=×100% 变形后为:溶质质量=溶液质量×溶质质量分数
2.溶液稀释计算主要是根据稀释前后溶质质量相等列式:若浓溶液的质量为m浓,质量分数为a%,加m水稀释后质量分数为b%,则可列式为:m浓·a%=(m浓+m水)·b%
3.化学方程式反映的是纯净物间的质量关系,涉及到的一般都是溶液中的溶质的质量,常要用到的公式:
m溶质=m溶液×a%,然后把得到的溶质的质量代入方程式计算。
知识点三、能根据化学方程式进行纯净物质间的计算
1.知道反应物(或生成物)的质量求生成物(或反应物)的质量。
2.根据质量守恒定律的化学方程式的计算
此内容是本课时的拓展,一类习题可根据质量守恒定律的定义或实质,利用反应物前后物质或元素质量守恒进行计算。另一类习题还可根据反应前后物质质量之差,算出气体或沉淀物的质量,再进行化学方程式的计算。
解题步骤:
(1)设未知量,用x、y等字母表示(不带单位);
(2)正确写出有关的化学方程式(注意配平);
(3)找出相关物质间的质量关系,写在对应化学式的下面;
(4)列出比例式,求出未知量;
(5)简明写出答案。
注意事项:
①根据化学方程式计算要注意解题格式化,准确列出有关反应物或生成物质量比,特别是相对分子质量的计算;
②题设中未知数没有单位,求出的未知数应带单位;
③计算中已知量每步都要带单位。
【题型一】化学式的计算 (2022 滨湖区一模)技术人员对甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)的混合水溶液进行测定,发现其中氧元素的质量分数为64%,则该溶液中溶剂水的质量分数为( ) A.30% B.36% C.64% D.72% (2020 石首市模拟)由氧化镁和另一种金属氧化物组成的混合物4g,已知含有氧元素1.8g,则另一种氧化物可能是( ) A.CuO B.Fe2O3 C.Al2O3 D.CaO 【题型二】溶液的计算 (2023 景县模拟)用MgCl2溶液喷洒路面可融雪、防尘。MgCl2在不同温度下的溶解度见下表。按图所示进行实验,下列说法正确的是( ) 温度/℃10203040溶解度/g53.654.655.857.5
A.甲溶液溶质质量分数为54% B.丙溶液属于不饱和溶液 C.丙溶液中含有的溶质质量最多 D.乙、丁溶液中溶质的质量分数:丁>乙 (2023 镜湖区模拟)为探究硝酸钾的溶解性,某同学按如下步骤进行了实验。下列说法不正确的是( ) 温度/℃102030405060KNO3溶解度/g20.931.645.863.985.5110.0
A.①③中的溶液均是不饱和溶液 B.②中的固体的质量是4.2g C.保持温度不变,若在③中加入25gKNO3固体可得到饱和溶液 D.溶液的溶质质量分数满足③>②>① 【题型三】化学方程式的计算 (2023 镇江一模)已知Cu2O+H2SO4═Cu+CuSO4+H2O。现将仅含铜、硫元素组成的纯净物16.0g敞口放在空气中充分加热,得16.0g两种元素组成的黑色固体纯净物。将该黑色固体纯净物放在密闭容器中继续加热至t℃,固体全部变红,冷却得13.6g Cu与Cu2O的固体混合物。将此混合物放入96.0g足量稀H2SO4中,充分反应,得蓝色溶液和红色固体。下列说法正确的是( ) A.灼烧过程中产生3.2g SO2 B.铜、硫元素组成的化合物的化学式为CuS C.充分反应后所得蓝色溶液溶质质量分数为8% D.若将13.6g固体混合物与足量的CO高温充分反应,可生成3.2g CO2 (2023 巴南区模拟)甲醛(HCHO)是一种防腐剂,同时也是一种有毒物质。为了测定溶液中甲醛的含量。某同学取含甲醛的溶液10.0g,滴加过量酸性KMnO4溶液11.1g,(反应的方程式为:4KMnO4+5HCHO+6H2SO4═2K2SO4+4MnSO4+5CO2↑+11H2O );整个过程中无沉淀产生。将产生的气体用40.0g10%NaOH溶液恰好完全吸收,吸收后溶液的总质量为41.1g;试计算。(已知MnSO4的相对分子质量为151) (1)甲醛中碳、氢元素的质量比 。 (2)若用20%的溶液配制40.0g10%的NaOH,需要加入水的质量。 (3)所得溶液中MnSO4的质量分数。
难度:★★★ 建议时间:25分钟
(2021 广元模拟)取一定质量的碳酸钙,高温加热一段时间后,得到碳酸钙和氧化钙的固体混合物,其中碳、氧元素质量比为1:5,那么该固体混合物中碳酸钙和氧化钙的质量比为( )
A.7:25 B.50:21 C.21:50 D.25:14
(2023 东莞市校级二模)高铁酸钾[K2FeO4]能溶于水,是高效、多功能水处理剂.K2FeO4中铁元素的化合价为( )
A.﹣1 B.+2 C.+3 D.+6
(2023 双流区校级模拟)甲原子与乙原子的质量比为a:b,而乙原子与碳原子的质量比为c:d,则甲原子的相对原子质量为( )
A. B. C. D.
(2023 临汾一模)氮元素对地球上的生命极其重要,它不仅是组成蛋白质必不可少的元素,还是核酸等生命物质的重要成分。下列五种物质:NH3、N2、NO、X、HNO3,均含有氮元素,且氮元素的化合价按照一定顺序排列,则物质X是( )
A.NaNO3 B.N2O C.N2O5 D.NO2
(2023 衡阳县模拟)在C2H4、C2H5OH的混合物中,已知氧元素的质量分数为y,则碳元素的质量分数为( )
A.(1) B.(1) C.(1) D.(1)
(2023 古交市校级一模)笑气是人类最早应用于医疗的麻醉剂之一,如果长期过量吸入笑气,就会对人体造成不可逆的伤害。笑气是氮的一种氧化物,该氧化物中氮元素的化合价为+1,笑气的化学式是( )
A.N2 B.N2O C.N2O4 D.NO2
(2023 丰台区二模)如图是KNO3的溶解度曲线,下列说法正确的是( )
A.20℃时,向100g水中加入40gKNO3,得到140g溶液
B.40℃时,KNO3饱和溶液的溶质质量分数为63.9%
C.60℃时,KNO3饱和溶液中溶质与溶剂的质量比为11:10
D.将60℃的KNO3饱和溶液降温至40℃,溶液质量不变
(2023 民权县一模)固体硝酸钾、硝酸钠的溶解度曲线如图所示。下列说法正确的是( )
A.在t1℃时,硝酸钾、硝酸钠溶液的溶质质量分数相等
B.硝酸钾、硝酸钠的溶液从t2℃降温至t1℃一定有晶体析出
C.t2℃时,向30 g硝酸钾的饱和溶液中加10 g水可得到20%的溶液
D.将t1℃时两固体的饱和溶液分别升温至t2℃,两溶液的溶质质量分数相等
(2023 南山区校级三模)t1℃时,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示;升温到t2℃时(忽略水分蒸发),现象如图乙所示;图丙是a、b两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.图丙中曲线N表示b物质的溶解度曲线
B.图甲中两烧杯内a、b溶液的溶质质量分数相等
C.图乙中烧杯内b溶液的溶质质量分数为25%
D.可用降温结晶的方法从饱和a溶液中得到固体a
(2023 桐柏县三模)Mg、Al、Fe的固体混合物21.4g加入一定量的H2SO4恰好完全反应,反应后的溶液质量增加了21.2g,将反应后溶液蒸干得到固体的质量为( )
A.21.6g B.31.0g C.38.5g D.42.4g
(2023 东莞市二模)从微观上看,化学反应是微观粒子按一定的数目关系进行的。某碳氢化合物(化学式为CxHy)在密闭容器内充分燃烧,生成二氧化碳和水。部分物质的分子数随反应过程的变化如图所示。下列说法正确的是( )
A.该反应前后分子数目不变
B.t时刻,容器中O2和CO2的质量相等
C.该碳氢化合物的化学式为C3H8
D.该反应生成的二氧化碳和水的质量之比为22:9
(2023 蕲春县模拟)氧化亚铜(Cu2O)是鲜红色粉末状固体,可用作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂等。现将Cu2O和Cu的固体混合物6.8g放入烧杯中,加入足量的稀硫酸,充分反应后,过滤、洗涤、干燥,得到4.8g固体。(已知Cu2O+H2SO4=CuSO4+Cu+H2O)。则原混合物中的Cu2O和Cu质量比为( )
A.9:8 B.17:12 C.1:1 D.9:4
(2023 天宁区校级模拟)“天宫课堂”中宇航员将维生素C泡腾片[含维生素C、柠檬酸( C6H8O7)和碳酸氢钠]塞入一个水球,水球里立即产生很多气泡,其中一个反应为:C6H8O7+xNaHCO3═NaxC6H8﹣xO7+xH2O+xCO2↑。为测定柠檬酸钠(NaxC6H8﹣xO7)化学式中的x,用4套相同装置加等量的水后,分别装入如表所示质量的柠檬酸和碳酸氢钠固体进行实验测得该条件下数据如表,推测x的数值为( )
实验组别 柠檬酸/g 碳酸氢钠/g 气体体积/mL
1 1.92 0.84 224
2 1.92 1.68 448
3 1.92 2.52 672
4 1.92 3.36 672
A.4 B.3 C.2 D.1
(2023 临沂一模)习近平总书记用“文明其精神,野蛮其体魄”来激励青少年多运动,重视强身健体。因为运动时,身体可以产生多巴胺,让人心情舒畅,缓解焦虑,提高身体免疫力。多巴胺的化学式为C8H11NO2。
(1)在多巴胺中,氮元素和氧元素的质量比为 (填最简整数比);
(2)多巴胺中碳元素的质量分数 (精确到0.1%)。
(2023 河西区一模)条形码的黏性主要来源于合成胶黏剂丙烯酸,化学式为C3H4O2。计算:
(1)丙烯酸的相对分子质量为 ;
(2)丙烯酸中碳、氧元素的质量比为 (填最简比);
(3)丙烯酸中碳元素的质量分数为 ;
(4)3.6g丙烯酸中含有的碳元素的质量是 g。
(2023 嘉禾县校级二模)山西老陈醋是中国四大名醋之一可促进胃液分泌,抑制血糖升高,降低血脂。陈醋中含有乙酸(化学式CH3COOH),如图是某品牌陈醋的部分标签。
(1)乙酸的相对分子质量为 。
(2)乙酸中氢、氧元素的质量比是 。
(3)一瓶陈醋中至少含有碳元素的质量是多少(写出计算过程)
(2023 魏县一模)在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
(1)该温度下,实验①所得溶液是 溶液(填“饱和”或“不饱和”)。
(2)实验③所得溶液中溶质的质量分数是 (写出计算过程)
(3)现有溶质质量分数为10%的KCl的溶液300g,若配制成溶质质量分数为3%的KCl的溶液,问需要加水的质量是多少。(写出计算过程)
(2023 邹平市二模)化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有50g废液的锥形瓶中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)该反应是 (填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为 ℃。
(3)计算废液中硫酸的质量分数。(写出计算过程)
(2023 唐山模拟)医学上常用过氧化氢溶液来清洗创口和局部抗菌,玲玲同学取68.0g某医用过氧化氢溶液放入锥形瓶中,然后加入2.0g二氧化锰,每隔一分钟观察并记录一次锥形瓶及物质的质量(如表),直到实验结束。
时间/分钟 0 1 2 3 4 5
锥形瓶及物质质量/g 100 99.3 98.9 98.6 98.4 98.4
请计算:
(1)共生成氧气 g。
(2)过氧化氢溶液中溶质的质量分数。
(2023 重庆模拟)新冠疫情中常用84消毒液进行环境消毒,其主要成分是次氯酸钠(NaClO)。制备次氯酸钠的发生器中发生反应的总化学方程式为:NaCl+H2ONaClO+H2↑。现电解600g溶质的质量分数为26%的氯化钠溶液一段时间,溶液质量减少4g(假设不考虑其他副产物)。请计算:
(1)NaCl中氯元素的质量分数 (填“>”、“=”或“<”)NaClO中氯元素的质量分数。
(2)电解所得溶液中次氯酸钠的质量分数。
(3)用于电解的600g26%的氯化钠溶液是通过在10%的氯化钠溶液中加入氯化钠固体的方式配制的,计算需要加入NaCl固体的质量。(计算结果保留一位小数)
参考答案与详细解析
知识点回顾(时间:5分钟)
知识点一、根据化学式的相关计算
以化合物AaBb为例,可推导出下列计算公式
1.相对分子质量:相对分子质量=A的相对原子质量×a+B的相对原子质量×b;
2.A、B原子个数比==
3.A、B元素质量比==
4.A元素的质量分数=A元素的质量分数=×100%
5.A元素的质量=化合物(AaBb)质量×A元素的质量分数
知识点二、有关溶液的计算
1.溶液质量=溶质质量+溶剂质量
溶质质量分数=×100% 变形后为:溶质质量=溶液质量×溶质质量分数
2.溶液稀释计算主要是根据稀释前后溶质质量相等列式:若浓溶液的质量为m浓,质量分数为a%,加m水稀释后质量分数为b%,则可列式为:m浓·a%=(m浓+m水)·b%
3.化学方程式反映的是纯净物间的质量关系,涉及到的一般都是溶液中的溶质的质量,常要用到的公式:
m溶质=m溶液×a%,然后把得到的溶质的质量代入方程式计算。
知识点三、能根据化学方程式进行纯净物质间的计算
1.知道反应物(或生成物)的质量求生成物(或反应物)的质量。
2.根据质量守恒定律的化学方程式的计算
此内容是本课时的拓展,一类习题可根据质量守恒定律的定义或实质,利用反应物前后物质或元素质量守恒进行计算。另一类习题还可根据反应前后物质质量之差,算出气体或沉淀物的质量,再进行化学方程式的计算。
解题步骤:
(1)设未知量,用x、y等字母表示(不带单位);
(2)正确写出有关的化学方程式(注意配平);
(3)找出相关物质间的质量关系,写在对应化学式的下面;
(4)列出比例式,求出未知量;
(5)简明写出答案。
注意事项:
①根据化学方程式计算要注意解题格式化,准确列出有关反应物或生成物质量比,特别是相对分子质量的计算;
②题设中未知数没有单位,求出的未知数应带单位;
③计算中已知量每步都要带单位。
【题型一】化学式的计算 (2022 滨湖区一模)技术人员对甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)的混合水溶液进行测定,发现其中氧元素的质量分数为64%,则该溶液中溶剂水的质量分数为( ) A.30% B.36% C.64% D.72% 【解答】解:根据甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)和水的分子式,可以发现四种物质中,H和O的原子个数比均为2:1,则该混合物中氢元素和氧元素的质量比为(1×2):(16×1)=1:8,其中氧元素的质量分数为64%,则氢元素质量分数为8%,故碳元素的质量分数为1﹣64%﹣8%=28%,对甲醛(HCHO)、乙酸(CH3COOH)和乳酸(C3H6O3)三种物质的化学式可以改写成CH2O、(CH2O)2、(CH2O)3,因此可以将混合物看出是分子式为CH2O的有机物与H2O的结合,碳元素的质量分数为28%,则CH2O的质量分数为,故水的质量分数为1﹣70%=30%。 故选:A。 (2020 石首市模拟)由氧化镁和另一种金属氧化物组成的混合物4g,已知含有氧元素1.8g,则另一种氧化物可能是( ) A.CuO B.Fe2O3 C.Al2O3 D.CaO 【解答】解:混合物中氧元素的质量分数为100%=45%; 氧化镁(MgO)中氧元素的质量分数为:; 所以要达到混合物中氧元素的质量分数为45%,另一种金属氧化物中氧元素的质量分数需大于45%; A、CuO中氧元素的质量分数为:100%=20%<45%,故A不适合。 B、Fe2O3中氧元素的质量分数为:100%=30%<45%,故B不适合。 C、Al2O3中氧元素的质量分数为:100%≈47.1%>45%,故C适合。 D、CaO中氧元素的质量分数为:100%≈28.6%<45%,故D不适合。 故选:C。 【题型二】溶液的计算 (2023 景县模拟)用MgCl2溶液喷洒路面可融雪、防尘。MgCl2在不同温度下的溶解度见下表。按图所示进行实验,下列说法正确的是( ) 温度/℃10203040溶解度/g53.654.655.857.5
A.甲溶液溶质质量分数为54% B.丙溶液属于不饱和溶液 C.丙溶液中含有的溶质质量最多 D.乙、丁溶液中溶质的质量分数:丁>乙 【解答】解:A、由表格数据可知:20℃时氯化镁的溶解度为54.6g,故此时50g水最多溶解54.6g÷2=27.3g氯化镁,故甲溶液为该温度下该物质的不饱和溶液,其中溶质质量分数为,说法错误,不符合题意; B、由表格数据可知:40℃时氯化镁的溶解度为57.5g,丙体系中有50g+50=100g水和27g+30.5g=57.5g氯化镁,此时氯化镁恰好完全溶解,丙溶液属于饱和溶液,说法错误,不符合题意; C、丙溶液中溶剂质量为100g、溶质质量为57.5g,而氯化镁溶解度随温度的升高而增大,丙溶液温度为40℃,其温度最大,故丙溶液中含有的溶质质量最多,说法正确,符合题意; D、由表格数据可知:20℃时氯化镁的溶解度为54.6g,乙溶液的溶质质量分数为,10℃时氯化镁的溶解度为53.6g,丁溶液的溶质质量分数为,乙、丁溶液中溶质的质量分数:丁<乙,说法错误,不符合题意; 故选:C。 (2023 镜湖区模拟)为探究硝酸钾的溶解性,某同学按如下步骤进行了实验。下列说法不正确的是( ) 温度/℃102030405060KNO3溶解度/g20.931.645.863.985.5110.0
A.①③中的溶液均是不饱和溶液 B.②中的固体的质量是4.2g C.保持温度不变,若在③中加入25gKNO3固体可得到饱和溶液 D.溶液的溶质质量分数满足③>②>① 【解答】解:A、由表格中的信息可知:硝酸钾在20℃时的溶解度是31.6g,则20℃中,50g水中最多能溶解硝酸钾15.8g,因此①为不饱和溶液;60℃时,硝酸钾的溶解度为110g,50g水中最多能溶解硝酸钾55g,③中只有硝酸钾20g,故③为不饱和溶液,故A说法正确; B、由以上分析可知,20℃中,50g水中最多能溶解硝酸钾15.8g,②中未溶解的固体的质量是 10g+10g﹣15.8 g=4.2g,故B说法正确; C、由以上分析可知,60℃时,硝酸钾的溶解度为110g,50g水中最多能溶解硝酸钾55g,③中只有硝酸钾20g,保持温度不变,若在③中加入55g﹣20g=35g,硝酸钾固体可得到饱和溶液,故C说法错误; D、②中硝酸钾的溶质质量分数是,③中硝酸钾的溶质质量分数是 ,②③溶液的溶质质量分数:③>②,①②溶液中的溶剂的质量相等,②中溶质的质量比①中的多,故①②溶液的溶质质量分数:②>①,故D说法正确。 故选:C。 【题型三】化学方程式的计算 (2023 镇江一模)已知Cu2O+H2SO4═Cu+CuSO4+H2O。现将仅含铜、硫元素组成的纯净物16.0g敞口放在空气中充分加热,得16.0g两种元素组成的黑色固体纯净物。将该黑色固体纯净物放在密闭容器中继续加热至t℃,固体全部变红,冷却得13.6g Cu与Cu2O的固体混合物。将此混合物放入96.0g足量稀H2SO4中,充分反应,得蓝色溶液和红色固体。下列说法正确的是( ) A.灼烧过程中产生3.2g SO2 B.铜、硫元素组成的化合物的化学式为CuS C.充分反应后所得蓝色溶液溶质质量分数为8% D.若将13.6g固体混合物与足量的CO高温充分反应,可生成3.2g CO2 【解答】解:依据题意可知,燃烧后得16.0g两种元素组成的黑色固体纯净物为CuO,则铜元素的质量为16.0g100%=12.8g,铜、硫元素组成的纯净物中硫元素的质量为16.0g﹣12.8g=3.2g。 A.分析S+O2SO2反应可知,3.2g硫元素燃烧生成SO2的质量为6.4g,故A错误; B.通过上述分析可知,铜、硫元素组成的化合物中铜、硫元素的个数比为:2:1,则化学式为Cu2S,故B错误; C.设13.6g固体混合物中铜的质量为x x+(13.6g﹣x)100%=12.8g x=6.4g,则Cu2O的质量为7.2g, 设生成硫酸铜的质量为z,生成Cu的质量为y Cu2O+H2SO4═Cu+CuSO4+H2O 144 64 160 7.2g y z z=8.0g y=3.2g x=1.6g 充分反应后所得蓝色溶液溶质质量分数为100%=8%, 故C正确; D.设将13.6g固体混合物与足量的CO高温充分反应,生成CO2的质量为A Cu2O+CO2Cu+CO2 144 44 7.2g A A=2.2g 故D错误; 故选:C。 (2023 巴南区模拟)甲醛(HCHO)是一种防腐剂,同时也是一种有毒物质。为了测定溶液中甲醛的含量。某同学取含甲醛的溶液10.0g,滴加过量酸性KMnO4溶液11.1g,(反应的方程式为:4KMnO4+5HCHO+6H2SO4═2K2SO4+4MnSO4+5CO2↑+11H2O );整个过程中无沉淀产生。将产生的气体用40.0g10%NaOH溶液恰好完全吸收,吸收后溶液的总质量为41.1g;试计算。(已知MnSO4的相对分子质量为151) (1)甲醛中碳、氢元素的质量比 。 (2)若用20%的溶液配制40.0g10%的NaOH,需要加入水的质量。 (3)所得溶液中MnSO4的质量分数。 【解答】解:(1)甲醛中碳、氢元素的质量比12:2=6:1; (2)若用20%的溶液配制40.0g10%的NaOH,需要加入水的质量为:40g20g; 答:需要加入水的质量为20g (3)设所得溶液中MnSO4的质量分数为x。 4KMnO4+5HCHO+6H2SO4═2K2SO4+4MnSO4+5CO2↑+11H2O 604 220 x 41.1g﹣40.0g=1.1g 解得:x=3.02g 所得溶液中MnSO4的质量分数:15.1%。 答:所得溶液中MnSO4的质量分数为15.1%。 故答案为:(1)6:1; (2)20g; (3)15.1%。
难度:★★★ 建议时间:25分钟
(2021 广元模拟)取一定质量的碳酸钙,高温加热一段时间后,得到碳酸钙和氧化钙的固体混合物,其中碳、氧元素质量比为1:5,那么该固体混合物中碳酸钙和氧化钙的质量比为( )
A.7:25 B.50:21 C.21:50 D.25:14
【解答】解:碳酸钙高温分解生成氧化钙和二氧化碳,反应后的碳元素全部存在于碳酸钙中,碳酸钙中碳元素和氧元素的质量比为:12:(16×3)=3:12,假设碳元素的质量为3份质量,则由碳、氧元素质量比为1:5=3:15可知,氧化钙中氧元素的质量为3份质量,因此碳酸钙的质量为:325,氧化钙的质量为:3,故该固体混合物中碳酸钙和氧化钙的质量比为:25:50:21;
由以上计算可知,B符合题意
故选:B。
(2023 东莞市校级二模)高铁酸钾[K2FeO4]能溶于水,是高效、多功能水处理剂.K2FeO4中铁元素的化合价为( )
A.﹣1 B.+2 C.+3 D.+6
【解答】解:钾元素显+1价,氧元素显﹣2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(﹣2)×4=0,则x=+6价。
故选:D。
(2023 双流区校级模拟)甲原子与乙原子的质量比为a:b,而乙原子与碳原子的质量比为c:d,则甲原子的相对原子质量为( )
A. B. C. D.
【解答】解:因为甲:乙=a:b,甲=(a 乙):b
又因 乙:碳原子=c:d,乙=(碳原子 c):d
甲=(a c 碳原子):(b d)
所以甲原子的相对原子质量为(12ac):(bd),
即
故选:A。
(2023 临汾一模)氮元素对地球上的生命极其重要,它不仅是组成蛋白质必不可少的元素,还是核酸等生命物质的重要成分。下列五种物质:NH3、N2、NO、X、HNO3,均含有氮元素,且氮元素的化合价按照一定顺序排列,则物质X是( )
A.NaNO3 B.N2O C.N2O5 D.NO2
【解答】解:已知氢元素的化合价为+1价,氧元素的化合价为﹣2价,根据化合价的原则(在化合物中正、负化合价的代数和为零),则:NH3中氮元素的化合价为:﹣3价;N2中氮元素的化合价为0;NO中氮元素的化合价为+2价;HNO3中氮元素的化合价为+5价。则X中氮元素的化合价为+3或+4。
A、NaNO3中氮元素的化合价为:+5价,故A不符合题意。
B、N2O中氮元素的化合价为:+1价,故B不符合题意;
C、N2O5中氮元素的化合价为:+5价,故C不符合题意;
D、NO2中氮元素的化合价为:+4价,故D符合题意;
故选:D。
(2023 衡阳县模拟)在C2H4、C2H5OH的混合物中,已知氧元素的质量分数为y,则碳元素的质量分数为( )
A.(1) B.(1) C.(1) D.(1)
【解答】解:C2H5OH可以变形为C2H4 H2O,所以C2H4、C2H5OH可以视为C2H4、H2O组成的混合物,因为氧元素的质量分数为y,故H2O的质量分数为:,所以C2H4的质量分数为:(1y),其中碳元素的质量分数为:(1y)(1y);
故选:B。
(2023 古交市校级一模)笑气是人类最早应用于医疗的麻醉剂之一,如果长期过量吸入笑气,就会对人体造成不可逆的伤害。笑气是氮的一种氧化物,该氧化物中氮元素的化合价为+1,笑气的化学式是( )
A.N2 B.N2O C.N2O4 D.NO2
【解答】解:笑气是氮的一种氧化物,该氧化物中氮元素的化合价为+1,氧元素的化合价为﹣2价,化合价数值约到最简交叉写在元素右下角,其化学式为N2O。
故选:B。
(2023 丰台区二模)如图是KNO3的溶解度曲线,下列说法正确的是( )
A.20℃时,向100g水中加入40gKNO3,得到140g溶液
B.40℃时,KNO3饱和溶液的溶质质量分数为63.9%
C.60℃时,KNO3饱和溶液中溶质与溶剂的质量比为11:10
D.将60℃的KNO3饱和溶液降温至40℃,溶液质量不变
【解答】解:A、20℃时,硝酸钾的溶解度为31.6g,20℃时,向100g水中加入40gKNO3,最多能溶解31.6g,得到131.6g饱和溶液,故选项说法错误。
B、40℃时,硝酸钾的溶解度为63.9g,KNO3饱和溶液的溶质质量分数为100%<63.9%,故选项说法错误。
C、60℃时,硝酸钾的溶解度为110g,60℃时,KNO3饱和溶液中溶质与溶剂的质量比为110g:100g=11:10,故选项说法正确。
D、硝酸钾的溶解度随着温度的降低而减小,将60℃的KNO3饱和溶液降温至40℃,有晶体析出,溶液质量减少,故选项说法错误。
故选:C。
(2023 民权县一模)固体硝酸钾、硝酸钠的溶解度曲线如图所示。下列说法正确的是( )
A.在t1℃时,硝酸钾、硝酸钠溶液的溶质质量分数相等
B.硝酸钾、硝酸钠的溶液从t2℃降温至t1℃一定有晶体析出
C.t2℃时,向30 g硝酸钾的饱和溶液中加10 g水可得到20%的溶液
D.将t1℃时两固体的饱和溶液分别升温至t2℃,两溶液的溶质质量分数相等
【解答】解:A.在t1℃时,硝酸钾、硝酸钠的溶解度曲线相交于一点,即该温度下,硝酸钾、硝酸钠的溶解度相等,但硝酸钾、硝酸钠溶液不一定是饱和溶液,所以溶质质量分数无法确定是否相等,故A不正确;
B.硝酸钾、硝酸钠的溶液不一定饱和,所以从t2℃降温至t1℃不一定有晶体析出,故B不正确;
C.t2℃时,硝酸钾的溶解度为200g,向30 g硝酸钾的饱和溶液中加10 g水得到溶液的溶质质量分数为:50%,故C不正确;
D.t1℃时,硝酸钾、硝酸钠的溶解度曲线相交于一点,溶解度相等,溶质质量分数相等,将t1℃时两固体的饱和溶液分别升温至t2℃,两固体的溶解度增大,溶液由饱和变为不饱和溶液,溶液的溶质质量分数不变,所以两溶液的溶质质量分数相等,故D正确。
故选:D。
(2023 南山区校级三模)t1℃时,将a、b两种固体物质各25g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图甲所示;升温到t2℃时(忽略水分蒸发),现象如图乙所示;图丙是a、b两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.图丙中曲线N表示b物质的溶解度曲线
B.图甲中两烧杯内a、b溶液的溶质质量分数相等
C.图乙中烧杯内b溶液的溶质质量分数为25%
D.可用降温结晶的方法从饱和a溶液中得到固体a
【解答】解:A、结合图甲、图乙可知,b物质的溶解度随着温度升高而增大,故图丙中曲线M表示b物质的溶解度曲线,则曲线N表示a物质的溶解度曲线,故A错误;
B、由图甲可知,t1℃时,a、b均是饱和饱和溶液,结合图丙可知,t1℃时a、b两物质溶解度相等,故图甲中两烧杯内a、b溶液的溶质质量分数相等,故B正确;
C、图乙中烧杯b内固体全部溶解,b溶液的溶质质量分数为100%=20%,故C错误;
D、a物质的溶解度随温度降低而增大,降低温度,a的溶解度增大,饱和溶液变成不饱和溶液,故不能用降温结晶的方法从饱和a溶液中得到固体a,故D错误。
故选:B。
(2023 桐柏县三模)Mg、Al、Fe的固体混合物21.4g加入一定量的H2SO4恰好完全反应,反应后的溶液质量增加了21.2g,将反应后溶液蒸干得到固体的质量为( )
A.21.6g B.31.0g C.38.5g D.42.4g
【解答】解:Mg、Al、Fe的固体混合物21.4g加入一定量的硫酸恰好完全反应,反应后的溶液质量增加了21.2g,则生成H2的质量为21.4g﹣21.2g=0.2g,根据反应前后元素的质量相等,产生氢气中的氢元素的质量等于反应掉的硫酸中氢元素的质量,则硫酸中氢元素的质量为0.2g,且硫酸中氢元素的质量与硫酸根离子的质量的质量比为2:96=1:48,则硫酸根离子的质量为:0.2g×48=9.6g,将反应后溶液蒸发结晶、干燥,Mg、Al、Fe完全反应完后转化为MgSO4、Al2(SO4)3、FeSO4,故获得固体质量为9.6g+21.4g=31.0g。
故选:B。
(2023 东莞市二模)从微观上看,化学反应是微观粒子按一定的数目关系进行的。某碳氢化合物(化学式为CxHy)在密闭容器内充分燃烧,生成二氧化碳和水。部分物质的分子数随反应过程的变化如图所示。下列说法正确的是( )
A.该反应前后分子数目不变
B.t时刻,容器中O2和CO2的质量相等
C.该碳氢化合物的化学式为C3H8
D.该反应生成的二氧化碳和水的质量之比为22:9
【解答】解:由图可知,参加反应的有机物、氧气,生成的二氧化碳的分子个数比为:n:(6n﹣n):3n=1:5:3,设化学方程式中水前面的化学计量数为m,则化学方程式为nCxHy+5nO23nCO2+mH2O;根据质量守恒定律,化学反应前后,元素的种类不变,原子的种类、总个数不变;根据氧原子个数守恒,反应物中有10n个氧原子,生成物二氧化碳中只含有6n个氧原子,因此化学方程式中水前面的化学计量数为4n,即生成水分子个数为4n,故化学方程式为CxHy+5O23CO2+4H2O,根据质量守恒定律,则x=3,y=8,即有机物的化学式为C3H8;
A、由反应的化学方程式可知,反应前的分子个数发生变化,故错误;
B、t时刻,O2和CO2的分子数相等,质量不相等,故错误;
C、反应的氧原子个数是10n,生成的二氧化碳中的氧原子是6n,则生成的水分子中氧原子是10n﹣6n=4n,该反应生成的水分子数目为4n,由质量守恒定律可知,CxHy+5O23CO2+4H2O,即x=3,y=8,碳氢化合物的化学式是C3H8,故正确;
D、该反应生成的二氧化碳和水的质量之比为:(3n×44):(4n×18)=11:6,故错误;
故选:C。
(2023 蕲春县模拟)氧化亚铜(Cu2O)是鲜红色粉末状固体,可用作杀菌剂、陶瓷和搪瓷的着色剂、红色玻璃染色剂等。现将Cu2O和Cu的固体混合物6.8g放入烧杯中,加入足量的稀硫酸,充分反应后,过滤、洗涤、干燥,得到4.8g固体。(已知Cu2O+H2SO4=CuSO4+Cu+H2O)。则原混合物中的Cu2O和Cu质量比为( )
A.9:8 B.17:12 C.1:1 D.9:4
【解答】解:设原混合物中的Cu2O的质量为x,生成铜的质量为y,
Cu2O+H2SO4=CuSO4+Cu+H2O,
144 64
x y
,
y,
根据题意有:6.8g﹣x4.8g,
x=3.6g,
原混合物中的Cu的质量为:6.8g﹣3.6g=3.2g,
则原混合物中的Cu2O和Cu质量比为:3.6g:3.2g=9:8,
故选:A。
(2023 天宁区校级模拟)“天宫课堂”中宇航员将维生素C泡腾片[含维生素C、柠檬酸( C6H8O7)和碳酸氢钠]塞入一个水球,水球里立即产生很多气泡,其中一个反应为:C6H8O7+xNaHCO3═NaxC6H8﹣xO7+xH2O+xCO2↑。为测定柠檬酸钠(NaxC6H8﹣xO7)化学式中的x,用4套相同装置加等量的水后,分别装入如表所示质量的柠檬酸和碳酸氢钠固体进行实验测得该条件下数据如表,推测x的数值为( )
实验组别 柠檬酸/g 碳酸氢钠/g 气体体积/mL
1 1.92 0.84 224
2 1.92 1.68 448
3 1.92 2.52 672
4 1.92 3.36 672
A.4 B.3 C.2 D.1
【解答】解:由表格中的数据可知,加入0.84g碳酸氢钠产生气体的体积为224mL,加入1.68g碳酸氢钠产生气体的体积为448mL,即每0.84g碳酸氢钠产生气体的体积为224mL,而加入2.52g、3.36g碳酸氢钠产生气体的体积为672mL,说明在实验组别3中,1.92g柠檬酸和2.52g碳酸氢钠恰好完全反应;
C6H8O7+xNaHCO3═NaxC6H8﹣xO7+xH2O+xCO2↑
192 84x
1.92g 2.52g
x=3
故选:B。
(2023 临沂一模)习近平总书记用“文明其精神,野蛮其体魄”来激励青少年多运动,重视强身健体。因为运动时,身体可以产生多巴胺,让人心情舒畅,缓解焦虑,提高身体免疫力。多巴胺的化学式为C8H11NO2。
(1)在多巴胺中,氮元素和氧元素的质量比为 (填最简整数比);
(2)多巴胺中碳元素的质量分数 (精确到0.1%)。
【解答】解:(1)在多巴胺中,氮元素和氧元素的质量比=14:(16×2)=7:16。
(2)多巴胺中碳元素的质量分数62.7%。
故答案为:(1)7:16;
(2)62.7%。
(2023 河西区一模)条形码的黏性主要来源于合成胶黏剂丙烯酸,化学式为C3H4O2。计算:
(1)丙烯酸的相对分子质量为 ;
(2)丙烯酸中碳、氧元素的质量比为 (填最简比);
(3)丙烯酸中碳元素的质量分数为 ;
(4)3.6g丙烯酸中含有的碳元素的质量是 g。
【解答】解:(1)丙烯酸(C3H4O2)的相对分子质量为12×3+1×4+16×2=72;故答案为:72;
(2)丙烯酸中碳元素与氧元素的质量比为(12×3):(16×2)=9:8,故答案为:9:8;
(3)丙烯酸中碳元素的质量分数为50%;故答案为:50%;
(4)3.6g丙烯酸中含有的碳元素的质量是3.6g×50%=1.8g;故答案为:1.8。
(2023 嘉禾县校级二模)山西老陈醋是中国四大名醋之一可促进胃液分泌,抑制血糖升高,降低血脂。陈醋中含有乙酸(化学式CH3COOH),如图是某品牌陈醋的部分标签。
(1)乙酸的相对分子质量为 。
(2)乙酸中氢、氧元素的质量比是 。
(3)一瓶陈醋中至少含有碳元素的质量是多少(写出计算过程)
【解答】解:(1)乙酸的相对分子质量为12×2+1×4+16×2=60;
故填:60;
(2)乙酸中氢、氧两种元素的质量比(1×4):(16×2)=1:8;
故填:1:8;
(3)一瓶陈醋中至少含有碳元素的质量是500mL×4g/100mL100%=8g。
答:一瓶陈醋中至少含有碳元素的质量是8g。
故答案为:(1)60;(2)1:8;(3)8g。
(2023 魏县一模)在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
(1)该温度下,实验①所得溶液是 溶液(填“饱和”或“不饱和”)。
(2)实验③所得溶液中溶质的质量分数是 (写出计算过程)
(3)现有溶质质量分数为10%的KCl的溶液300g,若配制成溶质质量分数为3%的KCl的溶液,问需要加水的质量是多少。(写出计算过程)
【解答】解:(1)饱和溶液是指一定温度下不能继续溶解某种溶质的溶液,还能继续溶解该溶质的溶液是不饱和溶液。①能继续溶解这种溶质,所以是不饱和溶液;故答案为:不饱和;
(2)根据图示可知100g水中加入60g氯化钾所得溶液质量为140g,说明只溶解了40g,所以该温度下的溶解度是40g;实验③溶液的质量分数为100%≈28.6%;故答案为:28.6%;
(3)设需要加水的质量是x,根据题意可得:
300g×10%=(300g+x)×3%
解得:x=700g
答:需要加水的质量是700g。
(2023 邹平市二模)化学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有50g废液的锥形瓶中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等电子设备采集信息并绘制成如图,请据图回答相关问题。(杂质可溶但不参加反应)
(1)该反应是 (填“吸热”或“放热”)反应。
(2)恰好完全反应时,溶液的温度为 ℃。
(3)计算废液中硫酸的质量分数。(写出计算过程)
【解答】解:(1)由图像可知,溶液的温度升高,说明该反应是放热反应。
(2)该反应是放热反应,恰好完全反应时溶液温度最高,由图像可知,恰好完全反应时溶液的温度为t3℃。
(3)设50g废液中硫酸的质量为x。
2NaOH+H2SO4=Na2SO4+2H2O
80 98
40g×20% x
解得:x=9.8g
废液中硫酸的质量分数为:
答:废液中硫酸的质量分数19.6%。
故答案为:(1)放热;
(2)t3;
(3)19.6%。
(2023 唐山模拟)医学上常用过氧化氢溶液来清洗创口和局部抗菌,玲玲同学取68.0g某医用过氧化氢溶液放入锥形瓶中,然后加入2.0g二氧化锰,每隔一分钟观察并记录一次锥形瓶及物质的质量(如表),直到实验结束。
时间/分钟 0 1 2 3 4 5
锥形瓶及物质质量/g 100 99.3 98.9 98.6 98.4 98.4
请计算:
(1)共生成氧气 g。
(2)过氧化氢溶液中溶质的质量分数。
【解答】解:(1)根据质量守恒定律,反应前后物质的总质量不变,则共生成氧气的质量为:100g﹣98.4g=1.6g。
(2)设过氧化氢溶液中溶质的质量为x。
2H2O22H2O+O2↑
68 32
x 1.6g
x=3.4g
则过氧化氢溶液中溶质的质量分数为:100%=5%。
答:过氧化氢溶液中溶质的质量分数为5%。
(2023 重庆模拟)新冠疫情中常用84消毒液进行环境消毒,其主要成分是次氯酸钠(NaClO)。制备次氯酸钠的发生器中发生反应的总化学方程式为:NaCl+H2ONaClO+H2↑。现电解600g溶质的质量分数为26%的氯化钠溶液一段时间,溶液质量减少4g(假设不考虑其他副产物)。请计算:
(1)NaCl中氯元素的质量分数 (填“>”、“=”或“<”)NaClO中氯元素的质量分数。
(2)电解所得溶液中次氯酸钠的质量分数。
(3)用于电解的600g26%的氯化钠溶液是通过在10%的氯化钠溶液中加入氯化钠固体的方式配制的,计算需要加入NaCl固体的质量。(计算结果保留一位小数)
【解答】解:(1)NaCl和 NaClO中都是含有1个氯原子,但NaClO比NaCl多一个氧原子,相对分子质量更大,所以NaCl中氯元素的质量分数>NaClO中氯元素的质量分数。
(2)根据质量守恒定律,氢气的质量为4g,
设生成的次氯酸钠的质量为x。
NaCl+H2ONaClO+H2↑
74.5 2
x 4g
x=149g
电解所得溶液中次氯酸钠的质量分数100%=25%
答:电解所得溶液中次氯酸钠的质量分数25%。
(3)设需要加入NaCl固体的质量为y。
(600g﹣y)×10%+y=600g×26%
解得y≈106.7g。
同课章节目录
