2.1.2碳酸钠和碳酸氢钠、焰色试验学案(无答案)高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.2碳酸钠和碳酸氢钠、焰色试验学案(无答案)高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 144.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-08 10:24:42 | ||
图片预览

文档简介
2.1.2 碳酸钠和碳酸氢钠 焰色试验
【学习目标】
1.运用变化观念理解并掌握Na2CO3、NaHCO3的性质和相互转化的途径。
2.了解焰色试验的现象及原理并能够作出解释,提升自身的实验探究能力与创新意识。
【知识回顾】
碳酸钠 化学式:_______________ 俗称:_______________
碳酸氢钠 化学式:_______________ 俗称:_______________
【学习任务】
碳酸钠和碳酸氢钠的性质探究
碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究 课本P38实验2-4
实验步骤 1 g Na2CO3 1 g NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 ________________ _____________________
②加几滴水并将温度计伸入其中 加水后_____________,温度计示数__________ 加水后 溶解,温度计示数_______
③加5 mL水 振荡一段时间________ 固体量 ____________
④加1~2滴酚酞 溶液_____________ 溶液变__________
初步结论 ①Na2CO3 溶于水______ ,NaHCO3溶于水_________ ②相同温度下在水中的溶解度: Na2CO3 _________NaHCO3 ③Na2CO3和NaHCO3的水溶液碱性:Na2CO3______NaHCO3
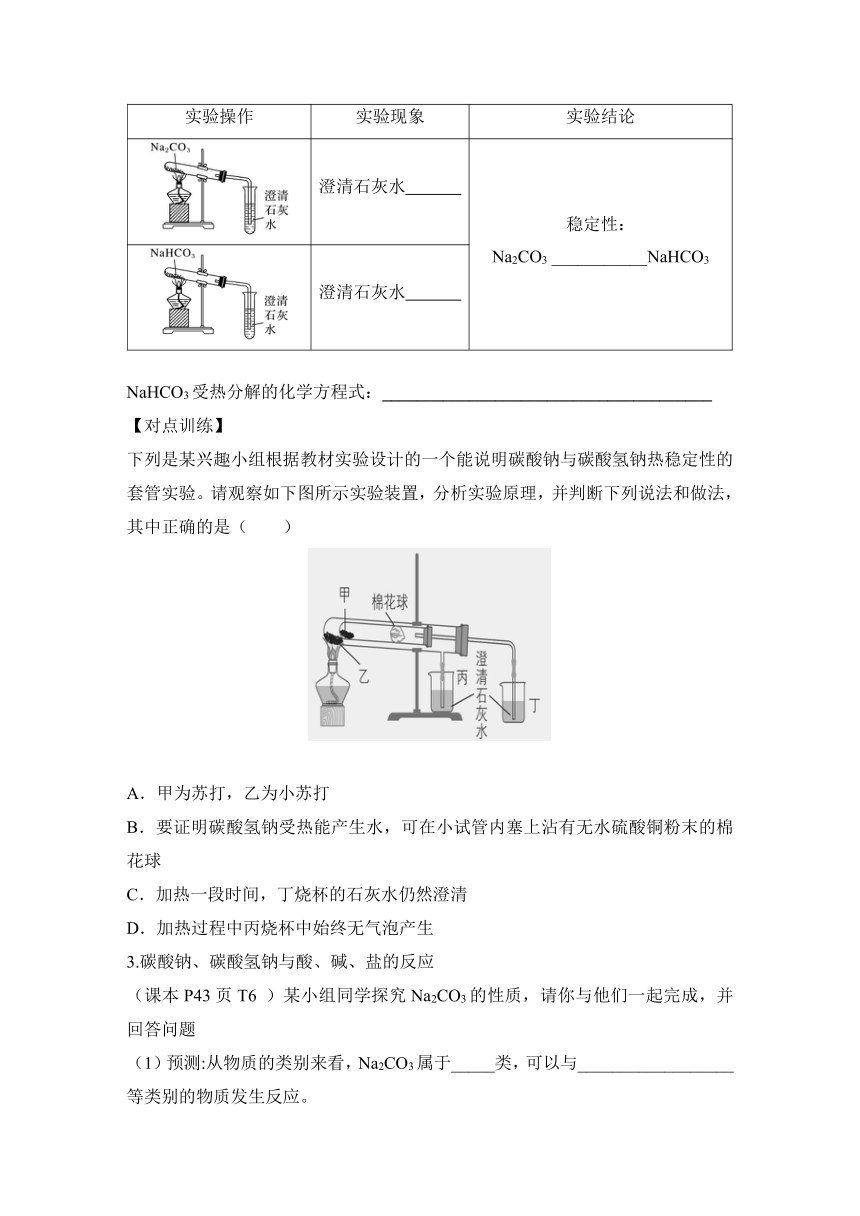
碳酸钠、碳酸氢钠热稳定性的实验探究 课本P39实验2-5
实验操作 实验现象 实验结论
澄清石灰水 稳定性: Na2CO3 ___________NaHCO3
澄清石灰水
NaHCO3受热分解的化学方程式:______________________________________
【对点训练】
下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中正确的是( )
A.甲为苏打,乙为小苏打
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热一段时间,丁烧杯的石灰水仍然澄清
D.加热过程中丙烧杯中始终无气泡产生
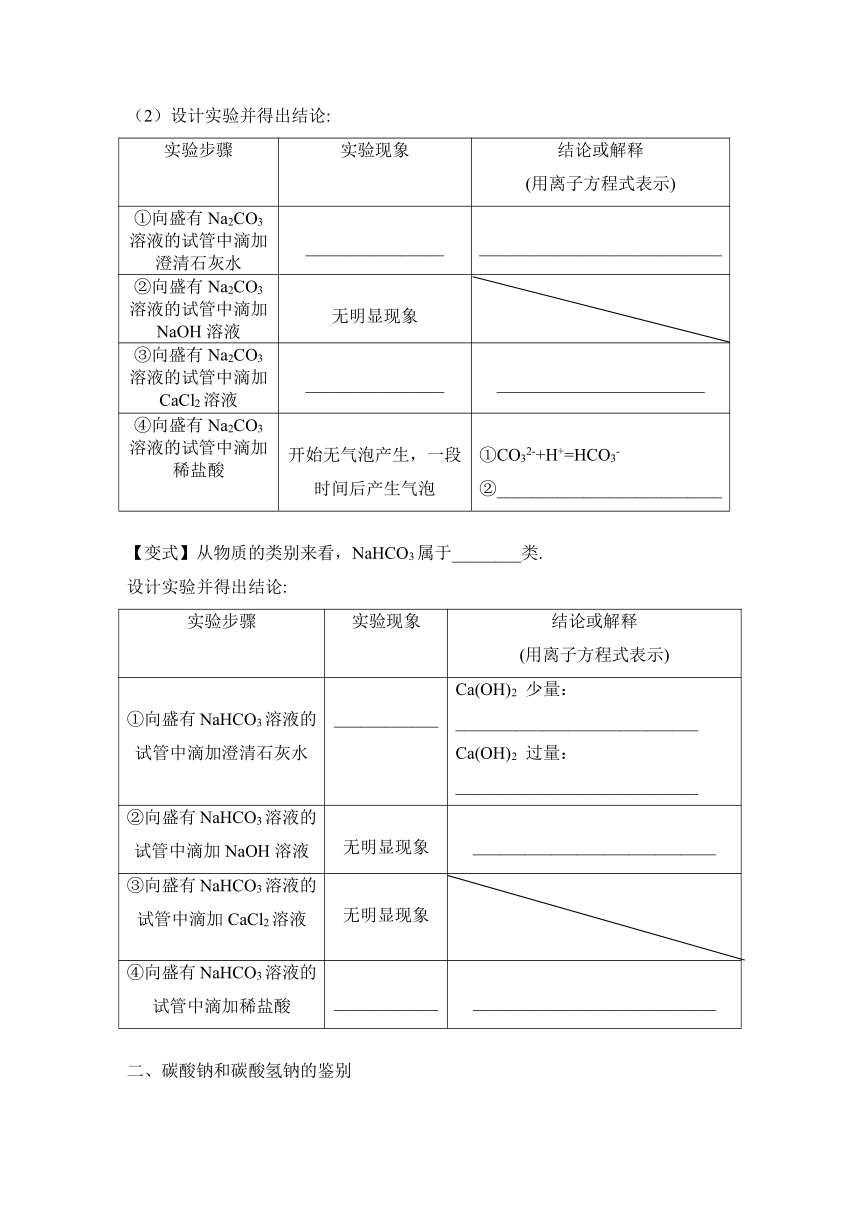
3.碳酸钠、碳酸氢钠与酸、碱、盐的反应
(课本P43页T6 )某小组同学探究Na2CO3的性质,请你与他们一起完成,并回答问题
(1)预测:从物质的类别来看,Na2CO3属于_____类,可以与__________________等类别的物质发生反应。
(2)设计实验并得出结论:
实验步骤 实验现象 结论或解释 (用离子方程式表示)
①向盛有Na2CO3溶液的试管中滴加澄清石灰水 ________________ ____________________________
②向盛有Na2CO3溶液的试管中滴加NaOH溶液 无明显现象
③向盛有Na2CO3溶液的试管中滴加CaCl2溶液 ________________ ________________________
④向盛有Na2CO3溶液的试管中滴加稀盐酸 开始无气泡产生,一段时间后产生气泡 ①CO32-+H+=HCO3- ②__________________________
【变式】从物质的类别来看,NaHCO3属于________类.
设计实验并得出结论:
实验步骤 实验现象 结论或解释 (用离子方程式表示)
①向盛有NaHCO3溶液的试管中滴加澄清石灰水 ____________ Ca(OH)2 少量: ____________________________ Ca(OH)2 过量: ____________________________
②向盛有NaHCO3溶液的试管中滴加NaOH溶液 无明显现象 ____________________________
③向盛有NaHCO3溶液的试管中滴加CaCl2溶液 无明显现象
④向盛有NaHCO3溶液的试管中滴加稀盐酸 ____________ ____________________________
碳酸钠和碳酸氢钠的鉴别
碳酸钠和碳酸氢钠都是白色固体,在实验室中如果忘记标记标签,就很难进行辨认,请你设计实验方案鉴别碳酸钠和碳酸氢钠 。(提示:可以根据前面学习的碳酸钠和碳酸氢钠的性质不同) (下面方法可以不用填写完)
方法1:______________________________________________________________
方法2:______________________________________________________________
方法3:_______________________________________________________________
方法4:______________________________________________________________
方法5:______________________________________________________________
【思考】能不能用澄清石灰水鉴别?
_____________________________________________________________________
碳酸钠和碳酸氢钠的相互转化或除杂
【思考】1. 根据所学碳酸钠和碳酸氢钠的性质,设计实验方案,碳酸钠如何转化成碳酸氢钠,碳酸氢钠如何转化成碳酸钠?
①_____________ ②__________
Na2CO3 NaHCO3
①固体:_____ ②溶液:_________
2.完成下面表格,括号内物质是杂质
除杂方法或所用试剂 反应原理(写出化学方程式)
Na2CO3固体(NaHCO3) __________________ __________________
NaHCO3溶液(Na2CO3) __________________ __________________
Na2CO3溶液(NaHCO3) __________________ __________________
四、焰色试验
1.概念:很多 __________________ 在灼烧时都会使火焰呈现特殊的颜色。根据火焰呈现的特征颜色,可以判断试样所含的__________ ,化学上把这样的定性分析操作称为焰色试验。
【注意】(1)焰色试验是________________________的性质
焰色试验属于_________________变化
不是所有金属灼烧时都有颜色,如铂、铁的火焰是无色的。
2.焰色试验的一般操作步骤
①洗-----用______________洗净铂丝(或光洁无锈的铁丝)
②烧-----将洗净的铂丝(或光洁无锈的铁丝)在酒精灯(最好用煤气灯)外焰上灼烧至与原火焰颜色相同
③蘸-----蘸取待测物质
④烧-----在酒精灯上灼烧,并观察火焰的颜色
⑤洗-----用盐酸洗净铂丝(或光洁无锈的铁丝)并在火焰上烧至与原火焰颜色相同
几种常见金属元素的焰色
金属元素 锂 钠 钾 铷 钙 锶 钡 铜
颜色
【注意】观察钾元素的火焰焰色时要透过蓝色钴玻璃,目的是滤去所含杂质钠元素的黄光
【记忆口诀】黄钠紫铷钾,砖洋紫三红,钙锶锂分明,黄绿钡绿铜
用途
(1)检验金属元素的存在,如:鉴别NaCl和KCl溶液。
(2)利用焰色反应制节日烟花。
(3)照明或其他
【对点训练】
1.下述对焰色反应实验操作注意事项的说明,正确的是( )
① 钾的火焰颜色要透过蓝色钴玻璃观察
② 先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③ 每次实验后,要将铂丝用硫酸洗净
④ 实验时最好选择本身颜色较浅的火焰
⑤ 没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全正确
2、下列说法正确的是( )
A. 颜色试验为黄色,说明该物质中一定含有钠元素
B. 某物质的焰色试验不显紫色(未透过蓝色钴玻璃),说明该物质中肯定没有钾元素
C. 焰色试验不能用于物质的鉴别
D. 焰色试验是化学变化
【学习目标】
1.运用变化观念理解并掌握Na2CO3、NaHCO3的性质和相互转化的途径。
2.了解焰色试验的现象及原理并能够作出解释,提升自身的实验探究能力与创新意识。
【知识回顾】
碳酸钠 化学式:_______________ 俗称:_______________
碳酸氢钠 化学式:_______________ 俗称:_______________
【学习任务】
碳酸钠和碳酸氢钠的性质探究
碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究 课本P38实验2-4
实验步骤 1 g Na2CO3 1 g NaHCO3
①观察两支试管中碳酸钠、碳酸氢钠的形态 ________________ _____________________
②加几滴水并将温度计伸入其中 加水后_____________,温度计示数__________ 加水后 溶解,温度计示数_______
③加5 mL水 振荡一段时间________ 固体量 ____________
④加1~2滴酚酞 溶液_____________ 溶液变__________
初步结论 ①Na2CO3 溶于水______ ,NaHCO3溶于水_________ ②相同温度下在水中的溶解度: Na2CO3 _________NaHCO3 ③Na2CO3和NaHCO3的水溶液碱性:Na2CO3______NaHCO3
碳酸钠、碳酸氢钠热稳定性的实验探究 课本P39实验2-5
实验操作 实验现象 实验结论
澄清石灰水 稳定性: Na2CO3 ___________NaHCO3
澄清石灰水
NaHCO3受热分解的化学方程式:______________________________________
【对点训练】
下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中正确的是( )
A.甲为苏打,乙为小苏打
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热一段时间,丁烧杯的石灰水仍然澄清
D.加热过程中丙烧杯中始终无气泡产生
3.碳酸钠、碳酸氢钠与酸、碱、盐的反应
(课本P43页T6 )某小组同学探究Na2CO3的性质,请你与他们一起完成,并回答问题
(1)预测:从物质的类别来看,Na2CO3属于_____类,可以与__________________等类别的物质发生反应。
(2)设计实验并得出结论:
实验步骤 实验现象 结论或解释 (用离子方程式表示)
①向盛有Na2CO3溶液的试管中滴加澄清石灰水 ________________ ____________________________
②向盛有Na2CO3溶液的试管中滴加NaOH溶液 无明显现象
③向盛有Na2CO3溶液的试管中滴加CaCl2溶液 ________________ ________________________
④向盛有Na2CO3溶液的试管中滴加稀盐酸 开始无气泡产生,一段时间后产生气泡 ①CO32-+H+=HCO3- ②__________________________
【变式】从物质的类别来看,NaHCO3属于________类.
设计实验并得出结论:
实验步骤 实验现象 结论或解释 (用离子方程式表示)
①向盛有NaHCO3溶液的试管中滴加澄清石灰水 ____________ Ca(OH)2 少量: ____________________________ Ca(OH)2 过量: ____________________________
②向盛有NaHCO3溶液的试管中滴加NaOH溶液 无明显现象 ____________________________
③向盛有NaHCO3溶液的试管中滴加CaCl2溶液 无明显现象
④向盛有NaHCO3溶液的试管中滴加稀盐酸 ____________ ____________________________
碳酸钠和碳酸氢钠的鉴别
碳酸钠和碳酸氢钠都是白色固体,在实验室中如果忘记标记标签,就很难进行辨认,请你设计实验方案鉴别碳酸钠和碳酸氢钠 。(提示:可以根据前面学习的碳酸钠和碳酸氢钠的性质不同) (下面方法可以不用填写完)
方法1:______________________________________________________________
方法2:______________________________________________________________
方法3:_______________________________________________________________
方法4:______________________________________________________________
方法5:______________________________________________________________
【思考】能不能用澄清石灰水鉴别?
_____________________________________________________________________
碳酸钠和碳酸氢钠的相互转化或除杂
【思考】1. 根据所学碳酸钠和碳酸氢钠的性质,设计实验方案,碳酸钠如何转化成碳酸氢钠,碳酸氢钠如何转化成碳酸钠?
①_____________ ②__________
Na2CO3 NaHCO3
①固体:_____ ②溶液:_________
2.完成下面表格,括号内物质是杂质
除杂方法或所用试剂 反应原理(写出化学方程式)
Na2CO3固体(NaHCO3) __________________ __________________
NaHCO3溶液(Na2CO3) __________________ __________________
Na2CO3溶液(NaHCO3) __________________ __________________
四、焰色试验
1.概念:很多 __________________ 在灼烧时都会使火焰呈现特殊的颜色。根据火焰呈现的特征颜色,可以判断试样所含的__________ ,化学上把这样的定性分析操作称为焰色试验。
【注意】(1)焰色试验是________________________的性质
焰色试验属于_________________变化
不是所有金属灼烧时都有颜色,如铂、铁的火焰是无色的。
2.焰色试验的一般操作步骤
①洗-----用______________洗净铂丝(或光洁无锈的铁丝)
②烧-----将洗净的铂丝(或光洁无锈的铁丝)在酒精灯(最好用煤气灯)外焰上灼烧至与原火焰颜色相同
③蘸-----蘸取待测物质
④烧-----在酒精灯上灼烧,并观察火焰的颜色
⑤洗-----用盐酸洗净铂丝(或光洁无锈的铁丝)并在火焰上烧至与原火焰颜色相同
几种常见金属元素的焰色
金属元素 锂 钠 钾 铷 钙 锶 钡 铜
颜色
【注意】观察钾元素的火焰焰色时要透过蓝色钴玻璃,目的是滤去所含杂质钠元素的黄光
【记忆口诀】黄钠紫铷钾,砖洋紫三红,钙锶锂分明,黄绿钡绿铜
用途
(1)检验金属元素的存在,如:鉴别NaCl和KCl溶液。
(2)利用焰色反应制节日烟花。
(3)照明或其他
【对点训练】
1.下述对焰色反应实验操作注意事项的说明,正确的是( )
① 钾的火焰颜色要透过蓝色钴玻璃观察
② 先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③ 每次实验后,要将铂丝用硫酸洗净
④ 实验时最好选择本身颜色较浅的火焰
⑤ 没有铂丝时,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全正确
2、下列说法正确的是( )
A. 颜色试验为黄色,说明该物质中一定含有钠元素
B. 某物质的焰色试验不显紫色(未透过蓝色钴玻璃),说明该物质中肯定没有钾元素
C. 焰色试验不能用于物质的鉴别
D. 焰色试验是化学变化
