1.3.2氧化剂和还原剂课件(共13张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化剂和还原剂课件(共13张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-08 18:24:50 | ||
图片预览

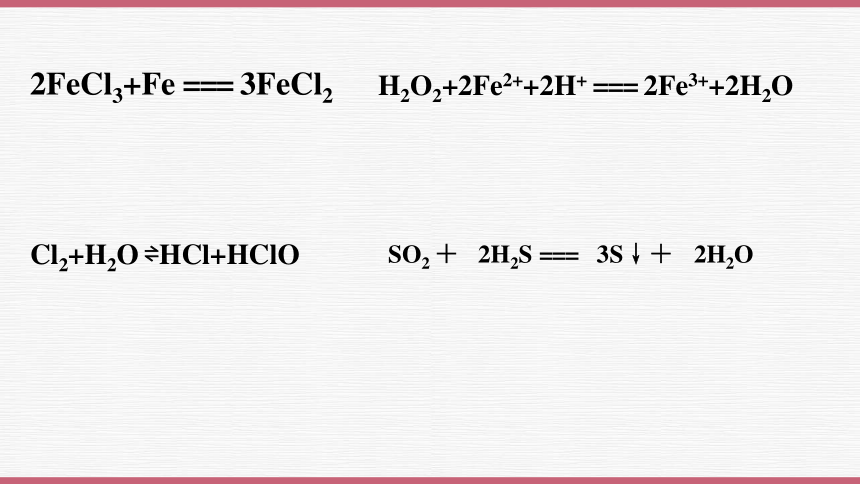


文档简介
(共13张PPT)
第2课时 氧化剂和还原剂
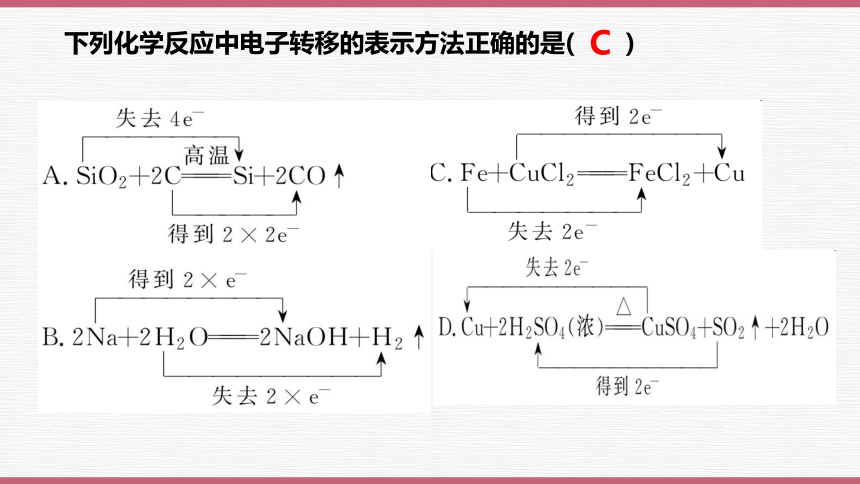
下列化学反应中电子转移的表示方法正确的是( )
C
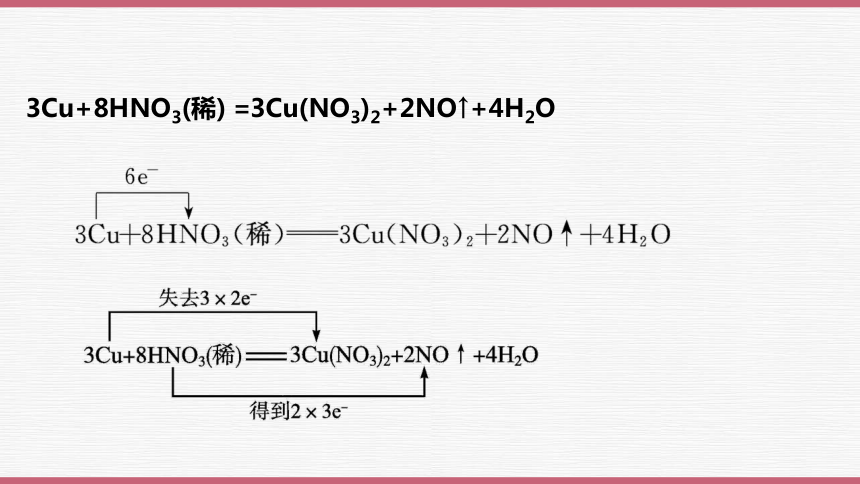
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O
2FeCl3+Fe === 3FeCl2
H2O2+2Fe2++2H+ === 2Fe3++2H2O
Cl2+H2O HCl+HClO
SO2 + 2H2S === 3S↓+ 2H2O
01
氧化剂和还原剂
氧化剂和还原剂
01
1.氧化还原反应中的四种物质
氧化剂:氧化还原反应中________电子(或电子对________)的物质
还原剂:氧化还原反应中________电子(或电子对________)的物质
氧化产物:还原剂失电子(被氧化)后的生成物
还原产物:氧化剂得电子(被还原)后的生成物
得 偏向
失 偏移
氧化剂和还原剂
01
2.两种性质
氧化性:氧化剂所表现出 ________的性质。
还原性:还原剂所表现出 ________的性质。
失电子
得电子
3.两个过程
被氧化:在氧化还原过程中,还原剂化合价升高的过程。
被还原:在氧化还原过程中,氧化剂化合价降低的过程。
氧化剂和还原剂
01
相应关系
氧化剂和还原剂
01
思考与交流
金属原子失去电子的数目越多,其还原性越强吗?
非金属原子得到电子的数目越多,其氧化性越强吗?
氧化性、还原性只与原子得、失电子的难易程度有关,而与得、失电
子数目的多少无关。
金属原子失电子能力越强,其还原性就越强,如Na>Al;
非金属原子得电子能力越强,其氧化性就越强,如Cl>S。
氧化剂和还原剂
01
【自我小测】判断正误:
(1)金属阳离子只具有氧化性,不具有还原性。( )
提示 ×。若金属阳离子处于中间价态,如Fe2+,则既有氧化性又有还原性。
(2)金属元素的原子失去电子的数目越多,该金属的还原性越强。( )
提示 ×。金属的还原性强弱与失电子难易程度有关,与数目无关.
(3)元素处于最高价时,该物质一定具有强氧化性。( )
提示 ×。钾元素的+1价为最高价,但K+氧化性很弱。
(4)金属单质只有还原性,非金属单质只有氧化性。( )
提示 ×。金属只有正价,故金属单质只有还原性;非金属通常有正价也有负价,故非金属单质通常既有氧化性,又有还原性。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(1)常见的氧化剂
①非金属单质Cl2、Br2、O2、O3等;
②高价金属阳离子Fe3+等;
③高价或较高价含氧化合物H2SO4(浓)、MnO2、HClO、KMnO4、HNO3等;
④过氧化物Na2O2、H2O2等。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(1)常见的还原剂
①活泼或较活泼的金属K、Na、Mg、Al、Zn、Fe等;
②低价金属阳离子Fe2+等;
③部分非金属阴离子I-、S2-等;
④含较低价元素的化合物CO、SO2、H2SO3、Na2SO3等;
⑤部分非金属单质H2、C(高温下)等。
氧化剂和还原剂
01
下列对X+2Y = X2++2Y-的叙述中正确的是( )
A.Y被还原,X2+是还原产物 B.Y被还原,X发生氧化反应
C.X是还原剂,Y被氧化 D.X是氧化剂,X显氧化性
B
下列变化中需要加入还原剂才能实现的是( )
A.MnSO4→KMnO4 B.NaCl→AgCl
C.NO2→HNO3 D.Fe2O3→Fe
D
第2课时 氧化剂和还原剂
下列化学反应中电子转移的表示方法正确的是( )
C
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O
2FeCl3+Fe === 3FeCl2
H2O2+2Fe2++2H+ === 2Fe3++2H2O
Cl2+H2O HCl+HClO
SO2 + 2H2S === 3S↓+ 2H2O
01
氧化剂和还原剂
氧化剂和还原剂
01
1.氧化还原反应中的四种物质
氧化剂:氧化还原反应中________电子(或电子对________)的物质
还原剂:氧化还原反应中________电子(或电子对________)的物质
氧化产物:还原剂失电子(被氧化)后的生成物
还原产物:氧化剂得电子(被还原)后的生成物
得 偏向
失 偏移
氧化剂和还原剂
01
2.两种性质
氧化性:氧化剂所表现出 ________的性质。
还原性:还原剂所表现出 ________的性质。
失电子
得电子
3.两个过程
被氧化:在氧化还原过程中,还原剂化合价升高的过程。
被还原:在氧化还原过程中,氧化剂化合价降低的过程。
氧化剂和还原剂
01
相应关系
氧化剂和还原剂
01
思考与交流
金属原子失去电子的数目越多,其还原性越强吗?
非金属原子得到电子的数目越多,其氧化性越强吗?
氧化性、还原性只与原子得、失电子的难易程度有关,而与得、失电
子数目的多少无关。
金属原子失电子能力越强,其还原性就越强,如Na>Al;
非金属原子得电子能力越强,其氧化性就越强,如Cl>S。
氧化剂和还原剂
01
【自我小测】判断正误:
(1)金属阳离子只具有氧化性,不具有还原性。( )
提示 ×。若金属阳离子处于中间价态,如Fe2+,则既有氧化性又有还原性。
(2)金属元素的原子失去电子的数目越多,该金属的还原性越强。( )
提示 ×。金属的还原性强弱与失电子难易程度有关,与数目无关.
(3)元素处于最高价时,该物质一定具有强氧化性。( )
提示 ×。钾元素的+1价为最高价,但K+氧化性很弱。
(4)金属单质只有还原性,非金属单质只有氧化性。( )
提示 ×。金属只有正价,故金属单质只有还原性;非金属通常有正价也有负价,故非金属单质通常既有氧化性,又有还原性。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(1)常见的氧化剂
①非金属单质Cl2、Br2、O2、O3等;
②高价金属阳离子Fe3+等;
③高价或较高价含氧化合物H2SO4(浓)、MnO2、HClO、KMnO4、HNO3等;
④过氧化物Na2O2、H2O2等。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(1)常见的还原剂
①活泼或较活泼的金属K、Na、Mg、Al、Zn、Fe等;
②低价金属阳离子Fe2+等;
③部分非金属阴离子I-、S2-等;
④含较低价元素的化合物CO、SO2、H2SO3、Na2SO3等;
⑤部分非金属单质H2、C(高温下)等。
氧化剂和还原剂
01
下列对X+2Y = X2++2Y-的叙述中正确的是( )
A.Y被还原,X2+是还原产物 B.Y被还原,X发生氧化反应
C.X是还原剂,Y被氧化 D.X是氧化剂,X显氧化性
B
下列变化中需要加入还原剂才能实现的是( )
A.MnSO4→KMnO4 B.NaCl→AgCl
C.NO2→HNO3 D.Fe2O3→Fe
D
