化学人教版(2019)必修第一册1.1.2分散系及其分类(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1.2分散系及其分类(共38张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 29.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-09 08:30:03 | ||
图片预览









文档简介
(共38张PPT)
分散系及其分类
知识点一、分散系
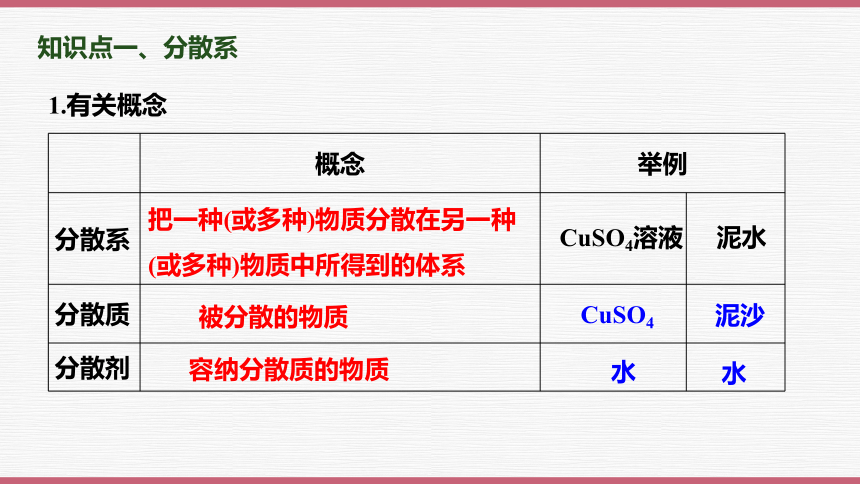
概念 举例 分散系
分散质
分散剂
把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系
被分散的物质
容纳分散质的物质
CuSO4溶液
泥水
CuSO4
泥沙
水
1.有关概念
水
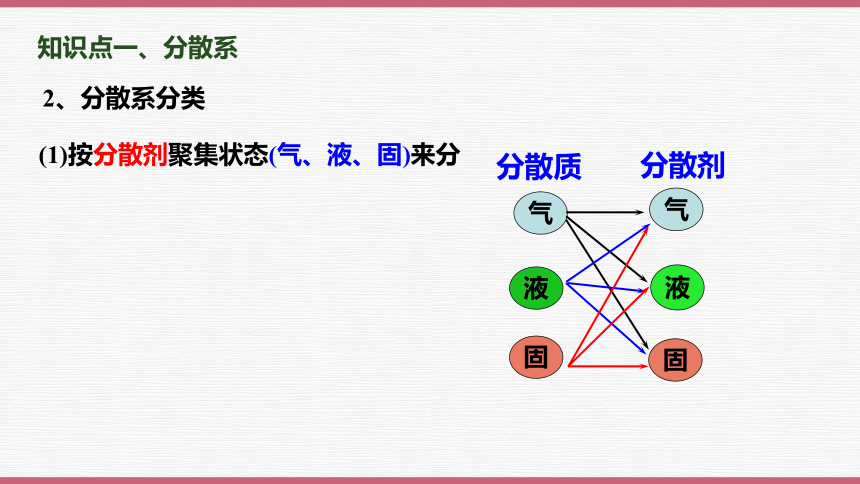
2、分散系分类
分散质
分散剂
气
液
固
气
液
固
(1)按分散剂聚集状态(气、液、固)来分
知识点一、分散系
分散质 分散剂 实 例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟、灰尘
汽水
牛奶、酒精的水溶液
糖水、油漆、泥水
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
知识点一、分散系
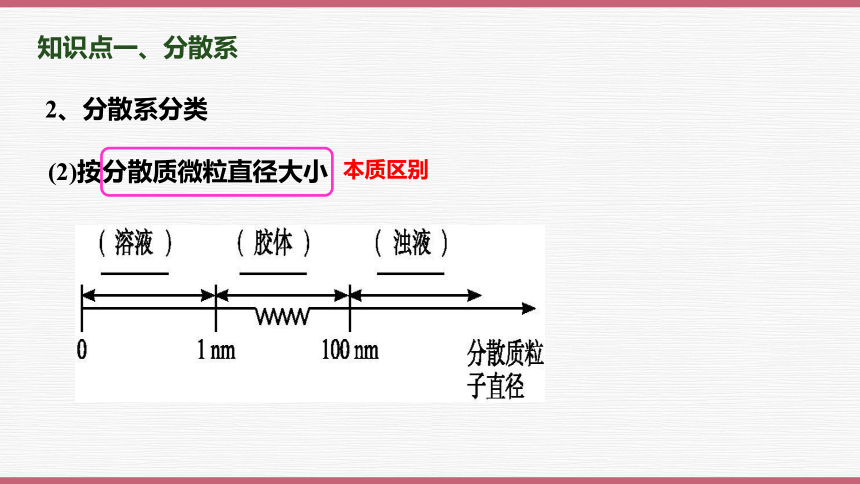
2、分散系分类
(2)按分散质微粒直径大小
知识点一、分散系
本质区别
知识点一、分散系
交流:
1.下列哪些属于溶液、浊液或胶体?
泥浆水、氢氧化钙悬浊液、澄清石灰水、牛奶、海水、豆浆
泥浆水和氢氧化钙悬浊液属于浊液。
澄清石灰水和海水属于溶液,牛奶和豆浆属于胶体。
2.PM2.5分散在空气中形成的混合物属于胶体吗?
PM2.5是指直径小于2.5pm的颗粒,1pm=1000nm,而胶体的范围在1nm~100nm之间。所以一般来说不是胶体,而是浊液。
知识点二、胶体
1. 概念: 分散质粒子直径 1nm<d<100nm 之间的分散系
(10-9m<d<10-7m)
注意:胶体不是一类物质,而是几乎任何物质都可能形成的一种分散状态。例如:NaCl溶于水形成溶液,如果分散在酒精中则可形成胶体。
2. 氢氧化铁胶体的制取
(1)反应原理:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
==
(2)操作步骤:
在100 mL小烧杯中加入40 mL蒸馏水,加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,即制得Fe(OH)3胶体(透明的红褐色液体)。
知识点二、胶体
实验仪器与药品:FeCl3饱和溶液、蒸馏水、试管、酒精灯等。
氢氧化铁胶体制备注意事项:
(1)若将蒸馏水换成氨水或NaOH溶液,能否得到Fe(OH)3胶体?
(2)若将蒸馏水换成自来水,能否得到Fe(OH)3胶体?
(3)为什么使用FeCl3饱和溶液?
(4)用什么方法证明得到的分散系为胶体?
(5)在制备Fe(OH)3胶体时,能否用玻璃棒搅拌?
(6)持续加热可能有什么现象?
自来水中含有杂质离子,易使胶粒聚成,产生沉淀。
不能,会聚沉
利用丁达尔效应
更容易生成Fe(OH)3胶体
过度加热会聚沉
会直接生成产生Fe(OH)3沉淀。
1、实验过程
把装有CuSO4溶液、Fe(OH)3胶体的试管,分别用激光笔照射烧杯中的液体,在与光束垂直的方向进行观察。
2、探究过程
问题1、激光笔照射硫酸铜溶液,有什么现象?
问题2、激光笔照射氢氧化铁胶体,有什么现象?
问题3、产生不同现象的原因是什么?
3. 胶体的性质
知识点二、胶体
3. 胶体的性质
(1)丁达尔效应:
应用:鉴别胶体与溶液的一种常用物理方法
原因:胶体粒子直径大小与光的波长相近,胶粒对光有散射作用。
例1.下列分散系不能发生丁达尔现象的是( )
A.豆浆 B.牛奶 C.蔗糖溶液 D.烟、云、雾
C
当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”。
知识点二、胶体
丁达尔效应是胶体和溶液的本质区别吗
提示:不是。
胶体和溶液的本质区别是分散质粒子的大小不同。
3. 胶体的性质
(2)布朗运动:
悬浮在水中的小颗粒做不停地、无秩序地运动
原因:溶剂分子不均匀地撞击胶体粒子,
使其不断改变方向、改变速率
知识点二、胶体
3. 胶体的性质
(3)电泳:
原因:胶粒带电荷
外加电场作用下,胶体粒子在分散剂里向电极做定向移动的现象。
知识点二、胶体
应用:工厂静电除尘
特别提醒
胶体电性 (1)正电: 一般来说,金属氢氧化物、金属氧化物的胶体粒子带正电荷,如Fe(OH)3 , Al(OH)3 , Cr(OH)3 , Fe2O3 (2)负电: 非金属氧化物、金属硫化物的胶体粒子带负电荷,如As2S3 , Sb2S3 , H2SiO3 , Au , Ag。(另外土壤胶粒子也带负电) (3)不带电:像淀粉溶液,蛋白质溶液一类的高分子胶体粒子是不带电的。 (4)注意胶体与胶体粒子的区别,胶体的很多性质均是由胶体粒子体现的。
如胶体粒子的直径在1~100 nm之间,胶体粒子吸附了阳离子或阴离子
而带正电或负电,能产生电泳现象等,胶体不带电。
3. 胶体的性质
(4)聚沉:
使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出的过程
加入少量电解质
中和胶体微粒的电荷,使之聚集沉淀
豆浆里加盐卤或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐
河海交汇处形成三角洲 FeCl3溶液用于止血
加入带相反电荷胶粒的胶体
电性中和,使之聚集沉淀
Fe(OH)3胶体中加入硅酸胶体 不同血型的人不能互相输血
不同墨水混合使用会导致钢笔堵塞
加热
加速胶粒碰撞,减弱胶粒的吸附能力使之沉淀
知识点二、胶体
3. 胶体的性质
如何实现胶体和溶液的分离?
(5)渗析:
(透过性)
利用半透膜把胶体中混有的离子或分子从胶体中分离出来。
原因:胶体微粒不能透过半透膜,
溶液中分子和离子能透过半透膜。
应用:可以净化胶体,血液透析
知识点二、胶体
主要原因:同种胶体粒子的电性相同,互斥而不易聚沉
次要原因:胶体微粒作布朗运动
胶体稳定的原因:
生活中属于胶体的常见物质
云、雾、烟;墨水;血液;淀粉溶液、豆浆、牛奶、蛋清;有色玻璃、珍珠;Al(OH) 胶体、Fe(OH) 胶体
生活中与胶体有关的现象或应用小结
现象或应用 性质
清晨在森林中看到光束
血液透析
淀粉溶液的提纯
盐卤制豆腐
不同品牌墨水不能混用
入海口处三角洲的形成
明矾净水
土壤具有保肥能力
工厂利用高压电除尘
丁达尔效应
透过性
透过性
介稳性(聚沉)
介稳性(聚沉)
介稳性(聚沉)
介稳性(聚沉)
电泳
介稳性(聚沉)
03
三类分散系的比较
思考交流:
1.鸡蛋壳表面有很小的孔,可以透过空气和水蒸气,使鸡蛋呼吸。为什么鸡蛋里的蛋清和蛋黄等不能流出蛋壳外呢?
2.三种分散系的分散质粒子大小各不相同,物理性质上有哪些不同?
03
三类分散系的比较
1、实验过程
取FeCl3溶液、淀粉胶体、泥沙浊液,分别用滤纸过滤。
2、探究过程
问题1、泥沙能否透过滤纸?
问题2、FeCl3溶液能否透过滤纸?
问题3、碘水滴到下层滤纸上是否变蓝色?
分散系 泥沙水 FeCl3溶液 淀粉胶体
能否透过滤纸 否 能 能
03
三类分散系的比较
1、实验过程
将淀粉胶体和NaCl溶液装入半透膜制成的小口袋中,用绳子系上悬挂在装有蒸馏水的烧杯中,静置五分钟后取烧杯中的液体分别装入两支试管中。
2、探究过程
问题1、AgNO3滴加到试管1中出现沉淀的原因?
问题2、碘水滴加到试管2中不变蓝色的原因?
03
三类分散系的比较
原因:分散质粒子的大小不同。
分散系 NaCl溶液 淀粉胶体
能否透过半透膜 能 否
分散系 泥沙水 FeCl3溶液 淀粉胶体
能否透过滤纸 否 能 能
溶液既可以透过半透膜、也可以透过滤纸;胶体不能透过半透膜、但可以透过滤纸;浊液两者皆不可透过。
不同分散系的比较
溶液 胶体 浊液 悬浊液 乳浊液
分散质微粒的直径 <1 nm 1~100 nm >100 nm >100 nm
微粒 小分子或离子 许多分子集合体或高分子 大量分子聚集成的固体小颗粒 大量分子聚集成的小液滴
实例 酒精、氯化钠溶液 Fe(OH)3胶体、淀粉溶液 泥水、石灰浆 油水混合物、油漆
外观 均一、透明 均一、透明 不均一、不透明、久置沉淀 不均一、不透明、久置分层
稳定性 稳定 较稳定 不稳定 不稳定
能否透过滤纸 能 能 不能 不能
能否透过半透膜 能 不能 不能 不能
鉴别 无丁达尔效应 有丁达尔效应 静置沉降 静置分层
胶体的性质总结
(1)介稳性:1、胶体粒子带有同种电荷,相互排斥,不易聚集成更大颗粒。(主要原因)
2、胶体粒子在不停的做布朗运动。(次要原因)
(2)丁达尔效应:当光束通过胶体时,可以看到一条光亮的“通路”,这是由于胶体粒子对光线散射形成的。丁达尔效应可用来区分胶体和溶液。
(3)聚沉:胶体形成沉淀析出的现象(一定条件下,中和或减弱胶体粒子的电荷,胶体粒子就会聚集成较大颗粒析出)。
其方法主要有:1、加热或搅拌 原因:胶体粒子加速运动,增加碰撞机会,导致胶体凝聚而沉淀。
2、加入电解质溶液 原因:加入的离子中和了胶体粒子所带电荷,使胶粒聚集成较大颗粒而沉淀。
3、加带相反电荷胶体粒子的胶体 原因:带相反电荷胶粒相遇时互相中和电荷,从而聚集成大颗粒而沉积。
胶体的性质总结
(4)电泳现象:胶体粒子带电荷,胶体粒子在电场的作用下发生定向移动。
(5)布朗运动
(6)透过性:能透过滤纸,不能透过半透膜
原因:胶体粒子带电荷,当胶粒带正电荷时向阴极运动,当胶粒带负电荷时向阳极运动。
特别提醒:胶体不带电,胶体中的胶粒能够吸附体系中的带电离子而使胶粒带电荷,但整个分散系仍呈电中性。
课堂感悟
分散质
分散系
分散剂
溶液
胶体
浊液
本质区别:分散质粒子大小
性质差别:主要表现在物理性质方面
已知鸡蛋清溶液是一种胶体,现有三瓶无色溶液:
NaCl溶液、Na2SO4溶液、鸡蛋清溶液,
试根据已学过的知识鉴别它们。
提示:可通过是否产生丁达尔效应首先鉴别出鸡蛋清溶液,
然后取余下的两种溶液,分别滴几滴BaCl2溶液,有白色沉淀生成的为Na2SO4溶液,无明显现象的为NaCl溶液。
判断 (正确的打“√”,错误的打“×”)
(1)所有分散系均为混合物 ( )
(2)油水混合物属于悬浊液 ( )
(3)胶体区别于其他分散系的本质特征是能发生丁达尔效应 ( )
(4)蔗糖溶液、淀粉溶液属于溶液,云、雾、烟属于胶体( )
(5)直径介于1~100 nm之间的粒子称为胶体( )
(6)氢氧化铁胶体为无色透明的液体,能产生丁达尔效应( )
(7)丁达尔效应可用来鉴定溶液与胶体( )
√
当 堂 巩 固
×
×
×
×
×
√
1、制备纳米材料时,首先用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液 C、胶体 D、乳浊液
C
2、胶体区别于其他分散系的本质特征是( )
A.胶体的分散质能透过滤纸 B.胶体是纯净物,其他分散系是混合物
C.胶体能产生丁达尔现象 D.胶体的分散质粒子直径在1~100nm之间
D
当 堂 巩 固
3.下列应用或事实与胶体的性质没有关系的是( )
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.清晨的阳光穿过茂密的林木枝叶所产生的美丽景象
4.用半透膜把分子或离子从胶体溶液中分离出来的方法是( )
A.电泳 B.电解 C.凝聚 D.渗析
C
D
当堂巩固
5、羟基氧化铝是一种“纳米材料”,粒子直径为1~100nm。下列关于其描述正确的是( )
A.羟基氧化铝可以发生丁达尔效应
B.羟基氧化铝可以穿过半透膜
C.羟基氧化铝粒子带负电荷
D.以上说法都不对
D
当 堂 巩 固
5、羟基氧化铝是一种“纳米材料”,粒子直径为1~100nm。若将其均匀地分散到蒸馏水中,形成某一分散系,下列描述正确的是( )
①是溶液;②是胶体;③能产生丁达尔效应
④能透过滤纸;⑤不能透过滤纸;⑥静置后,会析出沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
B
当 堂 巩 固
C
当 堂 巩 固
6、关于胶体和溶液的区别,下列叙述正确的是( )
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
C.溶液中通过一束光线没有特殊现象, 胶体中通过一束光线会出现光亮的通路
D.溶液稳定,放置后不会生成沉淀,胶体不稳定,放置后会生成沉淀
A
当 堂 巩 固
7、下列关于胶体的叙述中不正确的是( )
A.布朗运动是胶体粒子特有的运动方式,只用肉眼就可以把胶体、
溶液和浊液区别开来
B.向Fe(OH)3胶体中加入少量稀硫酸,会生成红褐色沉淀
C.丁达尔效应是胶体的特性
D.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,
故在电场作用下会产生电泳现象
当 堂 巩 固
8.通过如图装置完成氢氧化铁胶体的制备
及性质实验。
①向沸水中加入几滴FeCl3饱和溶液,继续煮
沸至液体呈红褐色停止加热。
②把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置
于暗处,用红色激光笔照射两烧杯中的液体,
观察现象。
(1)图中盛有FeCl3饱和溶液的仪器名称为_________。
(2)Fe(OH)3胶体_________(填“能”或“不能”)透过滤纸,请写出制备Fe(OH)3胶体的化学方程式:_________。
胶头滴管
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
==
能
当 堂 巩 固
(3)步骤②中能观察到的现象为_________,Fe(OH)3胶体产生的现象称为_________。胶体与其他分散系不同的根本原因是_________。
(4)若将实验改为向FeCl3饱和溶液中加入NaOH溶液,则观察到的现象为_________,该反应的化学方程式为_________。
(5)取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀盐酸,边滴加边振荡,在此过程中可看到的现象为 ______________
生成红褐色沉淀
分散质粒子的直径大小不同
丁达尔效应
当光束通过氢氧化铁胶体时,可以看到一条光亮的“通路”,而光束通过硫酸铜溶液时,则看不到此现象
试管中先生成的红褐色,然后沉淀逐渐溶解,最终又得到棕黄色的溶液
高一学生的化学笔记中有如下内容:
①物质按照组成可以分为单质和化合物
②单质又可分为金属单质、非金属单质和稀有气体
③化合物主要包括:酸、碱、盐和氧化物
④按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体
⑤溶液呈电中性,胶体带有电荷
你认为他的笔记中有几处错误( )
A.两处 B.三处 C.四处 D.五处
B
有机物
不
分散系及其分类
知识点一、分散系
概念 举例 分散系
分散质
分散剂
把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系
被分散的物质
容纳分散质的物质
CuSO4溶液
泥水
CuSO4
泥沙
水
1.有关概念
水
2、分散系分类
分散质
分散剂
气
液
固
气
液
固
(1)按分散剂聚集状态(气、液、固)来分
知识点一、分散系
分散质 分散剂 实 例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟、灰尘
汽水
牛奶、酒精的水溶液
糖水、油漆、泥水
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
知识点一、分散系
2、分散系分类
(2)按分散质微粒直径大小
知识点一、分散系
本质区别
知识点一、分散系
交流:
1.下列哪些属于溶液、浊液或胶体?
泥浆水、氢氧化钙悬浊液、澄清石灰水、牛奶、海水、豆浆
泥浆水和氢氧化钙悬浊液属于浊液。
澄清石灰水和海水属于溶液,牛奶和豆浆属于胶体。
2.PM2.5分散在空气中形成的混合物属于胶体吗?
PM2.5是指直径小于2.5pm的颗粒,1pm=1000nm,而胶体的范围在1nm~100nm之间。所以一般来说不是胶体,而是浊液。
知识点二、胶体
1. 概念: 分散质粒子直径 1nm<d<100nm 之间的分散系
(10-9m<d<10-7m)
注意:胶体不是一类物质,而是几乎任何物质都可能形成的一种分散状态。例如:NaCl溶于水形成溶液,如果分散在酒精中则可形成胶体。
2. 氢氧化铁胶体的制取
(1)反应原理:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
==
(2)操作步骤:
在100 mL小烧杯中加入40 mL蒸馏水,加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,即制得Fe(OH)3胶体(透明的红褐色液体)。
知识点二、胶体
实验仪器与药品:FeCl3饱和溶液、蒸馏水、试管、酒精灯等。
氢氧化铁胶体制备注意事项:
(1)若将蒸馏水换成氨水或NaOH溶液,能否得到Fe(OH)3胶体?
(2)若将蒸馏水换成自来水,能否得到Fe(OH)3胶体?
(3)为什么使用FeCl3饱和溶液?
(4)用什么方法证明得到的分散系为胶体?
(5)在制备Fe(OH)3胶体时,能否用玻璃棒搅拌?
(6)持续加热可能有什么现象?
自来水中含有杂质离子,易使胶粒聚成,产生沉淀。
不能,会聚沉
利用丁达尔效应
更容易生成Fe(OH)3胶体
过度加热会聚沉
会直接生成产生Fe(OH)3沉淀。
1、实验过程
把装有CuSO4溶液、Fe(OH)3胶体的试管,分别用激光笔照射烧杯中的液体,在与光束垂直的方向进行观察。
2、探究过程
问题1、激光笔照射硫酸铜溶液,有什么现象?
问题2、激光笔照射氢氧化铁胶体,有什么现象?
问题3、产生不同现象的原因是什么?
3. 胶体的性质
知识点二、胶体
3. 胶体的性质
(1)丁达尔效应:
应用:鉴别胶体与溶液的一种常用物理方法
原因:胶体粒子直径大小与光的波长相近,胶粒对光有散射作用。
例1.下列分散系不能发生丁达尔现象的是( )
A.豆浆 B.牛奶 C.蔗糖溶液 D.烟、云、雾
C
当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”。
知识点二、胶体
丁达尔效应是胶体和溶液的本质区别吗
提示:不是。
胶体和溶液的本质区别是分散质粒子的大小不同。
3. 胶体的性质
(2)布朗运动:
悬浮在水中的小颗粒做不停地、无秩序地运动
原因:溶剂分子不均匀地撞击胶体粒子,
使其不断改变方向、改变速率
知识点二、胶体
3. 胶体的性质
(3)电泳:
原因:胶粒带电荷
外加电场作用下,胶体粒子在分散剂里向电极做定向移动的现象。
知识点二、胶体
应用:工厂静电除尘
特别提醒
胶体电性 (1)正电: 一般来说,金属氢氧化物、金属氧化物的胶体粒子带正电荷,如Fe(OH)3 , Al(OH)3 , Cr(OH)3 , Fe2O3 (2)负电: 非金属氧化物、金属硫化物的胶体粒子带负电荷,如As2S3 , Sb2S3 , H2SiO3 , Au , Ag。(另外土壤胶粒子也带负电) (3)不带电:像淀粉溶液,蛋白质溶液一类的高分子胶体粒子是不带电的。 (4)注意胶体与胶体粒子的区别,胶体的很多性质均是由胶体粒子体现的。
如胶体粒子的直径在1~100 nm之间,胶体粒子吸附了阳离子或阴离子
而带正电或负电,能产生电泳现象等,胶体不带电。
3. 胶体的性质
(4)聚沉:
使胶体粒子聚集成为较大的颗粒,从而形成沉淀从分散剂里析出的过程
加入少量电解质
中和胶体微粒的电荷,使之聚集沉淀
豆浆里加盐卤或石膏(CaSO4·2H2O)溶液使之凝聚成豆腐
河海交汇处形成三角洲 FeCl3溶液用于止血
加入带相反电荷胶粒的胶体
电性中和,使之聚集沉淀
Fe(OH)3胶体中加入硅酸胶体 不同血型的人不能互相输血
不同墨水混合使用会导致钢笔堵塞
加热
加速胶粒碰撞,减弱胶粒的吸附能力使之沉淀
知识点二、胶体
3. 胶体的性质
如何实现胶体和溶液的分离?
(5)渗析:
(透过性)
利用半透膜把胶体中混有的离子或分子从胶体中分离出来。
原因:胶体微粒不能透过半透膜,
溶液中分子和离子能透过半透膜。
应用:可以净化胶体,血液透析
知识点二、胶体
主要原因:同种胶体粒子的电性相同,互斥而不易聚沉
次要原因:胶体微粒作布朗运动
胶体稳定的原因:
生活中属于胶体的常见物质
云、雾、烟;墨水;血液;淀粉溶液、豆浆、牛奶、蛋清;有色玻璃、珍珠;Al(OH) 胶体、Fe(OH) 胶体
生活中与胶体有关的现象或应用小结
现象或应用 性质
清晨在森林中看到光束
血液透析
淀粉溶液的提纯
盐卤制豆腐
不同品牌墨水不能混用
入海口处三角洲的形成
明矾净水
土壤具有保肥能力
工厂利用高压电除尘
丁达尔效应
透过性
透过性
介稳性(聚沉)
介稳性(聚沉)
介稳性(聚沉)
介稳性(聚沉)
电泳
介稳性(聚沉)
03
三类分散系的比较
思考交流:
1.鸡蛋壳表面有很小的孔,可以透过空气和水蒸气,使鸡蛋呼吸。为什么鸡蛋里的蛋清和蛋黄等不能流出蛋壳外呢?
2.三种分散系的分散质粒子大小各不相同,物理性质上有哪些不同?
03
三类分散系的比较
1、实验过程
取FeCl3溶液、淀粉胶体、泥沙浊液,分别用滤纸过滤。
2、探究过程
问题1、泥沙能否透过滤纸?
问题2、FeCl3溶液能否透过滤纸?
问题3、碘水滴到下层滤纸上是否变蓝色?
分散系 泥沙水 FeCl3溶液 淀粉胶体
能否透过滤纸 否 能 能
03
三类分散系的比较
1、实验过程
将淀粉胶体和NaCl溶液装入半透膜制成的小口袋中,用绳子系上悬挂在装有蒸馏水的烧杯中,静置五分钟后取烧杯中的液体分别装入两支试管中。
2、探究过程
问题1、AgNO3滴加到试管1中出现沉淀的原因?
问题2、碘水滴加到试管2中不变蓝色的原因?
03
三类分散系的比较
原因:分散质粒子的大小不同。
分散系 NaCl溶液 淀粉胶体
能否透过半透膜 能 否
分散系 泥沙水 FeCl3溶液 淀粉胶体
能否透过滤纸 否 能 能
溶液既可以透过半透膜、也可以透过滤纸;胶体不能透过半透膜、但可以透过滤纸;浊液两者皆不可透过。
不同分散系的比较
溶液 胶体 浊液 悬浊液 乳浊液
分散质微粒的直径 <1 nm 1~100 nm >100 nm >100 nm
微粒 小分子或离子 许多分子集合体或高分子 大量分子聚集成的固体小颗粒 大量分子聚集成的小液滴
实例 酒精、氯化钠溶液 Fe(OH)3胶体、淀粉溶液 泥水、石灰浆 油水混合物、油漆
外观 均一、透明 均一、透明 不均一、不透明、久置沉淀 不均一、不透明、久置分层
稳定性 稳定 较稳定 不稳定 不稳定
能否透过滤纸 能 能 不能 不能
能否透过半透膜 能 不能 不能 不能
鉴别 无丁达尔效应 有丁达尔效应 静置沉降 静置分层
胶体的性质总结
(1)介稳性:1、胶体粒子带有同种电荷,相互排斥,不易聚集成更大颗粒。(主要原因)
2、胶体粒子在不停的做布朗运动。(次要原因)
(2)丁达尔效应:当光束通过胶体时,可以看到一条光亮的“通路”,这是由于胶体粒子对光线散射形成的。丁达尔效应可用来区分胶体和溶液。
(3)聚沉:胶体形成沉淀析出的现象(一定条件下,中和或减弱胶体粒子的电荷,胶体粒子就会聚集成较大颗粒析出)。
其方法主要有:1、加热或搅拌 原因:胶体粒子加速运动,增加碰撞机会,导致胶体凝聚而沉淀。
2、加入电解质溶液 原因:加入的离子中和了胶体粒子所带电荷,使胶粒聚集成较大颗粒而沉淀。
3、加带相反电荷胶体粒子的胶体 原因:带相反电荷胶粒相遇时互相中和电荷,从而聚集成大颗粒而沉积。
胶体的性质总结
(4)电泳现象:胶体粒子带电荷,胶体粒子在电场的作用下发生定向移动。
(5)布朗运动
(6)透过性:能透过滤纸,不能透过半透膜
原因:胶体粒子带电荷,当胶粒带正电荷时向阴极运动,当胶粒带负电荷时向阳极运动。
特别提醒:胶体不带电,胶体中的胶粒能够吸附体系中的带电离子而使胶粒带电荷,但整个分散系仍呈电中性。
课堂感悟
分散质
分散系
分散剂
溶液
胶体
浊液
本质区别:分散质粒子大小
性质差别:主要表现在物理性质方面
已知鸡蛋清溶液是一种胶体,现有三瓶无色溶液:
NaCl溶液、Na2SO4溶液、鸡蛋清溶液,
试根据已学过的知识鉴别它们。
提示:可通过是否产生丁达尔效应首先鉴别出鸡蛋清溶液,
然后取余下的两种溶液,分别滴几滴BaCl2溶液,有白色沉淀生成的为Na2SO4溶液,无明显现象的为NaCl溶液。
判断 (正确的打“√”,错误的打“×”)
(1)所有分散系均为混合物 ( )
(2)油水混合物属于悬浊液 ( )
(3)胶体区别于其他分散系的本质特征是能发生丁达尔效应 ( )
(4)蔗糖溶液、淀粉溶液属于溶液,云、雾、烟属于胶体( )
(5)直径介于1~100 nm之间的粒子称为胶体( )
(6)氢氧化铁胶体为无色透明的液体,能产生丁达尔效应( )
(7)丁达尔效应可用来鉴定溶液与胶体( )
√
当 堂 巩 固
×
×
×
×
×
√
1、制备纳米材料时,首先用特殊方法把固体物质加工到纳米级(1nm~100nm,1nm=10-9m)的超细粉末粒子。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是 ( )
A、溶液 B、悬浊液 C、胶体 D、乳浊液
C
2、胶体区别于其他分散系的本质特征是( )
A.胶体的分散质能透过滤纸 B.胶体是纯净物,其他分散系是混合物
C.胶体能产生丁达尔现象 D.胶体的分散质粒子直径在1~100nm之间
D
当 堂 巩 固
3.下列应用或事实与胶体的性质没有关系的是( )
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.清晨的阳光穿过茂密的林木枝叶所产生的美丽景象
4.用半透膜把分子或离子从胶体溶液中分离出来的方法是( )
A.电泳 B.电解 C.凝聚 D.渗析
C
D
当堂巩固
5、羟基氧化铝是一种“纳米材料”,粒子直径为1~100nm。下列关于其描述正确的是( )
A.羟基氧化铝可以发生丁达尔效应
B.羟基氧化铝可以穿过半透膜
C.羟基氧化铝粒子带负电荷
D.以上说法都不对
D
当 堂 巩 固
5、羟基氧化铝是一种“纳米材料”,粒子直径为1~100nm。若将其均匀地分散到蒸馏水中,形成某一分散系,下列描述正确的是( )
①是溶液;②是胶体;③能产生丁达尔效应
④能透过滤纸;⑤不能透过滤纸;⑥静置后,会析出沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
B
当 堂 巩 固
C
当 堂 巩 固
6、关于胶体和溶液的区别,下列叙述正确的是( )
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
C.溶液中通过一束光线没有特殊现象, 胶体中通过一束光线会出现光亮的通路
D.溶液稳定,放置后不会生成沉淀,胶体不稳定,放置后会生成沉淀
A
当 堂 巩 固
7、下列关于胶体的叙述中不正确的是( )
A.布朗运动是胶体粒子特有的运动方式,只用肉眼就可以把胶体、
溶液和浊液区别开来
B.向Fe(OH)3胶体中加入少量稀硫酸,会生成红褐色沉淀
C.丁达尔效应是胶体的特性
D.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,
故在电场作用下会产生电泳现象
当 堂 巩 固
8.通过如图装置完成氢氧化铁胶体的制备
及性质实验。
①向沸水中加入几滴FeCl3饱和溶液,继续煮
沸至液体呈红褐色停止加热。
②把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置
于暗处,用红色激光笔照射两烧杯中的液体,
观察现象。
(1)图中盛有FeCl3饱和溶液的仪器名称为_________。
(2)Fe(OH)3胶体_________(填“能”或“不能”)透过滤纸,请写出制备Fe(OH)3胶体的化学方程式:_________。
胶头滴管
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
==
能
当 堂 巩 固
(3)步骤②中能观察到的现象为_________,Fe(OH)3胶体产生的现象称为_________。胶体与其他分散系不同的根本原因是_________。
(4)若将实验改为向FeCl3饱和溶液中加入NaOH溶液,则观察到的现象为_________,该反应的化学方程式为_________。
(5)取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀盐酸,边滴加边振荡,在此过程中可看到的现象为 ______________
生成红褐色沉淀
分散质粒子的直径大小不同
丁达尔效应
当光束通过氢氧化铁胶体时,可以看到一条光亮的“通路”,而光束通过硫酸铜溶液时,则看不到此现象
试管中先生成的红褐色,然后沉淀逐渐溶解,最终又得到棕黄色的溶液
高一学生的化学笔记中有如下内容:
①物质按照组成可以分为单质和化合物
②单质又可分为金属单质、非金属单质和稀有气体
③化合物主要包括:酸、碱、盐和氧化物
④按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体
⑤溶液呈电中性,胶体带有电荷
你认为他的笔记中有几处错误( )
A.两处 B.三处 C.四处 D.五处
B
有机物
不
