化学人教版(2019)必修第二册8.1.2海水资源的开发利用(共73张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.2海水资源的开发利用(共73张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-09 20:39:44 | ||
图片预览







文档简介
(共73张PPT)
必修第二册
第八章
化学与可持续发展
第一节
自然资源的开发利用
第2课时
海水资源的开发和利用
中国水资源现状
海洋约占地球表面积的71% 。海水中水的储量约
为1.3×109亿吨,占地球总水量的97%。
(中国水资源现状) 中国是一个干旱缺水严重的国家。淡水资源总量为28000亿立方米,占全球淡水资源的6%,仅次于巴西、俄罗斯和加拿大,居世界第四位,但人均只有2200立方米,仅为世界平均水平的1/4、美国的1/5,在世界上名列121位,是全球13个人均水资源最贫乏的国家之一。因此,开发海水资源具有重要意义。
广阔的海洋资源
海水
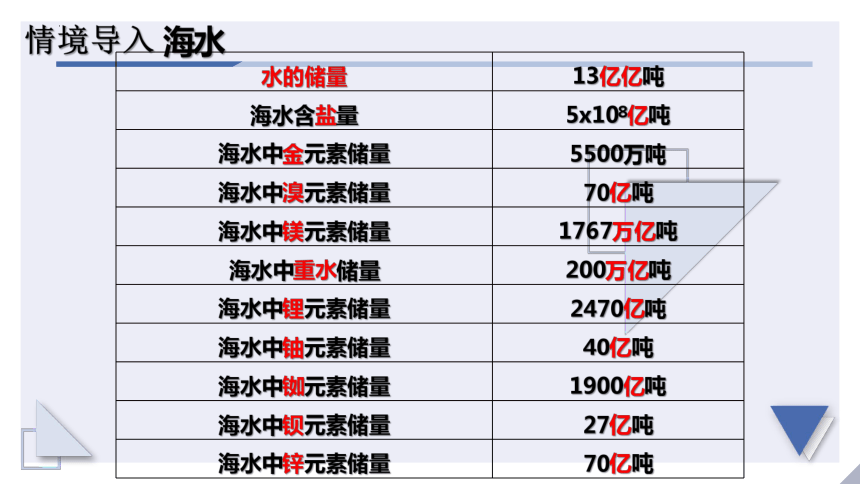
水的储量 13亿亿吨
海水含盐量 5x108亿吨
海水中金元素储量 5500万吨
海水中溴元素储量 70亿吨
海水中镁元素储量 1767万亿吨
海水中重水储量 200万亿吨
海水中锂元素储量 2470亿吨
海水中铀元素储量 40亿吨
海水中铷元素储量 1900亿吨
海水中钡元素储量 27亿吨
海水中锌元素储量 70亿吨
一.海水水资源的利用
1. 海水资源的特点
2. 利用途径及海水淡化方法
分离出盐分
广阔性
多样性
分散性
离子交换法
反渗析法
电渗析法(高二学)
海水淡化
提取出淡水
海水循环冷却
海水水资源的利用
蒸馏法
历史最久
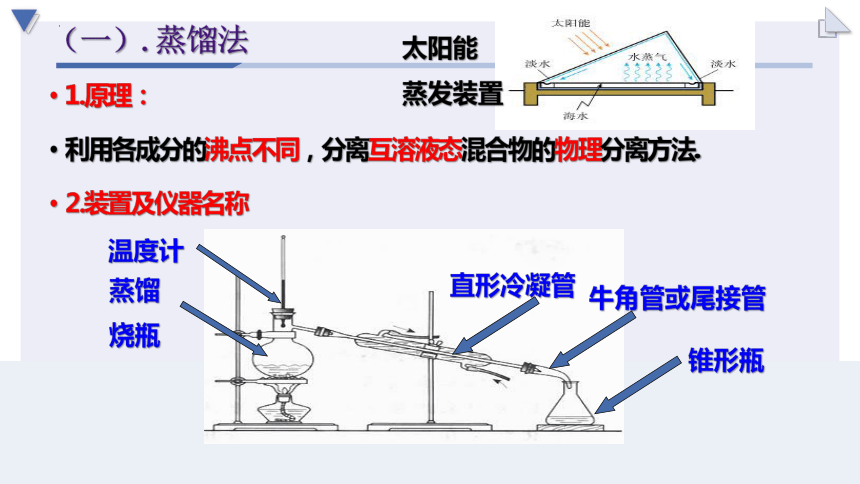
(一).蒸馏法
1.原理:
利用各成分的沸点不同,分离互溶液态混合物的物理分离方法.
2.装置及仪器名称
太阳能
蒸发装置
蒸馏
烧瓶
温度计
直形冷凝管
牛角管或尾接管
锥形瓶
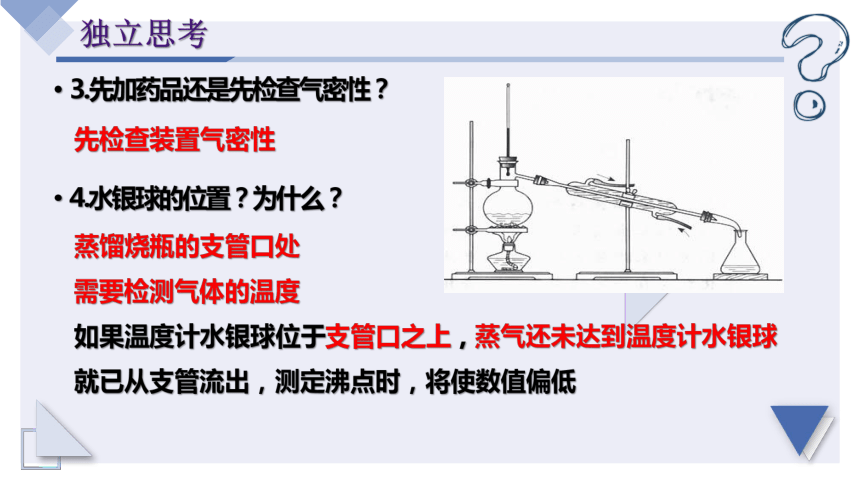
1.实验前,还需要检查?
2.为了防止液体暴沸,需要加入?
装置的气密性
沸石或碎瓷片
3.先加药品还是先检查气密性?
4.水银球的位置?为什么?
先检查装置气密性
蒸馏烧瓶的支管口处
需要检测气体的温度
如果温度计水银球位于支管口之上,蒸气还未达到温度计水银球就已从支管流出,测定沸点时,将使数值偏低
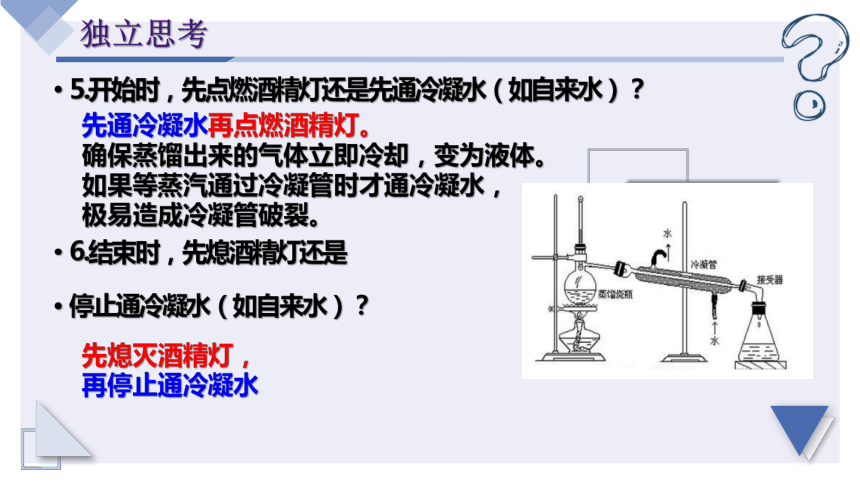
5.开始时,先点燃酒精灯还是先通冷凝水(如自来水)?
6.结束时,先熄酒精灯还是
停止通冷凝水(如自来水)?
先通冷凝水再点燃酒精灯。
确保蒸馏出来的气体立即冷却,变为液体。
如果等蒸汽通过冷凝管时才通冷凝水,
极易造成冷凝管破裂。
先熄灭酒精灯,
再停止通冷凝水
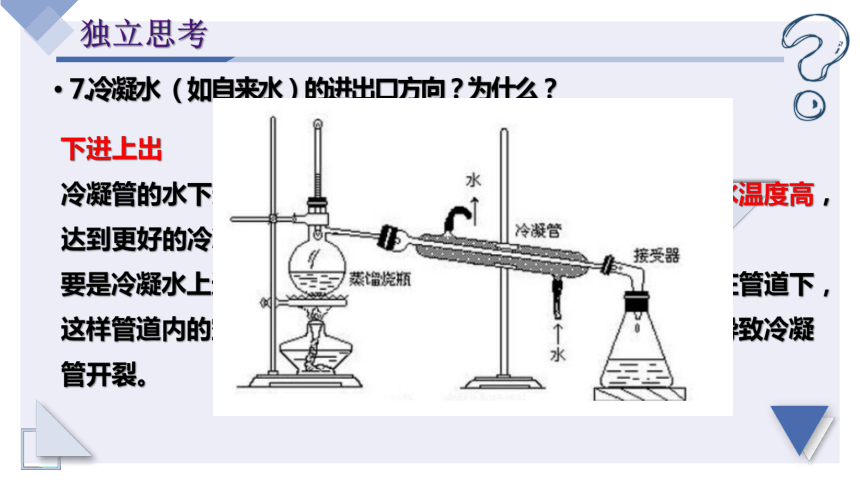
7.冷凝水 (如自来水)的进出口方向?为什么?
下进上出
冷凝管的水下进上出才能确保下端冷凝水温度低,上端冷凝水温度高,达到更好的冷凝效果,
要是冷凝水上进下出的话,会引起重力影响,冷凝水会聚集在管道下,这样管道内的空气将无法排出,出现受热不均匀,严重的会导致冷凝管开裂。
7.能不能用球形冷凝管?
不能
1.装置:将一根空气冷凝管作为内芯,在其外面焊有一较粗的外套管(水冷管),在外套管的两端各焊接一个小嘴是用以连接冷凝水的进出口(下嘴用以连接冷却水源,上嘴用以作冷却水的出口)。
2.作用:冷凝
3.对象:适用于沸点为140℃以下物质分离,
比如蒸馏、分馏(多步蒸馏)操作,
主要用于倾斜式蒸馏装置。
直形冷凝管
1.装置:用球泡状管作内芯管,其他部分与直形冷凝管相同。
与直形管相比,球形冷凝管有凹槽,斜放时会有校多液体残留在凹槽中。冷却面积更大,冷凝效率高。
2.作用:冷凝回流。蒸气冷凝后又流回反应体系,节约试剂,
并使反应进行更彻底。
3.对象:多用于垂直蒸馏装置,适用于各种沸点的液体。
球形冷凝管
1.装置:它的内芯管为螺旋形,增加了玻璃管的长度,冷却面较球泡形更大,其它部分与球形相同。
2.作用:冷凝回流
3.对象:收集沸点较低的液体。
同样由于内芯管为蛇形,蒸馏时积留的液体更多,
故适用于做垂直式的连续长时间的蒸馏或回流装置。
蛇形冷凝管
蒸馏法
是通过加热海水使之沸腾汽化,再把蒸汽冷凝成淡水的方法。
蒸馏法海水淡化技术是最早投人工业化应用的淡化技术,
特点是即使在污染严重、高生物活性的海水环境中也适用,产水纯度高。
蒸馏法淡化海水的实验操作步骤?
3.海水蒸馏实验的操作步骤:
连接装置→检查装置气密性→
向烧瓶中加入海水(试剂)和碎瓷片→
接通冷却水→给烧瓶加热→收集蒸馏水→
熄灭酒精灯→
待冷却至室温后停止通入冷却水→整理仪器。
(一).蒸馏法
加热装置 冷凝装置 接收装置
石棉网
加入沸石/碎瓷片,防暴沸
液体体积不应该超过容积的2/3,
不应少于1/3
温度计水银球处于支管口处
冷凝水:下进上出
牛角管伸入锥形瓶内
(最先使用,技术成熟,但成本高)
(二).离子交换法
1.概念:利用离子交换树脂作为吸附剂,将溶液中的待分离组分,依据其电荷差异,依靠库仑力吸附在树脂上,然后利用合适的洗脱剂将吸附质从树脂上洗脱下来,达到分离的目的。即溶液中的某种离子与离子交换树脂中的同性电荷离子发生离子交换。
2优点:成本低,工艺操作方便,提炼效率较高,设备结构简单,以及节约大量的有机溶剂等。
3.缺点:不一定能找到合适的树脂,生产周期长,生产过程中pH值变化较大。
(二).离子交换法
4.离子交换树脂的种类:
(1)阳离子交换树脂
这类树脂含有大量的强酸性基团,使树脂中的H+与溶液中的阳离子互相交换。
(2)阴离子交换树脂
这类树脂含有大量的强酸性基团,使树脂中的OH-与溶液中的阴离子互相交换。
(二).离子交换法
离子交换树脂可以把阴阳离子分别交换出来,使水得到纯化。
HR + Na+ = NaR + H+
ROH + Cl— = RCl +OH—
H++OH- =H2O
(二).离子交换法
目前正迅速发展,
需要不断更新离子交换树脂
法(目前正迅速发展,但需要不断更新离子交换树脂)。
(三).反渗透法
1.反渗透的原理:当把相同体积的稀溶液和浓溶液分别置于一容器的两侧,中间用半透膜阻隔,稀溶液中的溶剂将自然地穿过半透膜,向浓溶液侧流动,浓溶液侧的液面会比稀溶液的液面高出一定高度,形成一个压力差,达到渗透平衡状态,此种压力差即为渗透压。若在浓溶液侧施加一个大于渗透压的压力时,浓溶液中的溶剂会向稀溶液流动,此种溶剂的流动方向与原来渗透的方向相反,这一过程称为反渗透。
(三).反渗透法
2.半透膜:对透过的物质具有选择性的薄膜称为半透膜,
一般将只能透过溶剂而不能透过溶质的薄膜称之为理想半透膜。
3.半透膜的分类:
(1)阳离子交换膜(简称阳膜):只允许阳离子和水分子通过。
(2)阴离子交换膜(简称阴膜):只允许阴离子和水分子通过。
(3)质子交换膜:只允许氢离子和水分子通过。
(三).反渗透法
4.用途:可以淡化水。
过滤精度最高的膜分离技术。过滤精度达到0.0001um。过滤了自来水中的所有物质,没有矿物质和微量元素,这种水是可以直接饮用的。水中的杂质如可溶性固体、有机物、胶体物质及细菌等则被反渗透膜截留,在截流液中浓缩并被去除。一级反渗透可去除原水中97%以上的溶解性固体。
工业上电解饱和食盐水制备氯气的反应原理:
请结合阳膜的选择性,说说阳膜的作用?
(1)平衡电荷,形成闭合回路;
(2)防止Cl2和H2混合而引起爆炸;
(3)避免Cl2与NaOH反应,影响NaOH的产量;
(三).反渗透法
四.电渗析法
高二学
成本低,但未能大量生产
海水中的化学元素
水的储量 13亿亿吨
海水含盐量 5x108亿吨
海水中金元素储量 5500万吨
海水中溴元素储量 70亿吨
海水中镁元素储量 1767万亿吨
海水中重水储量 200万亿吨
海水中锂元素储量 2470亿吨
海水中铀元素储量 40亿吨
海水中铷元素储量 1900亿吨
海水中钡元素储量 27亿吨
海水中锌元素储量 70亿吨
二.海水的化学资源利用
海水提取Mg
海水淡化
海水提取NaCl
Br2的提取
1.海水提纯NaCl 的基本思路吗?
为了除去海水中的硫酸根离子、镁离子、钙离子杂质,
选择的试剂?采用什么实验操作 ?
1.海水提纯氯化钠
2.可能的组合有几种?分别是?
海水浓缩
过滤
HCl溶液,适量
蒸发结晶
NaOH溶液、BaCl2溶液、Na2CO3溶液
过量
①BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
从海水中制得氯化钠除了食用外,还有什么用途?
制备这些化工原料的反应原理?请写出相关的化学方程式?
NaCl
烧碱
纯碱
钠
氯气
氯化氢
海水制盐 “煮海为盐”
(1)氯碱工业:
(2)制钠和氯气:
(3)制盐酸:
(4)制漂白剂(84消毒液):
(5)制纯碱:
2NaCl(熔融)=== 2Na + Cl2↑
电解
2NaCl+ 2H2O === H2↑+ Cl2 ↑ +2NaOH
电解
H2+ Cl2 === 2HCl
点燃
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3 ===Na2CO3+CO2↑+H2O
△
(饱和食盐水)
NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
溴元素的用途
溴化银被用作照相中的感光剂。
当你“咔嚓”按下快门的时候,
相片上的部分溴化银就分解出银,
从而得到我们所说的底片。
溴元素的用途
有机合成中方面:过乙烯使溴水褪色的实验,这实际上就代表了一类重要的加成反应;
在制药方面:红药水,也是溴与汞的化合物;
灭火器方面:我们平时看到的诸如“1211”灭火器,就是分子里面有一个溴原子的多卤代烷烃;
溴钨灯,成为取代碘钨灯的新光源。
2.海水提纯溴(单质)Br2
P101
目的:
氧化溴离子
目的:用空气将生成的溴 吹出从而分离Br2
目的:
用SO2作还原剂将Br2还原为HBr,以使其与空气分离
①酸化
③吹出
④吸收
⑥蒸馏
⑦冷凝
⑤氧化
目的:
用氯气氧化溴离子
目的:分离Br2
目的:
将气态溴
转化为
液态溴
②氧化
⑧分离
1.为什么第一步要酸化?(即酸化的目的)请你写出相关离子方程式。
Cl2+2OH— =Cl—+ClO—+H2O
2.请结合第②、④步的转化写出相关的离子方程式?还原性强弱关系?
提示:还原性强弱:还原剂>还原产物;
氧化性强弱:氧化剂>氧化产物;
④Br2+SO2+2H2O=2Br-+SO42-+4H+ 还原性强弱:SO2>Br-
②2Br-+Cl2=2Cl-+Br2 还原性强弱:Br->Cl-
综上所述:还原性强弱:SO2>Br->Cl-
2.海水提纯溴(单质)Br2
为什么偏偏要设计②、③、④步的转化?
富集溴元素
步骤①中由于苦卤的总水量比较大,导致其得到的溴水浓度很低,经过步骤②③④可以减少溶液总体积,使溴元素得到充分富集,使其浓缩得到较高浓度的溴水溶液,这样便于后续的分离提纯。
镁元素在人体中的重要性
人体内镁的水平主要受肾脏调节,当人体中缺乏镁元素会出现以下情况:
1.神经系统紊乱,进而引起脾气急躁、精神不安与紧张。
2.肌肉震颤、绞痛以及经常性刺痛感。
3.心律不齐、心悸、低血糖、虚弱、疲倦等症状。
3.由于镁会转化为一种酶,有助于对维生素B1、B2、B6的利用,因此缺乏镁就可能会引起缺乏B族维生素的症状,通常是抽搐。
照明弹
镁因为熔点低,镁燃烧时发出耀眼白光
因此可以用于烟火、照明弹。
熔点 沸点
648.8℃ 1107℃
3.海水提纯镁单质
苦卤
(含Mg2+)
Mg(OH)2沉淀
MgCl2 溶液
Mg
无水MgCl2
过滤
盐酸
Cl2
蒸发
加碱
过滤
?
熔融
电解
1.工业上常用贝壳煅烧经过一系列反应得到石灰乳(主要成分:氢氧化钙)来沉淀海水中的镁离子,不用氢氧化钠?
2.请写出得到石灰乳的
相关化学方程式?
贝壳易得,成本低,煅烧然后制石灰乳很方便,
相比较氢氧化钠成本较高。
3.工业上通常用石灰乳,请写出下列相关化学方程式?
能表示离子方程式就用离子方程式表示。
①与石灰乳: , 反应
②与盐酸: , 反应
③制取镁单质: , 反应
Mg2++Ca(OH)2=Ca2++Mg(OH)2 复分解
2H++Mg(OH)2=Mg2++2H2 O 复分解
分解
4.蒸发氯化镁溶液,如果要得到无水氯化镁,需要太长的时间。
有没有什么方法可以改进?
S随T变化较大的甲:大部分物质,如,硝酸钾
S随T变化较小的乙:如氯化钠
S随T变化反而降低的丙:如氢氧化钙
溶解度曲线的变化规律
单一溶质的情况下,
利用溶解度曲线制备或提纯物质:
1.如何从氯化钠溶液得到氯化钠晶体?
2.如何从硝酸钾溶液得到硝酸钾晶体?
像这样S随T变化较小的物质的提纯,
采用蒸发结晶,过滤,洗涤,干燥。
像这样S随T变化较大的物质的提纯,
采用蒸发浓缩,冷却结晶,过滤,洗涤,干燥。
一.一种溶质
1.S随T变化小 (如NaCl)
2. S随T变化大:
含结晶水: (如KNO3 五水硫酸铜等 )
受热易分解:
利用溶解度曲线制备或提纯物质
蒸发浓缩,
冷却结晶,
洗涤,干燥。
蒸发结晶,
过滤,洗涤,干燥。
两种溶质的情况下,其中一种少量,
利用溶解度曲线制备或提纯物质:
1.KNO3(NaCl)
2.NaCl(KNO3)
像这样主物质S随T变化较大的物质的提纯,
采用蒸发浓缩,冷却结晶,过滤,洗涤干燥。
像这样主物质S随T变化较小的物质的提纯,
采用蒸发浓缩,趁热过滤,洗涤干燥。
二.两种溶质,其中一种为少量杂质
1.S随T变化大 蒸发浓缩,冷却结晶,过滤
主物质 如KNO3(NaCl)
2.S随T变化小 蒸发结晶,趁热过滤
如NaCl(KNO3)
利用溶解度曲线制备或提纯物质
两种溶质的情况下,都大量共存,
利用溶解度曲线制备或提纯物质:
如何分离KNO3和NaCl?
两种溶质的情况下,都大量共存,
利用溶解度曲线制备或提纯物质:
如何分离KNO3和NaCl?
滤渣(NaCl)
滤液(KNO3) KNO3
蒸发浓缩,趁热过滤,
冷却结晶
过滤
三.两种溶质,大量共存
利用溶解度曲线制备或提纯物质
蒸发浓缩,趁热过滤,
冷却结晶
过滤
滤渣(S随T变化小,NaCl)
滤液 滤渣
(S随T变化大,KNO3)
口诀: 陡降缓蒸
陡含缓要陡就降
缓含陡要缓就蒸
解释:陡是指受温度影响较大一般是溶解度温度增大而增大, 缓是指受温度影响较小平缓型曲线。降是指降温结晶,蒸是指蒸发结晶
利用溶解度曲线制备或提纯物质
3.海水提纯镁单质
苦卤
(含Mg2+)
Mg(OH)2沉淀
MgCl2 溶液
Mg
无水MgCl2
干燥
过滤
盐酸
MgCl2·6H2O
蒸发浓缩冷却结晶过滤洗涤
Ca(OH)2
Cl2
蒸发
加碱
过滤
熔融
电解
碘的用途
在农业上,常用的除草剂和农药中,碘是不可缺少的元素之一,用含有碘化物的饲料,可以提高营养价值。用它喂奶牛,产奶量就会增加;用它喂绵羊,羊毛又密又长;用它喂鸡,可以多生鸡蛋;用它喂猪,可以催肥……
碘也是人体中不可缺少的元素,它能调节人的生长发育和能量供应,在人体中,它集中在一个叫“甲状腺”的部分,碘对人身体的作用是通过甲状腺来实现的;一旦人缺少碘,就会得大脖子病——甲状腺肿。于是,大夫就会给这样的病人吃一些含碘的药;并嘱咐他多吃海带、紫菜、葱头、大葱和海鱼等等,因为这些食物里含丰富的碘。
2.海水提纯碘单质(I2)
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2或氯水
含I2的溶液
含I2的有机溶液
萃取分液
1.根据所学,氯水的主要成分是氯气,氯气是一种强氧化剂,能氧化碘离子生成碘单质I2
请写出该离子方程式?
2I- + Cl2= I2+ 2Cl-
2.过氧化氢是一种绿色氧化剂,比氯水更加环保,能更加有效的替代氯水。滴加适量稀硫酸和过氧化氢后的溶液之后,生成了碘单质I2
请写出该离子方程式?氧化剂是?稀硫酸的作用?
2I- + H2O2 + 2H+= I2+ 2H2O
氧化剂是H2O2
稀硫酸的作用是酸性
2.据所学可知,碘离子、氯离子和溴离子均没有颜色,而碘水虽然呈黄色,但是溶液浓度低颜色会比较浅。
那么,如何及时验证溶液中已经生成了碘单质I2?
取待测液于试管中,
加入H2O2溶液后,
(现)溶液颜色变为浅黄色,渐变变为深黄色;
(现)加入淀粉溶液后,溶液又变为深蓝色。
(结论)溶液中已经生成了碘单质
物质 颜色
过氧化钠固体 淡黄色
溴化银固体 淡黄色
碘化银固体 黄色
硫单质固体 黄色
氯化铁溶液 橘黄色
碘水 黄色
溴水 橙黄色
黄色的
3.通常萃取剂选择四氯化碳,试试分析现象?能得到纯净的碘I2?
分层,
待充分萃取后,
上层无色,
下层紫色,成分:I2+CCl4。
4.如何从I2和CCl4中,得到纯净的碘I2?
5.锥形瓶中收集到的物质是?
6.该装置有什么不足之处?如何改进?
7.除了CCl4还有没有其他萃取剂?
8.能不能用乙醇替代CCl4?
物质 沸点
I2 113.6℃
CCl4 76.8℃
蒸馏
CCl4
直接加热,温度可能高于114°C。
建议采用水浴加热。
苯 密度比水小
乙醇易溶于水 不会分层
2.海水提纯碘单质(I2)
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
下层:紫色
含I2+CCl4
CCl4
萃取分液
上层:无色
蒸馏
I2
但是,实际在45℃左右碘就会升华。工业上,用NaOH浓溶液反萃取。
反萃取
BCD
B
A
从海水中获得的产品还可以做工业原料,如生产烧碱、纯碱、金属钠及氯气、盐酸、漂白粉等含氯化工产品。写出有关反应的化学方程式?
1.电解氯化钠:
2.钠和TiCl4(熔融):
3.电解饱和食盐水:
4.侯氏制碱法:①制取碳酸氢钠
②制取碳酸钠
必修第二册
第八章
化学与可持续发展
第一节
自然资源的开发利用
第2课时
海水资源的开发和利用
中国水资源现状
海洋约占地球表面积的71% 。海水中水的储量约
为1.3×109亿吨,占地球总水量的97%。
(中国水资源现状) 中国是一个干旱缺水严重的国家。淡水资源总量为28000亿立方米,占全球淡水资源的6%,仅次于巴西、俄罗斯和加拿大,居世界第四位,但人均只有2200立方米,仅为世界平均水平的1/4、美国的1/5,在世界上名列121位,是全球13个人均水资源最贫乏的国家之一。因此,开发海水资源具有重要意义。
广阔的海洋资源
海水
水的储量 13亿亿吨
海水含盐量 5x108亿吨
海水中金元素储量 5500万吨
海水中溴元素储量 70亿吨
海水中镁元素储量 1767万亿吨
海水中重水储量 200万亿吨
海水中锂元素储量 2470亿吨
海水中铀元素储量 40亿吨
海水中铷元素储量 1900亿吨
海水中钡元素储量 27亿吨
海水中锌元素储量 70亿吨
一.海水水资源的利用
1. 海水资源的特点
2. 利用途径及海水淡化方法
分离出盐分
广阔性
多样性
分散性
离子交换法
反渗析法
电渗析法(高二学)
海水淡化
提取出淡水
海水循环冷却
海水水资源的利用
蒸馏法
历史最久
(一).蒸馏法
1.原理:
利用各成分的沸点不同,分离互溶液态混合物的物理分离方法.
2.装置及仪器名称
太阳能
蒸发装置
蒸馏
烧瓶
温度计
直形冷凝管
牛角管或尾接管
锥形瓶
1.实验前,还需要检查?
2.为了防止液体暴沸,需要加入?
装置的气密性
沸石或碎瓷片
3.先加药品还是先检查气密性?
4.水银球的位置?为什么?
先检查装置气密性
蒸馏烧瓶的支管口处
需要检测气体的温度
如果温度计水银球位于支管口之上,蒸气还未达到温度计水银球就已从支管流出,测定沸点时,将使数值偏低
5.开始时,先点燃酒精灯还是先通冷凝水(如自来水)?
6.结束时,先熄酒精灯还是
停止通冷凝水(如自来水)?
先通冷凝水再点燃酒精灯。
确保蒸馏出来的气体立即冷却,变为液体。
如果等蒸汽通过冷凝管时才通冷凝水,
极易造成冷凝管破裂。
先熄灭酒精灯,
再停止通冷凝水
7.冷凝水 (如自来水)的进出口方向?为什么?
下进上出
冷凝管的水下进上出才能确保下端冷凝水温度低,上端冷凝水温度高,达到更好的冷凝效果,
要是冷凝水上进下出的话,会引起重力影响,冷凝水会聚集在管道下,这样管道内的空气将无法排出,出现受热不均匀,严重的会导致冷凝管开裂。
7.能不能用球形冷凝管?
不能
1.装置:将一根空气冷凝管作为内芯,在其外面焊有一较粗的外套管(水冷管),在外套管的两端各焊接一个小嘴是用以连接冷凝水的进出口(下嘴用以连接冷却水源,上嘴用以作冷却水的出口)。
2.作用:冷凝
3.对象:适用于沸点为140℃以下物质分离,
比如蒸馏、分馏(多步蒸馏)操作,
主要用于倾斜式蒸馏装置。
直形冷凝管
1.装置:用球泡状管作内芯管,其他部分与直形冷凝管相同。
与直形管相比,球形冷凝管有凹槽,斜放时会有校多液体残留在凹槽中。冷却面积更大,冷凝效率高。
2.作用:冷凝回流。蒸气冷凝后又流回反应体系,节约试剂,
并使反应进行更彻底。
3.对象:多用于垂直蒸馏装置,适用于各种沸点的液体。
球形冷凝管
1.装置:它的内芯管为螺旋形,增加了玻璃管的长度,冷却面较球泡形更大,其它部分与球形相同。
2.作用:冷凝回流
3.对象:收集沸点较低的液体。
同样由于内芯管为蛇形,蒸馏时积留的液体更多,
故适用于做垂直式的连续长时间的蒸馏或回流装置。
蛇形冷凝管
蒸馏法
是通过加热海水使之沸腾汽化,再把蒸汽冷凝成淡水的方法。
蒸馏法海水淡化技术是最早投人工业化应用的淡化技术,
特点是即使在污染严重、高生物活性的海水环境中也适用,产水纯度高。
蒸馏法淡化海水的实验操作步骤?
3.海水蒸馏实验的操作步骤:
连接装置→检查装置气密性→
向烧瓶中加入海水(试剂)和碎瓷片→
接通冷却水→给烧瓶加热→收集蒸馏水→
熄灭酒精灯→
待冷却至室温后停止通入冷却水→整理仪器。
(一).蒸馏法
加热装置 冷凝装置 接收装置
石棉网
加入沸石/碎瓷片,防暴沸
液体体积不应该超过容积的2/3,
不应少于1/3
温度计水银球处于支管口处
冷凝水:下进上出
牛角管伸入锥形瓶内
(最先使用,技术成熟,但成本高)
(二).离子交换法
1.概念:利用离子交换树脂作为吸附剂,将溶液中的待分离组分,依据其电荷差异,依靠库仑力吸附在树脂上,然后利用合适的洗脱剂将吸附质从树脂上洗脱下来,达到分离的目的。即溶液中的某种离子与离子交换树脂中的同性电荷离子发生离子交换。
2优点:成本低,工艺操作方便,提炼效率较高,设备结构简单,以及节约大量的有机溶剂等。
3.缺点:不一定能找到合适的树脂,生产周期长,生产过程中pH值变化较大。
(二).离子交换法
4.离子交换树脂的种类:
(1)阳离子交换树脂
这类树脂含有大量的强酸性基团,使树脂中的H+与溶液中的阳离子互相交换。
(2)阴离子交换树脂
这类树脂含有大量的强酸性基团,使树脂中的OH-与溶液中的阴离子互相交换。
(二).离子交换法
离子交换树脂可以把阴阳离子分别交换出来,使水得到纯化。
HR + Na+ = NaR + H+
ROH + Cl— = RCl +OH—
H++OH- =H2O
(二).离子交换法
目前正迅速发展,
需要不断更新离子交换树脂
法(目前正迅速发展,但需要不断更新离子交换树脂)。
(三).反渗透法
1.反渗透的原理:当把相同体积的稀溶液和浓溶液分别置于一容器的两侧,中间用半透膜阻隔,稀溶液中的溶剂将自然地穿过半透膜,向浓溶液侧流动,浓溶液侧的液面会比稀溶液的液面高出一定高度,形成一个压力差,达到渗透平衡状态,此种压力差即为渗透压。若在浓溶液侧施加一个大于渗透压的压力时,浓溶液中的溶剂会向稀溶液流动,此种溶剂的流动方向与原来渗透的方向相反,这一过程称为反渗透。
(三).反渗透法
2.半透膜:对透过的物质具有选择性的薄膜称为半透膜,
一般将只能透过溶剂而不能透过溶质的薄膜称之为理想半透膜。
3.半透膜的分类:
(1)阳离子交换膜(简称阳膜):只允许阳离子和水分子通过。
(2)阴离子交换膜(简称阴膜):只允许阴离子和水分子通过。
(3)质子交换膜:只允许氢离子和水分子通过。
(三).反渗透法
4.用途:可以淡化水。
过滤精度最高的膜分离技术。过滤精度达到0.0001um。过滤了自来水中的所有物质,没有矿物质和微量元素,这种水是可以直接饮用的。水中的杂质如可溶性固体、有机物、胶体物质及细菌等则被反渗透膜截留,在截流液中浓缩并被去除。一级反渗透可去除原水中97%以上的溶解性固体。
工业上电解饱和食盐水制备氯气的反应原理:
请结合阳膜的选择性,说说阳膜的作用?
(1)平衡电荷,形成闭合回路;
(2)防止Cl2和H2混合而引起爆炸;
(3)避免Cl2与NaOH反应,影响NaOH的产量;
(三).反渗透法
四.电渗析法
高二学
成本低,但未能大量生产
海水中的化学元素
水的储量 13亿亿吨
海水含盐量 5x108亿吨
海水中金元素储量 5500万吨
海水中溴元素储量 70亿吨
海水中镁元素储量 1767万亿吨
海水中重水储量 200万亿吨
海水中锂元素储量 2470亿吨
海水中铀元素储量 40亿吨
海水中铷元素储量 1900亿吨
海水中钡元素储量 27亿吨
海水中锌元素储量 70亿吨
二.海水的化学资源利用
海水提取Mg
海水淡化
海水提取NaCl
Br2的提取
1.海水提纯NaCl 的基本思路吗?
为了除去海水中的硫酸根离子、镁离子、钙离子杂质,
选择的试剂?采用什么实验操作 ?
1.海水提纯氯化钠
2.可能的组合有几种?分别是?
海水浓缩
过滤
HCl溶液,适量
蒸发结晶
NaOH溶液、BaCl2溶液、Na2CO3溶液
过量
①BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
从海水中制得氯化钠除了食用外,还有什么用途?
制备这些化工原料的反应原理?请写出相关的化学方程式?
NaCl
烧碱
纯碱
钠
氯气
氯化氢
海水制盐 “煮海为盐”
(1)氯碱工业:
(2)制钠和氯气:
(3)制盐酸:
(4)制漂白剂(84消毒液):
(5)制纯碱:
2NaCl(熔融)=== 2Na + Cl2↑
电解
2NaCl+ 2H2O === H2↑+ Cl2 ↑ +2NaOH
电解
H2+ Cl2 === 2HCl
点燃
2NaOH+Cl2===NaClO+NaCl+H2O
2NaHCO3 ===Na2CO3+CO2↑+H2O
△
(饱和食盐水)
NaCl+CO2+H2O+NH3===NH4Cl+NaHCO3↓
溴元素的用途
溴化银被用作照相中的感光剂。
当你“咔嚓”按下快门的时候,
相片上的部分溴化银就分解出银,
从而得到我们所说的底片。
溴元素的用途
有机合成中方面:过乙烯使溴水褪色的实验,这实际上就代表了一类重要的加成反应;
在制药方面:红药水,也是溴与汞的化合物;
灭火器方面:我们平时看到的诸如“1211”灭火器,就是分子里面有一个溴原子的多卤代烷烃;
溴钨灯,成为取代碘钨灯的新光源。
2.海水提纯溴(单质)Br2
P101
目的:
氧化溴离子
目的:用空气将生成的溴 吹出从而分离Br2
目的:
用SO2作还原剂将Br2还原为HBr,以使其与空气分离
①酸化
③吹出
④吸收
⑥蒸馏
⑦冷凝
⑤氧化
目的:
用氯气氧化溴离子
目的:分离Br2
目的:
将气态溴
转化为
液态溴
②氧化
⑧分离
1.为什么第一步要酸化?(即酸化的目的)请你写出相关离子方程式。
Cl2+2OH— =Cl—+ClO—+H2O
2.请结合第②、④步的转化写出相关的离子方程式?还原性强弱关系?
提示:还原性强弱:还原剂>还原产物;
氧化性强弱:氧化剂>氧化产物;
④Br2+SO2+2H2O=2Br-+SO42-+4H+ 还原性强弱:SO2>Br-
②2Br-+Cl2=2Cl-+Br2 还原性强弱:Br->Cl-
综上所述:还原性强弱:SO2>Br->Cl-
2.海水提纯溴(单质)Br2
为什么偏偏要设计②、③、④步的转化?
富集溴元素
步骤①中由于苦卤的总水量比较大,导致其得到的溴水浓度很低,经过步骤②③④可以减少溶液总体积,使溴元素得到充分富集,使其浓缩得到较高浓度的溴水溶液,这样便于后续的分离提纯。
镁元素在人体中的重要性
人体内镁的水平主要受肾脏调节,当人体中缺乏镁元素会出现以下情况:
1.神经系统紊乱,进而引起脾气急躁、精神不安与紧张。
2.肌肉震颤、绞痛以及经常性刺痛感。
3.心律不齐、心悸、低血糖、虚弱、疲倦等症状。
3.由于镁会转化为一种酶,有助于对维生素B1、B2、B6的利用,因此缺乏镁就可能会引起缺乏B族维生素的症状,通常是抽搐。
照明弹
镁因为熔点低,镁燃烧时发出耀眼白光
因此可以用于烟火、照明弹。
熔点 沸点
648.8℃ 1107℃
3.海水提纯镁单质
苦卤
(含Mg2+)
Mg(OH)2沉淀
MgCl2 溶液
Mg
无水MgCl2
过滤
盐酸
Cl2
蒸发
加碱
过滤
?
熔融
电解
1.工业上常用贝壳煅烧经过一系列反应得到石灰乳(主要成分:氢氧化钙)来沉淀海水中的镁离子,不用氢氧化钠?
2.请写出得到石灰乳的
相关化学方程式?
贝壳易得,成本低,煅烧然后制石灰乳很方便,
相比较氢氧化钠成本较高。
3.工业上通常用石灰乳,请写出下列相关化学方程式?
能表示离子方程式就用离子方程式表示。
①与石灰乳: , 反应
②与盐酸: , 反应
③制取镁单质: , 反应
Mg2++Ca(OH)2=Ca2++Mg(OH)2 复分解
2H++Mg(OH)2=Mg2++2H2 O 复分解
分解
4.蒸发氯化镁溶液,如果要得到无水氯化镁,需要太长的时间。
有没有什么方法可以改进?
S随T变化较大的甲:大部分物质,如,硝酸钾
S随T变化较小的乙:如氯化钠
S随T变化反而降低的丙:如氢氧化钙
溶解度曲线的变化规律
单一溶质的情况下,
利用溶解度曲线制备或提纯物质:
1.如何从氯化钠溶液得到氯化钠晶体?
2.如何从硝酸钾溶液得到硝酸钾晶体?
像这样S随T变化较小的物质的提纯,
采用蒸发结晶,过滤,洗涤,干燥。
像这样S随T变化较大的物质的提纯,
采用蒸发浓缩,冷却结晶,过滤,洗涤,干燥。
一.一种溶质
1.S随T变化小 (如NaCl)
2. S随T变化大:
含结晶水: (如KNO3 五水硫酸铜等 )
受热易分解:
利用溶解度曲线制备或提纯物质
蒸发浓缩,
冷却结晶,
洗涤,干燥。
蒸发结晶,
过滤,洗涤,干燥。
两种溶质的情况下,其中一种少量,
利用溶解度曲线制备或提纯物质:
1.KNO3(NaCl)
2.NaCl(KNO3)
像这样主物质S随T变化较大的物质的提纯,
采用蒸发浓缩,冷却结晶,过滤,洗涤干燥。
像这样主物质S随T变化较小的物质的提纯,
采用蒸发浓缩,趁热过滤,洗涤干燥。
二.两种溶质,其中一种为少量杂质
1.S随T变化大 蒸发浓缩,冷却结晶,过滤
主物质 如KNO3(NaCl)
2.S随T变化小 蒸发结晶,趁热过滤
如NaCl(KNO3)
利用溶解度曲线制备或提纯物质
两种溶质的情况下,都大量共存,
利用溶解度曲线制备或提纯物质:
如何分离KNO3和NaCl?
两种溶质的情况下,都大量共存,
利用溶解度曲线制备或提纯物质:
如何分离KNO3和NaCl?
滤渣(NaCl)
滤液(KNO3) KNO3
蒸发浓缩,趁热过滤,
冷却结晶
过滤
三.两种溶质,大量共存
利用溶解度曲线制备或提纯物质
蒸发浓缩,趁热过滤,
冷却结晶
过滤
滤渣(S随T变化小,NaCl)
滤液 滤渣
(S随T变化大,KNO3)
口诀: 陡降缓蒸
陡含缓要陡就降
缓含陡要缓就蒸
解释:陡是指受温度影响较大一般是溶解度温度增大而增大, 缓是指受温度影响较小平缓型曲线。降是指降温结晶,蒸是指蒸发结晶
利用溶解度曲线制备或提纯物质
3.海水提纯镁单质
苦卤
(含Mg2+)
Mg(OH)2沉淀
MgCl2 溶液
Mg
无水MgCl2
干燥
过滤
盐酸
MgCl2·6H2O
蒸发浓缩冷却结晶过滤洗涤
Ca(OH)2
Cl2
蒸发
加碱
过滤
熔融
电解
碘的用途
在农业上,常用的除草剂和农药中,碘是不可缺少的元素之一,用含有碘化物的饲料,可以提高营养价值。用它喂奶牛,产奶量就会增加;用它喂绵羊,羊毛又密又长;用它喂鸡,可以多生鸡蛋;用它喂猪,可以催肥……
碘也是人体中不可缺少的元素,它能调节人的生长发育和能量供应,在人体中,它集中在一个叫“甲状腺”的部分,碘对人身体的作用是通过甲状腺来实现的;一旦人缺少碘,就会得大脖子病——甲状腺肿。于是,大夫就会给这样的病人吃一些含碘的药;并嘱咐他多吃海带、紫菜、葱头、大葱和海鱼等等,因为这些食物里含丰富的碘。
2.海水提纯碘单质(I2)
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2或氯水
含I2的溶液
含I2的有机溶液
萃取分液
1.根据所学,氯水的主要成分是氯气,氯气是一种强氧化剂,能氧化碘离子生成碘单质I2
请写出该离子方程式?
2I- + Cl2= I2+ 2Cl-
2.过氧化氢是一种绿色氧化剂,比氯水更加环保,能更加有效的替代氯水。滴加适量稀硫酸和过氧化氢后的溶液之后,生成了碘单质I2
请写出该离子方程式?氧化剂是?稀硫酸的作用?
2I- + H2O2 + 2H+= I2+ 2H2O
氧化剂是H2O2
稀硫酸的作用是酸性
2.据所学可知,碘离子、氯离子和溴离子均没有颜色,而碘水虽然呈黄色,但是溶液浓度低颜色会比较浅。
那么,如何及时验证溶液中已经生成了碘单质I2?
取待测液于试管中,
加入H2O2溶液后,
(现)溶液颜色变为浅黄色,渐变变为深黄色;
(现)加入淀粉溶液后,溶液又变为深蓝色。
(结论)溶液中已经生成了碘单质
物质 颜色
过氧化钠固体 淡黄色
溴化银固体 淡黄色
碘化银固体 黄色
硫单质固体 黄色
氯化铁溶液 橘黄色
碘水 黄色
溴水 橙黄色
黄色的
3.通常萃取剂选择四氯化碳,试试分析现象?能得到纯净的碘I2?
分层,
待充分萃取后,
上层无色,
下层紫色,成分:I2+CCl4。
4.如何从I2和CCl4中,得到纯净的碘I2?
5.锥形瓶中收集到的物质是?
6.该装置有什么不足之处?如何改进?
7.除了CCl4还有没有其他萃取剂?
8.能不能用乙醇替代CCl4?
物质 沸点
I2 113.6℃
CCl4 76.8℃
蒸馏
CCl4
直接加热,温度可能高于114°C。
建议采用水浴加热。
苯 密度比水小
乙醇易溶于水 不会分层
2.海水提纯碘单质(I2)
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
下层:紫色
含I2+CCl4
CCl4
萃取分液
上层:无色
蒸馏
I2
但是,实际在45℃左右碘就会升华。工业上,用NaOH浓溶液反萃取。
反萃取
BCD
B
A
从海水中获得的产品还可以做工业原料,如生产烧碱、纯碱、金属钠及氯气、盐酸、漂白粉等含氯化工产品。写出有关反应的化学方程式?
1.电解氯化钠:
2.钠和TiCl4(熔融):
3.电解饱和食盐水:
4.侯氏制碱法:①制取碳酸氢钠
②制取碳酸钠
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
