化学人教版(2019)选择性必修1 1.1.2中和反应热的测定 燃烧热(共52张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.2中和反应热的测定 燃烧热(共52张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 114.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-11 08:56:59 | ||
图片预览











文档简介
(共52张PPT)
中和反应热的测定
燃烧热
中和反应热的测定
A
原理
仪器
步骤
误差
燃烧热
B
概念
热化学方程式书写
学习目标
酸碱中和反应是放热反应,如何通过实验测定其反应热?
问题解决
中和反应
反应热的测定
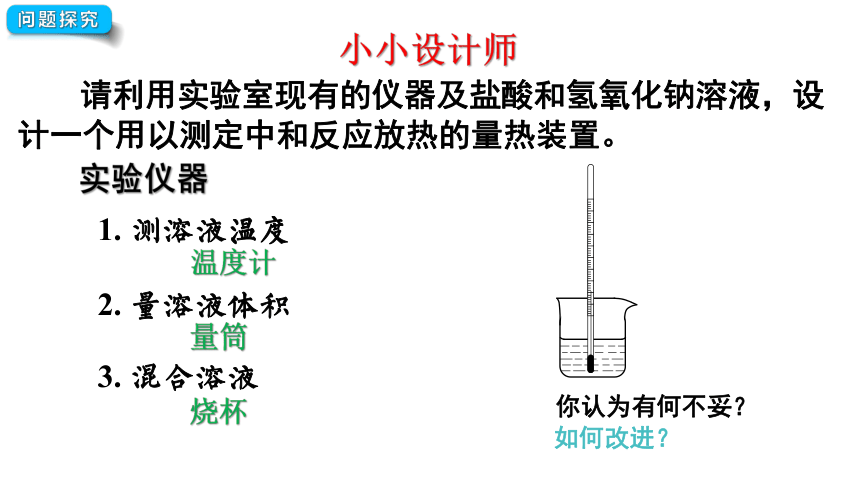
小小设计师
问题探究
请利用实验室现有的仪器及盐酸和氢氧化钠溶液,设计一个用以测定生成1 mol H2O放热的量热装置。
中和反应反应热的测定
温馨提醒
实验试剂
实验原理
实验仪器
1.1 试剂
中和反应反应热的测定
1
0.5 mol·L-1 盐酸(50 mL)
0.55 mol·L-1 NaOH溶液(50 mL)
蒸馏水
为何NaOH过量
为了保证HCl被完全中和
0.55
盐酸与NaOH溶液反应的过程中会放出热量,导致体系与环境之间的温度产生差异。
在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热
问题解决
热量的测定
问题探究
实验原理
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH
Q=mcΔt
1. 先求出热量
中和反应反应热的测定
c:比热容
m:体系的质量
Δt :反应前后体系的温度差
Q:放出的热量
2. 再求出水的量
n(H2O)=c(HCl)V(HCl)
3. 求出焓变
ΔH=
-
Q
n(H2O)
kJ·mol-1
1.2 原理
中和反应反应热的测定
1
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH
ΔH=
-
Q
n(H2O)
kJ·mol-1
小小设计师
问题探究
请利用实验室现有的仪器及盐酸和氢氧化钠溶液,设计一个用以测定中和反应放热的量热装置。
实验仪器
温度计
1. 测溶液温度
2. 量溶液体积
量筒
3. 混合溶液
烧杯
你认为有何不妥?
如何改进?
泡沫塑料
保温
隔热
减少热量损失
上、下移动,达到搅拌目的
能否用环形铜丝搅拌棒
若保温效果不好,ΔH如何值如何变化?
减少热量损失
如何加快反应?
问题探究
不能搅拌液体
1.3 仪器
中和热的测定
1
资料在线
量热计
1.4 步骤
中和反应反应热的测定
1
① 量取50 mL 0.5 mol·L-1 盐酸,倒入量热计中,测量、记录温度
② 量取50 mL 0.55 mol·L-1 NaOH溶液,测量、记录温度
(1) 测反应物温度
1.4 步骤
中和反应反应热的测定
1
③ NaOH溶液,迅速倒入量热计中,立即盖上盖板,不断搅拌,准确读出最高温度
(2) 测反应后体系温度
④ 重复上述步骤(1)至步骤(2)三次。
(1) 测反应物温度
目的是减少误差
1.5 数据处理
中和反应反应热的测定
1
实验次数 反应物的温度 /℃ 反应前体系的温度 反应后体系的温度 t2 /℃
HCl NaOH t1 /℃ t2 /℃ (t1-t2)/℃
1
2
3
实验重复多次,取测量所得数据的平均值作为计算依据。
多次计算求平均值以减小实验误差
思考﹒ 讨论
为了提高测定的准确度,应该采取的措施是什么?
2. 需要保温装置,保证反应过程中,不与外界发生热交换
1. 使用比较精确的温度计读出温度变化
3. 搅拌器搅拌,保证溶液温度均匀
1.6 关键——过二关
中和反应反应热的测定
1
隔热关
测量关
装置保温、隔热效果好,以减少热量的损失
精确的温度计(0.1℃刻度)
实验中只用一支温度计(使用后须用水洗净并用滤纸擦干再用)
混合液温度要不断搅拌
测反应混合液温度要随时读数,记录最高温度
温度计悬挂,使水银球处溶液中央位置(不靠容器壁或插底部)
碱液一次加入且迅速
在进行中和反应的反应热测定的实验中不需要用到的仪器是
A.天平
B.温度计
C.环形玻璃搅拌棒
D.量筒
看谁做得既准又快
问题解决
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1 25.0 25.2 25.1 28.5 3.4
2 24.9 25.1 25.0 28.3 3.3
3 25.6 25.4 25.5 29.0 3.5
某小组用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行实验。
设溶液的密度均为1 g·cm-3,反应后溶液的比热容c=4.18 J·g-1·℃-1
反应放出的热量Q=cmΔt=c·[m(盐酸)+m(NaOH溶液)]·(t2-t1)≈1.42 kJ
生成1 mol H2O放出的热量为
Q
n(H2O)
=
1.42 kJ
0.025
=
56.8 kJ
问题解决
大量实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
中和反应反应热
中和反应反应热是反应热的一种!!!
1. 小组测定为56.8 kJ,分析产生误差的可能原因?
2. 写出盐酸与氢氧化钠溶液反应的热化学方程式。
HCl(ag)+NaOH(ag)=NaCl(ag)+H2O (l)
ΔH=-57.3kJ·mol-1
3. 若为醋酸与氢氧化钠溶液反应,则放出的热量还是57.3 kJ 吗?
燃料的燃烧
依据反应事实,写出下列反应的热化学方程式:
1. 8 g甲烷完全燃烧生成气态水,放出445.0 kJ kJ热量。
2008年北京奥运会火炬--“祥云”,使用的燃料是丙烷
天然气水合物即可燃冰
水煤气主要成分是一氧化碳,氢气
练一练
2. 1 mol丙烷完全燃烧生成液态水,放出2 219.9 kJ 热量。
3. 煤气的主要成分为CO和H2, 14 gCO完全燃烧,放出141.5 kJ热量。
练一练
1. 8 g甲烷完全燃烧生成气态水,放出445.0 kJ kJ热量。
CH4(g) + O2(g) = CO2(g) + H2O(l) H= 445.0 kJ/mol
1
2
1
2
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) H= 890 kJ/mol
2. 1 mol丙烷完全燃烧生成液态水,放出2 219.9 kJ 热量。
C3H8(g) + 5O2(g) = 3CO2(g) + 4H2O(l) H= 2219.9 kJ/mol
3. 煤气的主要成分为CO和H2, 14 g一氧化碳完全燃烧,放出141.5 kJ热量。
1
2
CO(g) + O2(g) = CO2(g) H= 283 kJ/mol
身边的化学
家用燃料的变迁
柴草
煤炭
液化石油气
天然气
我们知道物质燃烧都会放出热量,那么不同物质燃烧放出的热量一样吗?如何比较不同物质的燃烧的热效率呢?
木材燃烧
煤炭燃烧
燃气燃烧
酒精燃烧
燃烧热
燃料的选择考虑的因素
燃料的种类很多,根据什么标准选择?
选择标准很多——贮量、开采、运输、贮存条件、价格、对生态环境影响,还有 能的高低。
燃烧热
燃烧热
2
在101 kPa下,1 mol纯物质完全燃烧生成指定产物时所放出的热量
概念
碳元素变为CO2(g) 、氢元素变为H2O(l)、硫元素变为SO2(g)、氮元素变为N2(g)等
C
CO2(g)
CO(g)
×
H
H2O (l)
H2O(g)
×
S
SO2(g)
SO3(g)
×
N
N2(g)
NOx(g)
×
单位
kJ/mol
哪个反应表示H2、CO的燃烧热?
H2(g) + O2(g) H2O(l) H2= 285.8 kJ/mol
1
2
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
2CO(g) + O2(g) 2CO2(g) H2= 566 kJ/mol
CO(g) + O2(g) CO2(g) H1= 283 kJ/mol
1
2
你学会了吗?
以下反应中,哪一个可表示C的燃烧热。
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1
不完全燃烧!
你学会了吗?
在101 kPa下,1 mol物质完全燃烧的反应热
2C(s)+2O2(g)=2CO2(g) ΔH=-787.0kJ·mol-1
可燃物的化学计量数为“1”
A.H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
D.CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1
E.CH4(g)+3/2O2(g)=CO(g) +2H2O(l) ΔH=-519.3 kJ·mol-1
看我七十二变
1. 测得101kPa时1mol C完全燃烧放出393.5 kJ的热量,请写出反应的热化学方程式。
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
考考你自己
2. 辛烷(C8H18)的燃烧热为5 518 kJ/mol,请写出反应的热化学方程式。
C8H18(l)+25/2O2(g)→8CO2(g)+9H2O(l) Δ H=5 518 kJ/mol
1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为_______。
已知H2和C3H8的燃烧热分别为:-285.8 kJ·mol-1、-2 220 kJ·mol-1 。
看谁做得既准又快
问题解决
如何通过实验测定燃料的燃烧热?
燃烧热的测量
氧弹
弹式量热计
搅拌器
温度计
引燃线
绝热外套
水
将待测物质放在一个充满氧气的密封金属容器(称为氧弹)内,再将此容器置于盛有一定量水的量热计内筒中,通过点火装置使氧弹中物质燃烧,反应放出的热量会使氧弹外面的水温升高。用温度计测量水温的变化,即可计算出此反应放出的热量。
燃烧热
2
在101 kPa下,1 mol纯物质完全燃烧生成指定产物时所放出的热量
概念
单位
kJ/mol
测定
量热计
某些物质的燃烧热(25 ℃,101 kPa) 名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) -393.5 乙烷 C2H6(g) -1 559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1 411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1 299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1 366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2 219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3 267.5
长征五号B运载火箭是专门为中国载人航天工程空间站建设而研制的一型新型运载火箭,以液态氧和液态氢作为火箭推进剂燃料,结合下表解释原因并写出热化学方程式。
思考﹒ 运用
某些物质的燃烧热(25 ℃,101 kPa) 名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) -393.5 乙烷 C2H6(g) -1 559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1 411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1 299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1 366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2 219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3 267.5
火箭推进剂燃料的选择
思考﹒ 运用
氢气、一氧化碳的燃烧热相近,能否都作为火箭推进剂?
火箭推进剂燃料的选择
思考﹒ 运用
H2(g) + O2(g)=H2O(l) H= 285.8 kJ/mol
1
2
H2(g) + O2(g)=H2O(g) H= 241.8 kJ/mol
1
2
CO(g) + O2(g)=CO2(g) H1= 283 kJ/mol
1
2
单位质量产生热量: ≈ 13.4 kJ/g
241.8 kJ
2 g+16 g
单位质量产生热量: ≈ 6.4 kJ/g
283 kJ
28 g+16 g
单位质量H2产生热量比CO多!
CO有毒,H2绿色环保!
火箭推进剂燃料的选择
思考﹒ 运用
火箭推进剂的发展主要着眼于能量高、排烟少、污染轻三个方面。
高能推进剂是将来推进剂研究的首选;
无烟推进剂的开发、 应用更是势在必行;
污染少的推进剂将大有发展前途。
优点:绿色、高能、推力大
缺点:低温贮存技术难度大;液氢密度小,燃料箱体积大
世界第一型首飞的液氧甲烷火箭!“朱雀二号”
液氢—液氧 四氧化二氮 煤油—液氧 甲烷—液氧
优点 环境友好 高能无毒 来源广泛 常温燃料 运输简单 耐冲击、耐摩擦 成本低廉 无毒无害 无毒无害
不易结焦积碳
缺点 价格较高 低温贮存较难 燃料占空间大 有毒性 有腐蚀性 污染环境 液氧需低温贮存 燃烧易结焦积碳 脱硫成本高
低温贮存
燃料占空间大
常见火箭推进剂
资料在线
回顾历史
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
中和热测定
原理
ΔH=
-
Q
n(H2O)
kJ·mol-1
装置
注意点
① 量筒中的溶液须一次且快速倒入烧杯中(否则热量会损失则增大误差)
② 环形玻璃搅拌棒不能用环形铜丝
(铜丝易导热,使热量损失大)
课堂小结
燃烧热
燃烧热热化学方程式正误判断方法
热化学方程式正误判断三看
一看
1
二看
2
三看
3
可燃物的化学计量数是否为1
元素完全燃烧生成的物质是否为指定产物
ΔH的数值和单位是否正确
规律方法点拨
课堂小结
项目 中和热 燃烧热
反应特点 中和反应 燃烧反应
反应条件 在稀溶液中 压强为101 kPa
量的要求 以___________为准 以____________为准
反应物、产物特点 酸和碱反应生成H2O和_________盐 完全燃烧生成_____的氧化物,如:C→CO2;H→H2O(l)
能量变化 强酸与强碱稀溶液反应:ΔH=-57.3 kJ·mol-1 不同反应的ΔH不相同,ΔH都为“-”
中和热与燃烧热
已知在一定条件下,CO的燃烧热为283 kJ·mol-1,CH4的燃烧热为890 kJ·mol-1,由1 mol CO和3 mol CH4组成的混合气体在上述条件下充分燃烧,释放的热量为
A.2 912 kJ
B.2 953 kJ
C.3 236 kJ
D.3 867 kJ
看谁做得既准又快
看谁做得既准又快
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸溶液的浓度和体积
②碱溶液的浓度和体积
③比热容
④反应后溶液的质量(单位:kg)
⑤生成水的物质的量
⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤
C.③④⑤⑥ D.全部
认识中和热与燃烧热
学会中和热测定及误差判断
中和反应热的测定
燃烧热
中和反应热的测定
A
原理
仪器
步骤
误差
燃烧热
B
概念
热化学方程式书写
学习目标
酸碱中和反应是放热反应,如何通过实验测定其反应热?
问题解决
中和反应
反应热的测定
小小设计师
问题探究
请利用实验室现有的仪器及盐酸和氢氧化钠溶液,设计一个用以测定生成1 mol H2O放热的量热装置。
中和反应反应热的测定
温馨提醒
实验试剂
实验原理
实验仪器
1.1 试剂
中和反应反应热的测定
1
0.5 mol·L-1 盐酸(50 mL)
0.55 mol·L-1 NaOH溶液(50 mL)
蒸馏水
为何NaOH过量
为了保证HCl被完全中和
0.55
盐酸与NaOH溶液反应的过程中会放出热量,导致体系与环境之间的温度产生差异。
在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热
问题解决
热量的测定
问题探究
实验原理
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH
Q=mcΔt
1. 先求出热量
中和反应反应热的测定
c:比热容
m:体系的质量
Δt :反应前后体系的温度差
Q:放出的热量
2. 再求出水的量
n(H2O)=c(HCl)V(HCl)
3. 求出焓变
ΔH=
-
Q
n(H2O)
kJ·mol-1
1.2 原理
中和反应反应热的测定
1
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH
ΔH=
-
Q
n(H2O)
kJ·mol-1
小小设计师
问题探究
请利用实验室现有的仪器及盐酸和氢氧化钠溶液,设计一个用以测定中和反应放热的量热装置。
实验仪器
温度计
1. 测溶液温度
2. 量溶液体积
量筒
3. 混合溶液
烧杯
你认为有何不妥?
如何改进?
泡沫塑料
保温
隔热
减少热量损失
上、下移动,达到搅拌目的
能否用环形铜丝搅拌棒
若保温效果不好,ΔH如何值如何变化?
减少热量损失
如何加快反应?
问题探究
不能搅拌液体
1.3 仪器
中和热的测定
1
资料在线
量热计
1.4 步骤
中和反应反应热的测定
1
① 量取50 mL 0.5 mol·L-1 盐酸,倒入量热计中,测量、记录温度
② 量取50 mL 0.55 mol·L-1 NaOH溶液,测量、记录温度
(1) 测反应物温度
1.4 步骤
中和反应反应热的测定
1
③ NaOH溶液,迅速倒入量热计中,立即盖上盖板,不断搅拌,准确读出最高温度
(2) 测反应后体系温度
④ 重复上述步骤(1)至步骤(2)三次。
(1) 测反应物温度
目的是减少误差
1.5 数据处理
中和反应反应热的测定
1
实验次数 反应物的温度 /℃ 反应前体系的温度 反应后体系的温度 t2 /℃
HCl NaOH t1 /℃ t2 /℃ (t1-t2)/℃
1
2
3
实验重复多次,取测量所得数据的平均值作为计算依据。
多次计算求平均值以减小实验误差
思考﹒ 讨论
为了提高测定的准确度,应该采取的措施是什么?
2. 需要保温装置,保证反应过程中,不与外界发生热交换
1. 使用比较精确的温度计读出温度变化
3. 搅拌器搅拌,保证溶液温度均匀
1.6 关键——过二关
中和反应反应热的测定
1
隔热关
测量关
装置保温、隔热效果好,以减少热量的损失
精确的温度计(0.1℃刻度)
实验中只用一支温度计(使用后须用水洗净并用滤纸擦干再用)
混合液温度要不断搅拌
测反应混合液温度要随时读数,记录最高温度
温度计悬挂,使水银球处溶液中央位置(不靠容器壁或插底部)
碱液一次加入且迅速
在进行中和反应的反应热测定的实验中不需要用到的仪器是
A.天平
B.温度计
C.环形玻璃搅拌棒
D.量筒
看谁做得既准又快
问题解决
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1 25.0 25.2 25.1 28.5 3.4
2 24.9 25.1 25.0 28.3 3.3
3 25.6 25.4 25.5 29.0 3.5
某小组用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行实验。
设溶液的密度均为1 g·cm-3,反应后溶液的比热容c=4.18 J·g-1·℃-1
反应放出的热量Q=cmΔt=c·[m(盐酸)+m(NaOH溶液)]·(t2-t1)≈1.42 kJ
生成1 mol H2O放出的热量为
Q
n(H2O)
=
1.42 kJ
0.025
=
56.8 kJ
问题解决
大量实验测得,在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
中和反应反应热
中和反应反应热是反应热的一种!!!
1. 小组测定为56.8 kJ,分析产生误差的可能原因?
2. 写出盐酸与氢氧化钠溶液反应的热化学方程式。
HCl(ag)+NaOH(ag)=NaCl(ag)+H2O (l)
ΔH=-57.3kJ·mol-1
3. 若为醋酸与氢氧化钠溶液反应,则放出的热量还是57.3 kJ 吗?
燃料的燃烧
依据反应事实,写出下列反应的热化学方程式:
1. 8 g甲烷完全燃烧生成气态水,放出445.0 kJ kJ热量。
2008年北京奥运会火炬--“祥云”,使用的燃料是丙烷
天然气水合物即可燃冰
水煤气主要成分是一氧化碳,氢气
练一练
2. 1 mol丙烷完全燃烧生成液态水,放出2 219.9 kJ 热量。
3. 煤气的主要成分为CO和H2, 14 gCO完全燃烧,放出141.5 kJ热量。
练一练
1. 8 g甲烷完全燃烧生成气态水,放出445.0 kJ kJ热量。
CH4(g) + O2(g) = CO2(g) + H2O(l) H= 445.0 kJ/mol
1
2
1
2
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) H= 890 kJ/mol
2. 1 mol丙烷完全燃烧生成液态水,放出2 219.9 kJ 热量。
C3H8(g) + 5O2(g) = 3CO2(g) + 4H2O(l) H= 2219.9 kJ/mol
3. 煤气的主要成分为CO和H2, 14 g一氧化碳完全燃烧,放出141.5 kJ热量。
1
2
CO(g) + O2(g) = CO2(g) H= 283 kJ/mol
身边的化学
家用燃料的变迁
柴草
煤炭
液化石油气
天然气
我们知道物质燃烧都会放出热量,那么不同物质燃烧放出的热量一样吗?如何比较不同物质的燃烧的热效率呢?
木材燃烧
煤炭燃烧
燃气燃烧
酒精燃烧
燃烧热
燃料的选择考虑的因素
燃料的种类很多,根据什么标准选择?
选择标准很多——贮量、开采、运输、贮存条件、价格、对生态环境影响,还有 能的高低。
燃烧热
燃烧热
2
在101 kPa下,1 mol纯物质完全燃烧生成指定产物时所放出的热量
概念
碳元素变为CO2(g) 、氢元素变为H2O(l)、硫元素变为SO2(g)、氮元素变为N2(g)等
C
CO2(g)
CO(g)
×
H
H2O (l)
H2O(g)
×
S
SO2(g)
SO3(g)
×
N
N2(g)
NOx(g)
×
单位
kJ/mol
哪个反应表示H2、CO的燃烧热?
H2(g) + O2(g) H2O(l) H2= 285.8 kJ/mol
1
2
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
2CO(g) + O2(g) 2CO2(g) H2= 566 kJ/mol
CO(g) + O2(g) CO2(g) H1= 283 kJ/mol
1
2
你学会了吗?
以下反应中,哪一个可表示C的燃烧热。
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1
不完全燃烧!
你学会了吗?
在101 kPa下,1 mol物质完全燃烧的反应热
2C(s)+2O2(g)=2CO2(g) ΔH=-787.0kJ·mol-1
可燃物的化学计量数为“1”
A.H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
D.CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1
E.CH4(g)+3/2O2(g)=CO(g) +2H2O(l) ΔH=-519.3 kJ·mol-1
看我七十二变
1. 测得101kPa时1mol C完全燃烧放出393.5 kJ的热量,请写出反应的热化学方程式。
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
考考你自己
2. 辛烷(C8H18)的燃烧热为5 518 kJ/mol,请写出反应的热化学方程式。
C8H18(l)+25/2O2(g)→8CO2(g)+9H2O(l) Δ H=5 518 kJ/mol
1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为_______。
已知H2和C3H8的燃烧热分别为:-285.8 kJ·mol-1、-2 220 kJ·mol-1 。
看谁做得既准又快
问题解决
如何通过实验测定燃料的燃烧热?
燃烧热的测量
氧弹
弹式量热计
搅拌器
温度计
引燃线
绝热外套
水
将待测物质放在一个充满氧气的密封金属容器(称为氧弹)内,再将此容器置于盛有一定量水的量热计内筒中,通过点火装置使氧弹中物质燃烧,反应放出的热量会使氧弹外面的水温升高。用温度计测量水温的变化,即可计算出此反应放出的热量。
燃烧热
2
在101 kPa下,1 mol纯物质完全燃烧生成指定产物时所放出的热量
概念
单位
kJ/mol
测定
量热计
某些物质的燃烧热(25 ℃,101 kPa) 名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) -393.5 乙烷 C2H6(g) -1 559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1 411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1 299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1 366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2 219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3 267.5
长征五号B运载火箭是专门为中国载人航天工程空间站建设而研制的一型新型运载火箭,以液态氧和液态氢作为火箭推进剂燃料,结合下表解释原因并写出热化学方程式。
思考﹒ 运用
某些物质的燃烧热(25 ℃,101 kPa) 名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) -393.5 乙烷 C2H6(g) -1 559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1 411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1 299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1 366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2 219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3 267.5
火箭推进剂燃料的选择
思考﹒ 运用
氢气、一氧化碳的燃烧热相近,能否都作为火箭推进剂?
火箭推进剂燃料的选择
思考﹒ 运用
H2(g) + O2(g)=H2O(l) H= 285.8 kJ/mol
1
2
H2(g) + O2(g)=H2O(g) H= 241.8 kJ/mol
1
2
CO(g) + O2(g)=CO2(g) H1= 283 kJ/mol
1
2
单位质量产生热量: ≈ 13.4 kJ/g
241.8 kJ
2 g+16 g
单位质量产生热量: ≈ 6.4 kJ/g
283 kJ
28 g+16 g
单位质量H2产生热量比CO多!
CO有毒,H2绿色环保!
火箭推进剂燃料的选择
思考﹒ 运用
火箭推进剂的发展主要着眼于能量高、排烟少、污染轻三个方面。
高能推进剂是将来推进剂研究的首选;
无烟推进剂的开发、 应用更是势在必行;
污染少的推进剂将大有发展前途。
优点:绿色、高能、推力大
缺点:低温贮存技术难度大;液氢密度小,燃料箱体积大
世界第一型首飞的液氧甲烷火箭!“朱雀二号”
液氢—液氧 四氧化二氮 煤油—液氧 甲烷—液氧
优点 环境友好 高能无毒 来源广泛 常温燃料 运输简单 耐冲击、耐摩擦 成本低廉 无毒无害 无毒无害
不易结焦积碳
缺点 价格较高 低温贮存较难 燃料占空间大 有毒性 有腐蚀性 污染环境 液氧需低温贮存 燃烧易结焦积碳 脱硫成本高
低温贮存
燃料占空间大
常见火箭推进剂
资料在线
回顾历史
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
中和热测定
原理
ΔH=
-
Q
n(H2O)
kJ·mol-1
装置
注意点
① 量筒中的溶液须一次且快速倒入烧杯中(否则热量会损失则增大误差)
② 环形玻璃搅拌棒不能用环形铜丝
(铜丝易导热,使热量损失大)
课堂小结
燃烧热
燃烧热热化学方程式正误判断方法
热化学方程式正误判断三看
一看
1
二看
2
三看
3
可燃物的化学计量数是否为1
元素完全燃烧生成的物质是否为指定产物
ΔH的数值和单位是否正确
规律方法点拨
课堂小结
项目 中和热 燃烧热
反应特点 中和反应 燃烧反应
反应条件 在稀溶液中 压强为101 kPa
量的要求 以___________为准 以____________为准
反应物、产物特点 酸和碱反应生成H2O和_________盐 完全燃烧生成_____的氧化物,如:C→CO2;H→H2O(l)
能量变化 强酸与强碱稀溶液反应:ΔH=-57.3 kJ·mol-1 不同反应的ΔH不相同,ΔH都为“-”
中和热与燃烧热
已知在一定条件下,CO的燃烧热为283 kJ·mol-1,CH4的燃烧热为890 kJ·mol-1,由1 mol CO和3 mol CH4组成的混合气体在上述条件下充分燃烧,释放的热量为
A.2 912 kJ
B.2 953 kJ
C.3 236 kJ
D.3 867 kJ
看谁做得既准又快
看谁做得既准又快
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸溶液的浓度和体积
②碱溶液的浓度和体积
③比热容
④反应后溶液的质量(单位:kg)
⑤生成水的物质的量
⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤
C.③④⑤⑥ D.全部
认识中和热与燃烧热
学会中和热测定及误差判断
