化学人教版(2019)选择性必修1 1.1.1反应热 焓变 热化学方程式(共51张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.1反应热 焓变 热化学方程式(共51张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 149.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-11 08:57:44 | ||
图片预览








文档简介
(共51张PPT)
科学研究是为了发展人类文明。
埃米尔·费雪(Emil Fische,1852~1919),德国有机化学家,1902年诺贝尔化学奖得主。他阐明糖类的结构方面作出了重大贡献,并合成了葡萄糖、果糖、甘露糖等,并于1914年第一个合成核苷酸。
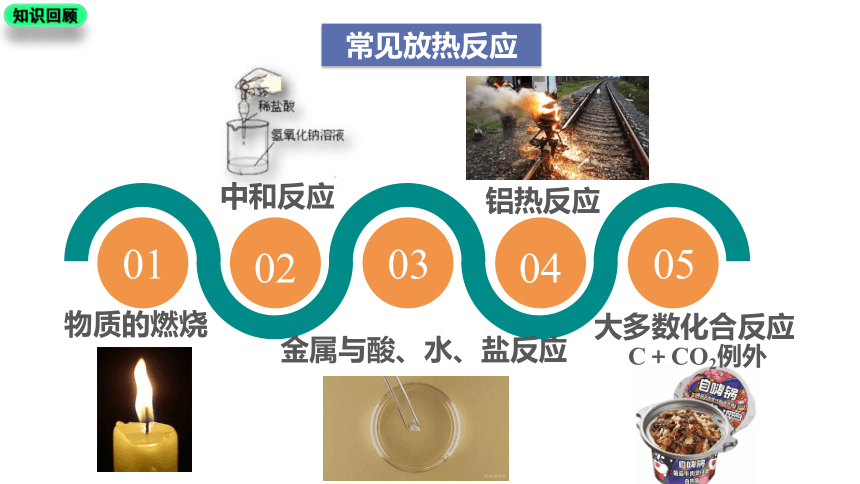
知识回顾
常见放热反应
01
02
03
04
05
物质的燃烧
中和反应
金属与酸、水、盐反应
铝热反应
大多数化合反应
C+CO2例外
知识回顾
01
02
03
04
05
大多数分解反应
C+CO2
C+H2O
H2+CuO
Ba(OH)2·8H2O
+NH4Cl
常见吸热反应
木块与烧杯粘在一起
2022年7月24日14时,长征五号B运载火箭托举着 “天问实验舱”,在中国海南文昌航天发射场点火升空。
液氢-液氧
煤油-液氧
箭长53. 7米
总质量837.5吨
反应热 焓变 热化学方程式
学习目标热化学方程式反应热体系环境反应热焓变内能焓焓变概念书写
反应热
1
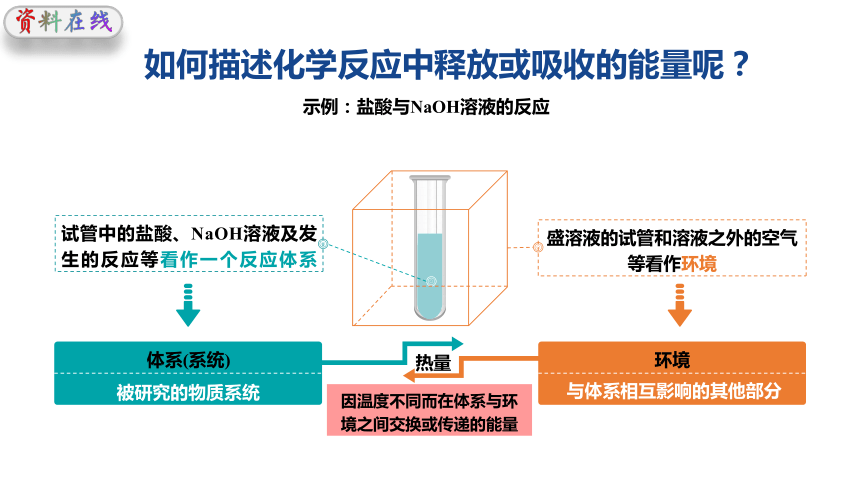
如何描述化学反应中释放或吸收的能量呢?
示例:盐酸与NaOH溶液的反应
试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系
体系(系统)
被研究的物质系统
环境
盛溶液的试管和溶液之外的空气等看作环境
与体系相互影响的其他部分
因温度不同而在体系与环境之间交换或传递的能量
热量
资料在线
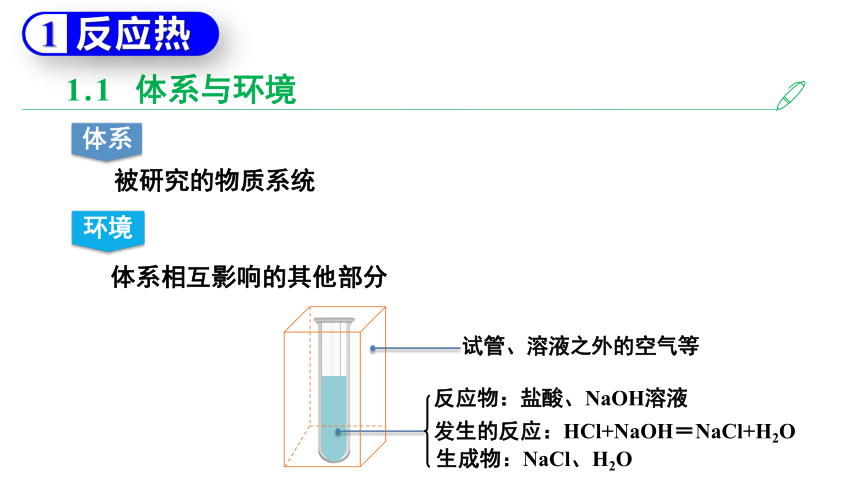
1.1 体系与环境
反应热
1
体系
被研究的物质系统
反应物:盐酸、NaOH溶液
发生的反应:HCl+NaOH=NaCl+H2O
生成物:NaCl、H2O
环境
体系相互影响的其他部分
试管、溶液之外的空气等
体系
环境
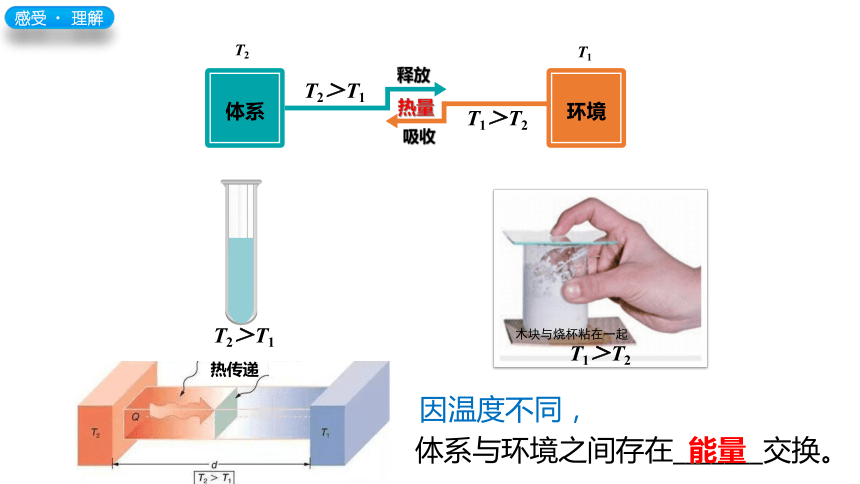
感受﹒ 理解
T2
T1
T2>T1
木块与烧杯粘在一起
T1>T2
热量
T2>T1
热传递
释放
T1>T2
吸收
体系与环境之间存在_______交换。
能量
因温度不同,
1.2 反应热
反应热
1
热量
因______不同而在_____与______之间交换或传递的______
温度
体系
环境
能量
体系
环境
T2
T1
热量
T2>T1
释放
T1>T2
吸收
感受﹒ 理解
化学反应的热效应
反应前后体系的温度相等
等温条件下,化学反应体系向环境释放或从环境吸收的热量
(反应热)
1.2 反应热
反应热
1
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
热量
因温度不同而在体系与环境之间交换或传递的能量
反应热
指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相同
测定
量热计
焓变
2
化学反应为什么会产生反应热?
体系
内能变化
产生
反应热
化学反应前后体系的内能发生了变化
2.1 内能
焓变
2
符号:
U
定义:
体系内物质的各种能量的总和
受温度、压强和物质的聚集状态等影响
在科学研究和生产实践中,化学反应通常是在等压条件下进行的。
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为 H)。
2.1 焓变
焓变
2
焓
与内能有关的物理量
符号:
H
定义:
焓变
符号:
ΔH
计算:
ΔH=H生成物-H反应物
单位:
kJ/mol
kJ·mol-1
焓变
体系
内能改变
产生
反应热
等压
反应热
研究表明,等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变(ΔH)
深化理解
2.1 焓变
焓变
2
焓
与内能有关
符号:
H
定义:
焓变
符号:
ΔH
计算:
ΔH=H生成物-H反应物
单位:
kJ/mol
kJ·mol-1
关系:
等压条件下的反应热等于反应的焓变
化学反应为什么会产生反应热?
体系
内能变化
产生
反应热
化学反应前后体系的内能发生了变化
宏观
微观
图示
2.2 宏观辨识——焓角度
焓变
2
反应物具有的总能量高
生成物具有的总能量低
放热反应
∑H (反应物)>∑H(生成物)
H<0
焓(H)
反应物
生成物
当反应体系放热时其焓减小,Δ H为负值,即ΔH<0
化学
反应
向环境
释放能量
图示
2.2 宏观辨识——焓角度
焓变
2
生成物具有的总能量高
反应物具有的总能量低
化学
反应
从环境
吸收能量
吸热反应
∑H (反应物) < ∑H(生成物)
H>0
焓(H)
反应物
生成物
当反应体系吸热时其焓增大,ΔH为正值,即ΔH>0
液氢-液氧
2H2+O2=2H2O
知识回顾
键能:25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
436 kJ/mol
焓(H)
H2= 436 kJ/mol
H2(g)
2H(g)
H1=+436 kJ/mol
H
H
键断裂
H
H
吸收能量
436.3kJ/mol
H
H
键断裂
H
H
提供能量
436kJ/mol
O
O
O
O
键断裂
吸收能量
496kJ/mol
+
+
键
形
成
O
H
H
释放能量
463kJ/mol
释放能量
463kJ/mol
+
+
键
形
成
O
H
H
释放能量
463kJ/mol
释放能量
463kJ/mol
氢气和氧气反应的能量示意图
共吸收
436×2+496=1 368kJ
共放出
463×4=1 852 kJ
放出
484 kJ热量
思考﹒ 运用
焓(H)
H2= 1 852 kJ/mol
2H2(g)+O2(g)
4H(g)+2O(g)
H1=+1 368 kJ/mol
2H2O(g)
H
H= H2- H1= 1 852 kJ/mol -(+1 368 kJ/mol)= 484 kJ/mol
感受﹒ 理解
2.3 微观探析——反应本质
焓变
2
反应物
生成物
化学反应
键断裂
键生成
原子重新组合
吸收能量
放出能量
吸收能量 < 释放能量
吸收能量 > 释放能量
放热反应
吸热反应
H(估算)=∑E (反应物键能)-∑E (生成物键能)
热化学方程式
3
如何用化学用语表示反应中放出或者吸收的热量呢?
热化学方程式
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
2 mol H2(g)与1 mol O2(g)反应生成2 mol H2O(g)时, 放出483.6 kJ的热量
交流讨论
热化学方程式
3
概念
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ/mol
表明反应放出或吸收的热量的化学方程式
物质变化
能量变化
H= 483.6 kJ/mol
2H2O (g)
H
2H2 (g) + O2 (g)
H =+184.6 kJ/mol
H =+483.6 kJ/mol
2H2O(g)=2H2(g)+O2(g)
热化学方程式
3
概念
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
表明反应放出或吸收的热量的化学方程式
物质变化
能量变化
意义
不仅表明了化学反应中物质变化,也表明了化学反应中的能量变化
CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.5 kJ/mol
表示:1 mol CaCO3完全分解生成CaO和CO2气体,吸收的热量为178.5 kJ。
热化学方程式
3
概念
意义
书写
写
写出配平的化学方程式
标
用s、g、l标出各物质的状态
注
在ΔH后注明正负号、数值及单位
思考﹒ 讨论
热化学方程式中,为何要标明物质的状态?
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=_______ kJ/mol
等质量水的焓
H2O(s)<H2O(l)< H2O(g)
水的聚集状态变化时的焓变示意图
熔化
蒸发
焓(H)增大
同种物质聚集状态不同,焓不同
思考﹒ 讨论
热化学方程式中,为何要标明物质的状态?
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=________ kJ/mol
H1=-483.6 kJ/mol
H2=-571.6 kJ/mol
2H2 (g) + O2 (g)
2H2O (g)
H
H2O (l)
-571.6
热化学方程式书写时,要标注物质的状态!
固体
(s)
液体
(l)
气体
(g)
溶液
(aq)
思考﹒ 讨论
如反应中H2与O2的量减半,ΔH还一样吗?
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6 kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH2=_______ kJ/mol
1
2
-241.8
1
2
×
1
2
×
1
2
×
1
2
×
H 的值与计量数成正比!
热化学方程式中
各物质前的化学计量数
可以是整数或分数
不表示分子个数
只表示物质的量!
H数值与
化学计量数成正比
化学计量数加倍,ΔH值也加倍
思考﹒ 讨论
同一反应(物质的状态及量均相同)在不同温度、压强下反应,焓变是否相同?
H2(g) + I2(g) 2HI(g) H= 9.48 kJ/mol
101kPa
100 oC
H2(g) + I2(g) 2HI(g) H= 14.9 kJ/mol
101kPa
25 oC
反应温度、压强不同
其 H 也不同
若反应在25 oC、101 kPa进行,该条件可不注明,其他温度和压强必须注明
除去温度、压强,其他条件不需标注
深化理解
ΔH中的单位mol-1代表什么含义?
阅读教材P9
小试身手
CH4可做火箭推进剂的燃料,0.5 mol CH4完全燃烧生成液体水放出445 kJ的热量,请写出热化学方程式。
A.CH4+2O2=CO2(g)+2H2O ΔH=-890J·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890 J·mol-1
C. CH4(g)+O2(g)=CO2(g) +2H2O(l) ΔH=-890 kJ
D.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) ΔH=-445 J·mol-1
未标物质状态
符号标错
单位标错
解后反思
一审状态
二审符号(“+”“-”)
三审数值
四审单位
热化学方程式
3
热化学方程式书写注意事项
①
②
③
④
状态
标明所有物质的状态
固体(s) 液体(l) 气体(g)
溶液(aq)
防标错或漏标
化学计量数
表示物质的量(整数或分数)
与焓变数值对应
焓变(ΔH)
防漏标“+”“-”
防ΔH的数值错误,与计量数成正比
防漏掉单位kJ·mol-1或错写成kJ
条件
温度 压强(25℃,101kPa时可不注明)
其他反应条件及“↑”“↓”不写
写出下列反应的热化学方程式:
(1) 1 mol C与水蒸气反应,生成CO和H2,吸收131.3 kJ的热量
(2) 0.5 mol Cu与氧气反应,生成CuO,放出78.5 kJ的热量
C(s)+H2O (g)=CO (g) +H2(g)
H=+131.3 kJ/mol
2Cu(s)+O2 (g)=2CuO (s)
H=-157.0 kJ/mol
请你试一试
H2是人类理想的能源,1 g H2完全燃烧生成液体水放出142.6 kJ的热量,
请写出热化学方程式。
请你试一试
2H2(g)+O2(g)=2H2O(l) ΔH=-570.4 kJ·mol-1
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+O2(g) ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+O2(g)=H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ
看我七十二变
考考你自己
家用液化气的主要成份是丙烷、丁烷、丙烯等,将0.0112 m3(标准状况下)丙烷气体完全燃烧,生成CO2气体和液态水,放出1 108.9 kJ热量。表示上述反应的热化学方程式正确的是
A.C3H8(g)+5O2(g)=3CO2(g) +4H2O(l) ΔH=-1 108.9 J·mol-1
B.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=+2 217.8 J·mol-1
C.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=+1 108.9 J·mol-1
D.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2217.8 J·mol-1
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
反应热与焓变
反应热
体系
被研究的物质系统
环境
体系相互影响的其他部分
反应热
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
焓变
定义
意义
反应热在等压条件下等于反应的焓变
原因
宏观:体系内能的变化
ΔH=H生成物-H反应物
微观:断键吸热 成键放热
放热反应ΔH<0
吸热反应ΔH>0
课堂小结
课堂小结
热化学方程式
标明所有物质的状态,防标错或漏标
1
2
3
化学计量数可为分数
关于ΔH:
①防漏标“+”或“-”
②防ΔH的数值错误,ΔH应与化学计量数成正比
③防漏掉单位kJ·mol-1或错写成kJ
A.2SO2+O2=2SO3 ΔH=-196.6 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=+241.8 kJ·mol-1
C.2H2(g)+O2(g)= 2H2O(l) ΔH=-571.6 kJ·mol-1
D.C(s)+O2(g)= CO2(g) ΔH=+393.5 kJ·mol-1
下列热化学方程式书写正确的是
成功体验
判断下列热化学方程式书写是否正确:
1. 12 g石墨转化为CO时,放出11.05 kJ的热量
2C(石墨,s)+O2(g)=2CO(g) H=-110.5 kJ/mol
2. 1 mol液态肼与氧气中完全燃烧生成氮和水蒸气,放出642 kJ的热量
N2H4(l)+O2(g)=N2(g) +2H2O(g) H=+642 kJ/mol
3. 已知:H2(g)+1/2O2(g)=H2O(l) H=-286 kJ/mol
则2H2O (l)=2H2(g)+O2 (g) H=+572 kJ/mol
看谁做得既准又快
科学研究是为了发展人类文明。
埃米尔·费雪(Emil Fische,1852~1919),德国有机化学家,1902年诺贝尔化学奖得主。他阐明糖类的结构方面作出了重大贡献,并合成了葡萄糖、果糖、甘露糖等,并于1914年第一个合成核苷酸。
知识回顾
常见放热反应
01
02
03
04
05
物质的燃烧
中和反应
金属与酸、水、盐反应
铝热反应
大多数化合反应
C+CO2例外
知识回顾
01
02
03
04
05
大多数分解反应
C+CO2
C+H2O
H2+CuO
Ba(OH)2·8H2O
+NH4Cl
常见吸热反应
木块与烧杯粘在一起
2022年7月24日14时,长征五号B运载火箭托举着 “天问实验舱”,在中国海南文昌航天发射场点火升空。
液氢-液氧
煤油-液氧
箭长53. 7米
总质量837.5吨
反应热 焓变 热化学方程式
学习目标热化学方程式反应热体系环境反应热焓变内能焓焓变概念书写
反应热
1
如何描述化学反应中释放或吸收的能量呢?
示例:盐酸与NaOH溶液的反应
试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系
体系(系统)
被研究的物质系统
环境
盛溶液的试管和溶液之外的空气等看作环境
与体系相互影响的其他部分
因温度不同而在体系与环境之间交换或传递的能量
热量
资料在线
1.1 体系与环境
反应热
1
体系
被研究的物质系统
反应物:盐酸、NaOH溶液
发生的反应:HCl+NaOH=NaCl+H2O
生成物:NaCl、H2O
环境
体系相互影响的其他部分
试管、溶液之外的空气等
体系
环境
感受﹒ 理解
T2
T1
T2>T1
木块与烧杯粘在一起
T1>T2
热量
T2>T1
热传递
释放
T1>T2
吸收
体系与环境之间存在_______交换。
能量
因温度不同,
1.2 反应热
反应热
1
热量
因______不同而在_____与______之间交换或传递的______
温度
体系
环境
能量
体系
环境
T2
T1
热量
T2>T1
释放
T1>T2
吸收
感受﹒ 理解
化学反应的热效应
反应前后体系的温度相等
等温条件下,化学反应体系向环境释放或从环境吸收的热量
(反应热)
1.2 反应热
反应热
1
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
热量
因温度不同而在体系与环境之间交换或传递的能量
反应热
指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相同
测定
量热计
焓变
2
化学反应为什么会产生反应热?
体系
内能变化
产生
反应热
化学反应前后体系的内能发生了变化
2.1 内能
焓变
2
符号:
U
定义:
体系内物质的各种能量的总和
受温度、压强和物质的聚集状态等影响
在科学研究和生产实践中,化学反应通常是在等压条件下进行的。
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为 H)。
2.1 焓变
焓变
2
焓
与内能有关的物理量
符号:
H
定义:
焓变
符号:
ΔH
计算:
ΔH=H生成物-H反应物
单位:
kJ/mol
kJ·mol-1
焓变
体系
内能改变
产生
反应热
等压
反应热
研究表明,等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变(ΔH)
深化理解
2.1 焓变
焓变
2
焓
与内能有关
符号:
H
定义:
焓变
符号:
ΔH
计算:
ΔH=H生成物-H反应物
单位:
kJ/mol
kJ·mol-1
关系:
等压条件下的反应热等于反应的焓变
化学反应为什么会产生反应热?
体系
内能变化
产生
反应热
化学反应前后体系的内能发生了变化
宏观
微观
图示
2.2 宏观辨识——焓角度
焓变
2
反应物具有的总能量高
生成物具有的总能量低
放热反应
∑H (反应物)>∑H(生成物)
H<0
焓(H)
反应物
生成物
当反应体系放热时其焓减小,Δ H为负值,即ΔH<0
化学
反应
向环境
释放能量
图示
2.2 宏观辨识——焓角度
焓变
2
生成物具有的总能量高
反应物具有的总能量低
化学
反应
从环境
吸收能量
吸热反应
∑H (反应物) < ∑H(生成物)
H>0
焓(H)
反应物
生成物
当反应体系吸热时其焓增大,ΔH为正值,即ΔH>0
液氢-液氧
2H2+O2=2H2O
知识回顾
键能:25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
436 kJ/mol
焓(H)
H2= 436 kJ/mol
H2(g)
2H(g)
H1=+436 kJ/mol
H
H
键断裂
H
H
吸收能量
436.3kJ/mol
H
H
键断裂
H
H
提供能量
436kJ/mol
O
O
O
O
键断裂
吸收能量
496kJ/mol
+
+
键
形
成
O
H
H
释放能量
463kJ/mol
释放能量
463kJ/mol
+
+
键
形
成
O
H
H
释放能量
463kJ/mol
释放能量
463kJ/mol
氢气和氧气反应的能量示意图
共吸收
436×2+496=1 368kJ
共放出
463×4=1 852 kJ
放出
484 kJ热量
思考﹒ 运用
焓(H)
H2= 1 852 kJ/mol
2H2(g)+O2(g)
4H(g)+2O(g)
H1=+1 368 kJ/mol
2H2O(g)
H
H= H2- H1= 1 852 kJ/mol -(+1 368 kJ/mol)= 484 kJ/mol
感受﹒ 理解
2.3 微观探析——反应本质
焓变
2
反应物
生成物
化学反应
键断裂
键生成
原子重新组合
吸收能量
放出能量
吸收能量 < 释放能量
吸收能量 > 释放能量
放热反应
吸热反应
H(估算)=∑E (反应物键能)-∑E (生成物键能)
热化学方程式
3
如何用化学用语表示反应中放出或者吸收的热量呢?
热化学方程式
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
2 mol H2(g)与1 mol O2(g)反应生成2 mol H2O(g)时, 放出483.6 kJ的热量
交流讨论
热化学方程式
3
概念
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ/mol
表明反应放出或吸收的热量的化学方程式
物质变化
能量变化
H= 483.6 kJ/mol
2H2O (g)
H
2H2 (g) + O2 (g)
H =+184.6 kJ/mol
H =+483.6 kJ/mol
2H2O(g)=2H2(g)+O2(g)
热化学方程式
3
概念
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
表明反应放出或吸收的热量的化学方程式
物质变化
能量变化
意义
不仅表明了化学反应中物质变化,也表明了化学反应中的能量变化
CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.5 kJ/mol
表示:1 mol CaCO3完全分解生成CaO和CO2气体,吸收的热量为178.5 kJ。
热化学方程式
3
概念
意义
书写
写
写出配平的化学方程式
标
用s、g、l标出各物质的状态
注
在ΔH后注明正负号、数值及单位
思考﹒ 讨论
热化学方程式中,为何要标明物质的状态?
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=_______ kJ/mol
等质量水的焓
H2O(s)<H2O(l)< H2O(g)
水的聚集状态变化时的焓变示意图
熔化
蒸发
焓(H)增大
同种物质聚集状态不同,焓不同
思考﹒ 讨论
热化学方程式中,为何要标明物质的状态?
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=________ kJ/mol
H1=-483.6 kJ/mol
H2=-571.6 kJ/mol
2H2 (g) + O2 (g)
2H2O (g)
H
H2O (l)
-571.6
热化学方程式书写时,要标注物质的状态!
固体
(s)
液体
(l)
气体
(g)
溶液
(aq)
思考﹒ 讨论
如反应中H2与O2的量减半,ΔH还一样吗?
2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6 kJ/mol
H2(g)+ O2(g)=H2O(g) ΔH2=_______ kJ/mol
1
2
-241.8
1
2
×
1
2
×
1
2
×
1
2
×
H 的值与计量数成正比!
热化学方程式中
各物质前的化学计量数
可以是整数或分数
不表示分子个数
只表示物质的量!
H数值与
化学计量数成正比
化学计量数加倍,ΔH值也加倍
思考﹒ 讨论
同一反应(物质的状态及量均相同)在不同温度、压强下反应,焓变是否相同?
H2(g) + I2(g) 2HI(g) H= 9.48 kJ/mol
101kPa
100 oC
H2(g) + I2(g) 2HI(g) H= 14.9 kJ/mol
101kPa
25 oC
反应温度、压强不同
其 H 也不同
若反应在25 oC、101 kPa进行,该条件可不注明,其他温度和压强必须注明
除去温度、压强,其他条件不需标注
深化理解
ΔH中的单位mol-1代表什么含义?
阅读教材P9
小试身手
CH4可做火箭推进剂的燃料,0.5 mol CH4完全燃烧生成液体水放出445 kJ的热量,请写出热化学方程式。
A.CH4+2O2=CO2(g)+2H2O ΔH=-890J·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890 J·mol-1
C. CH4(g)+O2(g)=CO2(g) +2H2O(l) ΔH=-890 kJ
D.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) ΔH=-445 J·mol-1
未标物质状态
符号标错
单位标错
解后反思
一审状态
二审符号(“+”“-”)
三审数值
四审单位
热化学方程式
3
热化学方程式书写注意事项
①
②
③
④
状态
标明所有物质的状态
固体(s) 液体(l) 气体(g)
溶液(aq)
防标错或漏标
化学计量数
表示物质的量(整数或分数)
与焓变数值对应
焓变(ΔH)
防漏标“+”“-”
防ΔH的数值错误,与计量数成正比
防漏掉单位kJ·mol-1或错写成kJ
条件
温度 压强(25℃,101kPa时可不注明)
其他反应条件及“↑”“↓”不写
写出下列反应的热化学方程式:
(1) 1 mol C与水蒸气反应,生成CO和H2,吸收131.3 kJ的热量
(2) 0.5 mol Cu与氧气反应,生成CuO,放出78.5 kJ的热量
C(s)+H2O (g)=CO (g) +H2(g)
H=+131.3 kJ/mol
2Cu(s)+O2 (g)=2CuO (s)
H=-157.0 kJ/mol
请你试一试
H2是人类理想的能源,1 g H2完全燃烧生成液体水放出142.6 kJ的热量,
请写出热化学方程式。
请你试一试
2H2(g)+O2(g)=2H2O(l) ΔH=-570.4 kJ·mol-1
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+O2(g) ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+O2(g)=H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ
看我七十二变
考考你自己
家用液化气的主要成份是丙烷、丁烷、丙烯等,将0.0112 m3(标准状况下)丙烷气体完全燃烧,生成CO2气体和液态水,放出1 108.9 kJ热量。表示上述反应的热化学方程式正确的是
A.C3H8(g)+5O2(g)=3CO2(g) +4H2O(l) ΔH=-1 108.9 J·mol-1
B.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=+2 217.8 J·mol-1
C.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=+1 108.9 J·mol-1
D.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2217.8 J·mol-1
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
反应热与焓变
反应热
体系
被研究的物质系统
环境
体系相互影响的其他部分
反应热
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
焓变
定义
意义
反应热在等压条件下等于反应的焓变
原因
宏观:体系内能的变化
ΔH=H生成物-H反应物
微观:断键吸热 成键放热
放热反应ΔH<0
吸热反应ΔH>0
课堂小结
课堂小结
热化学方程式
标明所有物质的状态,防标错或漏标
1
2
3
化学计量数可为分数
关于ΔH:
①防漏标“+”或“-”
②防ΔH的数值错误,ΔH应与化学计量数成正比
③防漏掉单位kJ·mol-1或错写成kJ
A.2SO2+O2=2SO3 ΔH=-196.6 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=+241.8 kJ·mol-1
C.2H2(g)+O2(g)= 2H2O(l) ΔH=-571.6 kJ·mol-1
D.C(s)+O2(g)= CO2(g) ΔH=+393.5 kJ·mol-1
下列热化学方程式书写正确的是
成功体验
判断下列热化学方程式书写是否正确:
1. 12 g石墨转化为CO时,放出11.05 kJ的热量
2C(石墨,s)+O2(g)=2CO(g) H=-110.5 kJ/mol
2. 1 mol液态肼与氧气中完全燃烧生成氮和水蒸气,放出642 kJ的热量
N2H4(l)+O2(g)=N2(g) +2H2O(g) H=+642 kJ/mol
3. 已知:H2(g)+1/2O2(g)=H2O(l) H=-286 kJ/mol
则2H2O (l)=2H2(g)+O2 (g) H=+572 kJ/mol
看谁做得既准又快
