第二章第2节 第1课时分子的空间结构教案 高中化学人教版(2019)选择性必修二
文档属性
| 名称 | 第二章第2节 第1课时分子的空间结构教案 高中化学人教版(2019)选择性必修二 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-10 11:57:26 | ||
图片预览

文档简介
分子的空间结构
第1课时
教学目标
1. 知道分子的结构是可以测定的,红外光谱技术是测定物质结构的基本方法;能说明红外光谱等实验手段在物质结构研究中的应用。
2. 结合实例了解共价分子具有特定的空间结构,体会共价分子的多样性和复杂性。能借助实物模型等建立对分子的空间结构的直观认识。
教学重难点
1.通过搭建模型类比微观电子对相互排斥,理解2、3、4对电子互相排斥时电子对在空间的形状。
2.理解电子对在空间的分布与分子形状的关联。
教学过程
一、新课导入
【科学史话】
我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔生理学或医学奖。你了解青蒿素分子的组成和结构测定的方法吗?
从青蒿素的结构式中我们可以看到,青蒿素包含的原子多,原子连接关系复杂,还含有过氧键,醚键,酯基等官能团。
我国研究人员从1973年初开始测定青蒿素的组成与结构,研究工作于1976年基本结束,历时四年。
下面让我们一起看看科学家运用了怎样的手段与方法,测定出了这些肉眼看不见的分子结构。
二、讲授新课
一、分子结构的测定
1. 质谱
在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,对这些峰进行系统分析,便可得知样品分子的相对分子质量。
研究人员利用高分辨质谱仪测定出青蒿素的相对分子质量为282.33。元素分析结果表明,青蒿素分子中含有63.8%的C、7.9%的H和28.3%的O。结合以上数据可推知,青蒿素的分子式为(C15H22O5)。
2. 红外光谱
有机物的同分异构现象是普遍且复杂的。知道分子式后需要进一步知道其中含有怎样的官能团。通过红外光谱的可以得到这一重要信息。
分子中的原子不是固定不动的,而是不断地振动着。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
这些吸收峰和化学键种类、振动方式是有对应关系的,利用这种关系,就可以分析出分子中含有的化学键和官能团信息。
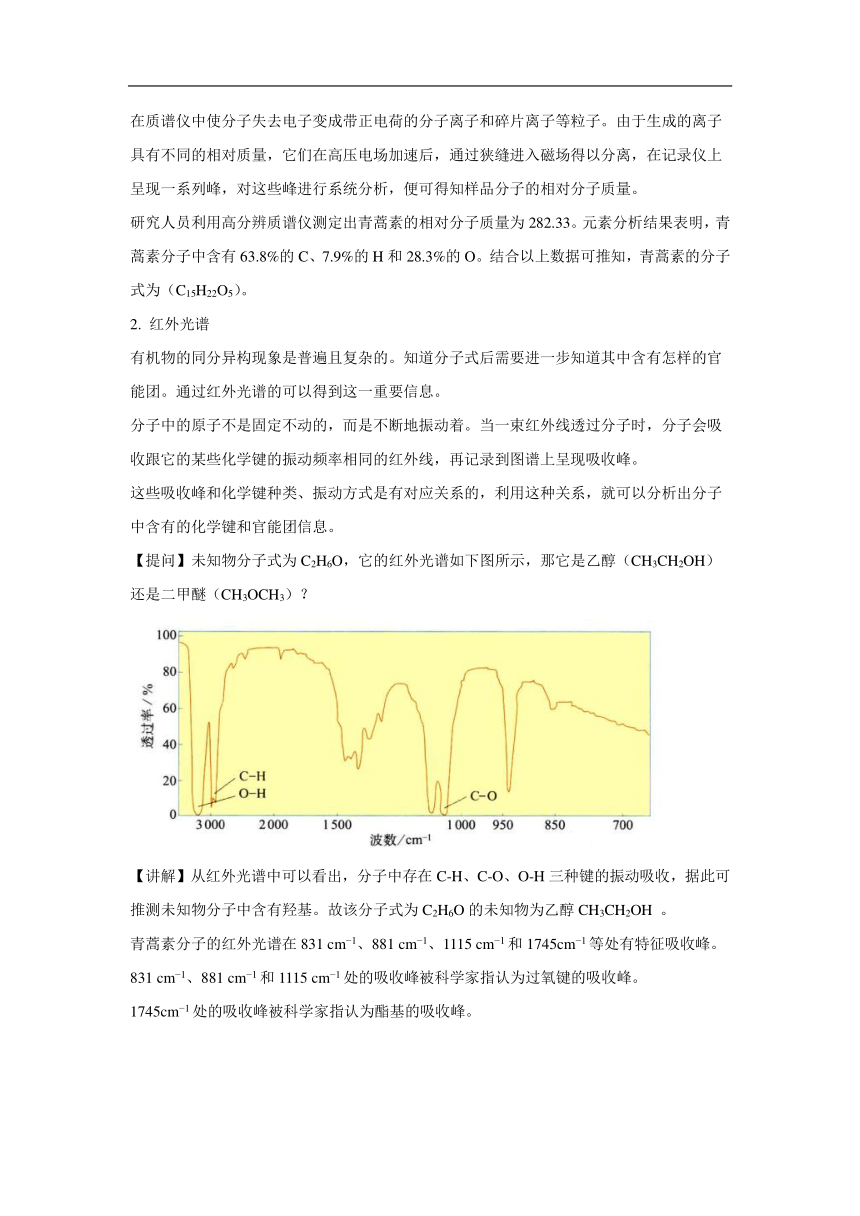
【提问】未知物分子式为C2H6O,它的红外光谱如下图所示,那它是乙醇(CH3CH2OH)还是二甲醚(CH3OCH3)?
【讲解】从红外光谱中可以看出,分子中存在C-H、C-O、O-H三种键的振动吸收,据此可推测未知物分子中含有羟基。故该分子式为C2H6O的未知物为乙醇CH3CH2OH 。
青蒿素分子的红外光谱在831 cm 1、881 cm 1、1115 cm 1和1745cm 1等处有特征吸收峰。
831 cm 1、881 cm 1和1115 cm 1处的吸收峰被科学家指认为过氧键的吸收峰。
1745cm 1处的吸收峰被科学家指认为酯基的吸收峰。
二、多样的分子空间结构
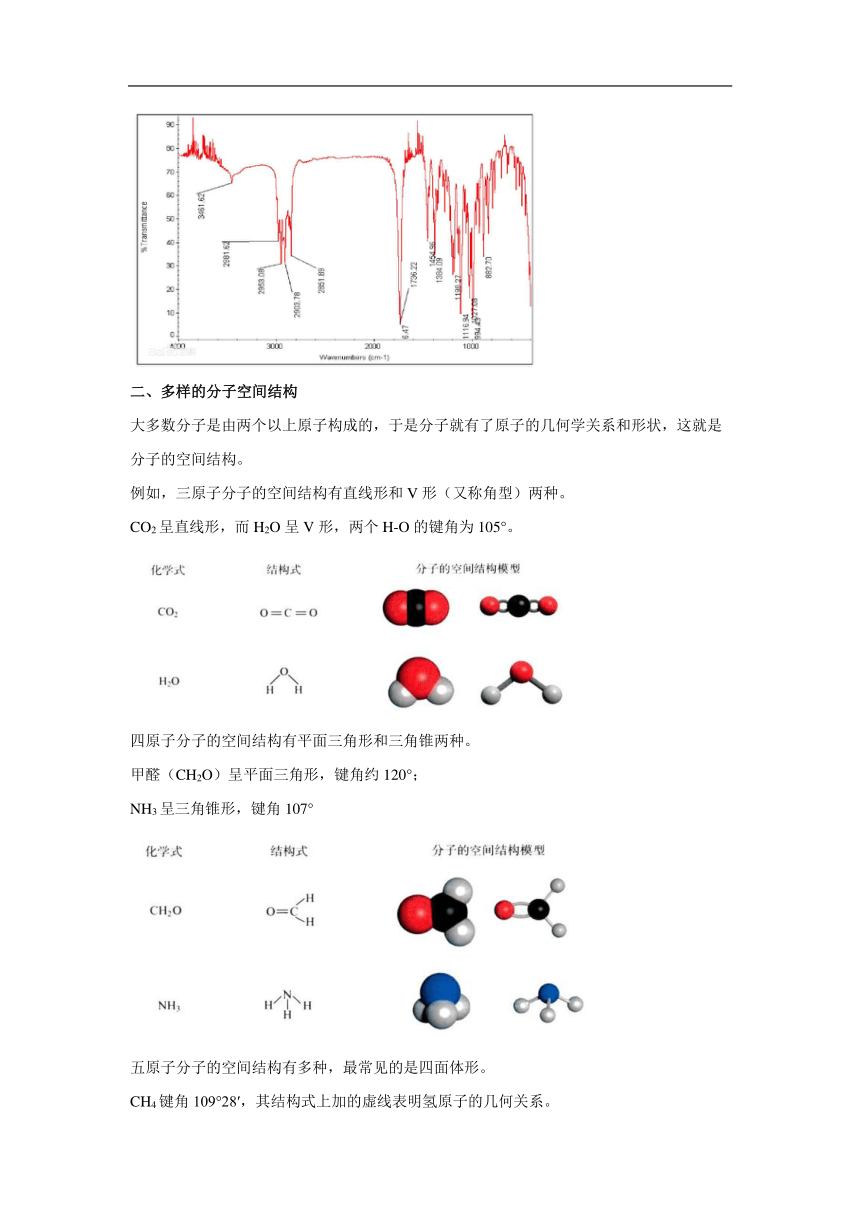
大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
例如,三原子分子的空间结构有直线形和V形(又称角型)两种。
CO2呈直线形,而H2O呈V形,两个H-O的键角为105°。
四原子分子的空间结构有平面三角形和三角锥两种。
甲醛(CH2O)呈平面三角形,键角约120°;
NH3呈三角锥形,键角107°
五原子分子的空间结构有多种,最常见的是四面体形。
CH4键角109°28′,其结构式上加的虚线表明氢原子的几何关系。
对于更多原子组成的分子,他们的空间结构更为复杂和丰富,例如
分子空间结构与其稳定性有关。例如,S8像顶皇冠,如果把其中一个向上的硫原子倒转向下,则不如皇冠式稳定;椅式C6H12比船式C6H12稳定。
三、价层电子对互斥模型
【交流分享】
通过上面对分子空间结构多样性和测定方法的介绍,大家还能提出怎样的问题?
1.CO2和H2O都是三原子分子,为什么CO2呈直线形而H2O呈V形?
2.CH2O和NH3都是四原子分子,为什么CH2O呈平面三角形而NH3呈三角锥形?
3.相同原子的分子空间结构不同,是什么因素决定了不同的结果?
4.人类测量、了解分子的空间结构有何意义?
5.把每个分子或离子都测定一遍,这样的工作量大到难以完成,是否有便捷的方法可以对它们的空间结构做出预测?
【思维启迪】
研究分子的空间结构有助于我们了解分子的性质,进而了解物质的宏观性质。比如物质的溶解性,蛋白质精密的空间结构对于它发挥生理功能的影响等。
有一种比较简单的理论叫做价层电子对互斥模型(VSEPR),它可以用来预测分子的空间结构。该理论的的核心观点为:
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。多重键只计算其中的σ键电子对,不计π键电子对。
【模型制作演示】
为什么CH4呈四面体而不是正方形?下面我们通过搭建模型的方式体会、验证。
将4个大小相同的气球系在一起,它会自动排列成什么形状?
四个气球会自动排列成为四面体的形状。这是由于气球之间相互排斥,彼此要尽可能远离。
CH4中的四根C-H σ键是4对共用电子,电子对均为负电,彼此之间的排斥与气球的排斥类似,因此4对电子也彼此远离,最终CH4呈现出了最稳定的正四面体形。
【模型制作】
请大家运用手头的气球,变换气球的个数分别为2个和3个,观察它们会自然排列成怎样的空间结构。
【总结】
运用类比的方法,总计归纳价层电子对(气球)数量分别为2、3、4时,
电子对在空间的排列分布形状,完成下列表格。
价层电子对数 电子对空间结构
2 直线形
3 平面三角形
4 四面体形
【提问】(1)NH3为什么是三角锥形而不是平面三角形?
【讲解】N原子共5个价电子,其中3个单电子,与3个H形成3个σ键,还有一对孤对电子。VSEPR中价层电子对除了共用的σ键电子对,还包含中心原子上的孤电子对。
【提问】(2)为什么在考虑分子形状时要先考虑中心孤对电子排斥,但是最终确定分子形状时又要将其略去?
【讲解】因孤对电子独属中心原子,而共用电子对共属于中心原子,它们均在中心原子的周围,它们之间的排斥是客观存在的。
分子形状描述的是组成分子的原子之间的几何学关系,与孤对电子无关。
事实上,在用仪器(如晶体X射线衍射)测定分子形状时,观察到的是原子之间的位置关系,观察不到孤对电子。
【提问】(3)CH4和NH3中中心原子的价电子对数均为4,为何H-C-H的键角为109°28′,而H-N-H的键角为107°?
【讲解】相比成键电子对受到左右两端带正电的原子核的吸引,而孤对电子只受到一端原子核的吸引。相比之下,孤对电子对较“胖”一些,占据较大的空间;而成键电子对较“瘦”,占据较小的空间。孤电子对与成键电子对之间的斥力也要大一些。N上的孤电子对对成键电子对“挤压”的更厉害,使键角减小。
【模型制作】
请利用橡皮泥和牙签制作CH4和NH3的空间结构模型。
注意NH3中孤对电子的影响,正确表示分子中的键角。
与小组的同学分享交流你的成果。
三、课堂小结
1.分子的微观结构是丰富多彩的,分子的空间结构与其性质紧密相连。
2.科学家研究分子结构的典型特征(如共价键的振动),建立了系统的方法,通过诸多现代仪器可以测定分子结构。
3.红外光谱、晶体X射线衍射、质谱都是常用的研究分析手段。
4.价层电子对互斥模型认为分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。价层电子对数量不同时,他们在空间最稳定的形状也不同。2对为直线形,3对为平面三角形,4对为四面体形。
价层电子对中孤对电子在考虑分子形状时要略去。
第1课时
教学目标
1. 知道分子的结构是可以测定的,红外光谱技术是测定物质结构的基本方法;能说明红外光谱等实验手段在物质结构研究中的应用。
2. 结合实例了解共价分子具有特定的空间结构,体会共价分子的多样性和复杂性。能借助实物模型等建立对分子的空间结构的直观认识。
教学重难点
1.通过搭建模型类比微观电子对相互排斥,理解2、3、4对电子互相排斥时电子对在空间的形状。
2.理解电子对在空间的分布与分子形状的关联。
教学过程
一、新课导入
【科学史话】
我国科学家屠呦呦因成功提取青蒿素而获得2015年诺贝尔生理学或医学奖。你了解青蒿素分子的组成和结构测定的方法吗?
从青蒿素的结构式中我们可以看到,青蒿素包含的原子多,原子连接关系复杂,还含有过氧键,醚键,酯基等官能团。
我国研究人员从1973年初开始测定青蒿素的组成与结构,研究工作于1976年基本结束,历时四年。
下面让我们一起看看科学家运用了怎样的手段与方法,测定出了这些肉眼看不见的分子结构。
二、讲授新课
一、分子结构的测定
1. 质谱
在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,对这些峰进行系统分析,便可得知样品分子的相对分子质量。
研究人员利用高分辨质谱仪测定出青蒿素的相对分子质量为282.33。元素分析结果表明,青蒿素分子中含有63.8%的C、7.9%的H和28.3%的O。结合以上数据可推知,青蒿素的分子式为(C15H22O5)。
2. 红外光谱
有机物的同分异构现象是普遍且复杂的。知道分子式后需要进一步知道其中含有怎样的官能团。通过红外光谱的可以得到这一重要信息。
分子中的原子不是固定不动的,而是不断地振动着。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
这些吸收峰和化学键种类、振动方式是有对应关系的,利用这种关系,就可以分析出分子中含有的化学键和官能团信息。
【提问】未知物分子式为C2H6O,它的红外光谱如下图所示,那它是乙醇(CH3CH2OH)还是二甲醚(CH3OCH3)?
【讲解】从红外光谱中可以看出,分子中存在C-H、C-O、O-H三种键的振动吸收,据此可推测未知物分子中含有羟基。故该分子式为C2H6O的未知物为乙醇CH3CH2OH 。
青蒿素分子的红外光谱在831 cm 1、881 cm 1、1115 cm 1和1745cm 1等处有特征吸收峰。
831 cm 1、881 cm 1和1115 cm 1处的吸收峰被科学家指认为过氧键的吸收峰。
1745cm 1处的吸收峰被科学家指认为酯基的吸收峰。
二、多样的分子空间结构
大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。
例如,三原子分子的空间结构有直线形和V形(又称角型)两种。
CO2呈直线形,而H2O呈V形,两个H-O的键角为105°。
四原子分子的空间结构有平面三角形和三角锥两种。
甲醛(CH2O)呈平面三角形,键角约120°;
NH3呈三角锥形,键角107°
五原子分子的空间结构有多种,最常见的是四面体形。
CH4键角109°28′,其结构式上加的虚线表明氢原子的几何关系。
对于更多原子组成的分子,他们的空间结构更为复杂和丰富,例如
分子空间结构与其稳定性有关。例如,S8像顶皇冠,如果把其中一个向上的硫原子倒转向下,则不如皇冠式稳定;椅式C6H12比船式C6H12稳定。
三、价层电子对互斥模型
【交流分享】
通过上面对分子空间结构多样性和测定方法的介绍,大家还能提出怎样的问题?
1.CO2和H2O都是三原子分子,为什么CO2呈直线形而H2O呈V形?
2.CH2O和NH3都是四原子分子,为什么CH2O呈平面三角形而NH3呈三角锥形?
3.相同原子的分子空间结构不同,是什么因素决定了不同的结果?
4.人类测量、了解分子的空间结构有何意义?
5.把每个分子或离子都测定一遍,这样的工作量大到难以完成,是否有便捷的方法可以对它们的空间结构做出预测?
【思维启迪】
研究分子的空间结构有助于我们了解分子的性质,进而了解物质的宏观性质。比如物质的溶解性,蛋白质精密的空间结构对于它发挥生理功能的影响等。
有一种比较简单的理论叫做价层电子对互斥模型(VSEPR),它可以用来预测分子的空间结构。该理论的的核心观点为:
分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
价层电子对是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。多重键只计算其中的σ键电子对,不计π键电子对。
【模型制作演示】
为什么CH4呈四面体而不是正方形?下面我们通过搭建模型的方式体会、验证。
将4个大小相同的气球系在一起,它会自动排列成什么形状?
四个气球会自动排列成为四面体的形状。这是由于气球之间相互排斥,彼此要尽可能远离。
CH4中的四根C-H σ键是4对共用电子,电子对均为负电,彼此之间的排斥与气球的排斥类似,因此4对电子也彼此远离,最终CH4呈现出了最稳定的正四面体形。
【模型制作】
请大家运用手头的气球,变换气球的个数分别为2个和3个,观察它们会自然排列成怎样的空间结构。
【总结】
运用类比的方法,总计归纳价层电子对(气球)数量分别为2、3、4时,
电子对在空间的排列分布形状,完成下列表格。
价层电子对数 电子对空间结构
2 直线形
3 平面三角形
4 四面体形
【提问】(1)NH3为什么是三角锥形而不是平面三角形?
【讲解】N原子共5个价电子,其中3个单电子,与3个H形成3个σ键,还有一对孤对电子。VSEPR中价层电子对除了共用的σ键电子对,还包含中心原子上的孤电子对。
【提问】(2)为什么在考虑分子形状时要先考虑中心孤对电子排斥,但是最终确定分子形状时又要将其略去?
【讲解】因孤对电子独属中心原子,而共用电子对共属于中心原子,它们均在中心原子的周围,它们之间的排斥是客观存在的。
分子形状描述的是组成分子的原子之间的几何学关系,与孤对电子无关。
事实上,在用仪器(如晶体X射线衍射)测定分子形状时,观察到的是原子之间的位置关系,观察不到孤对电子。
【提问】(3)CH4和NH3中中心原子的价电子对数均为4,为何H-C-H的键角为109°28′,而H-N-H的键角为107°?
【讲解】相比成键电子对受到左右两端带正电的原子核的吸引,而孤对电子只受到一端原子核的吸引。相比之下,孤对电子对较“胖”一些,占据较大的空间;而成键电子对较“瘦”,占据较小的空间。孤电子对与成键电子对之间的斥力也要大一些。N上的孤电子对对成键电子对“挤压”的更厉害,使键角减小。
【模型制作】
请利用橡皮泥和牙签制作CH4和NH3的空间结构模型。
注意NH3中孤对电子的影响,正确表示分子中的键角。
与小组的同学分享交流你的成果。
三、课堂小结
1.分子的微观结构是丰富多彩的,分子的空间结构与其性质紧密相连。
2.科学家研究分子结构的典型特征(如共价键的振动),建立了系统的方法,通过诸多现代仪器可以测定分子结构。
3.红外光谱、晶体X射线衍射、质谱都是常用的研究分析手段。
4.价层电子对互斥模型认为分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。价层电子对数量不同时,他们在空间最稳定的形状也不同。2对为直线形,3对为平面三角形,4对为四面体形。
价层电子对中孤对电子在考虑分子形状时要略去。
