第二章第2节 第3课时分子的空间结构教案 高中化学人教版(2019)选择性必修二
文档属性
| 名称 | 第二章第2节 第3课时分子的空间结构教案 高中化学人教版(2019)选择性必修二 |

|
|
| 格式 | docx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-10 11:58:42 | ||
图片预览

文档简介
分子的空间结构
第3课时
教学目标
1. 结合实例了解杂化轨道理论的要点和类型(sp3、sp2、sp),能运用杂化轨道理论解释简单共价分子和离子的空间结构。
教学重难点
1.应用杂化轨道理论解释分子的空间结构,尤其是含有孤电子对的分子的空间结构。
2.VSEPR模型与杂化轨道理论的关联。
教学过程
一、新课导入
价层电子对互斥模型预测CH4空间结构为正四面体形,且实验测得甲烷分子中的4个C-H键键长相同,H-C-H的键角为109°28′。
依据价键理论,C的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们与4个氢原子的1s原子轨道重叠,不可能得到正四面体形的甲烷分子。
至此出现了两个矛盾的事实,那怎样解释甲烷分子的空间结构为正四面体呢?
二、讲授新课
四、杂化轨道理论
1. 杂化轨道理论的提出与要点
鲍林为了解决分子空间结构与价键理论的矛盾,提出了杂化轨道理论。
它的要点是:
原子间结合形成分子时,中心原子的若干价层电子轨道会发生混杂,在混杂时保持轨道总数不变,但是得到了等量的方向不同的轨道。这些轨道用于形成σ键或放孤对电子。
分子最终的空间结构与杂化的方式有关,下面我们通过典型的例子进一步探讨该理论。
2. sp3杂化
当C与4个H形成CH4时,C的2s轨道和3个2p轨道会发生混杂,混杂后得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28′,称为sp3杂化轨道。
杂化轨道符号sp3表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
当C跟4个H结合时,C以4个sp3杂化轨道分别与4个H的1s轨道重叠,形成4个C-H σ键,因此呈正四面体形的空间结构。
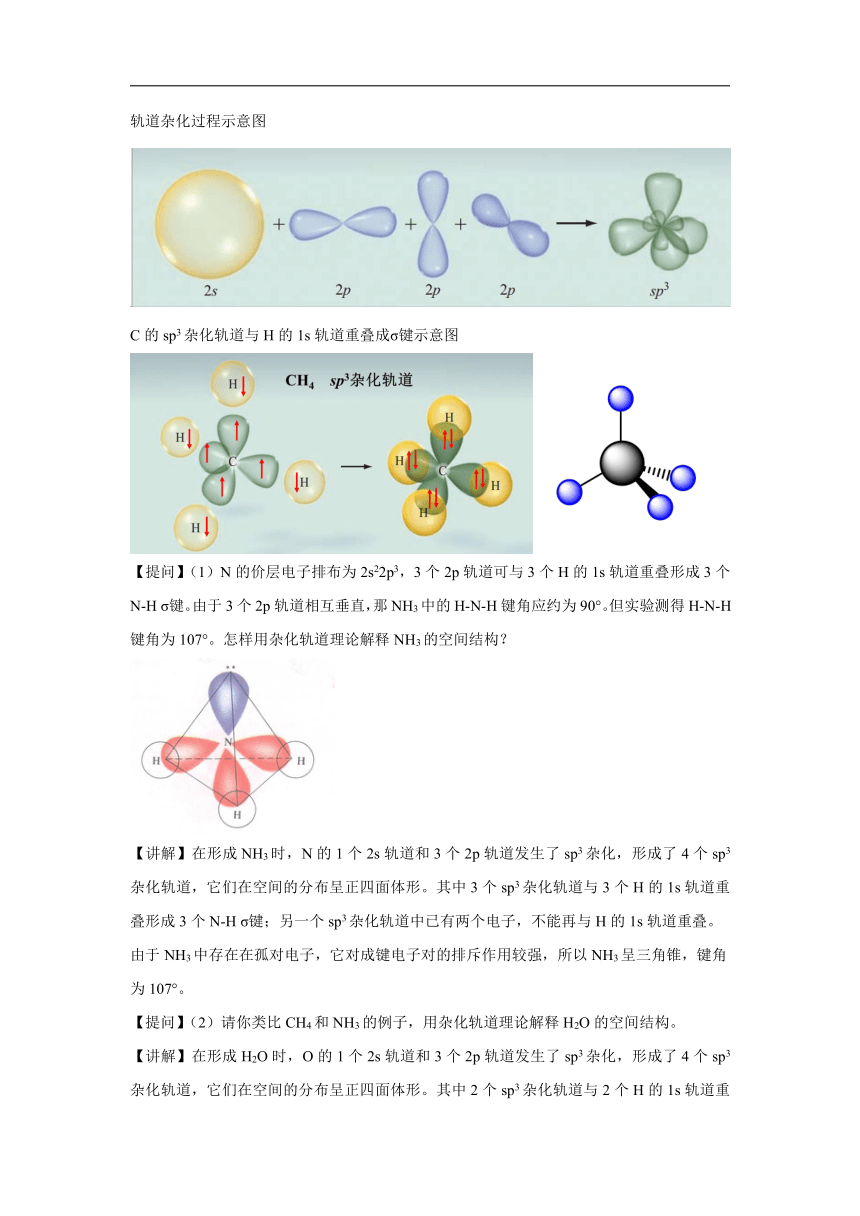
轨道杂化过程示意图
C的sp3杂化轨道与H的1s轨道重叠成σ键示意图
【提问】(1)N的价层电子排布为2s22p3,3个2p轨道可与3个H的1s轨道重叠形成3个N-H σ键。由于3个2p轨道相互垂直,那NH3中的H-N-H键角应约为90°。但实验测得H-N-H键角为107°。怎样用杂化轨道理论解释NH3的空间结构?
【讲解】在形成NH3时,N的1个2s轨道和3个2p轨道发生了sp3杂化,形成了4个sp3杂化轨道,它们在空间的分布呈正四面体形。其中3个sp3杂化轨道与3个H的1s轨道重叠形成3个N-H σ键;另一个sp3杂化轨道中已有两个电子,不能再与H的1s轨道重叠。
由于NH3中存在在孤对电子,它对成键电子对的排斥作用较强,所以NH3呈三角锥,键角为107°。
【提问】(2)请你类比CH4和NH3的例子,用杂化轨道理论解释H2O的空间结构。
【讲解】在形成H2O时,O的1个2s轨道和3个2p轨道发生了sp3杂化,形成了4个sp3杂化轨道,它们在空间的分布呈正四面体形。其中2个sp3杂化轨道与2个H的1s轨道重叠形成2个O-H σ键;另两个sp3杂化轨道中已各有两个电子,不能再与H的1s轨道重叠。
由于H2O中存在在2对孤对电子,它们对成键电子对的排斥作用较强,所以H2O呈V形,键角为105°。
除sp3杂化外,还有sp2杂化轨道和sp杂化轨道。
sp2杂化轨道由1个s轨道和2个p轨道杂化而得。sp2杂化轨道得到三个夹角为120°的平面三角形杂化轨道。
sp杂化轨道由1个s轨道和1个p轨道杂化而得。sp杂化轨道得到两个夹角为180°的直线形杂化轨道。
在这两种杂化形式中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道则用于形成σ键或用来容纳未参与成键的孤电子对。
3. sp2杂化
下面我们以BF3为例介绍sp2杂化
当B与3个F形成BF3时,B的2s轨道和2个2p轨道会发生混杂,混杂后得到3个新的能量相同、方向不同的轨道,各指向平面三角形的3个顶角,夹角120°。
当B跟3个F结合时,B以3个sp2杂化轨道分别与3个F的2p轨道重叠,形成3个B-F σ键,因此呈平面三角形的空间结构。
轨道杂化过程示意图
B的sp2杂化轨道与F的2p轨道重叠成σ键示意图
4. sp杂化
下面我们以BeCl2为例介绍sp杂化
当Be与2个Cl形成BeCl2时,Be的2s轨道和1个2p轨道会发生混杂,混杂后得到2个新的能量相同、方向不同的轨道,各指向直线段的2个顶点,夹角180°。
当Be跟2个Cl结合时,Be以2个sp杂化轨道分别与2个Cl的3p轨道重叠,形成2个Be-Cl σ键,因此呈直线形的空间结构。
轨道杂化过程示意图
Be的sp杂化轨道与Cl的3p轨道重叠成σ键示意图
【提问】(3)通过上面CH4、NH3、H2O、BF3、BeCl2的例子,你认为杂化轨道理论与VSEPR模型之间有何联系,概括归纳你的发现。
【讲解】杂化轨道理论中,通过杂化形成的杂化轨道用于形成σ键和放孤对电子。
在VSEPR模型中,确定VSEPR模型由σ键电子对和孤电子对数量总和决定。
因此VSEPR模型中价层电子对总数与原子的杂化形式有一一对应关系。
【思维启迪】
VSEPR模型与原子的杂化形式的对应关系如下图所示:
通过上表的对应关系,我们可以归纳得出:
价层电子对总数为4时,VSEPR模型为四面体,中心原子的杂化轨道类型为sp3;
价层电子对总数为3时,VSEPR模型为平面三角形,中心原子的杂化轨道类型为sp2;
价层电子对总数为2时,VSEPR模型为直线形,中心原子的杂化轨道类型为sp;
【典型例题】
例1. 确定和H3O+的中心原子的杂化轨道类型。
先确定和H3O+的VSEPR模型,然后再确定中心原子N和O的杂化轨道类型。
的中心原子N的孤对电子数为0,价层电子对数为3,VSEPR模型为平面三角形,中心原子N的杂化轨道类型为sp2杂化。
H3O+的中心原子O的孤对电子数为1,价层电子对数为4,VSEPR模型为四面体形,中心原子O的杂化轨道类型为sp3杂化。
三、课堂小结
1. 杂化轨道理论用于解释分子的空间结构:中心原子的原子内能量相近的原子轨道重新组合为具有不同空间分布特点的新的杂化轨道,使得分子呈现不同的空间结构。杂化轨道只能用于形成σ键或容纳孤电子对,形成π键的电子只能位于未杂化的原子轨道上。
2. VSEPR模型用于预测分子的空间结构。二者通过价层电子对总数这一参数联系。因此,如果没有实验数据得出分子的空间结构,可以借助价层电子对互斥模型预测分子的空间结构,从而确定分子中中心原子的杂化轨道类型。
第3课时
教学目标
1. 结合实例了解杂化轨道理论的要点和类型(sp3、sp2、sp),能运用杂化轨道理论解释简单共价分子和离子的空间结构。
教学重难点
1.应用杂化轨道理论解释分子的空间结构,尤其是含有孤电子对的分子的空间结构。
2.VSEPR模型与杂化轨道理论的关联。
教学过程
一、新课导入
价层电子对互斥模型预测CH4空间结构为正四面体形,且实验测得甲烷分子中的4个C-H键键长相同,H-C-H的键角为109°28′。
依据价键理论,C的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们与4个氢原子的1s原子轨道重叠,不可能得到正四面体形的甲烷分子。
至此出现了两个矛盾的事实,那怎样解释甲烷分子的空间结构为正四面体呢?
二、讲授新课
四、杂化轨道理论
1. 杂化轨道理论的提出与要点
鲍林为了解决分子空间结构与价键理论的矛盾,提出了杂化轨道理论。
它的要点是:
原子间结合形成分子时,中心原子的若干价层电子轨道会发生混杂,在混杂时保持轨道总数不变,但是得到了等量的方向不同的轨道。这些轨道用于形成σ键或放孤对电子。
分子最终的空间结构与杂化的方式有关,下面我们通过典型的例子进一步探讨该理论。
2. sp3杂化
当C与4个H形成CH4时,C的2s轨道和3个2p轨道会发生混杂,混杂后得到4个新的能量相同、方向不同的轨道,各指向正四面体的4个顶角,夹角109°28′,称为sp3杂化轨道。
杂化轨道符号sp3表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
当C跟4个H结合时,C以4个sp3杂化轨道分别与4个H的1s轨道重叠,形成4个C-H σ键,因此呈正四面体形的空间结构。
轨道杂化过程示意图
C的sp3杂化轨道与H的1s轨道重叠成σ键示意图
【提问】(1)N的价层电子排布为2s22p3,3个2p轨道可与3个H的1s轨道重叠形成3个N-H σ键。由于3个2p轨道相互垂直,那NH3中的H-N-H键角应约为90°。但实验测得H-N-H键角为107°。怎样用杂化轨道理论解释NH3的空间结构?
【讲解】在形成NH3时,N的1个2s轨道和3个2p轨道发生了sp3杂化,形成了4个sp3杂化轨道,它们在空间的分布呈正四面体形。其中3个sp3杂化轨道与3个H的1s轨道重叠形成3个N-H σ键;另一个sp3杂化轨道中已有两个电子,不能再与H的1s轨道重叠。
由于NH3中存在在孤对电子,它对成键电子对的排斥作用较强,所以NH3呈三角锥,键角为107°。
【提问】(2)请你类比CH4和NH3的例子,用杂化轨道理论解释H2O的空间结构。
【讲解】在形成H2O时,O的1个2s轨道和3个2p轨道发生了sp3杂化,形成了4个sp3杂化轨道,它们在空间的分布呈正四面体形。其中2个sp3杂化轨道与2个H的1s轨道重叠形成2个O-H σ键;另两个sp3杂化轨道中已各有两个电子,不能再与H的1s轨道重叠。
由于H2O中存在在2对孤对电子,它们对成键电子对的排斥作用较强,所以H2O呈V形,键角为105°。
除sp3杂化外,还有sp2杂化轨道和sp杂化轨道。
sp2杂化轨道由1个s轨道和2个p轨道杂化而得。sp2杂化轨道得到三个夹角为120°的平面三角形杂化轨道。
sp杂化轨道由1个s轨道和1个p轨道杂化而得。sp杂化轨道得到两个夹角为180°的直线形杂化轨道。
在这两种杂化形式中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道则用于形成σ键或用来容纳未参与成键的孤电子对。
3. sp2杂化
下面我们以BF3为例介绍sp2杂化
当B与3个F形成BF3时,B的2s轨道和2个2p轨道会发生混杂,混杂后得到3个新的能量相同、方向不同的轨道,各指向平面三角形的3个顶角,夹角120°。
当B跟3个F结合时,B以3个sp2杂化轨道分别与3个F的2p轨道重叠,形成3个B-F σ键,因此呈平面三角形的空间结构。
轨道杂化过程示意图
B的sp2杂化轨道与F的2p轨道重叠成σ键示意图
4. sp杂化
下面我们以BeCl2为例介绍sp杂化
当Be与2个Cl形成BeCl2时,Be的2s轨道和1个2p轨道会发生混杂,混杂后得到2个新的能量相同、方向不同的轨道,各指向直线段的2个顶点,夹角180°。
当Be跟2个Cl结合时,Be以2个sp杂化轨道分别与2个Cl的3p轨道重叠,形成2个Be-Cl σ键,因此呈直线形的空间结构。
轨道杂化过程示意图
Be的sp杂化轨道与Cl的3p轨道重叠成σ键示意图
【提问】(3)通过上面CH4、NH3、H2O、BF3、BeCl2的例子,你认为杂化轨道理论与VSEPR模型之间有何联系,概括归纳你的发现。
【讲解】杂化轨道理论中,通过杂化形成的杂化轨道用于形成σ键和放孤对电子。
在VSEPR模型中,确定VSEPR模型由σ键电子对和孤电子对数量总和决定。
因此VSEPR模型中价层电子对总数与原子的杂化形式有一一对应关系。
【思维启迪】
VSEPR模型与原子的杂化形式的对应关系如下图所示:
通过上表的对应关系,我们可以归纳得出:
价层电子对总数为4时,VSEPR模型为四面体,中心原子的杂化轨道类型为sp3;
价层电子对总数为3时,VSEPR模型为平面三角形,中心原子的杂化轨道类型为sp2;
价层电子对总数为2时,VSEPR模型为直线形,中心原子的杂化轨道类型为sp;
【典型例题】
例1. 确定和H3O+的中心原子的杂化轨道类型。
先确定和H3O+的VSEPR模型,然后再确定中心原子N和O的杂化轨道类型。
的中心原子N的孤对电子数为0,价层电子对数为3,VSEPR模型为平面三角形,中心原子N的杂化轨道类型为sp2杂化。
H3O+的中心原子O的孤对电子数为1,价层电子对数为4,VSEPR模型为四面体形,中心原子O的杂化轨道类型为sp3杂化。
三、课堂小结
1. 杂化轨道理论用于解释分子的空间结构:中心原子的原子内能量相近的原子轨道重新组合为具有不同空间分布特点的新的杂化轨道,使得分子呈现不同的空间结构。杂化轨道只能用于形成σ键或容纳孤电子对,形成π键的电子只能位于未杂化的原子轨道上。
2. VSEPR模型用于预测分子的空间结构。二者通过价层电子对总数这一参数联系。因此,如果没有实验数据得出分子的空间结构,可以借助价层电子对互斥模型预测分子的空间结构,从而确定分子中中心原子的杂化轨道类型。
