第四章第二节 电解池 第1课时 教案 高中化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章第二节 电解池 第1课时 教案 高中化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 309.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-10 12:05:08 | ||
图片预览

文档简介
第二节 电解池
第1课时
教材分析
电解池是借助于电能,使不能自发进行的氧化还原反应能够发生,从而使电能转化为化学能的装置。它的应用相当广泛,由此形成的工业也很多,如电镀、电解、电冶金电池充电等。本节课是学生学习原电池知识后的自然延伸,有助于学生更加系统地学习电化学知识,并为后续学习电化学知识在生产、生活和科研中的重要作用打好理论基础。
学情分析
本课时内容选自选择性必修1《化学反应原理》第四章第二节。通过必修2的学习,学生已经掌握了简单的原电池知识;通过选择性必修1《化学反应原理)第四章第一节的学习,学生已经具备借助氧化还原理论、金属活动性顺序和物理学中的电学知识判断原电池正、负极以及设计原电池和书写原电池电极反应的能力。因此,在本节课中,可利用原电池的原理逆向思考自然过渡到电解池的学习中去,并应用氧化还原相关知识拓展和延伸电化学理论。
教学目标
【知识与技能】
(1)使学生理解电解原理,初步掌握一般电解反应两极反应物、产物的判断方法,能写出电极反应式和电解化学方程式。
(2)理解电解质溶液、电极对电解的影响。
【过程与方法】
(1)利用惰性电极电解氯化铜的实验,有助于学生自主探究电解原理,增强学生对实验现象的观察、分析和推理能力。
(2)通过学生对科学探究过程的体验,使之具有一定的实验能力、观察能力和思维能力。
【情感态度与价值观】
(1)通过让学生动手做实验,激发学生学习化学的兴趣。
(2)通过以小组合作的形式对电解原理进行探究,培养学生的科学探究和合作学习的精神。
教学重难点
掌握电解原理,形成电解池工作原理的思维模型。
教学过程
一、导入新课
表演黑笔写红字魔术(电解池原理)。
(滤纸用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铁片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹)
【讲述】同学们,想知道我是怎样用黑色的笔写出红色字的吗?通过本节课的学习,你就会找到答案。
二、讲授新课
【板书】第二节 电解池
【交流研讨】
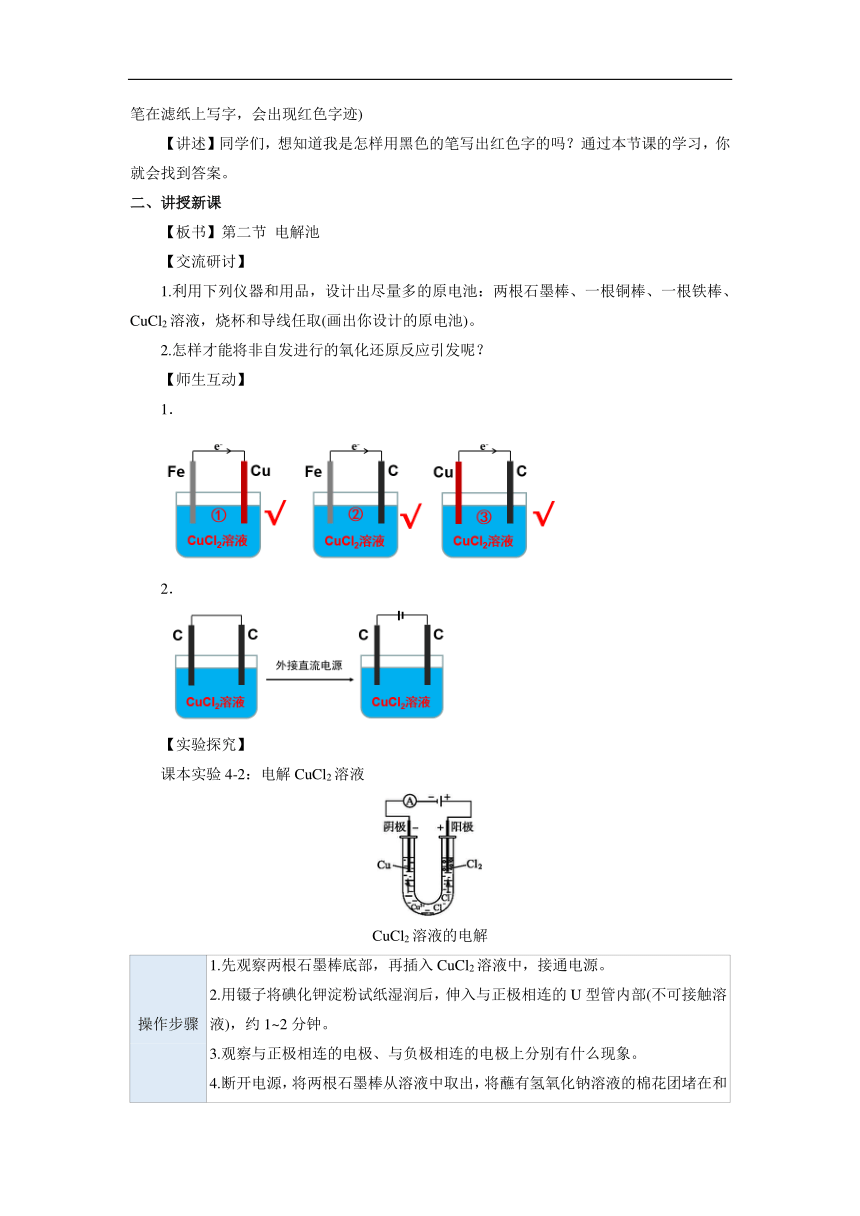
1.利用下列仪器和用品,设计出尽量多的原电池:两根石墨棒、一根铜棒、一根铁棒、CuCl2溶液,烧杯和导线任取(画出你设计的原电池)。
2.怎样才能将非自发进行的氧化还原反应引发呢?
【师生互动】
1.
2.
【实验探究】
课本实验4-2:电解CuCl2溶液
CuCl2溶液的电解
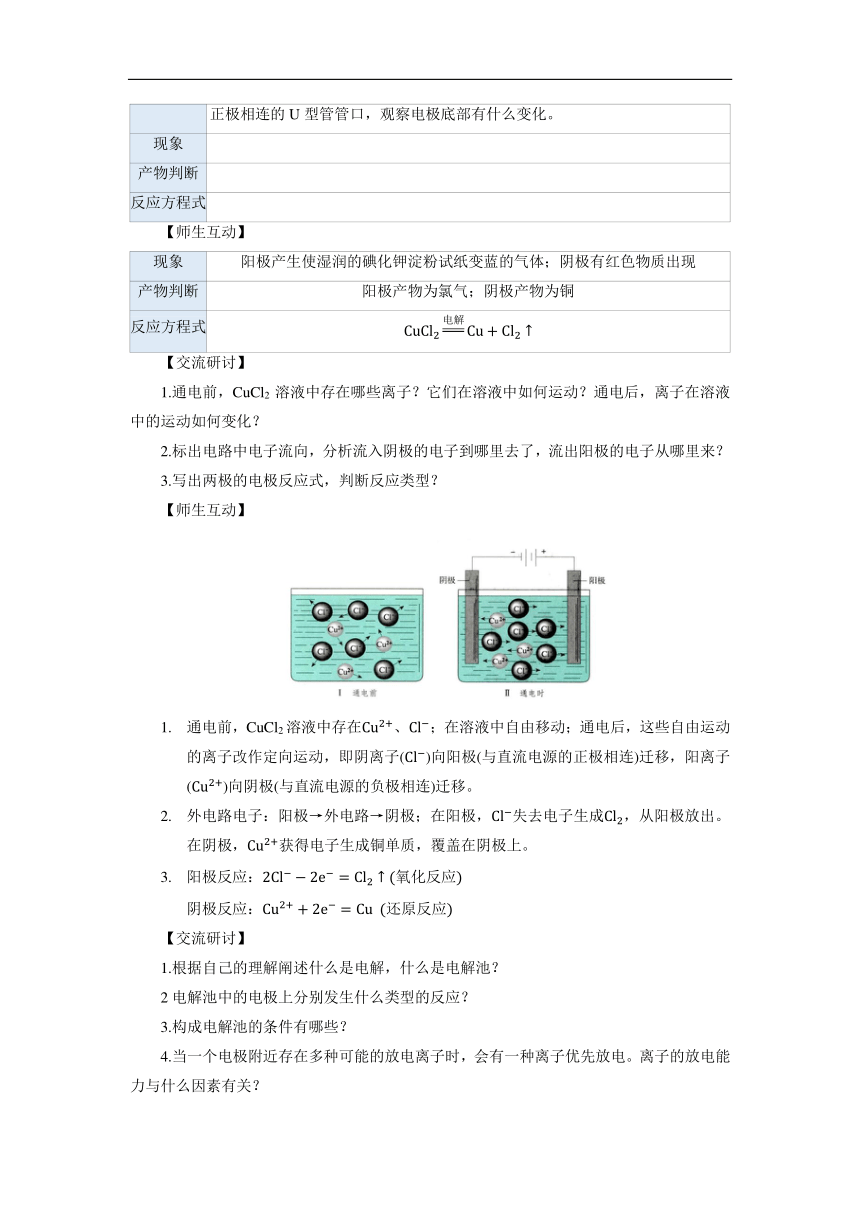
操作步骤 1.先观察两根石墨棒底部,再插入CuCl2溶液中,接通电源。 2.用镊子将碘化钾淀粉试纸湿润后,伸入与正极相连的U型管内部(不可接触溶液),约1~2分钟。 3.观察与正极相连的电极、与负极相连的电极上分别有什么现象。 4.断开电源,将两根石墨棒从溶液中取出,将蘸有氢氧化钠溶液的棉花团堵在和正极相连的U型管管口,观察电极底部有什么变化。
现象
产物判断
反应方程式
【师生互动】
现象 阳极产生使湿润的碘化钾淀粉试纸变蓝的气体;阴极有红色物质出现
产物判断 阳极产物为氯气;阴极产物为铜
反应方程式
【交流研讨】
1.通电前,CuCl2溶液中存在哪些离子?它们在溶液中如何运动?通电后,离子在溶液中的运动如何变化?
2.标出电路中电子流向,分析流入阴极的电子到哪里去了,流出阳极的电子从哪里来?
3.写出两极的电极反应式,判断反应类型?
【师生互动】
通电前,CuCl2溶液中存在;在溶液中自由移动;通电后,这些自由运动的离子改作定向运动,即阴离子()向阳极(与直流电源的正极相连)迁移,阳离子()向阴极(与直流电源的负极相连)迁移。
外电路电子:阳极→外电路→阴极;在阳极,失去电子生成,从阳极放出。在阴极,获得电子生成铜单质,覆盖在阴极上。
阳极反应:
阴极反应:
【交流研讨】
1.根据自己的理解阐述什么是电解,什么是电解池?
2电解池中的电极上分别发生什么类型的反应?
3.构成电解池的条件有哪些?
4.当一个电极附近存在多种可能的放电离子时,会有一种离子优先放电。离子的放电能力与什么因素有关?
离子的放电顺序是怎样的?(物质在电解池的阴、阳两极发生反应的过程叫放电)
【师生互动】
1.电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程,叫做电解。电解实质是电解质溶液导电的过程。
2.电解池:借助于电流引起氧化还原反应的装置,也就是把电能转化为化学能的装置,又叫电解槽。
3.电极:阳极与电源的正极相连,发生氧化反应;
阴极与电源的负极相连,发生还原反应。
4.电解池的构成条件
5.水溶液中离子的放电规律:
(1)影响离子放电能力的因素:①离子得失电子的能力;②离子的浓度。
(2)离子的放电顺序:
阴极:氧化性强的离子先得电子
阳极:阳极金属或还原性强的离子先失电子
活性电极
【交流研讨】
1.请设计一个电解NaCl溶液的简易装置图,标出阴、阳极,注明电子及阴、阳离子的移动方向,并写出电极反应式?
2.根据上述练习,思考如何判断电解池的阴极,有哪些依据?
3.分析总结书写电解池电极反应的一般思路?
【师生互动】
阳极反应:
阴极反应:
总反应:
反应类型:还原反应
电源连接:与电源的负极相连
微粒流向:电子流入,阳离子流向
电流流向:电流流出
3.
①分析电极(确定电极名称;分析电极类别)
②分析溶液(确定微粒种类;确定微粒物质的量或浓度)
③确定电极上的放电离子
④确定放电顺序
⑤写出电极方程式
【魔术揭秘】
回顾开始操作,实物再展示,分析所用装置是个什么装置,说出它的组成部分及所用原理,根据现象推测纸巾上所加物质。
【提示】应用电解原理:
纸巾上蘸有酚酞溶液,两只铅笔分别连接电源的正、负极,用阴极铅笔即可写出红字。
【练习1】判断正误:
①电解池中发生的反应是自发进行的。( )
②在电解池的阴极发生氧化反应。( )
③与电源正极相连的是电解池的阴极。( )
④电子从电源负极沿导线流入电解池的阴极。( )
⑤电解池溶液中阳离子移向阴极,且所有阳离子均得电子。( )
答案:①× ②× ③× ④√ ⑤×
【练习2】下列说法正确的是( )
①电解是把电能转变成化学能的过程
②电解是把化学能转变成电能的过程
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解可以实现
A.①②③④ B.②③ C.③④ D①③④
答案:D
【练习3】如图所示是电解氯化铜溶液的装置,其中c、d为石墨电极,下列有关判断正确的是( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子的浓度不变
答案:C
三、课堂小结
原电池与电解池的比较:
原电池 电解池
一个概念 将化学能转变为电能的装置 将电能转变为化学能的装置
两个电极 负极 较活泼金属—失电子—发生氧化反应 阳极 与电源正极相连—失电子—发生氧化反应
正极 不活泼金属或非金属导体—得电子—发生还原反应 阴极 与电源负极相连—得电子—发生还原反应
三个流向 电子 负极→外电路→正极 阳极→外电路→阴极
电流 正极→外电路→负极 阴极→外电路→阳极
离子 阳离子→正极 阴离子→负极 阳离子→阴极 阴离子→阳极
四个条件 ①活动性不同的两个电极 ②电解质溶液 ③形成闭合电路 ④自发进行的氧化还原反应 ①阴、阳电极 ②电解质溶液或熔融电解质 ③形成闭合电路 ④外加直流电源
相同点 自发进行←氧化还原反应→非自发进行
板书设计
第二节 电解池
第1课时 电解原理
1.电解
2.电解池
3.电极
4.电解池的构成条件
5.水溶液中离子的放电规律
教学反思
本节课运用对比的方法使学生加深对概念的理解。比如在讲电解原理的时候,由原电池的原理引入,引出电解池与原电池的区别;在判断电极反应物及产物的时候,在复习了离子的氧化性和还原性强弱的基础上,讲解离子的放电顺序,避免了学生的死记硬背。
今后的改进:
1.教学需要双边活动,现在的学生喜欢去听、去说、多少也会思考一些,但是动手的时候比较少,因此,在课堂上需要加强学生的练习;另外,注意调动课堂气氛,使全体学生都参与到课堂学习中。
2.在讲解电极反应式的书写时也要注意循序渐进的方式,由简单的电极反应式向复杂的电极反应式的书写过渡。
3.对于练习题应该更加优选一下 ,针对性越强,练习的效果会越好,通过一题多变,抓住“池、极、液”的特点,突破难点,使学生的正向思维、逆向思维得到充分训练。让学生今后遇到实际问题,能够抓实质、善分析、重迁移。
第1课时
教材分析
电解池是借助于电能,使不能自发进行的氧化还原反应能够发生,从而使电能转化为化学能的装置。它的应用相当广泛,由此形成的工业也很多,如电镀、电解、电冶金电池充电等。本节课是学生学习原电池知识后的自然延伸,有助于学生更加系统地学习电化学知识,并为后续学习电化学知识在生产、生活和科研中的重要作用打好理论基础。
学情分析
本课时内容选自选择性必修1《化学反应原理》第四章第二节。通过必修2的学习,学生已经掌握了简单的原电池知识;通过选择性必修1《化学反应原理)第四章第一节的学习,学生已经具备借助氧化还原理论、金属活动性顺序和物理学中的电学知识判断原电池正、负极以及设计原电池和书写原电池电极反应的能力。因此,在本节课中,可利用原电池的原理逆向思考自然过渡到电解池的学习中去,并应用氧化还原相关知识拓展和延伸电化学理论。
教学目标
【知识与技能】
(1)使学生理解电解原理,初步掌握一般电解反应两极反应物、产物的判断方法,能写出电极反应式和电解化学方程式。
(2)理解电解质溶液、电极对电解的影响。
【过程与方法】
(1)利用惰性电极电解氯化铜的实验,有助于学生自主探究电解原理,增强学生对实验现象的观察、分析和推理能力。
(2)通过学生对科学探究过程的体验,使之具有一定的实验能力、观察能力和思维能力。
【情感态度与价值观】
(1)通过让学生动手做实验,激发学生学习化学的兴趣。
(2)通过以小组合作的形式对电解原理进行探究,培养学生的科学探究和合作学习的精神。
教学重难点
掌握电解原理,形成电解池工作原理的思维模型。
教学过程
一、导入新课
表演黑笔写红字魔术(电解池原理)。
(滤纸用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铁片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹)
【讲述】同学们,想知道我是怎样用黑色的笔写出红色字的吗?通过本节课的学习,你就会找到答案。
二、讲授新课
【板书】第二节 电解池
【交流研讨】
1.利用下列仪器和用品,设计出尽量多的原电池:两根石墨棒、一根铜棒、一根铁棒、CuCl2溶液,烧杯和导线任取(画出你设计的原电池)。
2.怎样才能将非自发进行的氧化还原反应引发呢?
【师生互动】
1.
2.
【实验探究】
课本实验4-2:电解CuCl2溶液
CuCl2溶液的电解
操作步骤 1.先观察两根石墨棒底部,再插入CuCl2溶液中,接通电源。 2.用镊子将碘化钾淀粉试纸湿润后,伸入与正极相连的U型管内部(不可接触溶液),约1~2分钟。 3.观察与正极相连的电极、与负极相连的电极上分别有什么现象。 4.断开电源,将两根石墨棒从溶液中取出,将蘸有氢氧化钠溶液的棉花团堵在和正极相连的U型管管口,观察电极底部有什么变化。
现象
产物判断
反应方程式
【师生互动】
现象 阳极产生使湿润的碘化钾淀粉试纸变蓝的气体;阴极有红色物质出现
产物判断 阳极产物为氯气;阴极产物为铜
反应方程式
【交流研讨】
1.通电前,CuCl2溶液中存在哪些离子?它们在溶液中如何运动?通电后,离子在溶液中的运动如何变化?
2.标出电路中电子流向,分析流入阴极的电子到哪里去了,流出阳极的电子从哪里来?
3.写出两极的电极反应式,判断反应类型?
【师生互动】
通电前,CuCl2溶液中存在;在溶液中自由移动;通电后,这些自由运动的离子改作定向运动,即阴离子()向阳极(与直流电源的正极相连)迁移,阳离子()向阴极(与直流电源的负极相连)迁移。
外电路电子:阳极→外电路→阴极;在阳极,失去电子生成,从阳极放出。在阴极,获得电子生成铜单质,覆盖在阴极上。
阳极反应:
阴极反应:
【交流研讨】
1.根据自己的理解阐述什么是电解,什么是电解池?
2电解池中的电极上分别发生什么类型的反应?
3.构成电解池的条件有哪些?
4.当一个电极附近存在多种可能的放电离子时,会有一种离子优先放电。离子的放电能力与什么因素有关?
离子的放电顺序是怎样的?(物质在电解池的阴、阳两极发生反应的过程叫放电)
【师生互动】
1.电解:使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程,叫做电解。电解实质是电解质溶液导电的过程。
2.电解池:借助于电流引起氧化还原反应的装置,也就是把电能转化为化学能的装置,又叫电解槽。
3.电极:阳极与电源的正极相连,发生氧化反应;
阴极与电源的负极相连,发生还原反应。
4.电解池的构成条件
5.水溶液中离子的放电规律:
(1)影响离子放电能力的因素:①离子得失电子的能力;②离子的浓度。
(2)离子的放电顺序:
阴极:氧化性强的离子先得电子
阳极:阳极金属或还原性强的离子先失电子
活性电极
【交流研讨】
1.请设计一个电解NaCl溶液的简易装置图,标出阴、阳极,注明电子及阴、阳离子的移动方向,并写出电极反应式?
2.根据上述练习,思考如何判断电解池的阴极,有哪些依据?
3.分析总结书写电解池电极反应的一般思路?
【师生互动】
阳极反应:
阴极反应:
总反应:
反应类型:还原反应
电源连接:与电源的负极相连
微粒流向:电子流入,阳离子流向
电流流向:电流流出
3.
①分析电极(确定电极名称;分析电极类别)
②分析溶液(确定微粒种类;确定微粒物质的量或浓度)
③确定电极上的放电离子
④确定放电顺序
⑤写出电极方程式
【魔术揭秘】
回顾开始操作,实物再展示,分析所用装置是个什么装置,说出它的组成部分及所用原理,根据现象推测纸巾上所加物质。
【提示】应用电解原理:
纸巾上蘸有酚酞溶液,两只铅笔分别连接电源的正、负极,用阴极铅笔即可写出红字。
【练习1】判断正误:
①电解池中发生的反应是自发进行的。( )
②在电解池的阴极发生氧化反应。( )
③与电源正极相连的是电解池的阴极。( )
④电子从电源负极沿导线流入电解池的阴极。( )
⑤电解池溶液中阳离子移向阴极,且所有阳离子均得电子。( )
答案:①× ②× ③× ④√ ⑤×
【练习2】下列说法正确的是( )
①电解是把电能转变成化学能的过程
②电解是把化学能转变成电能的过程
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解可以实现
A.①②③④ B.②③ C.③④ D①③④
答案:D
【练习3】如图所示是电解氯化铜溶液的装置,其中c、d为石墨电极,下列有关判断正确的是( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子的浓度不变
答案:C
三、课堂小结
原电池与电解池的比较:
原电池 电解池
一个概念 将化学能转变为电能的装置 将电能转变为化学能的装置
两个电极 负极 较活泼金属—失电子—发生氧化反应 阳极 与电源正极相连—失电子—发生氧化反应
正极 不活泼金属或非金属导体—得电子—发生还原反应 阴极 与电源负极相连—得电子—发生还原反应
三个流向 电子 负极→外电路→正极 阳极→外电路→阴极
电流 正极→外电路→负极 阴极→外电路→阳极
离子 阳离子→正极 阴离子→负极 阳离子→阴极 阴离子→阳极
四个条件 ①活动性不同的两个电极 ②电解质溶液 ③形成闭合电路 ④自发进行的氧化还原反应 ①阴、阳电极 ②电解质溶液或熔融电解质 ③形成闭合电路 ④外加直流电源
相同点 自发进行←氧化还原反应→非自发进行
板书设计
第二节 电解池
第1课时 电解原理
1.电解
2.电解池
3.电极
4.电解池的构成条件
5.水溶液中离子的放电规律
教学反思
本节课运用对比的方法使学生加深对概念的理解。比如在讲电解原理的时候,由原电池的原理引入,引出电解池与原电池的区别;在判断电极反应物及产物的时候,在复习了离子的氧化性和还原性强弱的基础上,讲解离子的放电顺序,避免了学生的死记硬背。
今后的改进:
1.教学需要双边活动,现在的学生喜欢去听、去说、多少也会思考一些,但是动手的时候比较少,因此,在课堂上需要加强学生的练习;另外,注意调动课堂气氛,使全体学生都参与到课堂学习中。
2.在讲解电极反应式的书写时也要注意循序渐进的方式,由简单的电极反应式向复杂的电极反应式的书写过渡。
3.对于练习题应该更加优选一下 ,针对性越强,练习的效果会越好,通过一题多变,抓住“池、极、液”的特点,突破难点,使学生的正向思维、逆向思维得到充分训练。让学生今后遇到实际问题,能够抓实质、善分析、重迁移。
