化学人教版(2019)选择性必修1 1.1.1焓变 热化学方程式(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.1焓变 热化学方程式(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-11 16:23:06 | ||
图片预览







文档简介
(共24张PPT)
第一章 化学反应的热效应
第一节 反 应 热
第 一 讲 反应热的表示方法
反应热的
表示方法
反应热的
计算
反应热的
测量
本章要点
复习回顾
这个世界最本质的存在就是能量,能量的奥秘引导着文明一路向前
化学反应的过程,既是物质的转化过程,也是化学能与热、电等其它形式能量的转化过程。化学反应既遵守质量守恒定律,也遵守能量守恒定律。
能量是唯一的通用货币。要想达成任何目标,能量都必不可少。
能量流动方式的每一次改进,结果都带来了文化机制的提升
引自:瓦茨拉夫·斯米尔《能量与文明》
上海夜景
复习回顾
热量的吸收或释放是化学反应中最常见的能量变化形式。化学反应有的是放热反应,有的化学反应是吸热反应
所有的燃烧反应
大多数化合反应
金属与酸的反应
酸碱中和反应
化学中常见的放热反应:
化学常见的吸热反应:
部分化合反应:如碳与二氧化碳反应
……
大多数的分解反应
……
多数铵盐与碱的反应
1、化学反应过程中化学键断裂时要_____
化学键形成时要_____
吸收能量
放出能量
2、化学键的断裂和形成是化学反应中能量变化的主要原因,化学反应中的物质变化总会伴随能量变化,能量变化通常表现为热量的释放和吸收。
3、如果一个化学反应过程中放出的能量多于吸收的能量,则能量向环境释放热量,反应为放热反应,反之,反应为吸热反应。
【说明】化学反应的能量变化,除转化为热能外,还转化为机械能、光、声、电等多种能量形式,高中默认为在物定条件下化学反应能量全部转化为热能
复习回顾
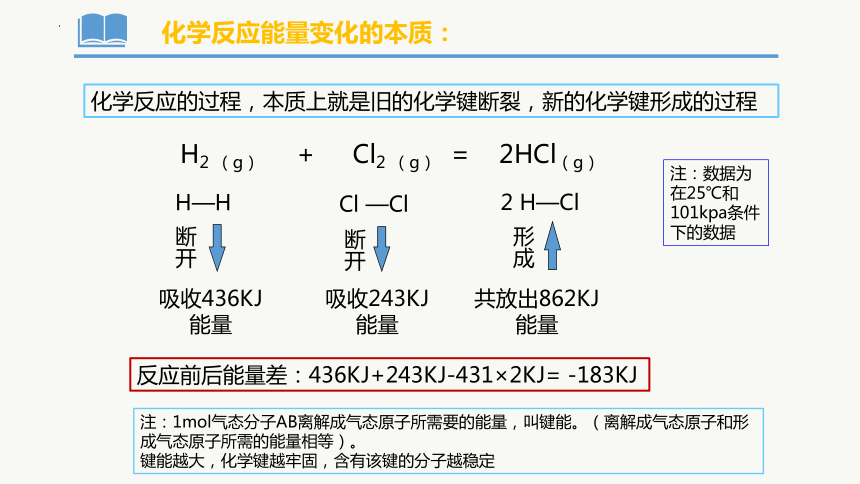
化学反应能量变化的本质:
化学反应的过程,本质上就是旧的化学键断裂,新的化学键形成的过程
H2 (g) + Cl2 (g) = 2HCl(g)
H—H
Cl —Cl
2 H—Cl
断开
断开
吸收436KJ 能量
吸收243KJ能量
共放出862KJ能量
形成
注:数据为在25℃和101kpa条件下的数据
反应前后能量差:436KJ+243KJ-431×2KJ= -183KJ
注:1mol气态分子AB离解成气态原子所需要的能量,叫键能。(离解成气态原子和形成气态原子所需的能量相等)。
键能越大,化学键越牢固,含有该键的分子越稳定
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
吸收能量
放热反应
吸热反应
反应热 焓变:
学生阅读教材
P4、P6、P7、P8
弄清相关概念
1、反应体系(系统):我们把化学反应中该反应的反应物和生成物看做一个反应体系,简称体系或系统
2、环境:而把除它们之外的物质(如空气等)称为环境。
3、热量:是指因温度不同而在体系与环境之间的热量交换或传递的能量
吸热反应:生(总)>反(总 )----体系能量升高,环境温度降低
放热反应:生(总)<反(总 )----体系能量降低,环境温度升高
体系
环境
反应热 焓变:
4、内能:任何一种物质都具有一定的能量,这种能量称为内能。
能量越低,物质越稳定 键能越大,物质越稳定
6、焓变(ΔH):物质的内能变化值
单位: 常用kJ/mol或kJ·mol-1
5、焓(H):是一个与内能有关的物理量
ΔH = H生成物-H反应物
反应热 焓变:
7、反应热:化学反应体系向环境中释放或从环境中吸收的热量。
恒压条件下体系的反应热 = 体系的焓变
用焓变表示反应热:
焓增加—吸热反应
表示为
“ + ”
或 ΔH>0
焓减少—放热反应
“- ”
表示为
或 ΔH<0
为什么会如此规定呢?
反应热 焓变:
吸热反应
放热反应
反应热 焓变:
从微观的角度讨论反应热的实质
H2 (g) + Cl2 (g) = 2HCl(g)
H—H
Cl —Cl
2 H—Cl
断开
断开
吸收436KJ 能量
吸收243KJ能量
共放出862KJ能量
形成
注:数据为在25℃和101kpa条件下的数据
反应前后消耗的能量差:
436KJ + 243KJ - 431×2KJ = -183KJ
反应热与键能
ΔH = E断键吸收-E成键放出
反应物键能和 = 生成物键能和 + Δ H
核心:化学反应前后能量守恒
练习
1、1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。
2、拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2生成NH3的反应热为: ,1mol H2生成NH3的反应热为: 。
+131.5
-92kJ/mol
-30.67kJ/mol
热化学反应方程式
1、定义:
能表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
例如:H2(g)+I2(g) =2HI (g) ΔH=-14.9 kJ/mol是碘单质和氢气反应的一个热化学反应方程式。
答: 表示1molH2(g)与1molI2(g)反应生成 2molHI (g) 放出14.9 kJ的热量。
如何理解 H2(g)+I2(g) =2HI (g) ΔH=-14.9 kJ/mol这个热化学方程式?
热化学反应方程式
思考:对比上述两种反应方程式,热化学方程式与化学方程式有哪些不同?正确书写热化学方程式应注意哪几点?
热化学反应方程式:
H2 (g) + 1/2 O2 (g) = H2O (l) ΔH=-285.8kJ/mol
化学方程式:2H2 + O2 = 2H2O
热化学反应方程式
③必须标明各种物质的状态(s—固体、l—液体、g—气体、aq—水溶液)。
②方程式后面必须标明反应热吸热还是放热的符号,
吸热反应ΔH为“+”、放热反应ΔH为“-”。
①需注明反应的温度和压强;因反应的温度和压强不同时,其ΔH会不同。(对于25℃、101KPa时进行的反应可以不注明)
2、热化学方程式书写的注意事项:
H2 (g) + 1/2 O2 (g) = H2O (g) ΔH=-241.8kJ/mol
H2 (g) + 1/2 O2 (g) = H2O (l) ΔH=-285.8kJ/mol
热化学反应方程式
⑦可逆反应向逆向进行时,反应热与正反应数值相等,符号相反。
⑥一般不需要注明反应的条件。不用↑或↓符号。
⑤ΔH的数值与反应的计量数成比例; 计量数不同, ΔH不同。
④热化学方程式中各物质化学式前面的计量数仅表示该物质的物质的量,所以,可以用分数表示。
2H2 (g) + O2 (g) = 2H2O (g) ΔH=-571.6 kJ/mol
H2 (g) + 1/2 O2 (g) = H2O (g) ΔH=-285.8kJ/mol
反应热大小的比较
如:2H2(g)+O2(g)=2H2O(l) △H1=-akJ/mol
H2(g)+1/2O2(g)=H2O(l) △H2=-bkJ/mol
a﹥b
△H1 <△H2
步骤:1、比较热量的绝对值大小,2、带符号比较 △H 大小
S(g)+O2(g)==SO2(g) △H1=- Q1 kJ/mol
S(s)+O2(g)==SO2(g) △H2=- Q2 kJ/mol
Q1>Q2
△H1 <△H2
3、反应热大小的比较
练习
1、书写下列反应的热化学方程式
①2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;
②1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
2Cu(s)+O2(g)=2CuO (s) △H=-314kJ/mol
S(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol
热化学反应方程式
2、已知在25℃,101kpa下,1克C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=-48.40 kJ·mol-1
B
热化学反应方程式
3、已知某温度下的热化学方程式:
2SO2(g) +O2(g) 2SO3(g) △H=-197kJ/mol
试写出SO3分解的热化学反应方程式。
2SO3(g) 2SO2(g) +O2(g) △H=+197kJ/mol
对于可逆反应,
①当反应逆向进行时,其反应热与正反应的数值相等,符号相反。
②其反应热是指反应物完全转变成生成物放出或吸收的热量。
练习
4、已知
①H2 (g) + 1/2 O2 (g) = H2O (g) ΔH1= akJ/mol
② 2H2 (g) + O2 (g) = 2H2O (g) ΔH2= b kJ/mol
③ H2 (g) + 1/2 O2 (g) = H2O (l) ΔH3= c kJ/mol
④ 2H2 (g) + O2 (g) = 2H2O (l) ΔH4= d kJ/mol
下列关系中正确的是( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
C
谢 谢 观 看
THANKS
第一章 化学反应的热效应
第一节 反 应 热
第 一 讲 反应热的表示方法
反应热的
表示方法
反应热的
计算
反应热的
测量
本章要点
复习回顾
这个世界最本质的存在就是能量,能量的奥秘引导着文明一路向前
化学反应的过程,既是物质的转化过程,也是化学能与热、电等其它形式能量的转化过程。化学反应既遵守质量守恒定律,也遵守能量守恒定律。
能量是唯一的通用货币。要想达成任何目标,能量都必不可少。
能量流动方式的每一次改进,结果都带来了文化机制的提升
引自:瓦茨拉夫·斯米尔《能量与文明》
上海夜景
复习回顾
热量的吸收或释放是化学反应中最常见的能量变化形式。化学反应有的是放热反应,有的化学反应是吸热反应
所有的燃烧反应
大多数化合反应
金属与酸的反应
酸碱中和反应
化学中常见的放热反应:
化学常见的吸热反应:
部分化合反应:如碳与二氧化碳反应
……
大多数的分解反应
……
多数铵盐与碱的反应
1、化学反应过程中化学键断裂时要_____
化学键形成时要_____
吸收能量
放出能量
2、化学键的断裂和形成是化学反应中能量变化的主要原因,化学反应中的物质变化总会伴随能量变化,能量变化通常表现为热量的释放和吸收。
3、如果一个化学反应过程中放出的能量多于吸收的能量,则能量向环境释放热量,反应为放热反应,反之,反应为吸热反应。
【说明】化学反应的能量变化,除转化为热能外,还转化为机械能、光、声、电等多种能量形式,高中默认为在物定条件下化学反应能量全部转化为热能
复习回顾
化学反应能量变化的本质:
化学反应的过程,本质上就是旧的化学键断裂,新的化学键形成的过程
H2 (g) + Cl2 (g) = 2HCl(g)
H—H
Cl —Cl
2 H—Cl
断开
断开
吸收436KJ 能量
吸收243KJ能量
共放出862KJ能量
形成
注:数据为在25℃和101kpa条件下的数据
反应前后能量差:436KJ+243KJ-431×2KJ= -183KJ
注:1mol气态分子AB离解成气态原子所需要的能量,叫键能。(离解成气态原子和形成气态原子所需的能量相等)。
键能越大,化学键越牢固,含有该键的分子越稳定
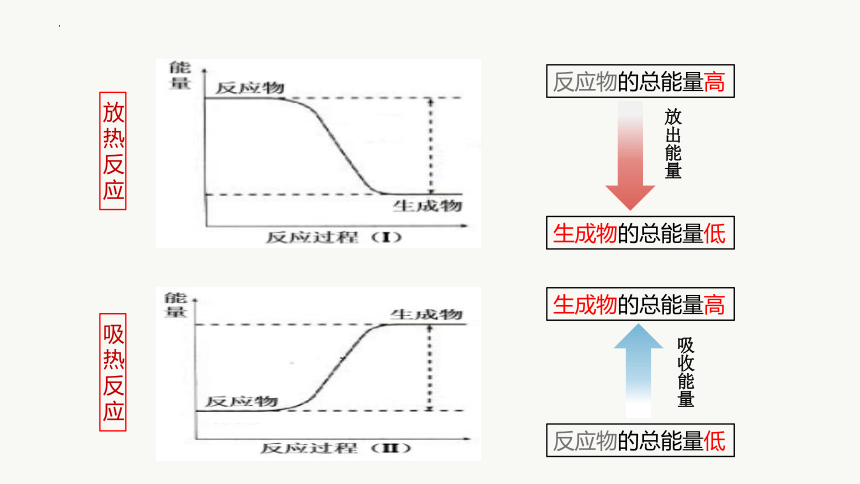
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
吸收能量
放热反应
吸热反应
反应热 焓变:
学生阅读教材
P4、P6、P7、P8
弄清相关概念
1、反应体系(系统):我们把化学反应中该反应的反应物和生成物看做一个反应体系,简称体系或系统
2、环境:而把除它们之外的物质(如空气等)称为环境。
3、热量:是指因温度不同而在体系与环境之间的热量交换或传递的能量
吸热反应:生(总)>反(总 )----体系能量升高,环境温度降低
放热反应:生(总)<反(总 )----体系能量降低,环境温度升高
体系
环境
反应热 焓变:
4、内能:任何一种物质都具有一定的能量,这种能量称为内能。
能量越低,物质越稳定 键能越大,物质越稳定
6、焓变(ΔH):物质的内能变化值
单位: 常用kJ/mol或kJ·mol-1
5、焓(H):是一个与内能有关的物理量
ΔH = H生成物-H反应物
反应热 焓变:
7、反应热:化学反应体系向环境中释放或从环境中吸收的热量。
恒压条件下体系的反应热 = 体系的焓变
用焓变表示反应热:
焓增加—吸热反应
表示为
“ + ”
或 ΔH>0
焓减少—放热反应
“- ”
表示为
或 ΔH<0
为什么会如此规定呢?
反应热 焓变:
吸热反应
放热反应
反应热 焓变:
从微观的角度讨论反应热的实质
H2 (g) + Cl2 (g) = 2HCl(g)
H—H
Cl —Cl
2 H—Cl
断开
断开
吸收436KJ 能量
吸收243KJ能量
共放出862KJ能量
形成
注:数据为在25℃和101kpa条件下的数据
反应前后消耗的能量差:
436KJ + 243KJ - 431×2KJ = -183KJ
反应热与键能
ΔH = E断键吸收-E成键放出
反应物键能和 = 生成物键能和 + Δ H
核心:化学反应前后能量守恒
练习
1、1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H= kJ/mol。
2、拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2生成NH3的反应热为: ,1mol H2生成NH3的反应热为: 。
+131.5
-92kJ/mol
-30.67kJ/mol
热化学反应方程式
1、定义:
能表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
例如:H2(g)+I2(g) =2HI (g) ΔH=-14.9 kJ/mol是碘单质和氢气反应的一个热化学反应方程式。
答: 表示1molH2(g)与1molI2(g)反应生成 2molHI (g) 放出14.9 kJ的热量。
如何理解 H2(g)+I2(g) =2HI (g) ΔH=-14.9 kJ/mol这个热化学方程式?
热化学反应方程式
思考:对比上述两种反应方程式,热化学方程式与化学方程式有哪些不同?正确书写热化学方程式应注意哪几点?
热化学反应方程式:
H2 (g) + 1/2 O2 (g) = H2O (l) ΔH=-285.8kJ/mol
化学方程式:2H2 + O2 = 2H2O
热化学反应方程式
③必须标明各种物质的状态(s—固体、l—液体、g—气体、aq—水溶液)。
②方程式后面必须标明反应热吸热还是放热的符号,
吸热反应ΔH为“+”、放热反应ΔH为“-”。
①需注明反应的温度和压强;因反应的温度和压强不同时,其ΔH会不同。(对于25℃、101KPa时进行的反应可以不注明)
2、热化学方程式书写的注意事项:
H2 (g) + 1/2 O2 (g) = H2O (g) ΔH=-241.8kJ/mol
H2 (g) + 1/2 O2 (g) = H2O (l) ΔH=-285.8kJ/mol
热化学反应方程式
⑦可逆反应向逆向进行时,反应热与正反应数值相等,符号相反。
⑥一般不需要注明反应的条件。不用↑或↓符号。
⑤ΔH的数值与反应的计量数成比例; 计量数不同, ΔH不同。
④热化学方程式中各物质化学式前面的计量数仅表示该物质的物质的量,所以,可以用分数表示。
2H2 (g) + O2 (g) = 2H2O (g) ΔH=-571.6 kJ/mol
H2 (g) + 1/2 O2 (g) = H2O (g) ΔH=-285.8kJ/mol
反应热大小的比较
如:2H2(g)+O2(g)=2H2O(l) △H1=-akJ/mol
H2(g)+1/2O2(g)=H2O(l) △H2=-bkJ/mol
a﹥b
△H1 <△H2
步骤:1、比较热量的绝对值大小,2、带符号比较 △H 大小
S(g)+O2(g)==SO2(g) △H1=- Q1 kJ/mol
S(s)+O2(g)==SO2(g) △H2=- Q2 kJ/mol
Q1>Q2
△H1 <△H2
3、反应热大小的比较
练习
1、书写下列反应的热化学方程式
①2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;
②1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
2Cu(s)+O2(g)=2CuO (s) △H=-314kJ/mol
S(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol
热化学反应方程式
2、已知在25℃,101kpa下,1克C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,表示上述反应的热化学方程式正确的是
A.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=-5518 kJ·mol-1
C.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=+5518 kJ·mol-1
D.C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH=-48.40 kJ·mol-1
B
热化学反应方程式
3、已知某温度下的热化学方程式:
2SO2(g) +O2(g) 2SO3(g) △H=-197kJ/mol
试写出SO3分解的热化学反应方程式。
2SO3(g) 2SO2(g) +O2(g) △H=+197kJ/mol
对于可逆反应,
①当反应逆向进行时,其反应热与正反应的数值相等,符号相反。
②其反应热是指反应物完全转变成生成物放出或吸收的热量。
练习
4、已知
①H2 (g) + 1/2 O2 (g) = H2O (g) ΔH1= akJ/mol
② 2H2 (g) + O2 (g) = 2H2O (g) ΔH2= b kJ/mol
③ H2 (g) + 1/2 O2 (g) = H2O (l) ΔH3= c kJ/mol
④ 2H2 (g) + O2 (g) = 2H2O (l) ΔH4= d kJ/mol
下列关系中正确的是( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
C
谢 谢 观 看
THANKS
