4.1.1糖类的组成和分类课件(共35张ppt)化学人教版(2019)选择性必修3
文档属性
| 名称 | 4.1.1糖类的组成和分类课件(共35张ppt)化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-11 18:45:10 | ||
图片预览











文档简介
(共35张PPT)
第四章 第一节
糖类
认识生活中的糖类
糖类在生命活动中起着重要作用,是生物体所需能量的主要来源,也是重要的能量储存物质,还是很多生物体的结构成分。
血液里的葡萄糖
甘蔗里的蔗糖
蜂蜜里的果糖
红薯里的淀粉
棉花里的纤维素
糖类的组成和分类
1.组成:
一般由碳、氢、氧三种元素组成,大多数糖符合通式Cm(H2O)n 又叫碳水化合物。
糖类一定符合通式Cm(H2O)n吗?符合通式Cm(H2O)n一定是糖类吗?
(2)符合Cm(H2O)n通式的物质不一定都是糖类化合物
(1)有些糖的分子式并不符合Cm(H2O)n
脱氧核糖 C5H10O4
乙酸 C2H4O2
甲醛 CH2O
(3)有甜味的不一定是糖,如甘油、木糖醇等;没有甜味的也可能是糖,
如淀粉、纤维素等。
鼠李糖 C6H12O5
碳水化合物这一名称并不准确,但因沿用已久,目前仍在使用。
糖类的组成和分类
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
2.定义:
葡萄糖——多羟基醛 果糖——多羟基酮
糖类的组成和分类
(1)单糖:不能水解的糖,如葡萄糖、果糖、核糖和脱氧核糖等。
(3)多糖:1mol糖水解后能产生10mol以上单糖,如淀粉、纤维素和糖原等。
(2)寡糖(低聚糖):1mol 糖水解后能产生2~10 mol单糖。
以二糖最为重要,常见的二糖有蔗糖、麦芽糖和乳糖等。
类别 单糖 二糖 多糖
代表物 葡萄糖、果糖 蔗糖、麦芽糖 淀粉、纤维素
化学式 C6H12O6 C12H22O11 (C6H10O5)n
结构关系 互为同分异构体 互为同分异构体 不是同分异构体
3.分类—根据糖类能否水解以及水解后的产物
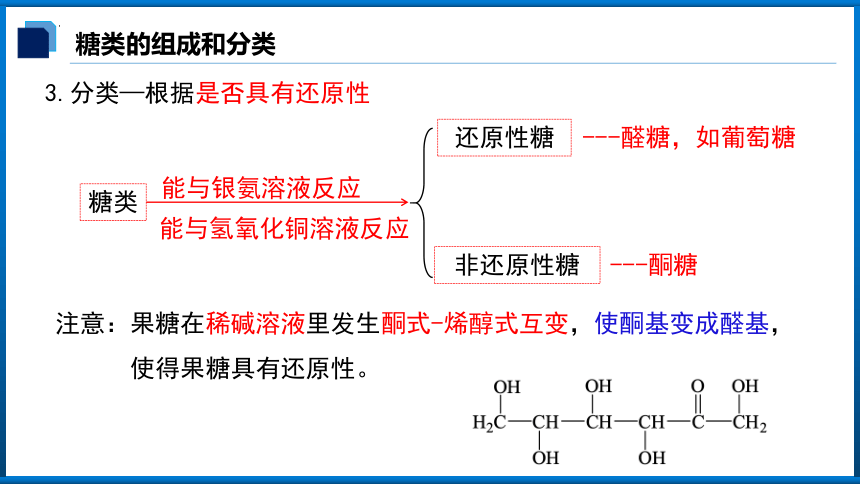
糖类的组成和分类
糖类
还原性糖
非还原性糖
能与银氨溶液反应
能与氢氧化铜溶液反应
---醛糖,如葡萄糖
---酮糖
注意:果糖在稀碱溶液里发生酮式-烯醇式互变,使酮基变成醛基,
使得果糖具有还原性。
3.分类—根据是否具有还原性
单糖—葡萄糖
1.葡萄糖
存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
(1)存在:
(3)物理性质:
易溶于水的无色晶体, 熔点146℃,有甜味,但甜度不如蔗糖。
(2)分子结构---多羟基醛:
CH2OH(CHOH)4CHO
结构简式:
单糖—葡萄糖
葡萄糖
【探究一】葡萄糖的分子结构
定性实验【实验4-1】
在一支洁净的试管中配制约2 mL银氨溶液,加入1 mL 10%葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
在另一支试管中加入2 mL 10% NaOH溶液,加入5滴5% CuSO4溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实验现象。
单糖—葡萄糖
(1)葡萄糖与银氨溶液
在一支洁净的试管中配制约2mL银氨溶液,加入lmL10%葡萄糖溶液,振荡,然后在水浴中加热。
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
(工业制镜)
CH2OH(CHOH)4COONH4 + 2Ag↓ + 3NH3 + H2O
【实验4-1】
单糖—葡萄糖
(2)葡萄糖与新制氢氧化铜
在另一支试管中加入2mL10%NaOH溶液,加入5滴5%CuSO4溶液,再加入2mL10%葡萄糖溶液,加热。
现象:
生成砖红色沉淀
(医学检验糖尿病)
CH2OH(CHOH)4COONa + Cu2O↓ + 3H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
【实验4-1】
单糖—葡萄糖
化学性质
葡萄糖
结构简式
置换反应:与Na反应:1mol葡萄糖 2.5molH2
氧化反应:
消去反应
取代反应
酯化反应
与浓HX反应
分子间脱水成醚
与高锰酸钾、溴水等强氧化剂反应
与弱氧化剂氧化;
还原反应(加成反应)
单糖—葡萄糖
化学性质
葡萄糖易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维持生命活动所需要的能量。低血糖的患者可利用静脉注射葡萄糖溶液的方式来迅速补充营养。
生理代谢:有氧条件
C6H12O6+ 6O2 6CO2 + 6H2O
酶
葡萄糖
单糖—葡萄糖
化学性质
生理代谢:无氧条件
C6H12O6 2CH3CH(OH)COOH
酶
葡萄糖
乳酸
生理代谢:酿酒
C6H12O6 2CH3CH2OH + 2CO2
酒曲酶
葡萄糖
单糖—果糖
2.果糖---与葡萄糖互为同分异构体
(1)存在:
果糖于水果和蜂蜜中含量较高,它比蔗糖的甜度高。
(3)物理性质:
纯净的果糖为无色晶体,易溶于水,乙醇和乙醚,吸湿性强,熔点103~105℃,最甜的糖。
(2)分子结构---多羟基酮:
CH2OH(CHOH)3COCH2OH
结构简式:
果糖
纯净的果糖为无色晶体,易溶于水,吸湿性强。果糖是一种多羟基酮,属于酮糖。即使果糖中没有醛基,但能发生互变异构产生醛基,也能发生银镜反应。因此,果糖也属于还原糖。
葡萄糖
果糖
碱性环境
“六碳糖”
单糖—果糖
思考:如何鉴别葡萄糖与果糖呢?
葡萄糖是一种多羟基醛,果糖是一种多羟基酮,根据醛与酮性质的差异,可选用溴水鉴别二者。由于溴溶于水后生成的次溴酸可以氧化醛基,而不能氧化羰基,因此可用溴水鉴别葡萄糖和果糖。
单糖—果糖
单糖
核糖与脱氧核糖
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。它们都是含有5个碳原子的单糖 戊糖。
H—C—OH
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
H—C—H
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
核糖:C5H10O5
脱氧核糖:C5H10O4
蔗糖
蔗糖(C12H22O11)是最常用的甜味剂,也是自然界种分布最广的一种二糖。蔗糖为无色晶体,熔点186℃,易溶于水。冰糖、白糖、红糖等常见食糖的主要成分都是蔗糖。
甘蔗
甜菜
二糖—蔗糖
蔗糖
蔗糖的形成:1分子葡萄糖和1分子果糖脱去1分子水形成;
蔗糖的水解:
化学方程式中用分子式表示某种糖时,必须注明其名称!
酸或酶
C12H22O11+H2O
C6H12O6+ C6H12O6
蔗糖
葡萄糖
果糖
二糖—蔗糖
【分析一】验证蔗糖水解产物的还原性:
实验思路:
实验装置:
二糖—蔗糖
【分析一】验证蔗糖水解产物的还原性:
实验分析:
稀硫酸的作用:
热水浴的作用:
NaOH溶液的作用:
二糖—蔗糖
催化蔗糖水解;
加快蔗糖水解速率;
中和作催化剂的稀硫酸,防止其消耗Cu(OH)2,防止实验失败!
麦芽糖
麦芽糖(C12H22O11)主要存在于发芽的谷粒和麦芽中,是淀粉水解过程中的一种中间产物。麦芽糖有甜味,但甜度不及蔗糖。使用含淀粉酶的麦芽作用于淀粉可制得饴糖,其主要成分为麦芽糖。
发芽的小麦
饴糖
二糖—麦芽糖
蔗糖的形成:2分子葡萄糖脱去1分子水形成;
蔗糖的水解:
化学方程式中用分子式表示某种糖时,必须注明其名称!
麦芽糖
酸或酶
C12H22O11+H2O
2C6H12O6
麦芽糖
葡萄糖
二糖—麦芽糖
葡萄糖属于还原糖,蔗糖和麦芽糖是否属于还原糖
实验 步骤
实验 现象
实验 结论 蔗糖_______还原糖,麦芽糖_______还原糖 无明显现象
出现砖红色沉淀
不属于
属于
二糖—麦芽糖
二糖
乳糖
乳糖(C12H22O11)也是一种常见的二糖,主要存在于哺乳动物的乳汁中,可用于婴儿食品、糖果、药物的生产。部分人群由于肠道内缺乏乳糖酶导致乳糖消化吸收障碍,出现乳糖不耐受的症状(腹胀腹泻)。
乳糖
水解
脱水缩合
葡萄糖
半乳糖
多糖
淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连接组成的,属于天然有机高分子,淀粉的相对分子质量可达到几十万,纤维素可达到几百万。由于二者n值不同,因此彼此不互为同分异构体!
粮食中的淀粉(C6H10O5)n
茎叶中的纤维素(C6H10O5)n
1.淀粉
淀粉是绿色植物光合作用的产物,是植物储存营养物质的一种形式,在种子、块茎中含量丰富,谷类和薯类含淀粉较多。
小麦
玉米
水稻
红薯
土豆
多糖—淀粉
1.淀粉
(1)物理性质:
(2)化学性质:
白色粉末状物质,没有甜味,不溶于冷水。
在热水中淀粉会部分溶解,形成胶状的淀粉糊。
淀粉遇碘显蓝色。
不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖;
在酸或酶的作用下水解。
(C6H10O5)n+nH2O nC6H12O6
酸或酶
淀粉 葡萄糖
直链淀粉
支链淀粉
(C6H10O5)n
多糖—淀粉
淀粉
【分析二】验证淀粉的水解程度:
现象A 现象B 结论
① 未出现银镜 溶液变蓝色
② 出现银镜 溶液变蓝色
③ 出现银镜 溶液不变蓝色
能不能在中和液中加碘水检验淀粉呢?
不可以!碱性环境下碘会反应,不能检验出淀粉!
多糖—淀粉
淀粉尚未水解
淀粉部分水解
淀粉完全水解
1.淀粉
(C6H10O5)n
淀粉/淀粉水解生成的葡萄糖
发酵
燃料乙醇、白酒、食醋、味精, 以及氨基酸、抗生素等药物。
淀粉酯化
可用于生产食品添加剂、表面活性剂和可降解塑料等
(3)用途
多糖—淀粉
2.纤维素
韭菜
秸秆
纤维素是自然界中分布最广泛的一种多糖,参与构成了植物的细胞壁,起着保护和支持作用。
棉花
木材
多糖—纤维素
2.纤维素
(1)物理性质:
(2)化学性质:
(C6H10O5)n
白色纤维状物质,没有甜味,不溶于水,也不溶于一般的有机溶剂。
不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖;
在酸或酶的作用下水解。
(C6H10O5)n+nH2O nC6H12O6
酸或酶
纤维素 葡萄糖
多糖—纤维素
纤维素
化学性质:
酯化反应:
纤维素乙酸酯/醋酸纤维
应用:不易燃烧,可用于生产塑料、过滤膜、
胶片等!
多糖—纤维素
纤维素
化学性质:
酯化反应:
纤维素硝酸酯/硝酸纤维
应用:极易燃烧,可用于生产火药、塑料和涂
料等!
多糖—纤维素
2.纤维素
(3)用途
(C6H10O5)n
纤维素有利于人体的消化
棉和麻的纤维用于纺织工业;制造黏胶纤维。木材、稻草、秸杆、蔗渣等用于造纸
制造纤维素乙酸酯(醋酸纤维):不易燃烧,可用于生产塑料、过滤膜、胶片等
制造纤维素硝酸酯(硝酸纤维):极易燃烧。可用于生产火药、塑料和涂料等。
01
02
03
04
多糖—纤维素
第四章 第一节
糖类
认识生活中的糖类
糖类在生命活动中起着重要作用,是生物体所需能量的主要来源,也是重要的能量储存物质,还是很多生物体的结构成分。
血液里的葡萄糖
甘蔗里的蔗糖
蜂蜜里的果糖
红薯里的淀粉
棉花里的纤维素
糖类的组成和分类
1.组成:
一般由碳、氢、氧三种元素组成,大多数糖符合通式Cm(H2O)n 又叫碳水化合物。
糖类一定符合通式Cm(H2O)n吗?符合通式Cm(H2O)n一定是糖类吗?
(2)符合Cm(H2O)n通式的物质不一定都是糖类化合物
(1)有些糖的分子式并不符合Cm(H2O)n
脱氧核糖 C5H10O4
乙酸 C2H4O2
甲醛 CH2O
(3)有甜味的不一定是糖,如甘油、木糖醇等;没有甜味的也可能是糖,
如淀粉、纤维素等。
鼠李糖 C6H12O5
碳水化合物这一名称并不准确,但因沿用已久,目前仍在使用。
糖类的组成和分类
从分子结构上看,糖类是多羟基醛、多羟基酮和它们的脱水缩合物。
2.定义:
葡萄糖——多羟基醛 果糖——多羟基酮
糖类的组成和分类
(1)单糖:不能水解的糖,如葡萄糖、果糖、核糖和脱氧核糖等。
(3)多糖:1mol糖水解后能产生10mol以上单糖,如淀粉、纤维素和糖原等。
(2)寡糖(低聚糖):1mol 糖水解后能产生2~10 mol单糖。
以二糖最为重要,常见的二糖有蔗糖、麦芽糖和乳糖等。
类别 单糖 二糖 多糖
代表物 葡萄糖、果糖 蔗糖、麦芽糖 淀粉、纤维素
化学式 C6H12O6 C12H22O11 (C6H10O5)n
结构关系 互为同分异构体 互为同分异构体 不是同分异构体
3.分类—根据糖类能否水解以及水解后的产物
糖类的组成和分类
糖类
还原性糖
非还原性糖
能与银氨溶液反应
能与氢氧化铜溶液反应
---醛糖,如葡萄糖
---酮糖
注意:果糖在稀碱溶液里发生酮式-烯醇式互变,使酮基变成醛基,
使得果糖具有还原性。
3.分类—根据是否具有还原性
单糖—葡萄糖
1.葡萄糖
存在于水果、蜂蜜,以及植物的种子、叶、根、花中。动物的血液和淋巴液中也含有葡萄糖。
(1)存在:
(3)物理性质:
易溶于水的无色晶体, 熔点146℃,有甜味,但甜度不如蔗糖。
(2)分子结构---多羟基醛:
CH2OH(CHOH)4CHO
结构简式:
单糖—葡萄糖
葡萄糖
【探究一】葡萄糖的分子结构
定性实验【实验4-1】
在一支洁净的试管中配制约2 mL银氨溶液,加入1 mL 10%葡萄糖溶液,振荡,然后在水浴中加热。观察实验现象。
在另一支试管中加入2 mL 10% NaOH溶液,加入5滴5% CuSO4溶液,再加入2 mL 10%葡萄糖溶液,加热。观察实验现象。
单糖—葡萄糖
(1)葡萄糖与银氨溶液
在一支洁净的试管中配制约2mL银氨溶液,加入lmL10%葡萄糖溶液,振荡,然后在水浴中加热。
CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
(工业制镜)
CH2OH(CHOH)4COONH4 + 2Ag↓ + 3NH3 + H2O
【实验4-1】
单糖—葡萄糖
(2)葡萄糖与新制氢氧化铜
在另一支试管中加入2mL10%NaOH溶液,加入5滴5%CuSO4溶液,再加入2mL10%葡萄糖溶液,加热。
现象:
生成砖红色沉淀
(医学检验糖尿病)
CH2OH(CHOH)4COONa + Cu2O↓ + 3H2O
CH2OH(CHOH)4CHO+2Cu(OH)2+NaOH
【实验4-1】
单糖—葡萄糖
化学性质
葡萄糖
结构简式
置换反应:与Na反应:1mol葡萄糖 2.5molH2
氧化反应:
消去反应
取代反应
酯化反应
与浓HX反应
分子间脱水成醚
与高锰酸钾、溴水等强氧化剂反应
与弱氧化剂氧化;
还原反应(加成反应)
单糖—葡萄糖
化学性质
葡萄糖易于被人体吸收,经酶的催化发生氧化反应放出热量,提供了维持生命活动所需要的能量。低血糖的患者可利用静脉注射葡萄糖溶液的方式来迅速补充营养。
生理代谢:有氧条件
C6H12O6+ 6O2 6CO2 + 6H2O
酶
葡萄糖
单糖—葡萄糖
化学性质
生理代谢:无氧条件
C6H12O6 2CH3CH(OH)COOH
酶
葡萄糖
乳酸
生理代谢:酿酒
C6H12O6 2CH3CH2OH + 2CO2
酒曲酶
葡萄糖
单糖—果糖
2.果糖---与葡萄糖互为同分异构体
(1)存在:
果糖于水果和蜂蜜中含量较高,它比蔗糖的甜度高。
(3)物理性质:
纯净的果糖为无色晶体,易溶于水,乙醇和乙醚,吸湿性强,熔点103~105℃,最甜的糖。
(2)分子结构---多羟基酮:
CH2OH(CHOH)3COCH2OH
结构简式:
果糖
纯净的果糖为无色晶体,易溶于水,吸湿性强。果糖是一种多羟基酮,属于酮糖。即使果糖中没有醛基,但能发生互变异构产生醛基,也能发生银镜反应。因此,果糖也属于还原糖。
葡萄糖
果糖
碱性环境
“六碳糖”
单糖—果糖
思考:如何鉴别葡萄糖与果糖呢?
葡萄糖是一种多羟基醛,果糖是一种多羟基酮,根据醛与酮性质的差异,可选用溴水鉴别二者。由于溴溶于水后生成的次溴酸可以氧化醛基,而不能氧化羰基,因此可用溴水鉴别葡萄糖和果糖。
单糖—果糖
单糖
核糖与脱氧核糖
核糖与脱氧核糖分别是生物体的遗传物质核糖核酸(RNA)与脱氧核糖核酸(DNA)的重要组成部分。它们都是含有5个碳原子的单糖 戊糖。
H—C—OH
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
H—C—H
—
H—C—OH
—
H—C—OH
—
H2C—OH
C
—
—
H
‖
O
核糖:C5H10O5
脱氧核糖:C5H10O4
蔗糖
蔗糖(C12H22O11)是最常用的甜味剂,也是自然界种分布最广的一种二糖。蔗糖为无色晶体,熔点186℃,易溶于水。冰糖、白糖、红糖等常见食糖的主要成分都是蔗糖。
甘蔗
甜菜
二糖—蔗糖
蔗糖
蔗糖的形成:1分子葡萄糖和1分子果糖脱去1分子水形成;
蔗糖的水解:
化学方程式中用分子式表示某种糖时,必须注明其名称!
酸或酶
C12H22O11+H2O
C6H12O6+ C6H12O6
蔗糖
葡萄糖
果糖
二糖—蔗糖
【分析一】验证蔗糖水解产物的还原性:
实验思路:
实验装置:
二糖—蔗糖
【分析一】验证蔗糖水解产物的还原性:
实验分析:
稀硫酸的作用:
热水浴的作用:
NaOH溶液的作用:
二糖—蔗糖
催化蔗糖水解;
加快蔗糖水解速率;
中和作催化剂的稀硫酸,防止其消耗Cu(OH)2,防止实验失败!
麦芽糖
麦芽糖(C12H22O11)主要存在于发芽的谷粒和麦芽中,是淀粉水解过程中的一种中间产物。麦芽糖有甜味,但甜度不及蔗糖。使用含淀粉酶的麦芽作用于淀粉可制得饴糖,其主要成分为麦芽糖。
发芽的小麦
饴糖
二糖—麦芽糖
蔗糖的形成:2分子葡萄糖脱去1分子水形成;
蔗糖的水解:
化学方程式中用分子式表示某种糖时,必须注明其名称!
麦芽糖
酸或酶
C12H22O11+H2O
2C6H12O6
麦芽糖
葡萄糖
二糖—麦芽糖
葡萄糖属于还原糖,蔗糖和麦芽糖是否属于还原糖
实验 步骤
实验 现象
实验 结论 蔗糖_______还原糖,麦芽糖_______还原糖 无明显现象
出现砖红色沉淀
不属于
属于
二糖—麦芽糖
二糖
乳糖
乳糖(C12H22O11)也是一种常见的二糖,主要存在于哺乳动物的乳汁中,可用于婴儿食品、糖果、药物的生产。部分人群由于肠道内缺乏乳糖酶导致乳糖消化吸收障碍,出现乳糖不耐受的症状(腹胀腹泻)。
乳糖
水解
脱水缩合
葡萄糖
半乳糖
多糖
淀粉和纤维素是最重要的多糖,它们都是由大量葡萄糖单元相互连接组成的,属于天然有机高分子,淀粉的相对分子质量可达到几十万,纤维素可达到几百万。由于二者n值不同,因此彼此不互为同分异构体!
粮食中的淀粉(C6H10O5)n
茎叶中的纤维素(C6H10O5)n
1.淀粉
淀粉是绿色植物光合作用的产物,是植物储存营养物质的一种形式,在种子、块茎中含量丰富,谷类和薯类含淀粉较多。
小麦
玉米
水稻
红薯
土豆
多糖—淀粉
1.淀粉
(1)物理性质:
(2)化学性质:
白色粉末状物质,没有甜味,不溶于冷水。
在热水中淀粉会部分溶解,形成胶状的淀粉糊。
淀粉遇碘显蓝色。
不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖;
在酸或酶的作用下水解。
(C6H10O5)n+nH2O nC6H12O6
酸或酶
淀粉 葡萄糖
直链淀粉
支链淀粉
(C6H10O5)n
多糖—淀粉
淀粉
【分析二】验证淀粉的水解程度:
现象A 现象B 结论
① 未出现银镜 溶液变蓝色
② 出现银镜 溶液变蓝色
③ 出现银镜 溶液不变蓝色
能不能在中和液中加碘水检验淀粉呢?
不可以!碱性环境下碘会反应,不能检验出淀粉!
多糖—淀粉
淀粉尚未水解
淀粉部分水解
淀粉完全水解
1.淀粉
(C6H10O5)n
淀粉/淀粉水解生成的葡萄糖
发酵
燃料乙醇、白酒、食醋、味精, 以及氨基酸、抗生素等药物。
淀粉酯化
可用于生产食品添加剂、表面活性剂和可降解塑料等
(3)用途
多糖—淀粉
2.纤维素
韭菜
秸秆
纤维素是自然界中分布最广泛的一种多糖,参与构成了植物的细胞壁,起着保护和支持作用。
棉花
木材
多糖—纤维素
2.纤维素
(1)物理性质:
(2)化学性质:
(C6H10O5)n
白色纤维状物质,没有甜味,不溶于水,也不溶于一般的有机溶剂。
不能被银氨溶液和氢氧化铜等弱氧化剂氧化,属于非还原糖;
在酸或酶的作用下水解。
(C6H10O5)n+nH2O nC6H12O6
酸或酶
纤维素 葡萄糖
多糖—纤维素
纤维素
化学性质:
酯化反应:
纤维素乙酸酯/醋酸纤维
应用:不易燃烧,可用于生产塑料、过滤膜、
胶片等!
多糖—纤维素
纤维素
化学性质:
酯化反应:
纤维素硝酸酯/硝酸纤维
应用:极易燃烧,可用于生产火药、塑料和涂
料等!
多糖—纤维素
2.纤维素
(3)用途
(C6H10O5)n
纤维素有利于人体的消化
棉和麻的纤维用于纺织工业;制造黏胶纤维。木材、稻草、秸杆、蔗渣等用于造纸
制造纤维素乙酸酯(醋酸纤维):不易燃烧,可用于生产塑料、过滤膜、胶片等
制造纤维素硝酸酯(硝酸纤维):极易燃烧。可用于生产火药、塑料和涂料等。
01
02
03
04
多糖—纤维素
