3.5有机合成课件(共61张ppt)化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.5有机合成课件(共61张ppt)化学人教版(2019)选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-11 19:21:02 | ||
图片预览







文档简介
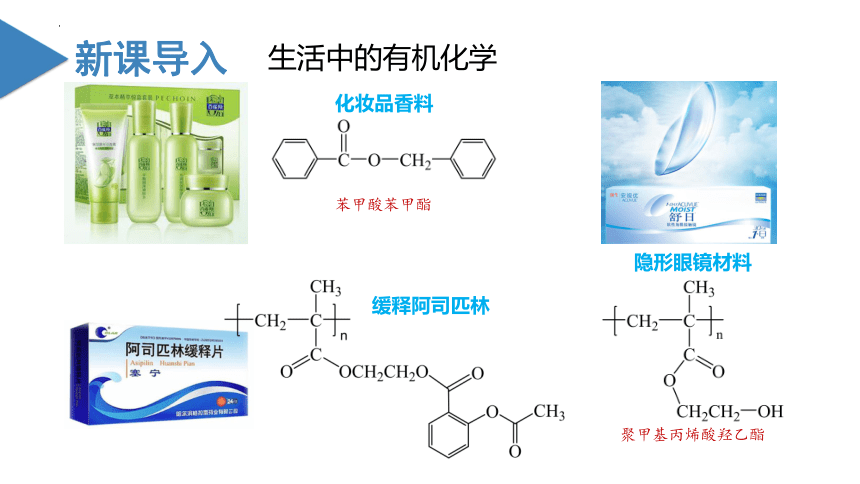
(共61张PPT)
第5节 有机合成
第三章 烃的衍生物
苯甲酸苯甲酯
化妆品香料
聚甲基丙烯酸羟乙酯
隐形眼镜材料
缓释阿司匹林
生活中的有机化学
苯甲酸苯甲酯
化妆品香料
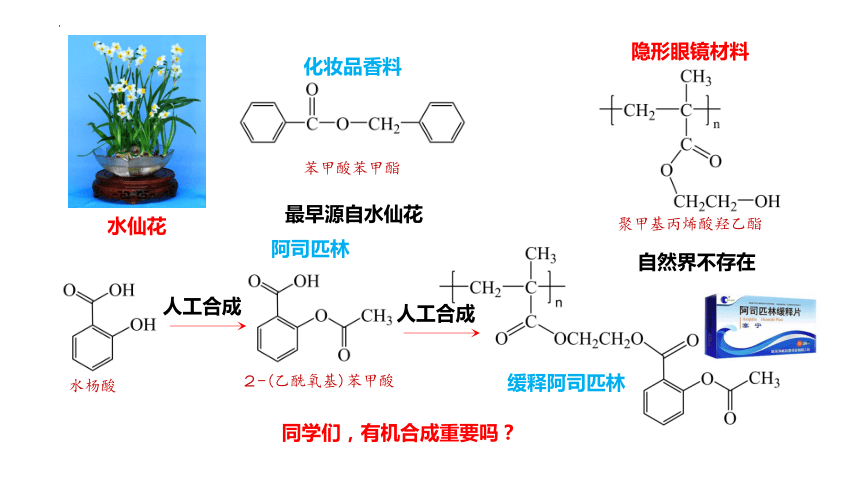
最早源自水仙花
水仙花
聚甲基丙烯酸羟乙酯
隐形眼镜材料
自然界不存在
同学们,有机合成重要吗?
2-(乙酰氧基)苯甲酸
阿司匹林
人工合成
水杨酸
人工合成
缓释阿司匹林
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
一、有机合成的过程
有机合成反应的常见装置
恒压分液漏斗
冷凝管
三颈烧瓶
温度计
有机合成
尽量选择____________的合成路线
1)原料选择
1.有机合成遵循的原则
廉价、易得、低毒、低污染
通常采用4个碳以下的单官能团化合物或单取代苯。
2)合成路线
尽量选择与目标化合物_____________的原料
步骤最少
结构相似
步骤越少,最后_____________越高。
产率
有机合成
3)绿色化学
1.有机合成遵循的原则
最大限度的利用原料分子的__________,达到_________。
4)合成优势
每个原子
零排放
操作简单、条件温和、能耗低、易实现
5)尊重事实
尊重客观事实,按一定反应顺序和规律引入________。
官能团
有机合成
有机合成的意义
①制备天然有机物,弥补自然资源的不足;
②对天然有机物进行局部的结构改造和修饰,使其性能更加完美;
③合成具有特定性质的、自然界并不存在的有机物,
以满足人类的特殊需要
阿司匹林缓释片
隐形眼镜材料
制备的维生素C
有机合成
目标化合物分子_ ____________和_______________。
2.有机合成的任务
碳骨架的构建
官能团的转化
碳链的增长或缩短、
成环或开环等
①官能团的引入: C=C 、卤素原子、 -OH 等
②官能团的消除和衍变
有机合成
二、有机合成的方法
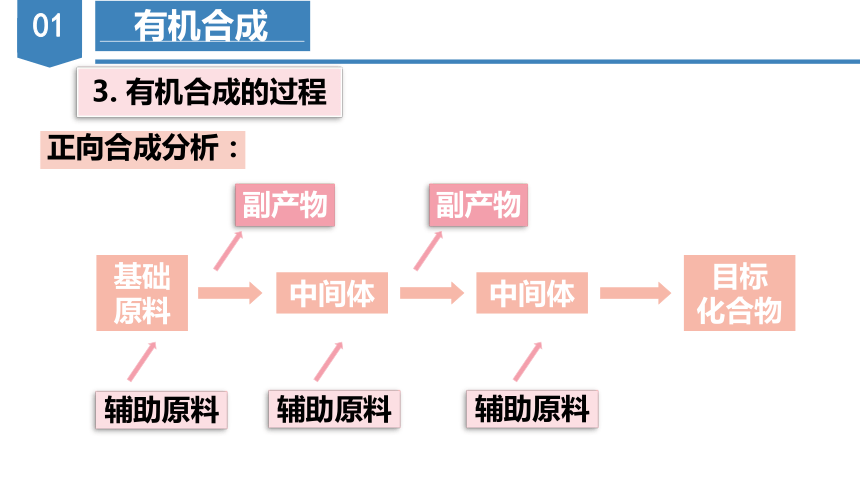
正合成法(正向思维)
逆合成法(逆向思维)
3. 有机合成的过程
基础原料
中间体
中间体
目标
化合物
副产物
副产物
辅助原料
辅助原料
辅助原料
正向合成分析:
有机合成
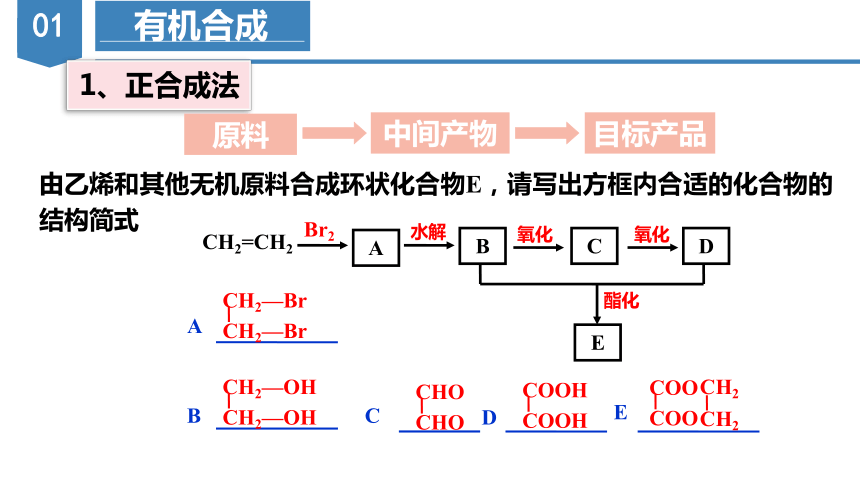
1、正合成法
中间产物
目标产品
原料
由乙烯和其他无机原料合成环状化合物E,请写出方框内合适的化合物的结构简式
CH2=CH2
A
酯化
氧化
氧化
B
D
E
C
Br2
水解
A
B
C
D
E
CH2—Br
CH2—Br
CH2—OH
CH2—OH
CHO
CHO
COOH
COOH
COO
COO
CH2
CH2
有机合成
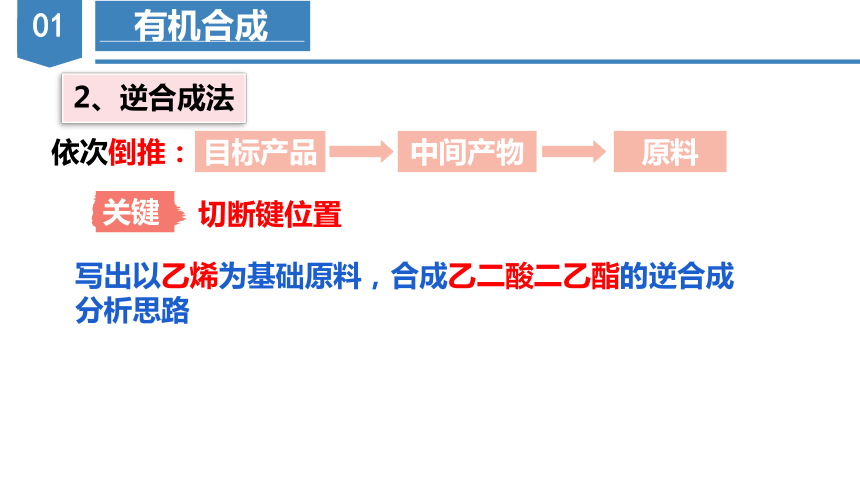
2、逆合成法
中间产物
目标产品
原料
依次倒推:
关键
切断键位置
写出以乙烯为基础原料,合成乙二酸二乙酯的逆合成分析思路
有机合成
2、逆合成法
利用逆向合成分析法分析乙烯如何合成乙二酸二乙酯。
C— OC2H5
C— OC2H5
O
O
COOH
COOH
2 CH3CH2OH
CH2OH
CH2OH
CH2Cl
CH2Cl
CH2
CH2
CH2
CH2
+ H2O
+ Cl2
石油裂解气
有机合成
2、逆合成法
利用逆向合成分析法分析如何合成乙二酸二乙酯。
C— OC2H5
C— OC2H5
O
O
COOH
COOH
2 CH3CH2OH
CH2OH
CH2OH
CH2Cl
CH2Cl
CH2
CH2
CH2
CH2
+ H2O
催化剂,▲
+ Cl2
石油裂解气
酯化反应
水解
氧化
【O】
有机合成
1.写出合成 的逆合成分析思路并写出各步反应方程式:
有机物原料库
苯、甲苯、乙烯、丙烯、乙炔、2—丁烯
CH3—CH=CH—CH3 + Br2
CH3—CH—CH—CH3
Br
Br
CH2=CH—CH=CH2
+ 2NaBr + 2H2O
CH3—CH—CH—CH3
Br
Br
+ 2NaOH
△
醇
CH2=CH—CH=CH2 + Br 2
CH2—CH=CH—CH2
Br
Br
+ 2HBr
CH2—CH=CH—CH2
Br
Br
+ 2H2O
△
NaOH
CH2—CH=CH—CH2
OH
OH
CH2=CH2 + Br 2
CH2—CH2
Br
Br
利用相对简单
易得的原料
具有特定结构和性质的目标分子
有机化学反应
合成
构建碳骨架
引入(优化)
官能团
碳链的增长
碳链的缩短
成环/开环
碳碳双键
碳碳三键
碳卤键
羟基
醛基
羧基
构建碳骨架
引入官能团
酯基
酮羰基
有机合成
有机合成的任务
种类 通式 官能团 分子结构特点 主要化学性质
烷烃 CnH2n+2 无 饱和键 取代反应:在光照时与气态卤素单质
烯烃 CnH2n(单烯烃) 碳碳双键: π键 (1)加成反应:与卤素单质、H2或H2O等能发生;
(2)氧化反应:能被酸性KMnO4溶液等强氧化剂氧化
炔烃 CnH2n-2(单炔烃) 碳碳三键:-C≡C- 卤代烃 一卤代烃: R-X 卤素原子:-X C-X键有极性,易断裂 (1)取代反应:与NaOH水溶液共热发生取代反应生成醇;
(2)消去反应:与NaOH醇溶液共热发生消去反应生成烯
醇 一元醇: R-OH 羟基:-OH 有C-O键和O-H键,有极性;-OH 与链烃基直接相连 (1)与活泼金属反应产生H2;
(2)与卤化氢或浓氢卤酸反应生成卤代烃;
(3)脱水反应:
乙醇 ;
(4)取代反应:与羧酸或无机含氧酸反应
(5)氧化反应:催化氧化为醛或酮;
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
种类 通式 官能团 分子结构特点 主要化学性质
醚 R-O-R 醚键: 性质稳定,一般不与酸、碱、氧化剂反应
酚 Ph-OH(Ph表示芳香基) 羟基:-OH -OH直接与苯基相连 (1)弱酸性:比碳酸酸性弱;
(2)取代反应:苯酚与浓溴水发生取代反应,生成白色沉淀2,4,6-三溴苯酚;
(3)显色反应:遇FeCl3(aq)呈紫色;
(4)氧化反应:氧化呈粉红色醌类物质
醛 醛基: C=O键有极性,具不饱和性 (1)加成反应:与H2发生加成反应生成醇;
(2)氧化反应:被氧化剂(O2、多伦试剂、斐林试剂、酸性高锰酸钾等)氧化为羧酸
羧酸 羧基: 受C=O影响,-OH键能够电离,产生H+ (1)酸性:具有酸的通性;
(2)取代反应:与醇发生酯化反应;
(3)能与含-NH2的物质生成酰胺;
(4)不能与H2发生加成反应
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
种类 通式 官能团 分子结构特点 主要化学性质
酯 酯基: 分子中RCO-和OR′之间的键容易断裂 取代反应:
(1)可发生水解反应生成羧酸(盐)和醇;
(2)可发生醇解反应生成新酯和新醇
氨基酸 RCH(NH2)COOH 氨基:-NH2, 羧基:-COOH -NH2有极性,易断裂 -COOH能电离,产生H+ (1)酸性:
(2)碱性:
(3)取代反应:能形成肽键 ( )
蛋白质 结构复杂无通式 肽键: , 氨基:-NH2, 羧基:-COOH 分子中RCO-和-NH-之间的键容易断裂 (1)具有两性;
(2)能发生水解反应;
(3)在一定条件下变性;
(4)含苯基的蛋白质遇浓硝酸变黄发生颜色反应;
(5)灼烧有特殊气味
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
种类 通式 官能团 分子结构特点 主要化学性质
糖 Cm(H2O)n 羟基:-OH, 醛基:-CHO, 羰基: O-H键,有极性,易断裂 C=O键有极性,具不饱和性 (1)氧化反应:含醛基的糖能发生银镜反应(或与新制氢氧化铜反应);
(2)加氢还原;
(3)酯化反应;
(4)多糖水解;
(5)葡萄糖发酵分解生成乙醇
油脂 酯基: 分子中RCO-和OR′之间的键容易断裂 (1)水解反应(在碱性溶液中的水解称为皂化反应);
(2)硬化反应
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
【知识重构2】常见有机反应类型与有机物类别的关系
反应条件 反应物及反应类型
NaOH水溶液、加热 卤代烃水解成醇,酯、酰胺水解反应
NaOH醇溶液、加热 卤代烃的消去反应
浓H2SO4、加热 醇消去反应,醇脱水成醚,酯化反应,苯的硝化、磺化等
稀H2SO4、加热 酯、低聚糖、多糖等的水解反应
溴水或溴的CCl4溶液 烯烃、炔烃的加成
浓溴水或饱和溴水 酚的取代反应
卤素单质、光照 多为饱和碳上的氢被取代
卤素单质、铁粉或FeX3 多为芳香烃发生苯环上的取代
O2/催化剂、加热 醇催化氧化为醛或酮,醛氧化成羧酸
新制Cu(OH)2或银氨溶液、加热 醛氧化成羧酸
KMnO4 多为有机物的氧化反应
H2、催化剂 烯烃(或炔烃)的加成,芳香烃的加成,酮、醛还原成醇的反应
构建碳骨架
1.碳链的增长
原料分子中的碳原子
目标分子中的碳原子
少于
引入含碳原子的官能团
1.引入-CN(氰基)
5.羟醛缩合反应
······
2.加聚反应
3.酯化反应
4.分子间脱水(取代反应)成醚
构建碳骨架
1.碳链的增长
(1)与HCN发生加成反应
CH3—C—CH3
O
催化剂
HCN
CH3—C—CN
OH
CH3
H2O,H+
CH3—C—COOH
OH
CH3
炔(烯)烃和醛(酮)中的不饱和键与HCN发生加成反应生成含有氰基(—CN)的物质,再经水解生成羧酸,或经催化加氢还原生成胺。
增加1个碳原子
(常考)
构建碳骨架
1.碳链的增长
(2)加聚反应
(3)酯化反应
(4)分子间脱水
具有α-H的醛,在碱催化下与另一分子的醛或酮进行亲核加成,生成β-羟基醛,β-羟基醛可以受热脱水生成α,β-不饱和醛
δ+
δ-
δ+
δ-
加热
O
CH3CH
H
CH2CHO
OH-
催化剂
O
CH3CH
H
CH2CHO
3-羟基丁醛
CH3CH
CHCHO
2-丁烯醛
巴豆醛
构建碳骨架
1.碳链的增长
(5)羟醛缩合反应
(极度常考)
【例1】完成下列羟醛缩合反应方程式的书写
H
C
O
H
C
O
CH
R
H
OH-
催化剂
加热
-H2O
H
C
O
H
H
C
O
C
H
R
H
C
H
C
O
C
R
H
C
O
H
H
C
O
CH
R
H
OH-
催化剂
加热
-H2O
H
C
O
H
H
H
C
O
C
H
R
H
C
H
H
C
O
C
R
构建碳骨架
常见信息题会出现的
(7)由卤代烃增长碳链
② CH3CH2Cl+NaCN→CH3CH2CN+NaCl
CH3C≡CNa+CH3CH2Cl→CH3C≡CCH2CH3+NaCl
③ 2CH3C≡CH+Na 2CH3C≡CNa+H2↑
液氨
① 2R—X +2Na
R—R+2NaX
④ + Cl-CH2CH3
无水AlCl3
CH2CH3
+ HCl
构建碳骨架
1.碳链的增长
(武兹反应)
⑤由格氏试剂与卤代烃、醛、酮反应增长碳链
R’—Cl
+ RMgCl
R’—R
+ MgCl2
RMgCl
RCl + Mg
无水乙醚
+ RMgCl
—OMgCl
R
H2O
—OH
R
构建碳骨架
1.碳链的增长
格林尼亚(Grignard)试剂
简称格氏试剂,1900年发现(29岁)
R X
Mg
RMgX
无水
乙醚
(X=Cl、Br)
【例1】通过格林试剂将丙酮合成1,1-二甲基丁醇
卤代烃与金属镁在无水乙醚中反应,可得格林试剂R—MgX,它可与醛、酮等羰基化合物加成:
O
MgBr
O
MgBr
H2O
O
H
+R—MgX
现欲合成(CH3)3C—OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
A.乙醛和氯乙烷 B.甲醛和1-溴丙烷
C.甲醛和2-溴丙烷 D.丙酮和一氯甲烷
D
碳链减短
1.碳链的减短
原料分子中的碳原子
目标分子中的碳原子
多于
断开碳链
你知道哪些缩短碳链的方法?
1.烃的裂化、裂解
4.某些芳香化合物的氧化反应
2.酯的水解反应
3.烯烃或炔烃的氧化反应
碳链减短
1.碳链的减短
(1)烷烃的分解反应(烃的裂化、裂解)
C4H10 CH4 + C3H6
△
(2)酯的水解反应(蛋白质水解、多糖水解)
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
(3)酰胺基的水解
CH3—C—NH2+ H2O CH3COOH+2NH3
O
HCl
△
(4)烯烃的氧化反应(常考)
KMnO4氧化反应
RCH=CH2
+
KMnO4/H+
RCOOH
CO2
+
C=CHR3
R2
R1
C=O
R2
R1
R3COOH
KMnO4/H+
烯烃
KMnO4/H+
CH3CH2C=O
CH3
+
O=CCH2CH2CH3
OH
二氢成气
一氢成酸
无氢成酮
碳链减短
CO2
(5)炔烃及芳香烃的侧链被KMnO4(H+)溶液氧化。
芳香烃:
炔烃:
RCOOH
RC≡CH
一氢成气、无氢成酸
与苯环相连的碳原子上至少连有一个氢原子才能被酸性KMnO4氧化。
碳链减短
练习3、下列反应能使碳链缩短的是( )
①烯烃被酸性KMnO4溶液氧化
②乙苯被酸性KMnO4溶液氧化
③重油裂化为汽油
④CH3COOCH3与NaOH溶液共热
⑤炔烃与溴水反应
A、①②③④⑤ B、②③④⑤
C、①②④⑤ D、①②③④
D
碳链减短
CH3CH=CH2
KMnO4/H+
CH3C≡CH
KMnO4/H+
CH3COOH + CO2
CH3COOH + CO2
CH3-CH=C-CH3
CH3
KMnO4/H+
CH3COOH +
CH3-C-CH3
=
O
练习1.完成下列方程式:
1.第尔斯-阿尔德反应(D-A反应)
2.形成环酯
3.形成环醚
成环/开环
共轭二烯烃加成
1.第尔斯-阿尔德反应(D-A反应)
成环/开环
共轭二烯烃1,4-加成
CH3CHCH2CH2C—OH
O
═
OH
CH—CH2
O CH2
C
O
═
H3C
+H2O
浓硫酸
△
2CH3—CH—C—OH
O
═
OH
+2H2O
CH3
O
C
═
O
O
C
═
O
CH3
浓硫酸
△
COOH
COOH
CH2OH
CH2OH
+
+2H2O
COOCH2
COOCH2
浓硫酸
△
2.形成环酯
成环/开环
OH
CH2-CH2
OH
CH2-CH2
O
+H2O
浓硫酸
+2H2O
浓硫酸
CH2OH
CH2OH
HOCH2
HOCH2
+
H2C
H2C
CH2
CH2
O
O
3、形成环醚
成环/开环
4、形成环酰胺类
+
△
+
△
碳链的开环
(1)环酯水解开环
(2)环烯烃氧化开环
KMnO4
H+
HOOC
HOOC
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
稀硫酸
△
稀H2SO4
Δ
CH2CH2
CH2—C
═
O
O
+H2O
CH2—CH2OH
CH2—C—OH
═
O
②Zn/H2O
①O3
OHCCH2CH2CH2CH2CHO
化合物丙是合成一种医药的中间体,可以通过如图反应制得。下列说法正确的是( )
A.乙的分子式为C5H10O2
B.甲的一氯代物有4种(不考虑立体异构)
C.乙可以发生取代反应、加成反应
D.丙不能使酸性高锰酸钾溶液褪色
C
构建碳骨架
碳链增长
碳链减短
成环/开环
利用相对简单
易得的原料
具有特定结构和性质的目标分子
有机化学反应
合成
构建碳骨架
引入官能团
碳链的增长
碳链的缩短
成环
碳碳双键
碳卤键
羟基
醛基
羧基
构建碳骨架
引入官能团
酯基
有机合成的主要任务
(一)引入碳碳双键
CH3CH2Br+NaOH
乙醇
2.醇的消去
1.卤代烃的消去
CH3CH2OH
CH2=CH2↑+H2O
浓硫酸
170℃
3.炔烃的不完全加成
CH≡CH+HCl
CH2=CHCl
催化剂
CH2=CH2↑+NaBr+H2O
引入官能团
CH4+Cl2 CH3Cl+HCl
光
↑
液溴
1.卤代反应
光
-CH3+Cl2
-CH2Cl+HCl
饱和溴水
-OH+3Br2
+3HBr
(二)引入碳卤键
引入官能团
CH3CH2 OH + H Br CH3CH2 Br +H2O
(浓溶液)
3.不饱和烃与X2、HX加成
CH2=CH2+Br2 CH2BrCH2Br
CH2=CH2+HCl CH2ClCH3
2.醇与HX取代
(二)引入碳卤键
CH≡CH+HCl
CH2=CHCl
催化剂
引入官能团
CH2=CH2+H2O CH3CH2OH
催化剂
加热、加压
2.醛/酮与H2加成
催化剂
CH3CHO+H2 CH3CH2OH
O
‖
CH3-C-CH3+H2 CH3-C-CH3
催化剂
OH
CH3CH2CH2Cl+NaOH CH3CH2CH2OH+NaCl
H2O
3.卤代烃的水解
1.烯烃与水加成
(三)引入羟基
引入官能团
CH3COOC2H5+NaOH CH3COONa+C2H5OH
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
4.酯的水解
(三)引入羟基
引入官能团
2.炔烃与水的加成反应
CH3CHCl2
NaOH、H2O
CH3CHO
3.二卤代烃水解
1.醇的氧化反应
(四)引入醛基
催化剂
CH3CH2OH+O2 CH3CHO+H2O
CH≡CH+H2O
CH3CHO
催化剂
引入官能团
同一碳原子上有两个羟基会脱去一分子水转化为醛基
CH3CH2OH
CH3COOH
KMnO4(H+)
2CH3CHO+O2
2CH3COOH
催化剂
2.醛的氧化
3.烯烃、炔烃、某些芳香化合物被酸性KMnO4氧化
KMnO4
H+
R-CH=CH2 RCOOH+CO2↑
KMnO4
H+
1.醇的氧化
(五)引入羧基
引入官能团
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
5.氰基的水解(酸性环境)
H2O
H+
CH3CH2CN CH3CH2COOH
4.酯的水解(酸性环境)
(五)引入羧基
CH3CCl3
NaOH、H2O
CH3COOH
6.三卤代烃水解
引入官能团
①酯化反应
②酰氯醇解
O
-C-
Cl
CH3
+
CH3OH
无水操作
O
-C-OCH3
+HCl
CH3
=
=
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
引入官能团
(六)引入酯基
下列说法错误的是( )
A.③发生氧化反应,⑥发生消去反应
B.M的结构简式为CH3CH2X
C.P的分子式为C4H10O
D.2-丁烯与Br2以1∶1加成可得三种不同产物
已知: +R—MgX
由乙醇合成CH3CH==CHCH3(2-丁烯)的流程如下:
D
官能团的保护
含有多个官能团的有机化合物在进行反应时,非目标官能团也可能受到影响,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。
醇羟基的保护
先将羟基转化为醚键,使醇转化为比较稳定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作用的基团(保护基),恢复羟基。
问:设计A、B两步的目的是什么?
防止碳碳双键被氧化
1.以HOCH2-CH=CH-CH2OH为原料合成HOOC-CH=CH-COOH
HOCH2-CH=CH-CH2OH
HOCH2-CHCl-CH2-CH2OH
HOOC-CHCl-CH2-COOH
HOOC-CH=CH-COOH
A
B
C
1.下列有机合成中①②步骤的目的是什么?
提示 ①保护酚羟基不被氧化;
②引入羧基。
2.有机合成的设计流程中有如下环节,其目的是什么?
提示 保护羰基不被反应。
01
02
03
构建碳骨架
引入官能团
官能团的保护
碳链的增长和缩短、成环/开环
途径:取代、加成、消去、氧化、还原
防止非目标官能团受到影响
【例1】已知溴乙烷与氰化钠反应后再水解可以得到丙酸:
CH3CH2Br CH3CH2CN CH3CH2COOH
产物分子比原化合物分子多了一个碳原子,增长了碳链。请根据以下框图回答问题。
NaCN
H2O
图中F分子中含有8个原子组成的环状结构。
(1)反应①②③中属于取代反应的是________(填反应序号)。
(2)写出结构简式:E__________________,F_______________________
______________________________。
②③
CH3
CH
CH2
HOOC
COOH
CH3
CH
CH
COO
CH2
CH3
COO
CH2
或
CH3
CH
CH2
COO
CH2
CH3
COO
CH
【例2】
3.中国科学院上海有机化学研究所人工合成了青蒿素,其部分合成路线如图所示:
下列说法中正确的是
A.“乙→丙”发生了消去反应 B.香茅醛不存在顺反异构现象
C.甲遇浓溴水产生白色沉淀 D.香茅醛可形成分子内氢键
香茅醛中有醛基,醛基中的氧原子可以和其他的-OH等的氢原子之间形成氢键,但不能形成分子内氢键
B
氧化反应
同一个碳上连了两个甲基,不存在顺反异构现象
属于醇类,不属于酚类,遇浓溴水不产生白色沉淀,
第5节 有机合成
第三章 烃的衍生物
苯甲酸苯甲酯
化妆品香料
聚甲基丙烯酸羟乙酯
隐形眼镜材料
缓释阿司匹林
生活中的有机化学
苯甲酸苯甲酯
化妆品香料
最早源自水仙花
水仙花
聚甲基丙烯酸羟乙酯
隐形眼镜材料
自然界不存在
同学们,有机合成重要吗?
2-(乙酰氧基)苯甲酸
阿司匹林
人工合成
水杨酸
人工合成
缓释阿司匹林
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
一、有机合成的过程
有机合成反应的常见装置
恒压分液漏斗
冷凝管
三颈烧瓶
温度计
有机合成
尽量选择____________的合成路线
1)原料选择
1.有机合成遵循的原则
廉价、易得、低毒、低污染
通常采用4个碳以下的单官能团化合物或单取代苯。
2)合成路线
尽量选择与目标化合物_____________的原料
步骤最少
结构相似
步骤越少,最后_____________越高。
产率
有机合成
3)绿色化学
1.有机合成遵循的原则
最大限度的利用原料分子的__________,达到_________。
4)合成优势
每个原子
零排放
操作简单、条件温和、能耗低、易实现
5)尊重事实
尊重客观事实,按一定反应顺序和规律引入________。
官能团
有机合成
有机合成的意义
①制备天然有机物,弥补自然资源的不足;
②对天然有机物进行局部的结构改造和修饰,使其性能更加完美;
③合成具有特定性质的、自然界并不存在的有机物,
以满足人类的特殊需要
阿司匹林缓释片
隐形眼镜材料
制备的维生素C
有机合成
目标化合物分子_ ____________和_______________。
2.有机合成的任务
碳骨架的构建
官能团的转化
碳链的增长或缩短、
成环或开环等
①官能团的引入: C=C 、卤素原子、 -OH 等
②官能团的消除和衍变
有机合成
二、有机合成的方法
正合成法(正向思维)
逆合成法(逆向思维)
3. 有机合成的过程
基础原料
中间体
中间体
目标
化合物
副产物
副产物
辅助原料
辅助原料
辅助原料
正向合成分析:
有机合成
1、正合成法
中间产物
目标产品
原料
由乙烯和其他无机原料合成环状化合物E,请写出方框内合适的化合物的结构简式
CH2=CH2
A
酯化
氧化
氧化
B
D
E
C
Br2
水解
A
B
C
D
E
CH2—Br
CH2—Br
CH2—OH
CH2—OH
CHO
CHO
COOH
COOH
COO
COO
CH2
CH2
有机合成
2、逆合成法
中间产物
目标产品
原料
依次倒推:
关键
切断键位置
写出以乙烯为基础原料,合成乙二酸二乙酯的逆合成分析思路
有机合成
2、逆合成法
利用逆向合成分析法分析乙烯如何合成乙二酸二乙酯。
C— OC2H5
C— OC2H5
O
O
COOH
COOH
2 CH3CH2OH
CH2OH
CH2OH
CH2Cl
CH2Cl
CH2
CH2
CH2
CH2
+ H2O
+ Cl2
石油裂解气
有机合成
2、逆合成法
利用逆向合成分析法分析如何合成乙二酸二乙酯。
C— OC2H5
C— OC2H5
O
O
COOH
COOH
2 CH3CH2OH
CH2OH
CH2OH
CH2Cl
CH2Cl
CH2
CH2
CH2
CH2
+ H2O
催化剂,▲
+ Cl2
石油裂解气
酯化反应
水解
氧化
【O】
有机合成
1.写出合成 的逆合成分析思路并写出各步反应方程式:
有机物原料库
苯、甲苯、乙烯、丙烯、乙炔、2—丁烯
CH3—CH=CH—CH3 + Br2
CH3—CH—CH—CH3
Br
Br
CH2=CH—CH=CH2
+ 2NaBr + 2H2O
CH3—CH—CH—CH3
Br
Br
+ 2NaOH
△
醇
CH2=CH—CH=CH2 + Br 2
CH2—CH=CH—CH2
Br
Br
+ 2HBr
CH2—CH=CH—CH2
Br
Br
+ 2H2O
△
NaOH
CH2—CH=CH—CH2
OH
OH
CH2=CH2 + Br 2
CH2—CH2
Br
Br
利用相对简单
易得的原料
具有特定结构和性质的目标分子
有机化学反应
合成
构建碳骨架
引入(优化)
官能团
碳链的增长
碳链的缩短
成环/开环
碳碳双键
碳碳三键
碳卤键
羟基
醛基
羧基
构建碳骨架
引入官能团
酯基
酮羰基
有机合成
有机合成的任务
种类 通式 官能团 分子结构特点 主要化学性质
烷烃 CnH2n+2 无 饱和键 取代反应:在光照时与气态卤素单质
烯烃 CnH2n(单烯烃) 碳碳双键: π键 (1)加成反应:与卤素单质、H2或H2O等能发生;
(2)氧化反应:能被酸性KMnO4溶液等强氧化剂氧化
炔烃 CnH2n-2(单炔烃) 碳碳三键:-C≡C- 卤代烃 一卤代烃: R-X 卤素原子:-X C-X键有极性,易断裂 (1)取代反应:与NaOH水溶液共热发生取代反应生成醇;
(2)消去反应:与NaOH醇溶液共热发生消去反应生成烯
醇 一元醇: R-OH 羟基:-OH 有C-O键和O-H键,有极性;-OH 与链烃基直接相连 (1)与活泼金属反应产生H2;
(2)与卤化氢或浓氢卤酸反应生成卤代烃;
(3)脱水反应:
乙醇 ;
(4)取代反应:与羧酸或无机含氧酸反应
(5)氧化反应:催化氧化为醛或酮;
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
种类 通式 官能团 分子结构特点 主要化学性质
醚 R-O-R 醚键: 性质稳定,一般不与酸、碱、氧化剂反应
酚 Ph-OH(Ph表示芳香基) 羟基:-OH -OH直接与苯基相连 (1)弱酸性:比碳酸酸性弱;
(2)取代反应:苯酚与浓溴水发生取代反应,生成白色沉淀2,4,6-三溴苯酚;
(3)显色反应:遇FeCl3(aq)呈紫色;
(4)氧化反应:氧化呈粉红色醌类物质
醛 醛基: C=O键有极性,具不饱和性 (1)加成反应:与H2发生加成反应生成醇;
(2)氧化反应:被氧化剂(O2、多伦试剂、斐林试剂、酸性高锰酸钾等)氧化为羧酸
羧酸 羧基: 受C=O影响,-OH键能够电离,产生H+ (1)酸性:具有酸的通性;
(2)取代反应:与醇发生酯化反应;
(3)能与含-NH2的物质生成酰胺;
(4)不能与H2发生加成反应
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
种类 通式 官能团 分子结构特点 主要化学性质
酯 酯基: 分子中RCO-和OR′之间的键容易断裂 取代反应:
(1)可发生水解反应生成羧酸(盐)和醇;
(2)可发生醇解反应生成新酯和新醇
氨基酸 RCH(NH2)COOH 氨基:-NH2, 羧基:-COOH -NH2有极性,易断裂 -COOH能电离,产生H+ (1)酸性:
(2)碱性:
(3)取代反应:能形成肽键 ( )
蛋白质 结构复杂无通式 肽键: , 氨基:-NH2, 羧基:-COOH 分子中RCO-和-NH-之间的键容易断裂 (1)具有两性;
(2)能发生水解反应;
(3)在一定条件下变性;
(4)含苯基的蛋白质遇浓硝酸变黄发生颜色反应;
(5)灼烧有特殊气味
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
种类 通式 官能团 分子结构特点 主要化学性质
糖 Cm(H2O)n 羟基:-OH, 醛基:-CHO, 羰基: O-H键,有极性,易断裂 C=O键有极性,具不饱和性 (1)氧化反应:含醛基的糖能发生银镜反应(或与新制氢氧化铜反应);
(2)加氢还原;
(3)酯化反应;
(4)多糖水解;
(5)葡萄糖发酵分解生成乙醇
油脂 酯基: 分子中RCO-和OR′之间的键容易断裂 (1)水解反应(在碱性溶液中的水解称为皂化反应);
(2)硬化反应
【知识重构1】烃和烃的衍生物的重要类别和主要化学性质
【知识重构2】常见有机反应类型与有机物类别的关系
反应条件 反应物及反应类型
NaOH水溶液、加热 卤代烃水解成醇,酯、酰胺水解反应
NaOH醇溶液、加热 卤代烃的消去反应
浓H2SO4、加热 醇消去反应,醇脱水成醚,酯化反应,苯的硝化、磺化等
稀H2SO4、加热 酯、低聚糖、多糖等的水解反应
溴水或溴的CCl4溶液 烯烃、炔烃的加成
浓溴水或饱和溴水 酚的取代反应
卤素单质、光照 多为饱和碳上的氢被取代
卤素单质、铁粉或FeX3 多为芳香烃发生苯环上的取代
O2/催化剂、加热 醇催化氧化为醛或酮,醛氧化成羧酸
新制Cu(OH)2或银氨溶液、加热 醛氧化成羧酸
KMnO4 多为有机物的氧化反应
H2、催化剂 烯烃(或炔烃)的加成,芳香烃的加成,酮、醛还原成醇的反应
构建碳骨架
1.碳链的增长
原料分子中的碳原子
目标分子中的碳原子
少于
引入含碳原子的官能团
1.引入-CN(氰基)
5.羟醛缩合反应
······
2.加聚反应
3.酯化反应
4.分子间脱水(取代反应)成醚
构建碳骨架
1.碳链的增长
(1)与HCN发生加成反应
CH3—C—CH3
O
催化剂
HCN
CH3—C—CN
OH
CH3
H2O,H+
CH3—C—COOH
OH
CH3
炔(烯)烃和醛(酮)中的不饱和键与HCN发生加成反应生成含有氰基(—CN)的物质,再经水解生成羧酸,或经催化加氢还原生成胺。
增加1个碳原子
(常考)
构建碳骨架
1.碳链的增长
(2)加聚反应
(3)酯化反应
(4)分子间脱水
具有α-H的醛,在碱催化下与另一分子的醛或酮进行亲核加成,生成β-羟基醛,β-羟基醛可以受热脱水生成α,β-不饱和醛
δ+
δ-
δ+
δ-
加热
O
CH3CH
H
CH2CHO
OH-
催化剂
O
CH3CH
H
CH2CHO
3-羟基丁醛
CH3CH
CHCHO
2-丁烯醛
巴豆醛
构建碳骨架
1.碳链的增长
(5)羟醛缩合反应
(极度常考)
【例1】完成下列羟醛缩合反应方程式的书写
H
C
O
H
C
O
CH
R
H
OH-
催化剂
加热
-H2O
H
C
O
H
H
C
O
C
H
R
H
C
H
C
O
C
R
H
C
O
H
H
C
O
CH
R
H
OH-
催化剂
加热
-H2O
H
C
O
H
H
H
C
O
C
H
R
H
C
H
H
C
O
C
R
构建碳骨架
常见信息题会出现的
(7)由卤代烃增长碳链
② CH3CH2Cl+NaCN→CH3CH2CN+NaCl
CH3C≡CNa+CH3CH2Cl→CH3C≡CCH2CH3+NaCl
③ 2CH3C≡CH+Na 2CH3C≡CNa+H2↑
液氨
① 2R—X +2Na
R—R+2NaX
④ + Cl-CH2CH3
无水AlCl3
CH2CH3
+ HCl
构建碳骨架
1.碳链的增长
(武兹反应)
⑤由格氏试剂与卤代烃、醛、酮反应增长碳链
R’—Cl
+ RMgCl
R’—R
+ MgCl2
RMgCl
RCl + Mg
无水乙醚
+ RMgCl
—OMgCl
R
H2O
—OH
R
构建碳骨架
1.碳链的增长
格林尼亚(Grignard)试剂
简称格氏试剂,1900年发现(29岁)
R X
Mg
RMgX
无水
乙醚
(X=Cl、Br)
【例1】通过格林试剂将丙酮合成1,1-二甲基丁醇
卤代烃与金属镁在无水乙醚中反应,可得格林试剂R—MgX,它可与醛、酮等羰基化合物加成:
O
MgBr
O
MgBr
H2O
O
H
+R—MgX
现欲合成(CH3)3C—OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
A.乙醛和氯乙烷 B.甲醛和1-溴丙烷
C.甲醛和2-溴丙烷 D.丙酮和一氯甲烷
D
碳链减短
1.碳链的减短
原料分子中的碳原子
目标分子中的碳原子
多于
断开碳链
你知道哪些缩短碳链的方法?
1.烃的裂化、裂解
4.某些芳香化合物的氧化反应
2.酯的水解反应
3.烯烃或炔烃的氧化反应
碳链减短
1.碳链的减短
(1)烷烃的分解反应(烃的裂化、裂解)
C4H10 CH4 + C3H6
△
(2)酯的水解反应(蛋白质水解、多糖水解)
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
(3)酰胺基的水解
CH3—C—NH2+ H2O CH3COOH+2NH3
O
HCl
△
(4)烯烃的氧化反应(常考)
KMnO4氧化反应
RCH=CH2
+
KMnO4/H+
RCOOH
CO2
+
C=CHR3
R2
R1
C=O
R2
R1
R3COOH
KMnO4/H+
烯烃
KMnO4/H+
CH3CH2C=O
CH3
+
O=CCH2CH2CH3
OH
二氢成气
一氢成酸
无氢成酮
碳链减短
CO2
(5)炔烃及芳香烃的侧链被KMnO4(H+)溶液氧化。
芳香烃:
炔烃:
RCOOH
RC≡CH
一氢成气、无氢成酸
与苯环相连的碳原子上至少连有一个氢原子才能被酸性KMnO4氧化。
碳链减短
练习3、下列反应能使碳链缩短的是( )
①烯烃被酸性KMnO4溶液氧化
②乙苯被酸性KMnO4溶液氧化
③重油裂化为汽油
④CH3COOCH3与NaOH溶液共热
⑤炔烃与溴水反应
A、①②③④⑤ B、②③④⑤
C、①②④⑤ D、①②③④
D
碳链减短
CH3CH=CH2
KMnO4/H+
CH3C≡CH
KMnO4/H+
CH3COOH + CO2
CH3COOH + CO2
CH3-CH=C-CH3
CH3
KMnO4/H+
CH3COOH +
CH3-C-CH3
=
O
练习1.完成下列方程式:
1.第尔斯-阿尔德反应(D-A反应)
2.形成环酯
3.形成环醚
成环/开环
共轭二烯烃加成
1.第尔斯-阿尔德反应(D-A反应)
成环/开环
共轭二烯烃1,4-加成
CH3CHCH2CH2C—OH
O
═
OH
CH—CH2
O CH2
C
O
═
H3C
+H2O
浓硫酸
△
2CH3—CH—C—OH
O
═
OH
+2H2O
CH3
O
C
═
O
O
C
═
O
CH3
浓硫酸
△
COOH
COOH
CH2OH
CH2OH
+
+2H2O
COOCH2
COOCH2
浓硫酸
△
2.形成环酯
成环/开环
OH
CH2-CH2
OH
CH2-CH2
O
+H2O
浓硫酸
+2H2O
浓硫酸
CH2OH
CH2OH
HOCH2
HOCH2
+
H2C
H2C
CH2
CH2
O
O
3、形成环醚
成环/开环
4、形成环酰胺类
+
△
+
△
碳链的开环
(1)环酯水解开环
(2)环烯烃氧化开环
KMnO4
H+
HOOC
HOOC
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
稀硫酸
△
稀H2SO4
Δ
CH2CH2
CH2—C
═
O
O
+H2O
CH2—CH2OH
CH2—C—OH
═
O
②Zn/H2O
①O3
OHCCH2CH2CH2CH2CHO
化合物丙是合成一种医药的中间体,可以通过如图反应制得。下列说法正确的是( )
A.乙的分子式为C5H10O2
B.甲的一氯代物有4种(不考虑立体异构)
C.乙可以发生取代反应、加成反应
D.丙不能使酸性高锰酸钾溶液褪色
C
构建碳骨架
碳链增长
碳链减短
成环/开环
利用相对简单
易得的原料
具有特定结构和性质的目标分子
有机化学反应
合成
构建碳骨架
引入官能团
碳链的增长
碳链的缩短
成环
碳碳双键
碳卤键
羟基
醛基
羧基
构建碳骨架
引入官能团
酯基
有机合成的主要任务
(一)引入碳碳双键
CH3CH2Br+NaOH
乙醇
2.醇的消去
1.卤代烃的消去
CH3CH2OH
CH2=CH2↑+H2O
浓硫酸
170℃
3.炔烃的不完全加成
CH≡CH+HCl
CH2=CHCl
催化剂
CH2=CH2↑+NaBr+H2O
引入官能团
CH4+Cl2 CH3Cl+HCl
光
↑
液溴
1.卤代反应
光
-CH3+Cl2
-CH2Cl+HCl
饱和溴水
-OH+3Br2
+3HBr
(二)引入碳卤键
引入官能团
CH3CH2 OH + H Br CH3CH2 Br +H2O
(浓溶液)
3.不饱和烃与X2、HX加成
CH2=CH2+Br2 CH2BrCH2Br
CH2=CH2+HCl CH2ClCH3
2.醇与HX取代
(二)引入碳卤键
CH≡CH+HCl
CH2=CHCl
催化剂
引入官能团
CH2=CH2+H2O CH3CH2OH
催化剂
加热、加压
2.醛/酮与H2加成
催化剂
CH3CHO+H2 CH3CH2OH
O
‖
CH3-C-CH3+H2 CH3-C-CH3
催化剂
OH
CH3CH2CH2Cl+NaOH CH3CH2CH2OH+NaCl
H2O
3.卤代烃的水解
1.烯烃与水加成
(三)引入羟基
引入官能团
CH3COOC2H5+NaOH CH3COONa+C2H5OH
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
4.酯的水解
(三)引入羟基
引入官能团
2.炔烃与水的加成反应
CH3CHCl2
NaOH、H2O
CH3CHO
3.二卤代烃水解
1.醇的氧化反应
(四)引入醛基
催化剂
CH3CH2OH+O2 CH3CHO+H2O
CH≡CH+H2O
CH3CHO
催化剂
引入官能团
同一碳原子上有两个羟基会脱去一分子水转化为醛基
CH3CH2OH
CH3COOH
KMnO4(H+)
2CH3CHO+O2
2CH3COOH
催化剂
2.醛的氧化
3.烯烃、炔烃、某些芳香化合物被酸性KMnO4氧化
KMnO4
H+
R-CH=CH2 RCOOH+CO2↑
KMnO4
H+
1.醇的氧化
(五)引入羧基
引入官能团
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
5.氰基的水解(酸性环境)
H2O
H+
CH3CH2CN CH3CH2COOH
4.酯的水解(酸性环境)
(五)引入羧基
CH3CCl3
NaOH、H2O
CH3COOH
6.三卤代烃水解
引入官能团
①酯化反应
②酰氯醇解
O
-C-
Cl
CH3
+
CH3OH
无水操作
O
-C-OCH3
+HCl
CH3
=
=
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
引入官能团
(六)引入酯基
下列说法错误的是( )
A.③发生氧化反应,⑥发生消去反应
B.M的结构简式为CH3CH2X
C.P的分子式为C4H10O
D.2-丁烯与Br2以1∶1加成可得三种不同产物
已知: +R—MgX
由乙醇合成CH3CH==CHCH3(2-丁烯)的流程如下:
D
官能团的保护
含有多个官能团的有机化合物在进行反应时,非目标官能团也可能受到影响,先将其转化为不受该反应影响的其他官能团,反应后再转化复原。
醇羟基的保护
先将羟基转化为醚键,使醇转化为比较稳定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作用的基团(保护基),恢复羟基。
问:设计A、B两步的目的是什么?
防止碳碳双键被氧化
1.以HOCH2-CH=CH-CH2OH为原料合成HOOC-CH=CH-COOH
HOCH2-CH=CH-CH2OH
HOCH2-CHCl-CH2-CH2OH
HOOC-CHCl-CH2-COOH
HOOC-CH=CH-COOH
A
B
C
1.下列有机合成中①②步骤的目的是什么?
提示 ①保护酚羟基不被氧化;
②引入羧基。
2.有机合成的设计流程中有如下环节,其目的是什么?
提示 保护羰基不被反应。
01
02
03
构建碳骨架
引入官能团
官能团的保护
碳链的增长和缩短、成环/开环
途径:取代、加成、消去、氧化、还原
防止非目标官能团受到影响
【例1】已知溴乙烷与氰化钠反应后再水解可以得到丙酸:
CH3CH2Br CH3CH2CN CH3CH2COOH
产物分子比原化合物分子多了一个碳原子,增长了碳链。请根据以下框图回答问题。
NaCN
H2O
图中F分子中含有8个原子组成的环状结构。
(1)反应①②③中属于取代反应的是________(填反应序号)。
(2)写出结构简式:E__________________,F_______________________
______________________________。
②③
CH3
CH
CH2
HOOC
COOH
CH3
CH
CH
COO
CH2
CH3
COO
CH2
或
CH3
CH
CH2
COO
CH2
CH3
COO
CH
【例2】
3.中国科学院上海有机化学研究所人工合成了青蒿素,其部分合成路线如图所示:
下列说法中正确的是
A.“乙→丙”发生了消去反应 B.香茅醛不存在顺反异构现象
C.甲遇浓溴水产生白色沉淀 D.香茅醛可形成分子内氢键
香茅醛中有醛基,醛基中的氧原子可以和其他的-OH等的氢原子之间形成氢键,但不能形成分子内氢键
B
氧化反应
同一个碳上连了两个甲基,不存在顺反异构现象
属于醇类,不属于酚类,遇浓溴水不产生白色沉淀,
