化学人教版(2019)选择性必修3 3.4.1乙酸(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 3.4.1乙酸(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 123.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-12 08:02:36 | ||
图片预览



文档简介
(共23张PPT)
人教版化学 选择性必修3
第三章 烃的衍生物
第四节 羧酸
第1课时 乙酸
食醋是中国古代劳动人民发明传统调味品,流传至今的是中国四大名醋,食醋中含有3% ~ 5%的乙酸,故乙酸又被称为醋酸。
羧酸的结构
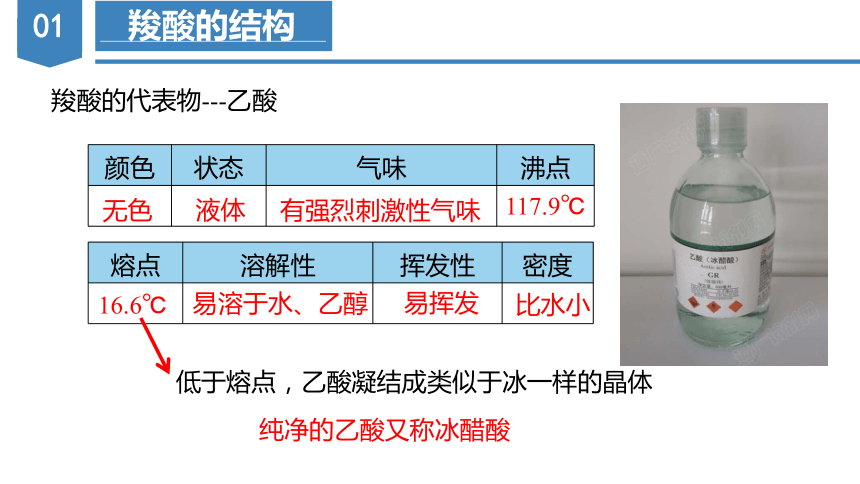
羧酸的代表物---乙酸
颜色 状态 气味 沸点
熔点 溶解性 挥发性 密度
无色
液体
有强烈刺激性气味
易溶于水、乙醇
易挥发
比水小
16.6℃
纯净的乙酸又称冰醋酸
低于熔点,乙酸凝结成类似于冰一样的晶体
117.9℃
羧酸的结构
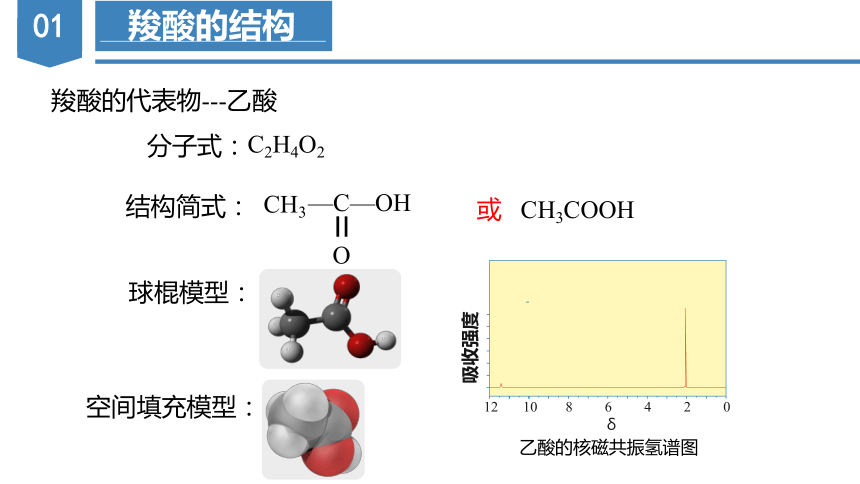
羧酸的代表物---乙酸
分子式:
结构简式:
球棍模型:
空间填充模型:
C2H4O2
或 CH3COOH
CH3
O
—C—OH
12
10
0
4
6
8
2
吸收强度
δ
乙酸的核磁共振氢谱图
羧酸的性质
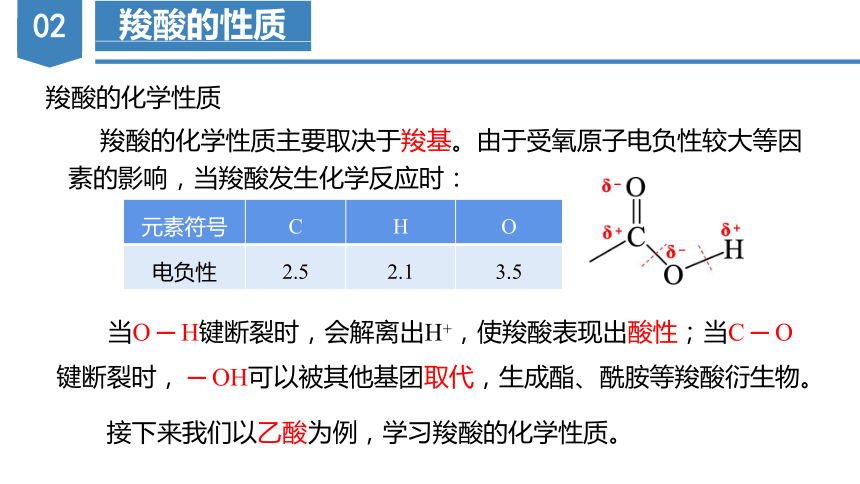
羧酸的化学性质
羧酸的化学性质主要取决于羧基。由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时:
元素符号 C H O
电负性 2.5 2.1 3.5
当O ─ H键断裂时,会解离出H+,使羧酸表现出酸性;当C ─ O键断裂时, ─ OH可以被其他基团取代,生成酯、酰胺等羧酸衍生物。
接下来我们以乙酸为例,学习羧酸的化学性质。
羧酸
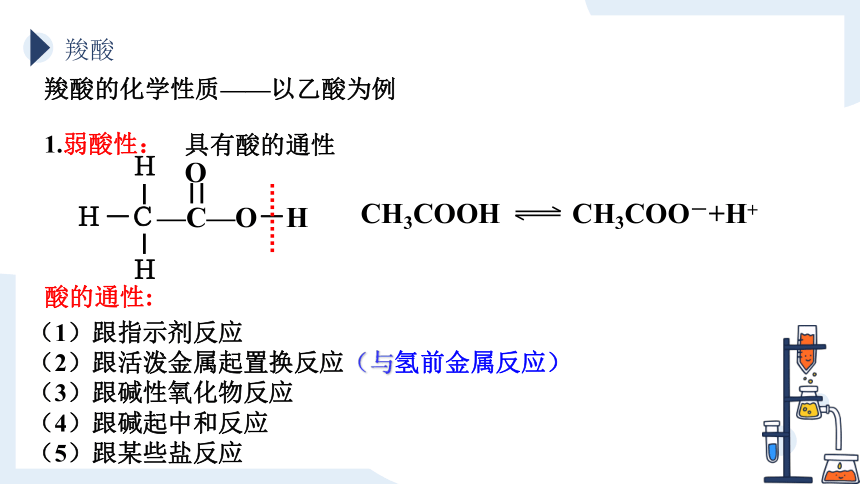
羧酸的化学性质——以乙酸为例
1.弱酸性:
CH3COOH CH3COO-+H+
C—C—O-H
H-
O
H
H
具有酸的通性
(1)跟指示剂反应
(2)跟活泼金属起置换反应(与氢前金属反应)
(3)跟碱性氧化物反应
(4)跟碱起中和反应
(5)跟某些盐反应
酸的通性:
羧酸
羧酸的化学性质
(1)使酸碱指示剂变色:能使紫色石蕊试液变红
(2)与活泼金属Na反应:
(4)与碱NaOH反应:
(5)与盐NaHCO3反应:
(3)与碱性氧化物CuO反应:
CH3COOH + NaHCO3 = CH3COONa+H2O+CO2↑
2CH3COOH + 2Na = 2CH3COONa+H2↑
CH3COOH + NaOH= CH3COONa+ H2O
2 CH3COOH + CuO =(CH3COO)2Cu + H2O
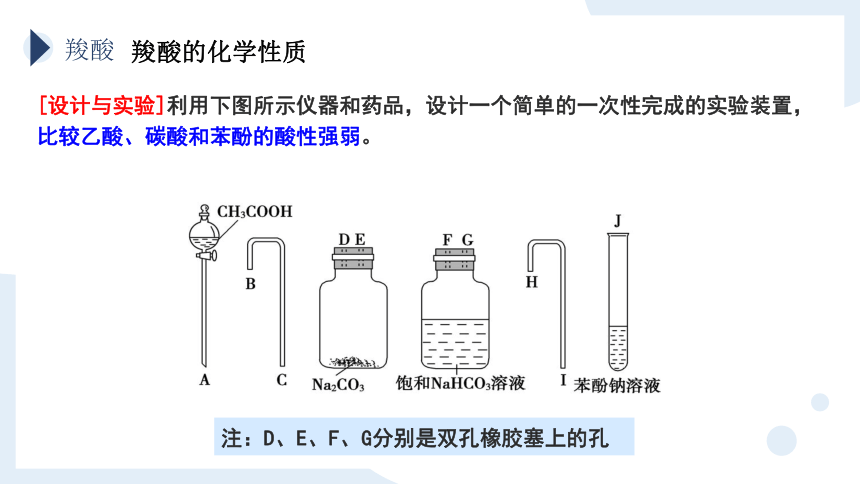
注:D、E、F、G分别是双孔橡胶塞上的孔
[设计与实验]利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。
羧酸
羧酸的化学性质
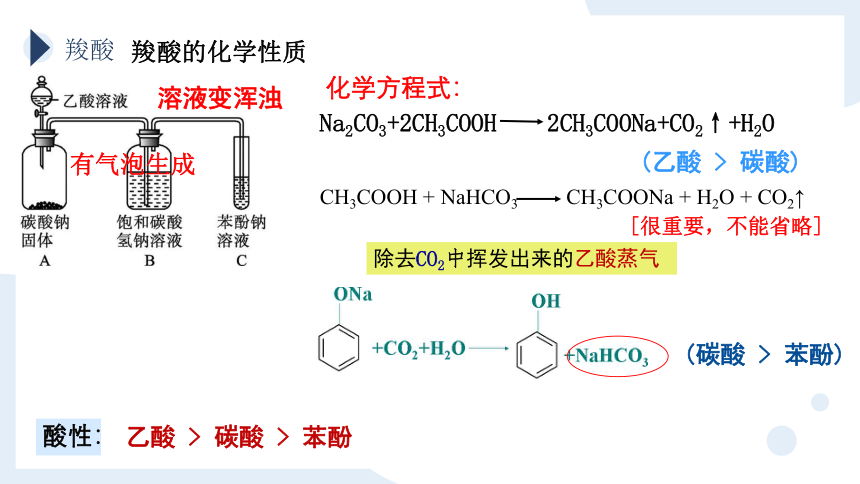
Na2CO3+2CH3COOH 2CH3COONa+CO2↑+H2O
CH3COOH + NaHCO3 CH3COONa + H2O + CO2↑
除去CO2中挥发出来的乙酸蒸气
乙酸 > 碳酸 > 苯酚
酸性:
[很重要,不能省略]
(乙酸 > 碳酸)
(碳酸 > 苯酚)
溶液变浑浊
有气泡生成
化学方程式:
羧酸
羧酸的化学性质
归纳总结
有机物羟基上的H原子的活泼性比较
有机物类别 反应物 羧酸 酚 醇
Na
NaOH
Na2CO3
NaHCO3
反应,生成H2 反应,生成H2 反应,生成H2
中和反应 中和反应 不反应
反应,可生成CO2 反应,生成NaHCO3 不反应
反应,生成CO2 不反应 不反应
有机物羟基上的H原子的活泼性:羧酸>酚>醇
可以用碳酸氢钠溶液检验有机物中是否含有羧基
羧酸
羧酸的化学性质
B
2.酯化反应(取代反应)——以乙酸为例
羧酸
羧酸的化学性质
酯化反应:酸跟醇作用,生成酯和水的反应.
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
反应机理:酸去羟基、醇去氢(羟基上的)
同位素示踪法
3ml乙醇
2ml浓硫酸
2ml乙酸
饱和碳酸钠溶液
1.注意试剂的添加顺序:
2.大试管中加两片碎瓷片
3.导管不能插到液面以下
乙醇
浓硫酸
乙酸
+H2O
1.饱和Na2CO3溶液上层有透明的不溶于水的油状液体产生
2.闻到香味-------乙酸乙酯
实验现象
CH3-C-O-C2H5
O
=
CH3-C-OH
O
=
+ H-O-C2H5
浓硫酸
乙醇与乙酸发生酯化反应的实验:
注 意:可逆反应
2.酯化反应
羧酸
羧酸的化学性质
[问题探究]
(1)浓H2SO4在酯化反应中起什么作用? 。
(2)碎瓷片的作用是 。
(3)饱和Na2CO3溶液作用 。
(4)不能用NaOH溶液代替饱和Na2CO3溶液 。
(5)导气管为什么不能插入液面下 。
(6)长导管的作用是: 。
催化剂和吸水剂
防暴沸
中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度,使之分层析出
导气和冷凝回流的作用
防止受热不匀发生倒吸
乙酸乙酯在NaOH存在下水解较彻底,几乎得不到乙酸乙酯
思考与讨论
在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请结合化学反应原理的有关知识进行说明。
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,
因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。
根据化学平衡原理,提高乙酸乙酯产率的措施有:
(3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。
追问:酯化反应中有无其它防倒吸的方法?
安全瓶
①
②
③
④“直接加热”改为“水浴加热”
乙酸酐
注意:乙酸酐不是酸性氧化物!
O
CH3—C—O—H
+ H2O
O
CH3—C—O—H
3.羧酸分子间脱水生成酸酐
乙酸酐
P2O5
说明:有机合成中可能会用乙酸酐代替乙酸进行酯化反应
(CH3CO)2O
羧酸
羧酸的化学性质
四、乙酸的用途
有机化工原料
农药
染料
醋酸纤维
香料
喷漆溶剂
医药
合成纤维
乙酸
老陈醋的酿制工艺
O
CH3—C—O—H
一、乙酸的物理性质
二、乙酸分子结构
三、乙酸的化学性质
①弱酸性
②酯化反应
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓H2SO4
△
酸性
酯化反应
:酸去羟基,醇去氢。
注意:受—OH的影响,
羧基上的碳氧双键不能加成
(断O—H键)
(断C—OH键)
C
C
实验室制取少量乙酸乙酯的装置如图所示。下列关于该实验的叙述中不正确的是( )。
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸;
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象;
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动;
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇。
A
人教版化学 选择性必修3
第三章 烃的衍生物
第四节 羧酸
第1课时 乙酸
食醋是中国古代劳动人民发明传统调味品,流传至今的是中国四大名醋,食醋中含有3% ~ 5%的乙酸,故乙酸又被称为醋酸。
羧酸的结构
羧酸的代表物---乙酸
颜色 状态 气味 沸点
熔点 溶解性 挥发性 密度
无色
液体
有强烈刺激性气味
易溶于水、乙醇
易挥发
比水小
16.6℃
纯净的乙酸又称冰醋酸
低于熔点,乙酸凝结成类似于冰一样的晶体
117.9℃
羧酸的结构
羧酸的代表物---乙酸
分子式:
结构简式:
球棍模型:
空间填充模型:
C2H4O2
或 CH3COOH
CH3
O
—C—OH
12
10
0
4
6
8
2
吸收强度
δ
乙酸的核磁共振氢谱图
羧酸的性质
羧酸的化学性质
羧酸的化学性质主要取决于羧基。由于受氧原子电负性较大等因素的影响,当羧酸发生化学反应时:
元素符号 C H O
电负性 2.5 2.1 3.5
当O ─ H键断裂时,会解离出H+,使羧酸表现出酸性;当C ─ O键断裂时, ─ OH可以被其他基团取代,生成酯、酰胺等羧酸衍生物。
接下来我们以乙酸为例,学习羧酸的化学性质。
羧酸
羧酸的化学性质——以乙酸为例
1.弱酸性:
CH3COOH CH3COO-+H+
C—C—O-H
H-
O
H
H
具有酸的通性
(1)跟指示剂反应
(2)跟活泼金属起置换反应(与氢前金属反应)
(3)跟碱性氧化物反应
(4)跟碱起中和反应
(5)跟某些盐反应
酸的通性:
羧酸
羧酸的化学性质
(1)使酸碱指示剂变色:能使紫色石蕊试液变红
(2)与活泼金属Na反应:
(4)与碱NaOH反应:
(5)与盐NaHCO3反应:
(3)与碱性氧化物CuO反应:
CH3COOH + NaHCO3 = CH3COONa+H2O+CO2↑
2CH3COOH + 2Na = 2CH3COONa+H2↑
CH3COOH + NaOH= CH3COONa+ H2O
2 CH3COOH + CuO =(CH3COO)2Cu + H2O
注:D、E、F、G分别是双孔橡胶塞上的孔
[设计与实验]利用下图所示仪器和药品,设计一个简单的一次性完成的实验装置,比较乙酸、碳酸和苯酚的酸性强弱。
羧酸
羧酸的化学性质
Na2CO3+2CH3COOH 2CH3COONa+CO2↑+H2O
CH3COOH + NaHCO3 CH3COONa + H2O + CO2↑
除去CO2中挥发出来的乙酸蒸气
乙酸 > 碳酸 > 苯酚
酸性:
[很重要,不能省略]
(乙酸 > 碳酸)
(碳酸 > 苯酚)
溶液变浑浊
有气泡生成
化学方程式:
羧酸
羧酸的化学性质
归纳总结
有机物羟基上的H原子的活泼性比较
有机物类别 反应物 羧酸 酚 醇
Na
NaOH
Na2CO3
NaHCO3
反应,生成H2 反应,生成H2 反应,生成H2
中和反应 中和反应 不反应
反应,可生成CO2 反应,生成NaHCO3 不反应
反应,生成CO2 不反应 不反应
有机物羟基上的H原子的活泼性:羧酸>酚>醇
可以用碳酸氢钠溶液检验有机物中是否含有羧基
羧酸
羧酸的化学性质
B
2.酯化反应(取代反应)——以乙酸为例
羧酸
羧酸的化学性质
酯化反应:酸跟醇作用,生成酯和水的反应.
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
反应机理:酸去羟基、醇去氢(羟基上的)
同位素示踪法
3ml乙醇
2ml浓硫酸
2ml乙酸
饱和碳酸钠溶液
1.注意试剂的添加顺序:
2.大试管中加两片碎瓷片
3.导管不能插到液面以下
乙醇
浓硫酸
乙酸
+H2O
1.饱和Na2CO3溶液上层有透明的不溶于水的油状液体产生
2.闻到香味-------乙酸乙酯
实验现象
CH3-C-O-C2H5
O
=
CH3-C-OH
O
=
+ H-O-C2H5
浓硫酸
乙醇与乙酸发生酯化反应的实验:
注 意:可逆反应
2.酯化反应
羧酸
羧酸的化学性质
[问题探究]
(1)浓H2SO4在酯化反应中起什么作用? 。
(2)碎瓷片的作用是 。
(3)饱和Na2CO3溶液作用 。
(4)不能用NaOH溶液代替饱和Na2CO3溶液 。
(5)导气管为什么不能插入液面下 。
(6)长导管的作用是: 。
催化剂和吸水剂
防暴沸
中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度,使之分层析出
导气和冷凝回流的作用
防止受热不匀发生倒吸
乙酸乙酯在NaOH存在下水解较彻底,几乎得不到乙酸乙酯
思考与讨论
在制取乙酸乙酯的实验中,如果要提高乙酸乙酯的产率,你认为应当采取哪些措施?请结合化学反应原理的有关知识进行说明。
(1)由于乙酸乙酯的沸点比乙酸、乙醇都低,
因此从反应物中不断蒸出乙酸乙酯可提高其产率。
(2)使用过量的乙醇,可提高乙酸转化为乙酸乙酯的产率。
根据化学平衡原理,提高乙酸乙酯产率的措施有:
(3)使用浓H2SO4作吸水剂,提高乙醇、乙酸的转化率。
追问:酯化反应中有无其它防倒吸的方法?
安全瓶
①
②
③
④“直接加热”改为“水浴加热”
乙酸酐
注意:乙酸酐不是酸性氧化物!
O
CH3—C—O—H
+ H2O
O
CH3—C—O—H
3.羧酸分子间脱水生成酸酐
乙酸酐
P2O5
说明:有机合成中可能会用乙酸酐代替乙酸进行酯化反应
(CH3CO)2O
羧酸
羧酸的化学性质
四、乙酸的用途
有机化工原料
农药
染料
醋酸纤维
香料
喷漆溶剂
医药
合成纤维
乙酸
老陈醋的酿制工艺
O
CH3—C—O—H
一、乙酸的物理性质
二、乙酸分子结构
三、乙酸的化学性质
①弱酸性
②酯化反应
CH3COOH + HOC2H5 CH3COOC2H5+H2O
浓H2SO4
△
酸性
酯化反应
:酸去羟基,醇去氢。
注意:受—OH的影响,
羧基上的碳氧双键不能加成
(断O—H键)
(断C—OH键)
C
C
实验室制取少量乙酸乙酯的装置如图所示。下列关于该实验的叙述中不正确的是( )。
A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸;
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象;
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动;
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇。
A
