2023-2024学年高一化学下学期期末考点大串讲 预测04化学反应与热能、电能(考题猜想)(含解析)
文档属性
| 名称 | 2023-2024学年高一化学下学期期末考点大串讲 预测04化学反应与热能、电能(考题猜想)(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-13 08:14:59 | ||
图片预览

文档简介
预测04 化学反应与热能、电能
考点一 化学反应与热能 【题型1】放热反应和吸热反应的判断
【题型2】反应过程能量变化图分析
【题型3】反应中能量变化的关系及相关计算
考点二 化学反应与电能 【题型1】原电池的工作原理
【题型2】原电池原理的应用
【题型3】化学电源分析
【题型4】化学反应与热能、电能综合分析题
考点一 化学反应与热能
01 放热反应和吸热反应的判断
【例1】
1.下列关于化学反应中物质或能量变化的判断正确的是
A.加热条件下进行的化学反应一定是吸热反应
B.化学键的断裂是化学反应中能量变化的主要原因
C.化学反应过程中一定伴随能量变化
D.将固体与固体混合并搅拌,反应放出热量
【例2】
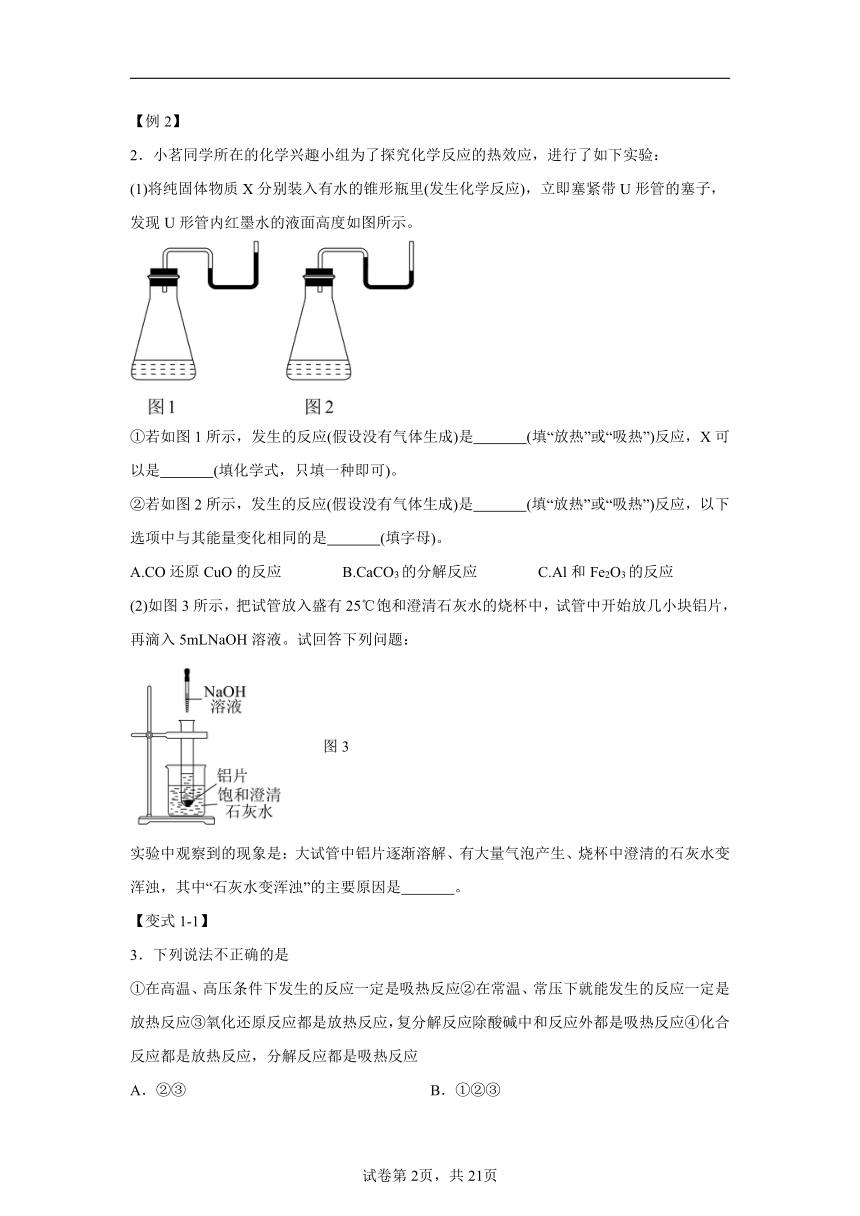
2.小茗同学所在的化学兴趣小组为了探究化学反应的热效应,进行了如下实验:
(1)将纯固体物质X分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
①若如图1所示,发生的反应(假设没有气体生成)是 (填“放热”或“吸热”)反应,X可以是 (填化学式,只填一种即可)。
②若如图2所示,发生的反应(假设没有气体生成)是 (填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是 (填字母)。
A.CO还原CuO的反应 B.CaCO3的分解反应 C.Al和Fe2O3的反应
(2)如图3所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放几小块铝片,再滴入5mLNaOH溶液。试回答下列问题:
图3
实验中观察到的现象是:大试管中铝片逐渐溶解、有大量气泡产生、烧杯中澄清的石灰水变浑浊,其中“石灰水变浑浊”的主要原因是 。
【变式1-1】
3.下列说法不正确的是
①在高温、高压条件下发生的反应一定是吸热反应②在常温、常压下就能发生的反应一定是放热反应③氧化还原反应都是放热反应,复分解反应除酸碱中和反应外都是吸热反应④化合反应都是放热反应,分解反应都是吸热反应
A.②③ B.①②③
C.①③④ D.①②③④
【变式1-2】
4.下列是吸热反应的是
A.一氧化碳在空气中的燃烧反应 B.Ba(OH)2·8H2O与氯化铵固体的反应
C.干冰升华 D.NaOH溶液与稀盐酸的反应
【变式1-3】
5.请根据相关的知识,回答下列问题:
(1)下列变化:①碘的升华;②冰熔化;③氯化钠溶于水;④氯化氢溶于水;⑤氢氧化钠溶于水。化学键未被破坏的是 (填序号),仅离子键被破坏的是 (填序号)。
(2)已知一定条件下,1 mol化学键断裂时吸收的能量相关数据如下表:
化学键 H—H O=O H—O
能量(kJ) 436 496 463
在25℃、1.013×105Pa时,H2(g)与O2(g)反应生成1 mol H2O(g)的热化学反应方程式为 ,该反应为 反应(填“吸热”或“放热”),反应的能量变化可用图 表示(填“甲”或“乙”)。
(3)下列变化中,属于吸热反应的是 (填序号)。
①铝片与稀盐酸的反应
②Ba(OH)2·8H2O晶体与NH4Cl晶体混合反应
③铁在氯气中燃烧
④氯酸钾分解制氧气
⑤生石灰与水反应生成熟石灰
02 反应过程能量变化图分析
【例1】
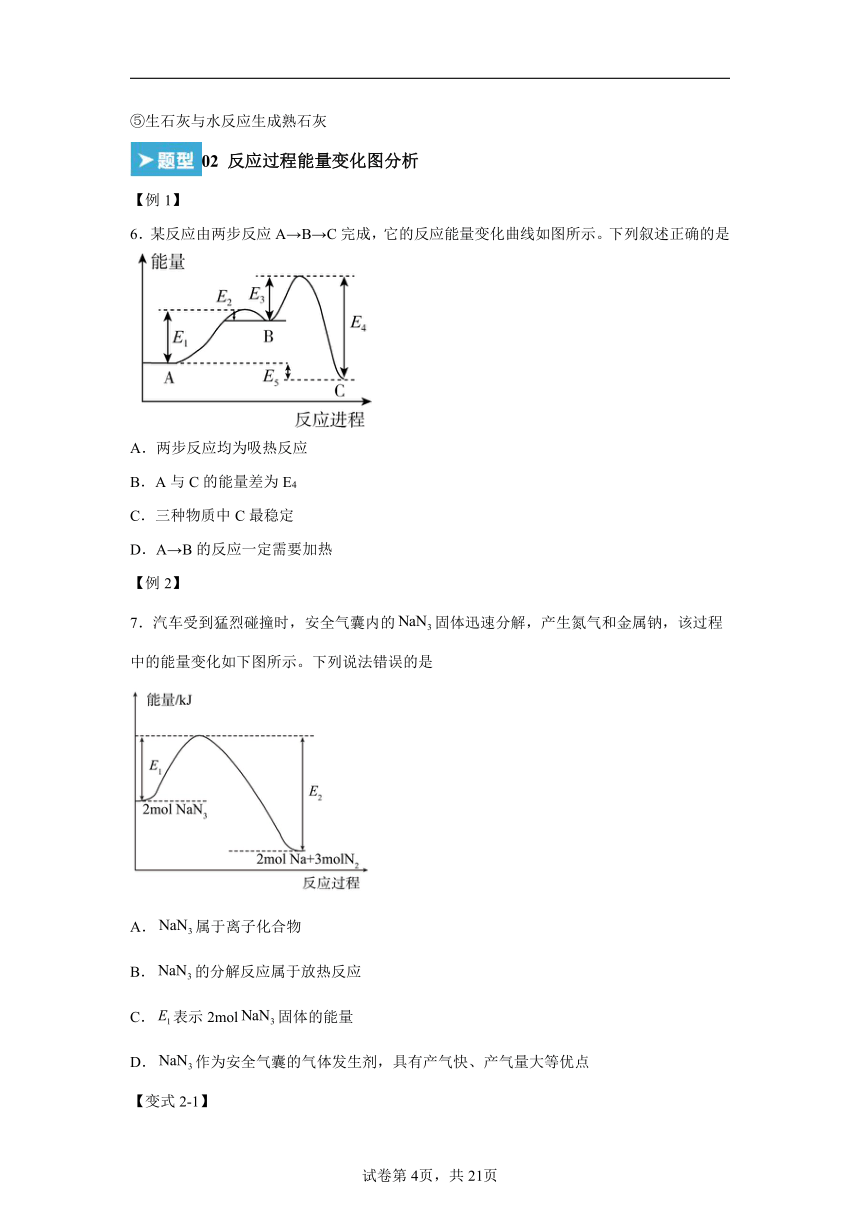
6.某反应由两步反应A→B→C完成,它的反应能量变化曲线如图所示。下列叙述正确的是
A.两步反应均为吸热反应
B.A与C的能量差为E4
C.三种物质中C最稳定
D.A→B的反应一定需要加热
【例2】
7.汽车受到猛烈碰撞时,安全气囊内的固体迅速分解,产生氮气和金属钠,该过程中的能量变化如下图所示。下列说法错误的是
A.属于离子化合物
B.的分解反应属于放热反应
C.表示2mol固体的能量
D.作为安全气囊的气体发生剂,具有产气快、产气量大等优点
【变式2-1】
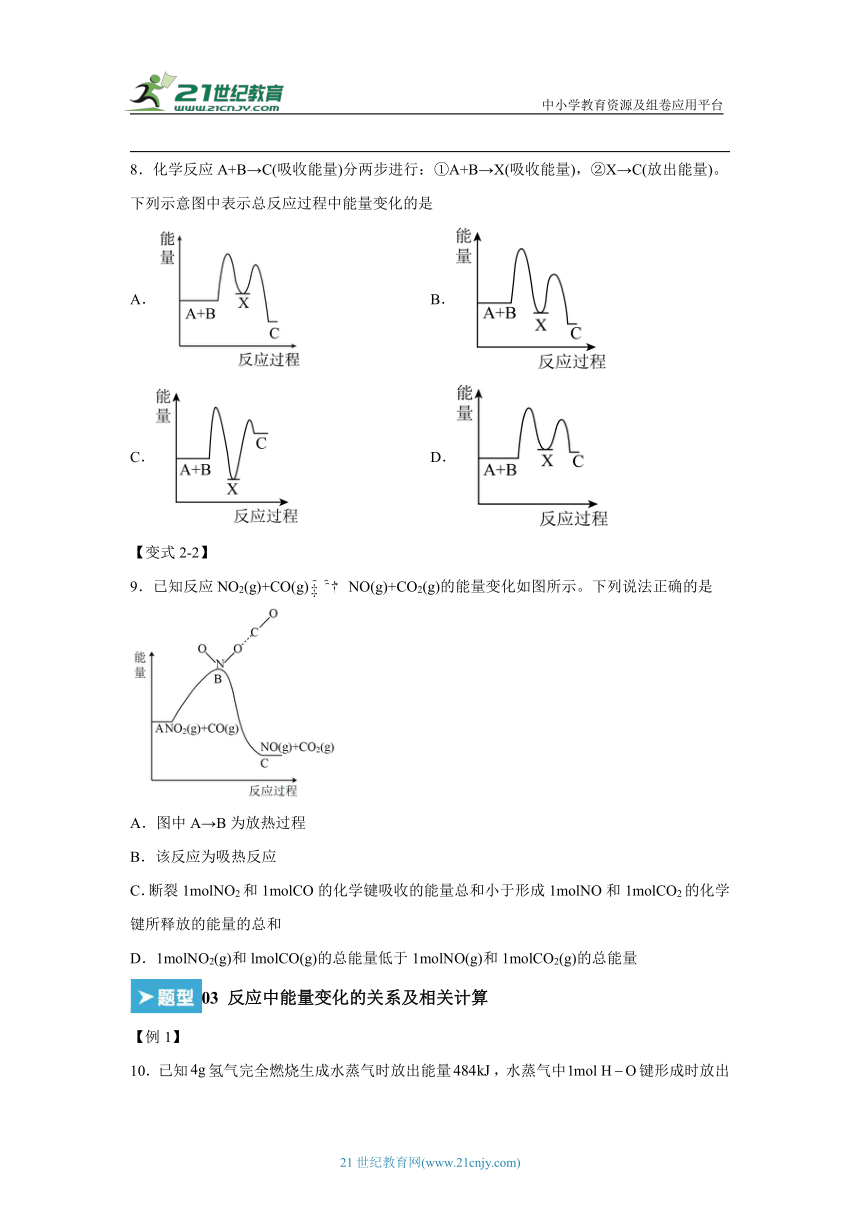
8.化学反应A+B→C(吸收能量)分两步进行:①A+B→X(吸收能量),②X→C(放出能量)。下列示意图中表示总反应过程中能量变化的是
A. B.
C. D.
【变式2-2】
9.已知反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示。下列说法正确的是
A.图中A→B为放热过程
B.该反应为吸热反应
C.断裂1molNO2和1molCO的化学键吸收的能量总和小于形成1molNO和1molCO2的化学键所释放的能量的总和
D.1molNO2(g)和lmolCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
03 反应中能量变化的关系及相关计算
【例1】
10.已知氢气完全燃烧生成水蒸气时放出能量,水蒸气中键形成时放出能量,键断裂时吸收的能量为,断开氧气中的化学键需要吸收的能量是
A. B. C. D.
【例2】
11.肼()是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、N-N键为154,则断裂1molN-H键所需的能量是
A.194kJ B.391kJ C.516kJ D.658kJ
【变式3-1】
12.氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是
A.燃烧时化学能全部转化为热能
B.断开1mol氧氢键吸收930kJ能量
C.相同条件下,1 mol氢原子的能量为E1,1 mol氢分子的能量为E2,则2E1D.该反应生成1 mol水蒸气时能量变化为245 kJ
【变式3-2】
13.与反应过程的能量变化如图所示,下列说法不正确的是
A.该反应为放热反应
B.该反应中与的总能量大于和的总能量
C.该反应的热化学方程式: kJ·mol
D.1mol和1mol反应生成1mol和1mol要放出41kJ的热量
【变式3-3】
14.现代社会中,人类的一切活动都离不开能量,从煤、石油和天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。回答下列问题:
(1)绿色能源也称清洁能源,是指在生产和使用过程中不产生有害物质排放的能源。下列属于绿色能源的是 (填标号,下同)。
①太阳能 ②煤 ③石油 ④风能 ⑤氢能
(2)下列反应中生成物总能量高于反应物总能量的是_______。
A.甲烷燃烧 B.灼热的炭与反应
C.镁与稀硫酸反应 D.钠和水反应
(3)与反应生成过程中的能量变化如图所示,和完全反应生成会 (填“吸收”或“放出” )的能量。
(4)已知反应在不同条件下的化学反应速率如下:
①
②
③
④
请比较上述4种情况反应的快慢: (按由大到小的顺序填写序号)。
(5)用和组合形成的质子交换膜燃料电池的结构如图所示:
①电极是 (填“正极”或“负极”),电极c的电极反应式是 。
②若电路中转移电子,则该燃料电池理论上消耗的在标准状况下的体积为 L。
考点二 化学反应与电能
01 原电池的工作原理
【例1】
15.有如图所示的实验装置,下列判断正确的是
a电极 b电极 X溶液 实验判断
A Cu Zn H2SO4 H+向b极迁移
B Zn Fe H2SO4 电子从Zn→Fe→Zn
C Al Mg NaOH a为负极,b为正极
D Cu 石墨 FeCl3 a极质量减小,b极质量增加
A.A B.B C.C D.D
【例2】
16.关于如图所示装置的叙述确的是
A.两装置均能将化学能转化为电能
B.两装置中锌片均发生还原反应
C.图2溶液中向铜片迁移
D.图2中溶解锌时转移电子
【变式1-1】
17.某小组利用如图装置研究原电池工作原理。下列叙述不正确的是
A.和不连接时,铁片上会有金属铜析出
B.和用导线连接时,铜片上的反应为
C.无论a和b是否连接,铁片均发生还原反应
D.a和b用导线连接时,溶液中向铜电极移动
【变式1-2】
18.某学生用如图所示装置研究原电池的原理,下列说法错误的是
A.装置(1)中铜棒上没有气体产生
B.装置(2)中棒逐渐溶解,铜棒电极反应式为:
C.当装置(3)电路中转移电子,负极和正极质量变化之差为
D.装置(2)与(3)中正极生成的物质质量之比为1∶32时,棒的质量变化相等
【变式1-3】
19.某化学兴趣小组为了探索电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
实验编号 电极材料 电解质溶液 电流计指针偏转方向
1 Mg、Al 稀盐酸 指向铝
2 Al、Cu 稀盐酸 偏向铜
3 A1、石墨 稀盐酸 偏向石墨
4 Mg、Al NaOH溶液 偏向镁
根据上表中记录的实验现象,下列说法不正确的是
A.实验1中铝电极上发生还原反应
B.实验2中电子从铝片经导线流向铜片
C.实验2和3都是A1做负极,实验1和4都是Al做正极
D.实验3正极的电极反应为2H++=H2↑
02 原电池原理的应用
【例1】
20.现有a、b、c、d四个金属电极,用导线两两相连组成原电池。①a、b相连插入硫酸铜溶液中后,b极变粗;②a、d相连插入稀硫酸中后,外电路电流从a流向d;③b、c相连插入稀硫酸中后,c极上有气泡产生;④c、d相连插入稀硫酸中后,d极溶解。则下列说法正确的是
A.由①和④可推出金属活动性:Cu>c
B.由②和③可推出金属活动性:d>c
C.由①②③可推出金属活动性:d>a>b>c
D.由①②④可推出金属活动性:a>b>d>c
【例2】
21.已知反应,下列叙述不正确的是
A.可将该反应设计成如图甲所示的原电池
B.反应过程中能量关系可用图乙表示
C.若Fe不纯(含有杂质碳),该反应的化学反应速率要减慢
D.图甲装置中,在铜表面被还原产生气泡
【变式2-1】
22.根据原电池原理,人们研制出性能各异的化学电池。
(1)锌铜原电池装置示意图如图所示,Zn片作 (填“正极”或“负极”)。
(2)铜片上观察到的实验现象是 ,锌片上的电极反应式为 。
(3)电流表指针发生偏转,说明该装置实现了化学能向 的转化。
(4)若把反应仿照上图设计成原电池,则两个电极分别为铜、 (填材料名称),电解质溶液为 (填化学式)。
(5)镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如图所示,其总反应为:。下列说法正确的是 (填字母序号)。
a.Mg作电池的负极 b.发生氧化反应
【变式2-2】
23.原电池是利用氧化还原反应设计的装置,该装置的特点是使氧化反应和还原反应在两个电极进行,“迫使”电子沿着特定的路线移动,从而产生电能。甲、乙两个原电池装置如图所示:
回答下列问题:
(1)若装置甲的溶液M为稀硫酸,两个电极采用镁棒和铝棒。
①电极X为 (填“正极”或“负极”),该电极反应式为 。
②该电池的正极是 (填“镁棒”或“铝棒”),该电极产物W是 (填化学式)。
③该原电池总反应的化学方程式是 。
(2)若装置甲中两电极质量变化与时间的关系如图所示,其中一个电极为Ag电极,则该电池的电解质溶液为 (填化学式)溶液,电极X为 (填字母)
a.Fe电极 b.Mg电极 c.Cu电极 d.Al电极
(3)将(1)中原电池生成的气体产物W通入装置乙中可制备燃料电池。
①正极为 (填“电极甲”或“电极乙”),该电极发生 (填“氧化反应”或“还原反应”)。
②该电池工作时,外电路中电子由 (填“电极甲”或“电极乙”,下同)流出;电解质溶液中的移向 。
03 化学电源分析
【例1】
24.如图是铅酸蓄电池的构造示意图,下列说法错误的是
A.铅酸蓄电池是二次电池,充电时电能转化为化学能
B.该电池工作时,电子由板通过外电路流向板
C.该电池工作时,负极的电极反应式为
D.该电池工作时,移向板
【例2】
25.某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料),其电池反应为Li+FePO4=LiFePO4。下列关于该电池的说法正确的是
A.a极为正极 B.b极发生氧化反应
C.Li+从a极室向b极室移动 D.可以用稀硫酸作电解质溶液
【例3】
26.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH 增大
D.溶液中Cl-向正极移动
【变式3-1】
27.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极
B.乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
【变式3-2】
28.氢氧燃料电池是一种常见化学电源,其工作示意图如图。下列说法正确的是
A.由正极流向负极
B.溶液的作用是传导电子
C.b电极上发生还原反应,电极反应式为
D.标准状况下a电极若每消耗,外电路转移电子数为
【变式3-2】
29.二次电池的充电可看作是其放电的逆过程。我国研究的锂硫电池是一种新型二次电池,其总反应是,充放电曲线如图所示,下列说法正确的是
A.充电时,化学能转化为电能
B.放电时,锂离子向负极移动
C.放电时,转化为时得到
D.从安全角度考虑,该电池的电解质溶液不宜用水作溶剂
【变式3-4】
30.化学能和电能的相互转化是能量转换的重要形式,请按要求完成下列电化学相关问题。
(1)把A、B、C、D四种金属按表中装置进行实验。
装置
电子从A到B C电极的质量增加 金属D不断溶解
根据表中信息判断四种金属活动性由大到小的顺序是 ;(用ABCD表示)
(2)盐桥式原电池的装置图如下
①铜为 (填“正”或“负”)极。
②若装置中铜电极的质量增加3.2g,则导线中转移电子的数目为
③该装置的盐桥中除添加琼脂外,还要添加饱和溶液,电池工作时,盐桥的作用是 。
(3)还原电化学法制备甲醇()的工作原理如图所示:
电池工作过程中通过质子膜向 (填“左”或者“右”)移动,通的一端发生的电极反应式为 。
(4)锂钊氧化物电池放电时的总反应:,则其正极充电时的电极反应式为: 。
(5)以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成四甲基氢氧化铵[(CH3)4NOH],其工作原理如图所示(a、b为石墨,c、d、e为离子交换膜),当制备时,a、b两个极共产生 气体。
04 化学反应与热能、电能综合分析题
【例1】
31.现代社会活动需要利用化学反应中的物质和能量变化。
Ⅰ.化学能与热能
下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题:
物质 HCl
键能/kJ 243 193 151 436 432
(1)以上物质中最不稳定的是 。
(2)按照反应,生成2mol HCl (填“吸收”或“放出”)的热量为 kJ。根据能量守恒定律,反应物的总能量应该 其生成物的总能量(填“大于”或“小于”)。
Ⅱ.化学能与电能
(3)把A、B、C、D四种金属按表中装置进行实验。
装置
A表面有气泡 B电极的质量增加 电子由A到D
根据表中信息判断四种金属活动性由大到小的顺序是 。
(4)“乙醇燃料电池”的工作原理为,装置如图所示。
①在该电池中的移动方向为由 (填“A到B”或“B到A”)。写出A电极的电极反应式: 。
②若标况下有11.2L 参与反应,理论上通过质子交换膜的数目为 。
【变式4-1】
32.任何化学反应都伴随着能量的变化,通过化学反应,化学能可以与热能、电能等不同形式的能量相互转化,用于生产、生活和科研。请回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用 (填“放热”或“吸热”)的化学变化或物理变化的原理。
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将 直接转变为电能(填:“化学能”“太阳能”“热能”等)
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
化学键
键能E/(kJ·mol) 946.0 a 390.8
一定温度下,利用催化剂将分解为和3 mol ,吸收90.8 kJ热量,则 。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液 。
(5)肼-过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
①惰性电极B是电池的 (填“正”或“负”)极,其电极反应式为 。
②电池工作过程中,若A极区产生14 g,则转移的电子数目为 。
③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为 。
【变式4-2】
33.硅、硫、氮是重要的非金属元素,请根据题意回答问题。
(1)大气污染物主要成分包括:SO2、NO2、CO、可吸入颗粒物等,主要来源于燃煤、机动车尾气和工业废气。
①其中SO2、NO2能形成酸雨,酸雨的pH< ,SO2型酸雨久置后溶液的pH会 (填“增大”、“减小”、“不变”),NO2能形成酸雨的原因是(用化学方程式表示): 。
②SO2在人们的生活也担任着重要的角色,其中SO2、H2O2、浓硝酸均具有漂白作用,其漂白原理与其他物质不同的是: 。
(2)SiO2可用于制作光导纤维,但遇强碱溶液会发生“断路”现象,其原因是: (用离子方程式表示)
(3)硝酸盐受热亦会发生分解且复杂,某学习小组对Cu(NO3)2的分解产生了兴趣,已知Cu(NO3)2受热分解的化学方程式为,将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,针对此现象下列分析合理的是_____。
A.NO2能支持燃烧
B.无法确定NO2是否支持燃烧
C.产物中有氧气,所以木条复燃
D.NO2肯定不支持燃烧
(4)铅酸蓄电池是我们生活中常见的二次电池,其结构示意图如下,电池工作时正极的电极方程式为: 。
(5)新型电池一钠硫电池以熔融金属钠、熔融硫和多硫化钠()分别作为两个电极的反应物,陶瓷(可传导)为电解质,装置示意图如下,请写出负极的电极方程式:
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A.铝热反应需要在高温条件下进行,但是该反应会放出大量的热,A错误;
B.化学反应中能量变化的主要原因是化学键的断裂和形成,B错误;
C.化学反应是旧键的断裂和新键形成的过程,旧键断裂吸收能量,新键形成放出能量,因此化学反应过程中一定伴随能量变化,C正确;
D.与的反应是吸热反应,D错误;
故选C。
2.(1) 放热 CaO 吸热 AB
(2)铝片与NaOH溶液反应放热,烧杯内溶液温度升高,Ca(OH)2溶解度降低,析出晶体
【详解】(1)①将纯固体物质X装入有水的锥形瓶里(假设没有气体生成),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度若如图1所示,U形管左侧液面降低,右侧液面升高,说明锥形瓶内气体膨胀,温度升高,发生的反应是放热反应,氧化钙和水反应生成氢氧化钙,反应放热,所以X可以是CaO。
②将纯固体物质X装入有水的锥形瓶里(假设没有气体生成),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度若如图2所示,U形管左侧液面升高,右侧液面下降,说明锥形瓶内气体收缩,温度降低,发生的反应是吸热反应;
A.CO还原CuO生成二氧化碳和铜,该反应是吸热反应,故选A;
B.CaCO3的分解生成氧化钙和二氧化碳,分解反应吸热,故选B;
C.Al和Fe2O3的反应生成氧化铝和铁,铝热反应放热,故不选C;
选AB;
(2)氢氧化钙的溶解度随温度升高而降低,铝片和氢氧化钠反应生成偏铝酸钠和氢气,反应放热,烧杯内溶液温度升高,氢氧化钙溶解度减小,有氢氧化钙析出,所以烧杯中澄清的石灰水变浑浊。
3.D
【详解】①反应为放热反应,①错误;
②为吸热反应,②错误;
③
为吸热反应,为放热反应,③错误;
④化合反应可能是吸热反应,如,分解反应可能是放热反应,如,④错误;
故①②③④均错误,故D符合;
故选D。
4.B
【详解】A.燃烧反应都是放热反应,所以一氧化碳在空气中的燃烧反应是放热反应,A不符合题意;
B.Ba(OH)2·8H2O与氯化铵固体发生的复分解反应,需要从空气中吸收热量,属于吸热反应,B符合题意;
C.干冰升华时,由固态转化为气态,分子间距离增大,需要吸收热量,但此过程为物理过程,不属于化学反应,C不符合题意;
D.NaOH溶液与稀盐酸发生中和反应,中和反应都是放热反应,D不符合题意;
故选B。
5.(1) ①② ③⑤
(2) H2(g)+O2(g)=H2O(g) ΔH=-242 kJ·mol-1 放热 甲
(3)②④
【详解】(1)①碘的升华、②冰熔化改变了分子间作用力,并未破坏发生化学键,③氯化钠溶于水发生电离,故仅破坏了离子键,④氯化氢溶于水发生电离,因为氯化氢是共价化合物,故仅破坏了共价键,⑤氢氧化钠溶于水破坏了离子键;化学键未被破坏的是:①②;仅离子键被破坏的是:③⑤;
(2)反应H2(g)+O2(g)=H2O(g)的ΔH=反应物的总键能-生成物的总键能=436 kJ·mol-1+×496 kJ·mol-1-2×463 kJ·mol-1=-242 kJ·mol-1,故热反应方程式为H2(g)+O2(g)=H2O(g) ΔH=-242 kJ·mol-1,该反应为放热反应,反应物的总能量大于生成物的总能量,故为甲;
(3)①铝片与稀盐酸的反应为放热反应;
②Ba(OH)2·8H2O晶体与NH4Cl晶体混合反应为吸热反应;
③铁在氯气中燃烧为放热反应;
④氯酸钾分解制氧气为吸热反应;
⑤生石灰与水反应生成熟石灰为放热反应;
故选②④。
6.C
【详解】A.根据图中信息A→B是吸热反应,B→C是放热反应,故A错误;
B.根据图中信息A与C的能量差为E5,故B错误;
C.根据能量越低越稳定,C物质的能量最低,因此三种物质中C最稳定,故C正确;
D.吸热反应、放热反应与反应条件无关,吸热反应并一定需要加热,比如氯化铵和Ba(OH)2 8H2O的反应不需要加热,因此A→B的反应不一定需要加热,故D错误。
综上所述,答案为C。
7.C
【详解】A.由Na+和N构成,属于离子化合物,故A正确;
B.的分解反应,反应物总能量大于生成物总能量,属于放热反应,故B正确;
C.表示该反应的活化能,故C错误;
D.汽车受到猛烈碰撞时,安全气囊内的固体迅速分解,产生氮气和金属钠,具有产气快、产气量大,故D正确;
选C。
8.D
【详解】A.化学反应A+B→C(吸收能量)的反应,说明反应物A、B的总能量比生成物C的总能量低,图示是反应物A、B的总能量比生成物C的总能量高,反应属于放热反应,与反应事实不吻合,A错误;
B.化学反应A+B→C(吸收能量)的反应,说明反应物A、B的总能量比生成物C的总能量低,图示是反应物A、B的总能量比生成物C的总能量高,反应属于放热反应,与反应事实不吻合。反应分两步进行,第一步反应①A+B→X(吸收能量),而图示A、B的总能量比中间产物X的能量高,反应是放热反应,也与反应事实不吻合,B错误;
C.化学反应A+B→C(吸收能量)分两步进行:①A+B→X(吸收能量),而图示显示的反应物A、B的总能量比中间产物X的总能量高,反应是放热反应,与题意不符合,C错误;
D.放热反应说明反应物的总能量比生成物的能量高;吸热反应说明反应物的总能量比生成物的能量低。图像显示反应事实吻合,D正确;
答案选D。
9.C
【详解】A.图中A→B的过程,能量升高,为吸热过程,A项错误;
B.生成物总能量小于反应物总能量,该反应为放热反应,B项错误;
C.该反应为放热反应,则断裂1molNO2和1molCO的化学键吸收的能量总和小于形成1molNO和1molCO2的化学键所释放的能量的总和,C项正确;
D.该反应为放热反应,反应物的总能量大于生成物的总能量,则1molNO2(g)和lmolCO(g)的总能量高于1molNO(g)和1molCO2(g)的总能量,D项错误;
答案选C。
10.C
【详解】根据题目信息,氢气即2mol氢气完全燃烧生成水蒸气时放出能量484kJ,写出对应的热化学方程式为2H2(g)+O2(g)=2H2O(g) ,反应中断裂了2molH-H键和1molO=O键、形成了4molO-H,设断开氧气中的化学键需要吸收的能量为x,则根据=断裂旧键所需的能量-生成新键释放的能量知,,解得x=496kJ,故选C。
11.B
【详解】根据图中内容可知,,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新建形成释放能量,设断裂1molN-H键所需的能量为K,所以有154+4K+500=2218;解得K=391;
故答案选B。
12.D
【详解】A. 燃烧是部分化学能变为热能,还有光能等,故错误;
B. 从图分析,断开2mol氢氧键吸收930kJ的能量,故错误;
C. 氢气分子变成氢原子要吸收能量,所以2E1>E2,故错误;
D. 该反应生成1mol水蒸气时的能量变化为930-436-249=245kJ,故正确;
故选D。
13.D
【详解】A.由图可知△H<0,该反应为放热反应,A选项正确;
B.由图可知反应物CO(g)+H2O(g)的总能量大于生成物CO2(g)+H2(g)的总能量,B选项正确;
C.由图可知该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= 41 kJ·mol 1,C选项正确;
D.图中反应是放热反应,其逆反应为吸热反应,D选项错误;
答案选D。
14.(1)①④⑤
(2)B
(3) 吸收 180
(4)③①②④
(5) 正极 11.2
【详解】(1)①太阳能④风能⑤氢能生产和使用过程中不产生有害物质,属于绿色能源;
(2)反应中生成物总能量高于反应物总能量,可知该反应为吸热反应,燃烧、活泼金属与酸、钠与水反应均为放热反应,反应物的能量高于生成物能量,灼热的炭与反应吸收能量,生成物能量高于反应物能量,故ACD不符合题意;故答案为:D;
(3)1mol与1mol反应断裂化学键吸收能量:(946+498)=1444kJ;生成2molNO时放出热量2×632=1264kJ热量,由此可知和完全反应生成会吸收180的能量;
(4)将各条件下速率均转化为氮气的速率,①对应氮气速率为:;
②;
③
④
4种情况反应的快慢:③①②④;
(5)①由图可知电子由电极c流出,电极c为负极,电极d为正极,电极c的电极反应式是;
②电极d上发生反应:,电路中转移电子,则该燃料电池理论上消耗的的物质的量为0.5mol,标准状况下的体积为11.2。
15.C
【详解】A. Cu、Zn、稀硫酸组成的原电池,锌较活泼,作原电池的负极,铜作原电池的正极,电解质溶液中的阳离子H+向正极铜电极移动,即向a极迁移,A错误;
B. Zn、Fe、稀硫酸组成的原电池,锌较活泼,作原电池的负极,铁作原电池的正极,电子从Zn流向Fe,但是无法再流向Zn,B错误;
C. 铝、镁、氢氧化钠溶液组成的原电池,电池反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝发生氧化反应,作原电池的负极,镁电极作原电池的正极,即a为负极,b为正极,C正确;
D. 铜、石墨、氯化铁溶液组成的原电池,电池反应为:2FeCl3+Cu=2FeCl2+CuCl2,铜电极发生氧化反应,作原电池的负极,电极反应为:Cu-2e- =Cu2+,电极质量减小,石墨作原电池的正极,电极反应式为:2Fe3++2e- =2Fe2+,电极质量不变,D错误;
故答案选C。
16.D
【详解】A.图2装置形成原电池,能将化学能转化为电能,但图1装置没有形成原电池,不能化学能转化为电能,A错误;
B.锌比铜活泼,两装置中锌片均发生氧化反应生成硫酸锌,B错误;
C.图2装置形成原电池,锌作负极,铜作正极,原电池工作时,阴离子移向负极,即溶液中向锌片迁移,C错误;
D.图2装置形成原电池,锌作负极,负极反应式为Zn-2e-=Zn2+,n(e-)=2n(Zn)=2×=0.2mol,D正确;
故选D。
17.C
【详解】A.和不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,所以铁片上会有金属铜析出,故A正确;
B.和用导线连接时,形成了原电池,铜作正极,发生的反应为:,故B正确;
C.和不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,和用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,无论和是否连接,铁片均会溶解,铁片均发生氧化反应,故C错误;
D.和用导线连接时,形成了原电池,为负极,为正极,铜离子移向铜电极,故D正确;
答案选C。
18.C
【分析】(1)因没有形成闭合回路,不是原电池装置;(2)形成了铜锌原电池,且Zn为负极;(3)也形成了铜锌原电池,Zn为负极。
【详解】A.装置(1)是化学腐蚀,锌和稀硫酸发生反应生成氢气,铜和稀硫酸不反应,铜棒上没有气体产生,A正确;
B.装置(2)是原电池装置,锌做负极,铜做正极,溶液中氢离子在铜电极生成氢气,电极反应式为:,B正确;
C.装置(3)是原电池装置,锌做负极失电子生成锌离子,铜做正极,溶液中铜离子得到电子生成铜,锌电极减轻,铜电极增重,当装置(3)电路中转移1mol电子,负极和正极质量变化之差为,C错误;
D.装置(2)与(3)中负极电极反应均为,装置(2)中正极上电极反应为,装置(3)中正极电极反应为,正极生成物质质量比为1∶32时,依据电子守恒计算的两个原电池中电子转移相同,所以反应的锌的质量相同,棒的质量变化相等,D正确;
故选C。
19.C
【详解】A.实验1中电解质溶液为稀盐酸,则根据金属活动性Mg>Al,则金属Mg做负极材料,化合价升高失去电子发生氧化反应,金属Al为正极发生还原反应,A项正确;
B.实验2中电解质溶液为稀盐酸,则金属Al为负极,化合价升高失去电子,则电子从负极经过导线流向正极,B项正确;
C.实验2中金属Al为负极,实验3中金属Al为负极,实验1中金属Al为正极,实验4中金属Al为负极,C项错误;
D.实验3正极为石墨,电解质溶液为稀盐酸,则溶液中的阳离子在石墨电极上变为氢气,正极的电极反应式为:2H++=H2↑,D项正确;
答案选C。
20.C
【分析】①a、b相连插入硫酸铜溶液中后,b极变粗,说明b电极是正极,铜离子放电,析出铜,金属性a>Cu,且a>b;②a、d相连插入稀硫酸中后,外电路电流从a流向d,a是正极,d是负极,金属性d>a;③b、c相连插入稀硫酸中后,c极上有气泡产生,c电极是正极,b电极是负极,金属性b>c;④c、d相连插入稀硫酸中后,d极溶解,d电极是负极,c电极是正极,金属性d>c。据此判断。
【详解】A.根据以上分析可知由①和④无法推出金属活动性:Cu>c,A错误;
B.由②和③可推出金属活动性:d>a、b>c,无法判断d与c的金属性强弱,B错误;
C.由①②③可推出金属活动性:d>a>b>c,C正确;
D.由①②④可推出金属活动性:d>a>b、d>c,b和c的金属性无法判断,D错误;
答案选C。
21.C
【详解】A.图甲构成了铜铁原电池,负极反应为、正极反应为,则总反应为,A正确;
B.该反应是放热反应,故可以用图乙表示其反应过程中的能量关系,B正确;
C.若铁不纯(含有碳单质),则可以形成很多微型原电池而加快反应速率,C错误;
D.根据电极反应式可知,在铜表面被还原产生H2,D正确;
故选C。
22.(1)负极
(2) 有气泡产生
(3)电能
(4) 银(或铂、石墨等其它合理答案) (或)
(5)a
【详解】(1)Zn比Cu活泼,Zn作负极;
(2)Cu作正极,电极反应式为2H++2e-=H2↑,实验现象是有气泡产生,锌片上的电极反应式为;
(3)电流计指针发生偏转,说明产生电流,该装置构成原电池,可以将化学能转化为电能;
(4)原电池中失电子的物质作负极,根据方程式知,铜失电子作负极,导电的银或铂、石墨等作正极;电解质是反应物中可溶性的、得电子的物质,所以电解质是可溶性的铁盐,可用(或)作电解质;
(5)a.镁-海水电池工作时,Mg发生失电子的反应,作电池的负极,石墨作正极,故a正确;
b.镁-海水电池工作时,石墨作正极,正极上O2发生得电子的还原反应生成OH-,故b错误;故答案为:a。
23.(1) 负极 铝棒 H2
(2) AgNO3 d
(3) 电极甲 还原反应 电极乙 电极乙
【详解】(1)①镁与硫酸反应,铝与硫酸反应,镁的活泼性比铝强,因此镁为负极,铝为正极,再根据X电极是电子流出的极,则电极X为负极,该电极反应式为;故答案为:负极;。
②根据前面分析该电池的正极是铝棒,该电极是氢离子得到电子变为氢气,因此正极产物W是H2;故答案为:铝棒;H2。
③该原电池总反应是镁和硫酸反应生成硫酸镁和氢气,其化学方程式是;故答案为:。
(2)若装置甲中两电极质量变化与时间的关系如图所示,其中一个电极为Ag电极,则一个电极质量增加10.8g,另一个电极质量减少0.9g,题中金属活泼性都比银弱,说明银为正极,银电极质量增加,则该电池的电解质溶液为硝酸银(AgNO3)溶液,有0.1mol银生成,有0.1mol电子转移,则负极会消耗0.05mol铁或0.05mol镁或0.05mol铜或铝,质量分别为2.8g、1.2g、3.2g、0.9g,则电极X为Al电极;故答案为:AgNO3;d。
(3)①燃烧电池中燃料为负极,氧化剂为正极,则正极为电极甲,氧气得到电子,则说明该电极发生还原反应;故答案为:电极甲;还原反应。
②该电池工作时,外电路中电子由负极即电极乙流出;根据原电池“同性相吸”,则电解质溶液中的移向负极即电极乙;故答案为:电极乙;电极乙。
24.D
【详解】A. 铅酸蓄电池是可充电电池,是二次电池,充电时电能转化为化学能,A项正确;
B. 在该电池中板为负极,则电池工作时,电子由板通过外电路流向板,B项正确;
C. 该电池工作时,负极的电极反应式为,C项正确;
D. 在原电池工作时,阳离子向正极移动,则该电池工作时移向板,D项错误;
故选D。
25.C
【详解】A.极为负极,A项错误;
B.b极为正极,得电子,发生还原反应,B项错误;
C.透过隔膜,从a极室进入b极室,C项正确;
D.是活泼金属,能与稀硫酸反应,故不能用稀硫酸作电解质溶液,D项错误。
答案为C。
26.C
【详解】A.组成原电池的负极被氧化,在Mg-H2O2电池中,镁为负极,而非正极,A项错误;
B. H2O2在石墨电极上得电子发生还原反应,B项错误;
C.工作时,正极反应式为H2O2+2H++2e-═2H2O,不断消耗H+离子,正极周围海水的pH增大,C项正确;
D.原电池中,阳离子向正极移动,阴离子向负极移动,形成闭合回路,所以溶液中的Cl-向负极移动,D项错误。
答案选C。
【点睛】本题考查原电池的工作原理等知识。正确书写电极反应式为解答该题的关键,镁-H2O2酸性燃料电池中,镁为活泼金属,应为原电池的负极,被氧化,电极反应式为Mg-2e-═Mg2+,H2O2具有氧化性,应为原电池的正极,被还原,电极反应式为H2O2+2H++2e-═2H2O,根据电极反应式判断原电池总反应式,根据电极反应判断溶液pH的变化。
27.A
【详解】A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,电子不经过电解质溶液,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,A项错误;
B.Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e +H2O=2Ag+2OH ,B项正确;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项正确;
D.铅蓄电池总反应式为,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确;
故答案选A。
28.C
【分析】由图可知,氧气发生还原反应,b为正极、则a为负极;
【详解】A.原电池转化阳离子由负极向正极迁移,由负极流向正极,A错误;
B.溶液为内电路,作用是传导离子,B错误;
C.b电极上氧气得到电子发生还原反应,电极反应式为,C正确;
D.标准状况下a电极若每消耗(为0.5mol),,则外电路转移电子数为,D错误;
故选C。
29.D
【详解】A.充电时,电能转化为化学能,故A错误;
B.放电时是原电池,原电池“同性相吸”即锂离子向 极移动,故B错误;
C.放电时,,则转化为时得到,故C错误;
D.Li与水要反应,因此从安全角度考虑,该电池的电解质溶液不宜用水作溶剂,故D正确。
综上所述,答案为D。
30.(1)D>A>B>C
(2) 正 0.1NA 使两溶液均保持电中性
(3) 左 CO + 4e- + 4H+ = CH3OH
(4)Li1+xV3O8-xe-=xLi++LiV3O8
(5)0.75
【详解】(1)原电池的一个应用是可以判断金属的活泼性,一般负极比正极活泼。电子从A到B说明A为负极,B为正极,A>B;C电极的质量增加说明Cu2+在正极析出,C为正极B为负极,B>C;金属D不断溶解,说明D为负极,A为正极,D>A,四种金属活动性由大到小的顺序是D>A>B>C;
(2)①锌铜原电池中,锌比铜活泼,故锌为负极,铜为正极;
②3.2g铜物质的量为0.05mol,由电极反应式Cu2++2e-=Cu可知,生成1mol铜,转移2mol电子,故生成0.05mol铜,导线中转移0.1mol电子,电子数目为0.1NA;
③电池工作时,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使两溶液均保持电中性;
(3)该装置是原电池,根据总反应:CO+2H2=CH3OH可知,C的化合价降低,CO在正极得到电子,H的化合价升高,H2在负极失去电子,所以通入H2的一端是负极;电池工作过程中阳离子移向正极,所以H+向左移动;通入CO的一端为正极,CO在酸性溶液中得到电子转变为CH3OH,电极反应式为:CO + 4e- + 4H+ = CH3OH;
(4)充电时阳极失电子发生氧化反应,即放电时正极的逆反应,所以电极方程式为:Li1+xV3O8-xe-=xLi++LiV3O8;
(5)由图可知,a极为阴极,发生还原反应,电极反应式为 2(CH3)4N++2H2O+2e =2(CH3)4NOH+H2↑,则制备1mol四甲基氢氧化铵则转移1mole-,阴极产生0.5molH2,阳极产生0.25molO2(电极反应式为4OH--4e-=O2↑+2H2O),共产生0.75mol气体。
31.(1)H2
(2) 放出 185 大于
(3)C>B>A>D
(4) A到B 2NA
【详解】(1)键能越大,则越不容易被破坏,则物质越稳定,结合图表可知,最稳定的是H2;
(2)反应的焓变等于生成物键能和减去反应物的键能和,则焓变为(243kJ/ml)+( 436kJ/ml)-2×(432kJ/ml)=-185kJ/ml,△H<0为放热反应,反应,生成2mol HCl放出的热量为185kJ。根据能量守恒定律,该反应放热,反应物的总能量应该>其生成物的总能量;
(3)活泼金属做负极,A表面有气泡说明A为正极,H+发生还原反应生成氢气,活动性B>A;B电极质量增加说明铜离子在B极发生还原反应生成铜单质,B为正极,活动性C>B;电子由负极到正极,A为负极,活动性A>D,综上所述活动性顺序为:C>B>A>D;
(4)①在该电池中乙醇为燃料失电子为负极(A),氧气为正极(B),条件为酸性介质,阳离子向正极(B)移动,的移动方向为由A到B;A为负极,乙醇发生氧化反应,电极的电极反应式:。
②正极反应式为:3O2+12H++12e-=6H2O,若标况下有11.2L (0.5mol)参与反应,理论上通过质子交换膜的的物质的量为2mol,数目为2NA。
32.(1)吸热
(2)太阳能
(3)436.0
(4)
(5) 正 H2O2+2e-=2OH- 2NA
【详解】(1)制作冷敷袋利用吸热的化学变化或物理变化的原理。
(2)光伏电池能将太阳能直接转变为电能。
(3)反应热=反应物的总键能-生成物的总键能,2NH3(g)N2(g)+3H2(g) △H =390.8kJ/mol×3×2-946 kJ/mol -3a kJ/mol =+90.8 kJ/mol,解得a=436.0。
(4)
根据总反应可知,单质铁失电子化合价升高,铁作负极,不如铁活泼的金属或导电的非金属作正极,如C,三价铁离子在正极得电子发生还原反应, FeCl3溶液为正极的电解质溶液,其装置图为:。
(5)①由图可知,氮元素价态升高失电子,故A极为负极,惰性电极B是电池的正极,H2O2得到电子生成OH-,根据得失电子守恒和电荷守恒配平电极方程式为:;
②由图可知,氮元素价态升高失电子,故A极为负极,电极反应式为,若A极区产生14 g,物质的量为0.5mol,转移得电子数目为0.5×4NA=2NA;
③有人提出可用甲烷去替代肼,甲烷在负极失去电子生成碳酸钠,根据得失电子守恒和电荷守恒配平电极方程式为:。
33.(1) 5.6 减小 3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3 SO2
(2)SiO2+2OH-=SiO+H2O
(3)A
(4)
(5)Na-e-=Na+
【详解】(1)①pH<5.6的雨水被称为酸雨;SO2型酸雨久置,亚硫酸会被空气中的氧气氧化成硫酸,酸性增强,溶液的pH会减小;NO2能形成酸雨的原因是3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;②SO2是暂时性漂白、H2O2和浓硝酸是利用强氧化性漂白,漂白原理与其他物质不同的是SO2;
(2)SiO2可用于制作光导纤维,但遇强碱溶液会发生SiO2+2OH-=SiO+H2O而出现“断路”现象;
(3)A、将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,说明木条燃烧所需氧气来自NO2,说明NO2能支持燃烧,故A正确;B、C、D错误,故选A;
(4)铅酸蓄电池工作时正极的电极方程式为;
(5)钠硫电池工作时,负极的电极方程式Na-e-=Na+。
答案第1页,共2页
答案第1页,共2页
考点一 化学反应与热能 【题型1】放热反应和吸热反应的判断
【题型2】反应过程能量变化图分析
【题型3】反应中能量变化的关系及相关计算
考点二 化学反应与电能 【题型1】原电池的工作原理
【题型2】原电池原理的应用
【题型3】化学电源分析
【题型4】化学反应与热能、电能综合分析题
考点一 化学反应与热能
01 放热反应和吸热反应的判断
【例1】
1.下列关于化学反应中物质或能量变化的判断正确的是
A.加热条件下进行的化学反应一定是吸热反应
B.化学键的断裂是化学反应中能量变化的主要原因
C.化学反应过程中一定伴随能量变化
D.将固体与固体混合并搅拌,反应放出热量
【例2】
2.小茗同学所在的化学兴趣小组为了探究化学反应的热效应,进行了如下实验:
(1)将纯固体物质X分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
①若如图1所示,发生的反应(假设没有气体生成)是 (填“放热”或“吸热”)反应,X可以是 (填化学式,只填一种即可)。
②若如图2所示,发生的反应(假设没有气体生成)是 (填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是 (填字母)。
A.CO还原CuO的反应 B.CaCO3的分解反应 C.Al和Fe2O3的反应
(2)如图3所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放几小块铝片,再滴入5mLNaOH溶液。试回答下列问题:
图3
实验中观察到的现象是:大试管中铝片逐渐溶解、有大量气泡产生、烧杯中澄清的石灰水变浑浊,其中“石灰水变浑浊”的主要原因是 。
【变式1-1】
3.下列说法不正确的是
①在高温、高压条件下发生的反应一定是吸热反应②在常温、常压下就能发生的反应一定是放热反应③氧化还原反应都是放热反应,复分解反应除酸碱中和反应外都是吸热反应④化合反应都是放热反应,分解反应都是吸热反应
A.②③ B.①②③
C.①③④ D.①②③④
【变式1-2】
4.下列是吸热反应的是
A.一氧化碳在空气中的燃烧反应 B.Ba(OH)2·8H2O与氯化铵固体的反应
C.干冰升华 D.NaOH溶液与稀盐酸的反应
【变式1-3】
5.请根据相关的知识,回答下列问题:
(1)下列变化:①碘的升华;②冰熔化;③氯化钠溶于水;④氯化氢溶于水;⑤氢氧化钠溶于水。化学键未被破坏的是 (填序号),仅离子键被破坏的是 (填序号)。
(2)已知一定条件下,1 mol化学键断裂时吸收的能量相关数据如下表:
化学键 H—H O=O H—O
能量(kJ) 436 496 463
在25℃、1.013×105Pa时,H2(g)与O2(g)反应生成1 mol H2O(g)的热化学反应方程式为 ,该反应为 反应(填“吸热”或“放热”),反应的能量变化可用图 表示(填“甲”或“乙”)。
(3)下列变化中,属于吸热反应的是 (填序号)。
①铝片与稀盐酸的反应
②Ba(OH)2·8H2O晶体与NH4Cl晶体混合反应
③铁在氯气中燃烧
④氯酸钾分解制氧气
⑤生石灰与水反应生成熟石灰
02 反应过程能量变化图分析
【例1】
6.某反应由两步反应A→B→C完成,它的反应能量变化曲线如图所示。下列叙述正确的是
A.两步反应均为吸热反应
B.A与C的能量差为E4
C.三种物质中C最稳定
D.A→B的反应一定需要加热
【例2】
7.汽车受到猛烈碰撞时,安全气囊内的固体迅速分解,产生氮气和金属钠,该过程中的能量变化如下图所示。下列说法错误的是
A.属于离子化合物
B.的分解反应属于放热反应
C.表示2mol固体的能量
D.作为安全气囊的气体发生剂,具有产气快、产气量大等优点
【变式2-1】
8.化学反应A+B→C(吸收能量)分两步进行:①A+B→X(吸收能量),②X→C(放出能量)。下列示意图中表示总反应过程中能量变化的是
A. B.
C. D.
【变式2-2】
9.已知反应NO2(g)+CO(g)NO(g)+CO2(g)的能量变化如图所示。下列说法正确的是
A.图中A→B为放热过程
B.该反应为吸热反应
C.断裂1molNO2和1molCO的化学键吸收的能量总和小于形成1molNO和1molCO2的化学键所释放的能量的总和
D.1molNO2(g)和lmolCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
03 反应中能量变化的关系及相关计算
【例1】
10.已知氢气完全燃烧生成水蒸气时放出能量,水蒸气中键形成时放出能量,键断裂时吸收的能量为,断开氧气中的化学键需要吸收的能量是
A. B. C. D.
【例2】
11.肼()是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、N-N键为154,则断裂1molN-H键所需的能量是
A.194kJ B.391kJ C.516kJ D.658kJ
【变式3-1】
12.氢气燃烧生成水蒸气的能量变化如图所示。下列说法正确的是
A.燃烧时化学能全部转化为热能
B.断开1mol氧氢键吸收930kJ能量
C.相同条件下,1 mol氢原子的能量为E1,1 mol氢分子的能量为E2,则2E1
【变式3-2】
13.与反应过程的能量变化如图所示,下列说法不正确的是
A.该反应为放热反应
B.该反应中与的总能量大于和的总能量
C.该反应的热化学方程式: kJ·mol
D.1mol和1mol反应生成1mol和1mol要放出41kJ的热量
【变式3-3】
14.现代社会中,人类的一切活动都离不开能量,从煤、石油和天然气等提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。回答下列问题:
(1)绿色能源也称清洁能源,是指在生产和使用过程中不产生有害物质排放的能源。下列属于绿色能源的是 (填标号,下同)。
①太阳能 ②煤 ③石油 ④风能 ⑤氢能
(2)下列反应中生成物总能量高于反应物总能量的是_______。
A.甲烷燃烧 B.灼热的炭与反应
C.镁与稀硫酸反应 D.钠和水反应
(3)与反应生成过程中的能量变化如图所示,和完全反应生成会 (填“吸收”或“放出” )的能量。
(4)已知反应在不同条件下的化学反应速率如下:
①
②
③
④
请比较上述4种情况反应的快慢: (按由大到小的顺序填写序号)。
(5)用和组合形成的质子交换膜燃料电池的结构如图所示:
①电极是 (填“正极”或“负极”),电极c的电极反应式是 。
②若电路中转移电子,则该燃料电池理论上消耗的在标准状况下的体积为 L。
考点二 化学反应与电能
01 原电池的工作原理
【例1】
15.有如图所示的实验装置,下列判断正确的是
a电极 b电极 X溶液 实验判断
A Cu Zn H2SO4 H+向b极迁移
B Zn Fe H2SO4 电子从Zn→Fe→Zn
C Al Mg NaOH a为负极,b为正极
D Cu 石墨 FeCl3 a极质量减小,b极质量增加
A.A B.B C.C D.D
【例2】
16.关于如图所示装置的叙述确的是
A.两装置均能将化学能转化为电能
B.两装置中锌片均发生还原反应
C.图2溶液中向铜片迁移
D.图2中溶解锌时转移电子
【变式1-1】
17.某小组利用如图装置研究原电池工作原理。下列叙述不正确的是
A.和不连接时,铁片上会有金属铜析出
B.和用导线连接时,铜片上的反应为
C.无论a和b是否连接,铁片均发生还原反应
D.a和b用导线连接时,溶液中向铜电极移动
【变式1-2】
18.某学生用如图所示装置研究原电池的原理,下列说法错误的是
A.装置(1)中铜棒上没有气体产生
B.装置(2)中棒逐渐溶解,铜棒电极反应式为:
C.当装置(3)电路中转移电子,负极和正极质量变化之差为
D.装置(2)与(3)中正极生成的物质质量之比为1∶32时,棒的质量变化相等
【变式1-3】
19.某化学兴趣小组为了探索电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
实验编号 电极材料 电解质溶液 电流计指针偏转方向
1 Mg、Al 稀盐酸 指向铝
2 Al、Cu 稀盐酸 偏向铜
3 A1、石墨 稀盐酸 偏向石墨
4 Mg、Al NaOH溶液 偏向镁
根据上表中记录的实验现象,下列说法不正确的是
A.实验1中铝电极上发生还原反应
B.实验2中电子从铝片经导线流向铜片
C.实验2和3都是A1做负极,实验1和4都是Al做正极
D.实验3正极的电极反应为2H++=H2↑
02 原电池原理的应用
【例1】
20.现有a、b、c、d四个金属电极,用导线两两相连组成原电池。①a、b相连插入硫酸铜溶液中后,b极变粗;②a、d相连插入稀硫酸中后,外电路电流从a流向d;③b、c相连插入稀硫酸中后,c极上有气泡产生;④c、d相连插入稀硫酸中后,d极溶解。则下列说法正确的是
A.由①和④可推出金属活动性:Cu>c
B.由②和③可推出金属活动性:d>c
C.由①②③可推出金属活动性:d>a>b>c
D.由①②④可推出金属活动性:a>b>d>c
【例2】
21.已知反应,下列叙述不正确的是
A.可将该反应设计成如图甲所示的原电池
B.反应过程中能量关系可用图乙表示
C.若Fe不纯(含有杂质碳),该反应的化学反应速率要减慢
D.图甲装置中,在铜表面被还原产生气泡
【变式2-1】
22.根据原电池原理,人们研制出性能各异的化学电池。
(1)锌铜原电池装置示意图如图所示,Zn片作 (填“正极”或“负极”)。
(2)铜片上观察到的实验现象是 ,锌片上的电极反应式为 。
(3)电流表指针发生偏转,说明该装置实现了化学能向 的转化。
(4)若把反应仿照上图设计成原电池,则两个电极分别为铜、 (填材料名称),电解质溶液为 (填化学式)。
(5)镁、海水、溶解氧可构成原电池,为水下小功率设备长时间供电,结构示意图如图所示,其总反应为:。下列说法正确的是 (填字母序号)。
a.Mg作电池的负极 b.发生氧化反应
【变式2-2】
23.原电池是利用氧化还原反应设计的装置,该装置的特点是使氧化反应和还原反应在两个电极进行,“迫使”电子沿着特定的路线移动,从而产生电能。甲、乙两个原电池装置如图所示:
回答下列问题:
(1)若装置甲的溶液M为稀硫酸,两个电极采用镁棒和铝棒。
①电极X为 (填“正极”或“负极”),该电极反应式为 。
②该电池的正极是 (填“镁棒”或“铝棒”),该电极产物W是 (填化学式)。
③该原电池总反应的化学方程式是 。
(2)若装置甲中两电极质量变化与时间的关系如图所示,其中一个电极为Ag电极,则该电池的电解质溶液为 (填化学式)溶液,电极X为 (填字母)
a.Fe电极 b.Mg电极 c.Cu电极 d.Al电极
(3)将(1)中原电池生成的气体产物W通入装置乙中可制备燃料电池。
①正极为 (填“电极甲”或“电极乙”),该电极发生 (填“氧化反应”或“还原反应”)。
②该电池工作时,外电路中电子由 (填“电极甲”或“电极乙”,下同)流出;电解质溶液中的移向 。
03 化学电源分析
【例1】
24.如图是铅酸蓄电池的构造示意图,下列说法错误的是
A.铅酸蓄电池是二次电池,充电时电能转化为化学能
B.该电池工作时,电子由板通过外电路流向板
C.该电池工作时,负极的电极反应式为
D.该电池工作时,移向板
【例2】
25.某锂离子电池的工作原理如图所示(a极材料为金属锂和石墨的复合材料),其电池反应为Li+FePO4=LiFePO4。下列关于该电池的说法正确的是
A.a极为正极 B.b极发生氧化反应
C.Li+从a极室向b极室移动 D.可以用稀硫酸作电解质溶液
【例3】
26.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH 增大
D.溶液中Cl-向正极移动
【变式3-1】
27.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.甲:溶液中Zn2+向Cu电极方向移动,电子由锌经电解质溶液流向铜电极
B.乙:正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
【变式3-2】
28.氢氧燃料电池是一种常见化学电源,其工作示意图如图。下列说法正确的是
A.由正极流向负极
B.溶液的作用是传导电子
C.b电极上发生还原反应,电极反应式为
D.标准状况下a电极若每消耗,外电路转移电子数为
【变式3-2】
29.二次电池的充电可看作是其放电的逆过程。我国研究的锂硫电池是一种新型二次电池,其总反应是,充放电曲线如图所示,下列说法正确的是
A.充电时,化学能转化为电能
B.放电时,锂离子向负极移动
C.放电时,转化为时得到
D.从安全角度考虑,该电池的电解质溶液不宜用水作溶剂
【变式3-4】
30.化学能和电能的相互转化是能量转换的重要形式,请按要求完成下列电化学相关问题。
(1)把A、B、C、D四种金属按表中装置进行实验。
装置
电子从A到B C电极的质量增加 金属D不断溶解
根据表中信息判断四种金属活动性由大到小的顺序是 ;(用ABCD表示)
(2)盐桥式原电池的装置图如下
①铜为 (填“正”或“负”)极。
②若装置中铜电极的质量增加3.2g,则导线中转移电子的数目为
③该装置的盐桥中除添加琼脂外,还要添加饱和溶液,电池工作时,盐桥的作用是 。
(3)还原电化学法制备甲醇()的工作原理如图所示:
电池工作过程中通过质子膜向 (填“左”或者“右”)移动,通的一端发生的电极反应式为 。
(4)锂钊氧化物电池放电时的总反应:,则其正极充电时的电极反应式为: 。
(5)以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成四甲基氢氧化铵[(CH3)4NOH],其工作原理如图所示(a、b为石墨,c、d、e为离子交换膜),当制备时,a、b两个极共产生 气体。
04 化学反应与热能、电能综合分析题
【例1】
31.现代社会活动需要利用化学反应中的物质和能量变化。
Ⅰ.化学能与热能
下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题:
物质 HCl
键能/kJ 243 193 151 436 432
(1)以上物质中最不稳定的是 。
(2)按照反应,生成2mol HCl (填“吸收”或“放出”)的热量为 kJ。根据能量守恒定律,反应物的总能量应该 其生成物的总能量(填“大于”或“小于”)。
Ⅱ.化学能与电能
(3)把A、B、C、D四种金属按表中装置进行实验。
装置
A表面有气泡 B电极的质量增加 电子由A到D
根据表中信息判断四种金属活动性由大到小的顺序是 。
(4)“乙醇燃料电池”的工作原理为,装置如图所示。
①在该电池中的移动方向为由 (填“A到B”或“B到A”)。写出A电极的电极反应式: 。
②若标况下有11.2L 参与反应,理论上通过质子交换膜的数目为 。
【变式4-1】
32.任何化学反应都伴随着能量的变化,通过化学反应,化学能可以与热能、电能等不同形式的能量相互转化,用于生产、生活和科研。请回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用 (填“放热”或“吸热”)的化学变化或物理变化的原理。
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将 直接转变为电能(填:“化学能”“太阳能”“热能”等)
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
化学键
键能E/(kJ·mol) 946.0 a 390.8
一定温度下,利用催化剂将分解为和3 mol ,吸收90.8 kJ热量,则 。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液 。
(5)肼-过氧化氢碱性燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
①惰性电极B是电池的 (填“正”或“负”)极,其电极反应式为 。
②电池工作过程中,若A极区产生14 g,则转移的电子数目为 。
③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为 。
【变式4-2】
33.硅、硫、氮是重要的非金属元素,请根据题意回答问题。
(1)大气污染物主要成分包括:SO2、NO2、CO、可吸入颗粒物等,主要来源于燃煤、机动车尾气和工业废气。
①其中SO2、NO2能形成酸雨,酸雨的pH< ,SO2型酸雨久置后溶液的pH会 (填“增大”、“减小”、“不变”),NO2能形成酸雨的原因是(用化学方程式表示): 。
②SO2在人们的生活也担任着重要的角色,其中SO2、H2O2、浓硝酸均具有漂白作用,其漂白原理与其他物质不同的是: 。
(2)SiO2可用于制作光导纤维,但遇强碱溶液会发生“断路”现象,其原因是: (用离子方程式表示)
(3)硝酸盐受热亦会发生分解且复杂,某学习小组对Cu(NO3)2的分解产生了兴趣,已知Cu(NO3)2受热分解的化学方程式为,将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,针对此现象下列分析合理的是_____。
A.NO2能支持燃烧
B.无法确定NO2是否支持燃烧
C.产物中有氧气,所以木条复燃
D.NO2肯定不支持燃烧
(4)铅酸蓄电池是我们生活中常见的二次电池,其结构示意图如下,电池工作时正极的电极方程式为: 。
(5)新型电池一钠硫电池以熔融金属钠、熔融硫和多硫化钠()分别作为两个电极的反应物,陶瓷(可传导)为电解质,装置示意图如下,请写出负极的电极方程式:
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A.铝热反应需要在高温条件下进行,但是该反应会放出大量的热,A错误;
B.化学反应中能量变化的主要原因是化学键的断裂和形成,B错误;
C.化学反应是旧键的断裂和新键形成的过程,旧键断裂吸收能量,新键形成放出能量,因此化学反应过程中一定伴随能量变化,C正确;
D.与的反应是吸热反应,D错误;
故选C。
2.(1) 放热 CaO 吸热 AB
(2)铝片与NaOH溶液反应放热,烧杯内溶液温度升高,Ca(OH)2溶解度降低,析出晶体
【详解】(1)①将纯固体物质X装入有水的锥形瓶里(假设没有气体生成),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度若如图1所示,U形管左侧液面降低,右侧液面升高,说明锥形瓶内气体膨胀,温度升高,发生的反应是放热反应,氧化钙和水反应生成氢氧化钙,反应放热,所以X可以是CaO。
②将纯固体物质X装入有水的锥形瓶里(假设没有气体生成),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度若如图2所示,U形管左侧液面升高,右侧液面下降,说明锥形瓶内气体收缩,温度降低,发生的反应是吸热反应;
A.CO还原CuO生成二氧化碳和铜,该反应是吸热反应,故选A;
B.CaCO3的分解生成氧化钙和二氧化碳,分解反应吸热,故选B;
C.Al和Fe2O3的反应生成氧化铝和铁,铝热反应放热,故不选C;
选AB;
(2)氢氧化钙的溶解度随温度升高而降低,铝片和氢氧化钠反应生成偏铝酸钠和氢气,反应放热,烧杯内溶液温度升高,氢氧化钙溶解度减小,有氢氧化钙析出,所以烧杯中澄清的石灰水变浑浊。
3.D
【详解】①反应为放热反应,①错误;
②为吸热反应,②错误;
③
为吸热反应,为放热反应,③错误;
④化合反应可能是吸热反应,如,分解反应可能是放热反应,如,④错误;
故①②③④均错误,故D符合;
故选D。
4.B
【详解】A.燃烧反应都是放热反应,所以一氧化碳在空气中的燃烧反应是放热反应,A不符合题意;
B.Ba(OH)2·8H2O与氯化铵固体发生的复分解反应,需要从空气中吸收热量,属于吸热反应,B符合题意;
C.干冰升华时,由固态转化为气态,分子间距离增大,需要吸收热量,但此过程为物理过程,不属于化学反应,C不符合题意;
D.NaOH溶液与稀盐酸发生中和反应,中和反应都是放热反应,D不符合题意;
故选B。
5.(1) ①② ③⑤
(2) H2(g)+O2(g)=H2O(g) ΔH=-242 kJ·mol-1 放热 甲
(3)②④
【详解】(1)①碘的升华、②冰熔化改变了分子间作用力,并未破坏发生化学键,③氯化钠溶于水发生电离,故仅破坏了离子键,④氯化氢溶于水发生电离,因为氯化氢是共价化合物,故仅破坏了共价键,⑤氢氧化钠溶于水破坏了离子键;化学键未被破坏的是:①②;仅离子键被破坏的是:③⑤;
(2)反应H2(g)+O2(g)=H2O(g)的ΔH=反应物的总键能-生成物的总键能=436 kJ·mol-1+×496 kJ·mol-1-2×463 kJ·mol-1=-242 kJ·mol-1,故热反应方程式为H2(g)+O2(g)=H2O(g) ΔH=-242 kJ·mol-1,该反应为放热反应,反应物的总能量大于生成物的总能量,故为甲;
(3)①铝片与稀盐酸的反应为放热反应;
②Ba(OH)2·8H2O晶体与NH4Cl晶体混合反应为吸热反应;
③铁在氯气中燃烧为放热反应;
④氯酸钾分解制氧气为吸热反应;
⑤生石灰与水反应生成熟石灰为放热反应;
故选②④。
6.C
【详解】A.根据图中信息A→B是吸热反应,B→C是放热反应,故A错误;
B.根据图中信息A与C的能量差为E5,故B错误;
C.根据能量越低越稳定,C物质的能量最低,因此三种物质中C最稳定,故C正确;
D.吸热反应、放热反应与反应条件无关,吸热反应并一定需要加热,比如氯化铵和Ba(OH)2 8H2O的反应不需要加热,因此A→B的反应不一定需要加热,故D错误。
综上所述,答案为C。
7.C
【详解】A.由Na+和N构成,属于离子化合物,故A正确;
B.的分解反应,反应物总能量大于生成物总能量,属于放热反应,故B正确;
C.表示该反应的活化能,故C错误;
D.汽车受到猛烈碰撞时,安全气囊内的固体迅速分解,产生氮气和金属钠,具有产气快、产气量大,故D正确;
选C。
8.D
【详解】A.化学反应A+B→C(吸收能量)的反应,说明反应物A、B的总能量比生成物C的总能量低,图示是反应物A、B的总能量比生成物C的总能量高,反应属于放热反应,与反应事实不吻合,A错误;
B.化学反应A+B→C(吸收能量)的反应,说明反应物A、B的总能量比生成物C的总能量低,图示是反应物A、B的总能量比生成物C的总能量高,反应属于放热反应,与反应事实不吻合。反应分两步进行,第一步反应①A+B→X(吸收能量),而图示A、B的总能量比中间产物X的能量高,反应是放热反应,也与反应事实不吻合,B错误;
C.化学反应A+B→C(吸收能量)分两步进行:①A+B→X(吸收能量),而图示显示的反应物A、B的总能量比中间产物X的总能量高,反应是放热反应,与题意不符合,C错误;
D.放热反应说明反应物的总能量比生成物的能量高;吸热反应说明反应物的总能量比生成物的能量低。图像显示反应事实吻合,D正确;
答案选D。
9.C
【详解】A.图中A→B的过程,能量升高,为吸热过程,A项错误;
B.生成物总能量小于反应物总能量,该反应为放热反应,B项错误;
C.该反应为放热反应,则断裂1molNO2和1molCO的化学键吸收的能量总和小于形成1molNO和1molCO2的化学键所释放的能量的总和,C项正确;
D.该反应为放热反应,反应物的总能量大于生成物的总能量,则1molNO2(g)和lmolCO(g)的总能量高于1molNO(g)和1molCO2(g)的总能量,D项错误;
答案选C。
10.C
【详解】根据题目信息,氢气即2mol氢气完全燃烧生成水蒸气时放出能量484kJ,写出对应的热化学方程式为2H2(g)+O2(g)=2H2O(g) ,反应中断裂了2molH-H键和1molO=O键、形成了4molO-H,设断开氧气中的化学键需要吸收的能量为x,则根据=断裂旧键所需的能量-生成新键释放的能量知,,解得x=496kJ,故选C。
11.B
【详解】根据图中内容可知,,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新建形成释放能量,设断裂1molN-H键所需的能量为K,所以有154+4K+500=2218;解得K=391;
故答案选B。
12.D
【详解】A. 燃烧是部分化学能变为热能,还有光能等,故错误;
B. 从图分析,断开2mol氢氧键吸收930kJ的能量,故错误;
C. 氢气分子变成氢原子要吸收能量,所以2E1>E2,故错误;
D. 该反应生成1mol水蒸气时的能量变化为930-436-249=245kJ,故正确;
故选D。
13.D
【详解】A.由图可知△H<0,该反应为放热反应,A选项正确;
B.由图可知反应物CO(g)+H2O(g)的总能量大于生成物CO2(g)+H2(g)的总能量,B选项正确;
C.由图可知该反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= 41 kJ·mol 1,C选项正确;
D.图中反应是放热反应,其逆反应为吸热反应,D选项错误;
答案选D。
14.(1)①④⑤
(2)B
(3) 吸收 180
(4)③①②④
(5) 正极 11.2
【详解】(1)①太阳能④风能⑤氢能生产和使用过程中不产生有害物质,属于绿色能源;
(2)反应中生成物总能量高于反应物总能量,可知该反应为吸热反应,燃烧、活泼金属与酸、钠与水反应均为放热反应,反应物的能量高于生成物能量,灼热的炭与反应吸收能量,生成物能量高于反应物能量,故ACD不符合题意;故答案为:D;
(3)1mol与1mol反应断裂化学键吸收能量:(946+498)=1444kJ;生成2molNO时放出热量2×632=1264kJ热量,由此可知和完全反应生成会吸收180的能量;
(4)将各条件下速率均转化为氮气的速率,①对应氮气速率为:;
②;
③
④
4种情况反应的快慢:③①②④;
(5)①由图可知电子由电极c流出,电极c为负极,电极d为正极,电极c的电极反应式是;
②电极d上发生反应:,电路中转移电子,则该燃料电池理论上消耗的的物质的量为0.5mol,标准状况下的体积为11.2。
15.C
【详解】A. Cu、Zn、稀硫酸组成的原电池,锌较活泼,作原电池的负极,铜作原电池的正极,电解质溶液中的阳离子H+向正极铜电极移动,即向a极迁移,A错误;
B. Zn、Fe、稀硫酸组成的原电池,锌较活泼,作原电池的负极,铁作原电池的正极,电子从Zn流向Fe,但是无法再流向Zn,B错误;
C. 铝、镁、氢氧化钠溶液组成的原电池,电池反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝发生氧化反应,作原电池的负极,镁电极作原电池的正极,即a为负极,b为正极,C正确;
D. 铜、石墨、氯化铁溶液组成的原电池,电池反应为:2FeCl3+Cu=2FeCl2+CuCl2,铜电极发生氧化反应,作原电池的负极,电极反应为:Cu-2e- =Cu2+,电极质量减小,石墨作原电池的正极,电极反应式为:2Fe3++2e- =2Fe2+,电极质量不变,D错误;
故答案选C。
16.D
【详解】A.图2装置形成原电池,能将化学能转化为电能,但图1装置没有形成原电池,不能化学能转化为电能,A错误;
B.锌比铜活泼,两装置中锌片均发生氧化反应生成硫酸锌,B错误;
C.图2装置形成原电池,锌作负极,铜作正极,原电池工作时,阴离子移向负极,即溶液中向锌片迁移,C错误;
D.图2装置形成原电池,锌作负极,负极反应式为Zn-2e-=Zn2+,n(e-)=2n(Zn)=2×=0.2mol,D正确;
故选D。
17.C
【详解】A.和不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,所以铁片上会有金属铜析出,故A正确;
B.和用导线连接时,形成了原电池,铜作正极,发生的反应为:,故B正确;
C.和不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,和用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,无论和是否连接,铁片均会溶解,铁片均发生氧化反应,故C错误;
D.和用导线连接时,形成了原电池,为负极,为正极,铜离子移向铜电极,故D正确;
答案选C。
18.C
【分析】(1)因没有形成闭合回路,不是原电池装置;(2)形成了铜锌原电池,且Zn为负极;(3)也形成了铜锌原电池,Zn为负极。
【详解】A.装置(1)是化学腐蚀,锌和稀硫酸发生反应生成氢气,铜和稀硫酸不反应,铜棒上没有气体产生,A正确;
B.装置(2)是原电池装置,锌做负极,铜做正极,溶液中氢离子在铜电极生成氢气,电极反应式为:,B正确;
C.装置(3)是原电池装置,锌做负极失电子生成锌离子,铜做正极,溶液中铜离子得到电子生成铜,锌电极减轻,铜电极增重,当装置(3)电路中转移1mol电子,负极和正极质量变化之差为,C错误;
D.装置(2)与(3)中负极电极反应均为,装置(2)中正极上电极反应为,装置(3)中正极电极反应为,正极生成物质质量比为1∶32时,依据电子守恒计算的两个原电池中电子转移相同,所以反应的锌的质量相同,棒的质量变化相等,D正确;
故选C。
19.C
【详解】A.实验1中电解质溶液为稀盐酸,则根据金属活动性Mg>Al,则金属Mg做负极材料,化合价升高失去电子发生氧化反应,金属Al为正极发生还原反应,A项正确;
B.实验2中电解质溶液为稀盐酸,则金属Al为负极,化合价升高失去电子,则电子从负极经过导线流向正极,B项正确;
C.实验2中金属Al为负极,实验3中金属Al为负极,实验1中金属Al为正极,实验4中金属Al为负极,C项错误;
D.实验3正极为石墨,电解质溶液为稀盐酸,则溶液中的阳离子在石墨电极上变为氢气,正极的电极反应式为:2H++=H2↑,D项正确;
答案选C。
20.C
【分析】①a、b相连插入硫酸铜溶液中后,b极变粗,说明b电极是正极,铜离子放电,析出铜,金属性a>Cu,且a>b;②a、d相连插入稀硫酸中后,外电路电流从a流向d,a是正极,d是负极,金属性d>a;③b、c相连插入稀硫酸中后,c极上有气泡产生,c电极是正极,b电极是负极,金属性b>c;④c、d相连插入稀硫酸中后,d极溶解,d电极是负极,c电极是正极,金属性d>c。据此判断。
【详解】A.根据以上分析可知由①和④无法推出金属活动性:Cu>c,A错误;
B.由②和③可推出金属活动性:d>a、b>c,无法判断d与c的金属性强弱,B错误;
C.由①②③可推出金属活动性:d>a>b>c,C正确;
D.由①②④可推出金属活动性:d>a>b、d>c,b和c的金属性无法判断,D错误;
答案选C。
21.C
【详解】A.图甲构成了铜铁原电池,负极反应为、正极反应为,则总反应为,A正确;
B.该反应是放热反应,故可以用图乙表示其反应过程中的能量关系,B正确;
C.若铁不纯(含有碳单质),则可以形成很多微型原电池而加快反应速率,C错误;
D.根据电极反应式可知,在铜表面被还原产生H2,D正确;
故选C。
22.(1)负极
(2) 有气泡产生
(3)电能
(4) 银(或铂、石墨等其它合理答案) (或)
(5)a
【详解】(1)Zn比Cu活泼,Zn作负极;
(2)Cu作正极,电极反应式为2H++2e-=H2↑,实验现象是有气泡产生,锌片上的电极反应式为;
(3)电流计指针发生偏转,说明产生电流,该装置构成原电池,可以将化学能转化为电能;
(4)原电池中失电子的物质作负极,根据方程式知,铜失电子作负极,导电的银或铂、石墨等作正极;电解质是反应物中可溶性的、得电子的物质,所以电解质是可溶性的铁盐,可用(或)作电解质;
(5)a.镁-海水电池工作时,Mg发生失电子的反应,作电池的负极,石墨作正极,故a正确;
b.镁-海水电池工作时,石墨作正极,正极上O2发生得电子的还原反应生成OH-,故b错误;故答案为:a。
23.(1) 负极 铝棒 H2
(2) AgNO3 d
(3) 电极甲 还原反应 电极乙 电极乙
【详解】(1)①镁与硫酸反应,铝与硫酸反应,镁的活泼性比铝强,因此镁为负极,铝为正极,再根据X电极是电子流出的极,则电极X为负极,该电极反应式为;故答案为:负极;。
②根据前面分析该电池的正极是铝棒,该电极是氢离子得到电子变为氢气,因此正极产物W是H2;故答案为:铝棒;H2。
③该原电池总反应是镁和硫酸反应生成硫酸镁和氢气,其化学方程式是;故答案为:。
(2)若装置甲中两电极质量变化与时间的关系如图所示,其中一个电极为Ag电极,则一个电极质量增加10.8g,另一个电极质量减少0.9g,题中金属活泼性都比银弱,说明银为正极,银电极质量增加,则该电池的电解质溶液为硝酸银(AgNO3)溶液,有0.1mol银生成,有0.1mol电子转移,则负极会消耗0.05mol铁或0.05mol镁或0.05mol铜或铝,质量分别为2.8g、1.2g、3.2g、0.9g,则电极X为Al电极;故答案为:AgNO3;d。
(3)①燃烧电池中燃料为负极,氧化剂为正极,则正极为电极甲,氧气得到电子,则说明该电极发生还原反应;故答案为:电极甲;还原反应。
②该电池工作时,外电路中电子由负极即电极乙流出;根据原电池“同性相吸”,则电解质溶液中的移向负极即电极乙;故答案为:电极乙;电极乙。
24.D
【详解】A. 铅酸蓄电池是可充电电池,是二次电池,充电时电能转化为化学能,A项正确;
B. 在该电池中板为负极,则电池工作时,电子由板通过外电路流向板,B项正确;
C. 该电池工作时,负极的电极反应式为,C项正确;
D. 在原电池工作时,阳离子向正极移动,则该电池工作时移向板,D项错误;
故选D。
25.C
【详解】A.极为负极,A项错误;
B.b极为正极,得电子,发生还原反应,B项错误;
C.透过隔膜,从a极室进入b极室,C项正确;
D.是活泼金属,能与稀硫酸反应,故不能用稀硫酸作电解质溶液,D项错误。
答案为C。
26.C
【详解】A.组成原电池的负极被氧化,在Mg-H2O2电池中,镁为负极,而非正极,A项错误;
B. H2O2在石墨电极上得电子发生还原反应,B项错误;
C.工作时,正极反应式为H2O2+2H++2e-═2H2O,不断消耗H+离子,正极周围海水的pH增大,C项正确;
D.原电池中,阳离子向正极移动,阴离子向负极移动,形成闭合回路,所以溶液中的Cl-向负极移动,D项错误。
答案选C。
【点睛】本题考查原电池的工作原理等知识。正确书写电极反应式为解答该题的关键,镁-H2O2酸性燃料电池中,镁为活泼金属,应为原电池的负极,被氧化,电极反应式为Mg-2e-═Mg2+,H2O2具有氧化性,应为原电池的正极,被还原,电极反应式为H2O2+2H++2e-═2H2O,根据电极反应式判断原电池总反应式,根据电极反应判断溶液pH的变化。
27.A
【详解】A.Zn较Cu活泼,做负极,Zn失电子变Zn2+,电子经导线转移到铜电极,电子不经过电解质溶液,铜电极负电荷变多,吸引了溶液中的阳离子,因而Zn2+和H+迁移至铜电极,A项错误;
B.Ag2O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e +H2O=2Ag+2OH ,B项正确;
C.Zn为较活泼电极,做负极,发生氧化反应,电极反应式为Zn-2e-=Zn2+,锌溶解,因而锌筒会变薄,C项正确;
D.铅蓄电池总反应式为,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确;
故答案选A。
28.C
【分析】由图可知,氧气发生还原反应,b为正极、则a为负极;
【详解】A.原电池转化阳离子由负极向正极迁移,由负极流向正极,A错误;
B.溶液为内电路,作用是传导离子,B错误;
C.b电极上氧气得到电子发生还原反应,电极反应式为,C正确;
D.标准状况下a电极若每消耗(为0.5mol),,则外电路转移电子数为,D错误;
故选C。
29.D
【详解】A.充电时,电能转化为化学能,故A错误;
B.放电时是原电池,原电池“同性相吸”即锂离子向 极移动,故B错误;
C.放电时,,则转化为时得到,故C错误;
D.Li与水要反应,因此从安全角度考虑,该电池的电解质溶液不宜用水作溶剂,故D正确。
综上所述,答案为D。
30.(1)D>A>B>C
(2) 正 0.1NA 使两溶液均保持电中性
(3) 左 CO + 4e- + 4H+ = CH3OH
(4)Li1+xV3O8-xe-=xLi++LiV3O8
(5)0.75
【详解】(1)原电池的一个应用是可以判断金属的活泼性,一般负极比正极活泼。电子从A到B说明A为负极,B为正极,A>B;C电极的质量增加说明Cu2+在正极析出,C为正极B为负极,B>C;金属D不断溶解,说明D为负极,A为正极,D>A,四种金属活动性由大到小的顺序是D>A>B>C;
(2)①锌铜原电池中,锌比铜活泼,故锌为负极,铜为正极;
②3.2g铜物质的量为0.05mol,由电极反应式Cu2++2e-=Cu可知,生成1mol铜,转移2mol电子,故生成0.05mol铜,导线中转移0.1mol电子,电子数目为0.1NA;
③电池工作时,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使两溶液均保持电中性;
(3)该装置是原电池,根据总反应:CO+2H2=CH3OH可知,C的化合价降低,CO在正极得到电子,H的化合价升高,H2在负极失去电子,所以通入H2的一端是负极;电池工作过程中阳离子移向正极,所以H+向左移动;通入CO的一端为正极,CO在酸性溶液中得到电子转变为CH3OH,电极反应式为:CO + 4e- + 4H+ = CH3OH;
(4)充电时阳极失电子发生氧化反应,即放电时正极的逆反应,所以电极方程式为:Li1+xV3O8-xe-=xLi++LiV3O8;
(5)由图可知,a极为阴极,发生还原反应,电极反应式为 2(CH3)4N++2H2O+2e =2(CH3)4NOH+H2↑,则制备1mol四甲基氢氧化铵则转移1mole-,阴极产生0.5molH2,阳极产生0.25molO2(电极反应式为4OH--4e-=O2↑+2H2O),共产生0.75mol气体。
31.(1)H2
(2) 放出 185 大于
(3)C>B>A>D
(4) A到B 2NA
【详解】(1)键能越大,则越不容易被破坏,则物质越稳定,结合图表可知,最稳定的是H2;
(2)反应的焓变等于生成物键能和减去反应物的键能和,则焓变为(243kJ/ml)+( 436kJ/ml)-2×(432kJ/ml)=-185kJ/ml,△H<0为放热反应,反应,生成2mol HCl放出的热量为185kJ。根据能量守恒定律,该反应放热,反应物的总能量应该>其生成物的总能量;
(3)活泼金属做负极,A表面有气泡说明A为正极,H+发生还原反应生成氢气,活动性B>A;B电极质量增加说明铜离子在B极发生还原反应生成铜单质,B为正极,活动性C>B;电子由负极到正极,A为负极,活动性A>D,综上所述活动性顺序为:C>B>A>D;
(4)①在该电池中乙醇为燃料失电子为负极(A),氧气为正极(B),条件为酸性介质,阳离子向正极(B)移动,的移动方向为由A到B;A为负极,乙醇发生氧化反应,电极的电极反应式:。
②正极反应式为:3O2+12H++12e-=6H2O,若标况下有11.2L (0.5mol)参与反应,理论上通过质子交换膜的的物质的量为2mol,数目为2NA。
32.(1)吸热
(2)太阳能
(3)436.0
(4)
(5) 正 H2O2+2e-=2OH- 2NA
【详解】(1)制作冷敷袋利用吸热的化学变化或物理变化的原理。
(2)光伏电池能将太阳能直接转变为电能。
(3)反应热=反应物的总键能-生成物的总键能,2NH3(g)N2(g)+3H2(g) △H =390.8kJ/mol×3×2-946 kJ/mol -3a kJ/mol =+90.8 kJ/mol,解得a=436.0。
(4)
根据总反应可知,单质铁失电子化合价升高,铁作负极,不如铁活泼的金属或导电的非金属作正极,如C,三价铁离子在正极得电子发生还原反应, FeCl3溶液为正极的电解质溶液,其装置图为:。
(5)①由图可知,氮元素价态升高失电子,故A极为负极,惰性电极B是电池的正极,H2O2得到电子生成OH-,根据得失电子守恒和电荷守恒配平电极方程式为:;
②由图可知,氮元素价态升高失电子,故A极为负极,电极反应式为,若A极区产生14 g,物质的量为0.5mol,转移得电子数目为0.5×4NA=2NA;
③有人提出可用甲烷去替代肼,甲烷在负极失去电子生成碳酸钠,根据得失电子守恒和电荷守恒配平电极方程式为:。
33.(1) 5.6 减小 3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3 SO2
(2)SiO2+2OH-=SiO+H2O
(3)A
(4)
(5)Na-e-=Na+
【详解】(1)①pH<5.6的雨水被称为酸雨;SO2型酸雨久置,亚硫酸会被空气中的氧气氧化成硫酸,酸性增强,溶液的pH会减小;NO2能形成酸雨的原因是3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;②SO2是暂时性漂白、H2O2和浓硝酸是利用强氧化性漂白,漂白原理与其他物质不同的是SO2;
(2)SiO2可用于制作光导纤维,但遇强碱溶液会发生SiO2+2OH-=SiO+H2O而出现“断路”现象;
(3)A、将少量Cu(NO3)2固体放入试管中,然后用带火星的木条放入试管中,发现木条复燃,说明木条燃烧所需氧气来自NO2,说明NO2能支持燃烧,故A正确;B、C、D错误,故选A;
(4)铅酸蓄电池工作时正极的电极方程式为;
(5)钠硫电池工作时,负极的电极方程式Na-e-=Na+。
答案第1页,共2页
答案第1页,共2页
同课章节目录
