6.1奇光异彩的金属同步练习 (含解析) 沪教版(上海)化学九年级下册
文档属性
| 名称 | 6.1奇光异彩的金属同步练习 (含解析) 沪教版(上海)化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 645.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-12 18:42:25 | ||
图片预览




文档简介
6.1奇光异彩的金属
共18题,共60分
题号 一 二 三 总分
得分
一、选择题(共20分)
1.(本题2分)我国西汉时期,在《淮南万毕术》中记载“曾青得铁则化为铜”,该变化的化学方程式为下列有关说法错误的是
A.该反应证明了铁的金属活动性比铜强
B.铁元素的化合价从0价升高到+2价
C.铜元素的化合价从+2价降低到0价
D.该反应属于复分解反应
2.(本题2分)下列有关环境保护的说法不正确的是
A.生活污水对环境污染小,可直接排放 B.废旧电池属于有害垃圾,必须分类回收处理
C.禁止露天焚烧秸秆,可减少雾霾产生 D.合理的施用农药和化肥,可有效减少环境污染
3.(本题2分)下列实验内容中,量的关系(“﹣﹣”前的量为横坐标,“﹣﹣”后的量为纵坐标)符合如图所示变化趋势的是( )
A.向一定质量氢氧化钠溶液中滴加盐酸时,盐酸﹣﹣水
B.加热一定质量高锰酸钾时,时间﹣﹣剩余固体中氧元素
C.向一定质量硫酸铜溶液中加入铁粉,铁粉﹣﹣反应后溶液的质量
D.一定质量过氧化氢溶液与二氧化锰制取氧气,时间﹣﹣溶液中溶质质量
4.(本题2分)下列生活中的做法合理的是
A.炒菜时油锅中的油着火,用水浇灭
B.大量食用加碘食盐预防甲状腺肿大
C.家中燃气泄漏应立即打开排风扇通风
D.食品包装袋内放一包铁粉,用来吸收袋内空气中的水和氧气
5.(本题2分)将一根洁净的铁钉放入稀硫酸中,下列叙述正确的是
①在铁钉表面产生气泡;②液体由无色变为蓝色;③铁钉逐渐变小;④产生的气体有刺激性气味
A.①③ B.②③④ C.①④ D.①②③
6.(本题2分)某同学将mgMg、A1、Zn、Fe 的混合物放入足量的稀盐酸中,充分反应后,将所得溶液小心蒸干,得到(m+7.1) g不含结晶水的固体,则m的取值范围是
A.2.4≤m≤6.5
B.2.4C.1.8≤m≤6.5
D.1.87.(本题2分)某化学反应的微观示意图如图所示。下列有关该化学反应的说法错误的是
A.化学反应前后元素的种类不变 B.原子重新组合成生成物分子
C.该反应是置换反应 D.生成的丙、丁分了个数比为1:1
8.(本题2分)在一定条件下,下列物质都能一步转化的是
A.Cu→CuO→Cu(OH)2 B.Mg→MgO→MgSO4
C.Fe→Fe2O3→FeSO4 D.S→SO2→Na2SO4
9.(本题2分)下列说法错误的是
选项 甲 乙
A 可燃气体 氢气、一氧化碳、天然气
B 常见合金 生铁、不锈钢、青铜
C 氧化物 水、过氧化氢、氢氧化钾
D 人体中常见微量元素 碘、锌、硒、铁等
A.A B.B C.C D.D
10.(本题2分)下列化学方程式书写正确的是
A.Cu + 2HCl =CuCl2 + H2↑ B.4Fe + 3O22Fe2O3
C.C + O2CO2 D.Al+FeSO4=Fe+AlSO4
二、判断题(共10分)
11.(本题2分)多数金属矿石中的金属元素主要以单质形式存在( )
12.(本题2分)置换反应中一定有元素化合价发生变化,则有元素化合价发生变化的反应一定是置换反应( )
13.(本题2分)锌与硫酸反应较为剧烈,产生大量气泡,溶液仍为无色。( )
14.(本题2分)铝合金属于合成材料( )
15.(本题2分)建高架桥用的钢筋属于金属材料( )
三、综合应用题(共30分)
16.(本题10分)地球上的金属广泛存在于地壳和海洋中,除少数很不活泼的金属如金、银等以单质形式存在外,其余都以化合物形式存在。某化学兴趣小组就金属资源的利用和组成开展研究性学习
研究一:金属的冶炼
(1)铝在地壳中主要以铝土矿形式存在,铝土矿的主要成分为A12O3(含有少量Fe2O3、SiO2等杂质)。铝土矿中的SiO2不溶于水,也不与盐酸反应。
①加入足量稀盐酸后,发生反应的化学方程式是 (任写一个)。
②Al2O3:通电后生成A1和一种气态单质,该反应的基本反应类型是 。
(2)较早工业上炼铁大多采用赤铁矿(Fe2O3)、磁铁矿(Fe3O4),而不采用黄铁矿(FeS2)、黄铜矿(CuFeS2),可能的原因是:
①英铁矿、黄铜矿含铁量相对低;
② 。
(3)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:
4CuFeS2+17O2+2H2SO44CuSO4+2Fe2(SO4)3+2H2O。
向上述反应后的溶液中加Fe粉,得到FeSO4溶液和Cu。
①发生的主要反应的化学方程式: ;Fe+2Fe2(SO4)3=3FeSO4。
②溶液经蒸发浓缩、降温结晶、过滤等操作得到FeSO4﹒7H2O晶体。
研究二:铁的氧化物组成的测定
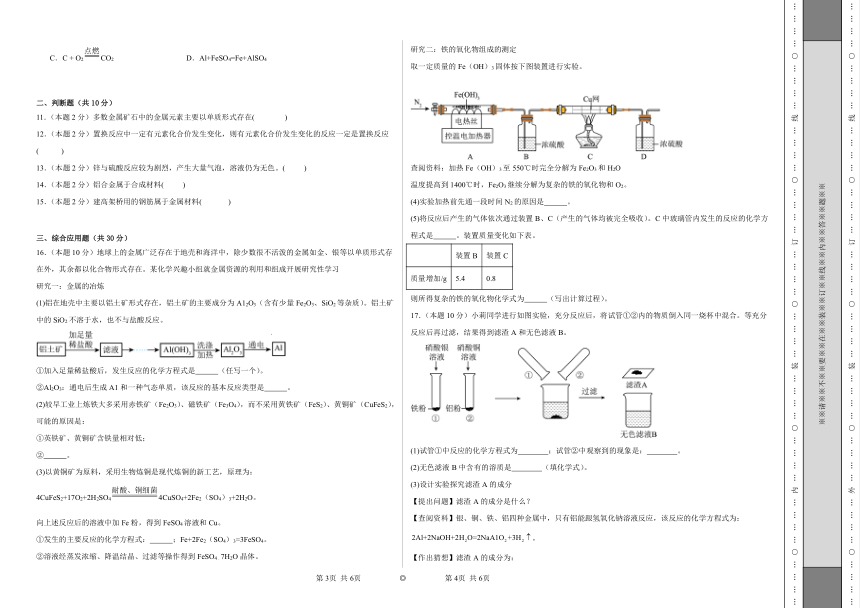
取一定质量的Fe(OH)3固体按下图装置进行实验。
查阅资料:加热Fe(OH)3至550℃时完全分解为Fe2O3和H2O
温度提高到1400℃时,Fe2O3继续分解为复杂的铁的氧化物和O2。
(4)实验加热前先通一段时间N2的原因是 。
(5)将反应后产生的气体依次通过装置B、C(产生的气体均被完全吸收)。C中玻璃管内发生的反应的化学方程式是 。装置质量变化如下表。
装置B 装置C
质量增加/g 5.4 0.8
则所得复杂的铁的氧化物化学式为 (写出计算过程)。
17.(本题10分)小莉同学进行如图实验,充分反应后,将试管①②内的物质倒入同一烧杯中混合。等充分反应后再过滤,结果得到滤渣A和无色滤液B。
(1)试管①中反应的化学方程式为 ;试管②中观察到的现象是: 。
(2)无色滤液B中含有的溶质是 (填化学式)。
(3)设计实验探究滤渣A的成分
【提出问题】滤渣A的成分是什么?
【查阅资料】银、铜、铁、铝四种金属中,只有铝能跟氢氧化钠溶液反应,该反应的化学方程式为:。
【作出猜想】滤渣A的成分为:
猜想Ⅰ:银、铜;猜想Ⅱ:银、铜、铁;猜想Ⅲ: 。
【分析思考】猜想Ⅰ一定不正确,原因是 。
【进行实验】结合猜想Ⅱ和Ⅲ,只要证明物质 是否存在即可。
实验步骤 实验现象
取滤渣样品放入小烧杯中,加入足量 溶液
【作出判断】如果 ,则猜想Ⅱ成立。如果 ,则猜想Ⅲ成立。
18.(本题10分)化学材料的应用和发展,极大的方便了我们的生活,提高我们的生活品质。
(1)材料在交通工具上有着广泛的应用。
应用 自行车 大飞机C919 共享汽车
用到的材料 轮胎:橡胶 机翼:铝锂合金 车身:钢
①上述交通工具用到的材料属于金属材料的是 (填一种即可),属于有机合成材料的是 。
②汽车车身表面的烤漆不仅美观,还能起到防锈的作用,工业上常用稀盐酸来除铁锈,该反应的化学方程式是 。
(2)铬是一种重要的金属材料,它具有良好的金属光泽和抗腐蚀性。某同学把一片表面用砂纸打磨过的金属铬放入稀酸中,发现铬片表面缓慢产生气泡,由此可得出铬与硫酸铜溶液 (选填能“或“不能”)反应。
(3)2019年1月3日嫦娥四号探测器成功着陆在月球背面,并通过“鹊桥”中继星传回了近距离拍摄的月背影像图,揭开了月背的神秘面纱。“鹊桥”号上伞状通信天线是用表面镀金的钼丝编织而成的金属网。这种镀金钼丝纤维只有头发丝四分之一细,其性能稳定。“编”出来的金属网既强韧,受得住发射飞行外力“折腾”,又能在太空中收放自如,可以说是“刚柔并济”。
①钼能制成细丝,是利用了钼 性,钼丝表面镀金,原因之一是利用了金的化学性质 。
②我国的钼矿储量非常丰富,用辉钼矿(AMS)制备的过程如图:
过程Ⅱ分两个阶段:
已知第一阶段反应中反应物与生成物的化学计量数之比为1:1:1:1,请写出第一阶段的化学方程式 ,两个阶段中属于置换反应的阶段是 。
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
学校:___________姓名:___________班级:___________考号:___________
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A、铁能与硫酸铜反应生成硫酸亚铁和铜,说明铁比铜活泼,不符合题意;
B、单质铁中铁元素的化合价为0,硫酸亚铁中铁元素的化合价为+2价,故铁元素的化合价从0价升高到+2价,不符合题意;
C、硫酸铜中铜元素显+2价,单质铜中铜元素的化合价为0,故铜元素的化合价从+2价降低到0价,不符合题意;
D、该反应符合“一种单质和一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,符合题意。
故选D。
2.A
【详解】A、生活污水会污染水源,应处理达标后排放,符合题意;
B、废旧电池中的重金属会污染水源和土壤,属于有害垃圾,应分类回收处理,保护环境,不符合题意;
C、禁止露天焚烧秸秆,可减少可吸入颗粒物的含量,减少雾霾产生,保护环境,不符合题意;
D、合理地施用化肥和农药,可以减少污染,保护环境,不符合题意。
故选A。
3.D
【详解】A、向氢氧化钠溶液中滴加盐酸时,随着稀盐酸的加入,除了反应生成水,而且溶液中含有水,所以水的量应一直增大,错误;
B、加热高锰酸钾时,产生氧气,氧元素的质量是减少了,但固体的总质量也减少,但不可能减少到0,错误;
C、向硫酸铜溶液中加入铁粉,发生反应:,根据每56份的Fe,置换出64份的Cu,故溶液质量是减少的,但不可能变为0,错误;
D、过氧化氢溶液在催化剂二氧化锰作用下,生成氧气和水,随着反应的进行,过氧化氢逐渐减少直至消失,正确。
故选D。
4.D
【详解】A、油的密度比水小,加少量水后,油会漂浮于水面上,与氧气的接触面积更大,更容易燃烧,应用锅盖盖灭,选项错误;
B、人体内碘元素过量也会造成甲状腺肿大,因此应合理适量摄入,选项错误;
C、家中燃气泄漏应立即打开排风扇通风,遇电火花可能发生爆炸,选项错误;
D、铁粉与空气中的氧气和水蒸气反应生成铁锈,可以吸收食品包装中的氧气和水蒸气,使食物保持新鲜,选项正确。
故选D。
5.A
【分析】铁与硫酸发生置换反应放出氢气,同时得到硫酸亚铁的溶液,铁钉随反应的进行逐渐溶解至完全反应后消失。
【详解】①置换产生氢气,可观察到铁钉表面上产生气泡,故正确;
②反应后得到的硫酸亚铁溶液为浅绿色,可观察到溶液变为浅绿色,原叙述不正确;
③反应不断消耗铁钉,会观察到铁钉逐渐变小,故正确;
④反应只产生氢气且氢气无色无味,因此不会有刺激性气味的气体,原叙述不正确。
故选A。
6.D
【详解】将mgMg、A1、Zn、Fe 的混合物放入足量的稀盐酸中,充分反应后,将所得溶液小心蒸干,得到(m+7.1) g不含结晶水的固体,该不含结晶水的固体是由金属离子(Mg2+、A13+、Zn2+、Fe2+)和Cl-组成的。根据质量守恒定律可知:不含结晶水的固体中含有Cl-的质量为(m+7.1) g-mg=7.1g。则该反应消耗稀盐酸的质量为:7.1g÷=7.3g。
假设分别为四种金属单质与等量的稀盐酸反应,则
由计算可知,若为四种金属单质与等量的稀盐酸反应时,m最大值为6.5g,最小值为1.8g,而该物质为混合物,故m的最大值应小于6.5g,最小值应大于1.8g,故选D。
7.C
【详解】A、根据微观示意图,反应前有S、O、H元素,反应后有S、O、H元素,所以化学反应前后元素的种类不变,故A正确;
B、化学反应的本质过程是分子分解成原子,原子重新组合成新的分子,故B正确;
C、该反应是H2S和O2反应生成SO2和H2O,生成物是两种化合物,不是置换反应,故C错误;
D、化学方程式为:,生成的丙、丁分了个数比为2:2=1:1,故D正确。
故选C。
8.B
【详解】A、铜能与氧气在加热的条件下反应生成氧化铜,氧化铜不能一步转化为氢氧化铜,故A不符合题意;
B、镁燃烧生成氧化镁,氧化镁与稀硫酸反应生成硫酸镁和水,故B符合题意;
C、铁能与空气中的氧气和水反应生成氧化铁,氧化铁不能一步转化为硫酸亚铁,故C不符合题意;
D、硫燃烧能生成二氧化硫,二氧化硫不能一步转化为硫酸钠,故D不符合题意。
故选B。
9.C
【详解】A、氢气、一氧化碳、天然气都是可燃气体,正确;
B、生铁、不锈钢是铁和碳的合金,青铜是铜和锡或铅的合金,正确;
C、氢氧化钾是由氢、氧、钾三种元素组成的,不属于氧化物,错误;
D、碘、锌、硒、铁是人体中常见微量元素,正确;
故选C。
10.C
【详解】A、在金属活动性顺序表中,铜排在氢之后,不能和盐酸反应生成氢气,A错误;
B、铁在纯氧中点燃,发生燃烧生成Fe3O4,化学方程式为3Fe+2O2Fe3O4,B错误;
C、C和O2在点燃的条件下生成CO2,C正确;
D、在金属活动性顺序中,Al排在Fe之前,可以置换出FeSO4中的Fe,化学方程式为2Al+3FeSO4=3Fe+Al2(SO4)3,D错误。
故选C。
11.错误
【详解】多数金属矿石中的金属元素主要以化合物形式存在,说法错误。
故填:错误
12.错误
【详解】有元素化合价发生变化的反应不一定是置换反应,例如氢气燃烧生成水,反应前氢元素、氧元素化合价都是0,反应后氢元素化合价是+1,氧元素化合价是-2,故说法错误。
13.正确
【详解】锌与硫酸反应生成硫酸锌和氢气,该反应较为剧烈,产生大量气泡,溶液仍为无色,故正确。
14.错误
【详解】纯金属和合金属于金属材料,故填:错误。
15.正确
【详解】金属材料包括合金和纯金属,钢筋属于合金,建高架桥用的钢筋属于金属材料,说法正确。
16.(1) Fe2O3+6HCl=2FeCl3+3H2O / Al2O3+6HCl=2AlCl3+3H2O 分解反应
(2)冶炼过程中会产生SO2,污染环境
(3)Fe+CuSO4=FeSO4+Cu
(4)排尽装置中的空气
(5) 解:设生成的Fe2O3的质量为x,则
x=16g
则氧化铁中铁元素的质量为,根据元素守恒,则复杂的铁的氧化物中,铁元素的化合价为11.2g,装置C增加的质量即为氧气的质量,即氧气的质量为0.8g,则复杂的铁的氧化物中,Fe与O的原子个数比为:
则所得复杂的铁的氧化物化学式为Fe4O5
【详解】(1)①氧化铝能与盐酸反应生成氯化铝和水,反应的化学方程式为,氧化铁能与盐酸反应生成氯化铁和水,反应的化学方程式为。
②电解氧化铝生成铝和一种气体单质,根据元素守恒,可知单质为氧气,该反应为一种物质生成多种物质的反应,属于分解反应。
(2)黄铁矿(FeS2)、黄铜矿(CuFeS2)中,均含有硫元素,根据元素守恒,则反应过程中均会生成二氧化硫,二氧化硫会污染空气。
(3)铁能与硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为。
(4)若想测定铁的氧化物,则需要测量生成的水的质量,则实验开始时先通一段时间N2,目的是除去装置中的空气,防止影响实验结果。
(5)由于温度提高到1400℃时,Fe2O3继续分解为复杂的铁的氧化物和O2,而铜能与氧气反应生成氧化铜,则C中玻璃管内发生的反应的化学方程式是。
计算过程见答案。
17.(1) 有红色固体析出,溶液由蓝色变成无色
(2)Al(NO3)3
(3) 银、铜、铁、铝 滤液是无色的,说明硝酸亚铁中的铁被铝置换出来,滤渣中一定含有铁 铝 氢氧化钠 无气泡产生,固体不溶解 有气泡产生,固体部分溶解
【详解】(1)试管①中铁和硝酸银反应生成硝酸亚铁和银,反应的化学方程式为:;
试管②中铝和硝酸铜反应生成硝酸铝和铜,观察到的现象是:有红色固体析出,溶液由蓝色变成无色;
(2)无色滤液B中一定不含硝酸亚铁(浅绿色)、硝酸铜(蓝色),含有的溶质是反应生成的硝酸铝,其化学式为:Al(NO3)3;
(3)提出猜想:滤渣A的成分为:
猜想一:银、铜;
猜想二:银、铜、铁;
猜想三:银、铜、铁、铝;
分析思考:猜想一不合理,理由是:滤液是无色的,说明硝酸亚铁中的铁被铝置换出来,因此滤渣中一定含有铁,故填:否;滤渣中一定含有铁;
进行实验:结合猜想Ⅱ和Ⅲ,只要证明物质铝是否存在即可。
取滤渣样品放入小烧杯中,加入足量氢氧化钠溶液,铝和氢氧化钠和水反应生成偏铝酸钠和氢气;
作出判断:如果无气泡产生,固体不溶解,则猜想Ⅱ成立;如果有气泡产生,固体部分溶解,则猜想Ⅲ成立。
18.(1) 钢(或铝锂合金) 橡胶
(2)能
(3) 延展 不活泼
第二阶段
【详解】(1)①金属材料包含纯金属和合金,上述交通工具用到的材料属于金属材料的是钢(或铝锂合金);有机合成材料包括:塑料、合成橡胶,合成纤维,所以属于有机合成材料的是橡胶,故填:钢(或铝锂合金);橡胶。
②铁锈的主要成分是氧化铁,氧化铁与稀盐酸反应生成氯化铁和水,该反应的化学方程式是: ,故填: 。
(2)铬是一种重要的金属材料,某同学把一片表面用砂纸打磨过的金属铬放入稀酸中,发现铬片表面缓慢产生气泡,说明铬是氢前金属,而铜是氢后金属,所以铬的活动性强于铜,由此可得出铬将铜从硫酸铜溶液中置换出来,故填:能。
(3)①钼能制成细丝,是利用了钼延展性,钼丝表面镀金,原因之一是利用了金的化学性质不活泼,故填:延展;不活泼。
②将MoO3在 H2的作用下转化为 Mo,第一阶段中氧化物1为MoO3,单质1为H2,根据反应生成物为氧化物2、3,且化学计量数之比为1:1:1:1,结合氢气的还原性,可以判断出氧化物 2 为 MoO2,氧化物 3 为 H2O;故方程式为:;第二阶段氧化物2为MoO2,单质1为H2,生成的氧化物 3 为H2O,根据最终产物为 Mo,即单质2 为 Mo,该反应的化学方程式为:,一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,故填: ;第二阶段。
答案第1页,共2页
答案第1页,共2页
共18题,共60分
题号 一 二 三 总分
得分
一、选择题(共20分)
1.(本题2分)我国西汉时期,在《淮南万毕术》中记载“曾青得铁则化为铜”,该变化的化学方程式为下列有关说法错误的是
A.该反应证明了铁的金属活动性比铜强
B.铁元素的化合价从0价升高到+2价
C.铜元素的化合价从+2价降低到0价
D.该反应属于复分解反应
2.(本题2分)下列有关环境保护的说法不正确的是
A.生活污水对环境污染小,可直接排放 B.废旧电池属于有害垃圾,必须分类回收处理
C.禁止露天焚烧秸秆,可减少雾霾产生 D.合理的施用农药和化肥,可有效减少环境污染
3.(本题2分)下列实验内容中,量的关系(“﹣﹣”前的量为横坐标,“﹣﹣”后的量为纵坐标)符合如图所示变化趋势的是( )
A.向一定质量氢氧化钠溶液中滴加盐酸时,盐酸﹣﹣水
B.加热一定质量高锰酸钾时,时间﹣﹣剩余固体中氧元素
C.向一定质量硫酸铜溶液中加入铁粉,铁粉﹣﹣反应后溶液的质量
D.一定质量过氧化氢溶液与二氧化锰制取氧气,时间﹣﹣溶液中溶质质量
4.(本题2分)下列生活中的做法合理的是
A.炒菜时油锅中的油着火,用水浇灭
B.大量食用加碘食盐预防甲状腺肿大
C.家中燃气泄漏应立即打开排风扇通风
D.食品包装袋内放一包铁粉,用来吸收袋内空气中的水和氧气
5.(本题2分)将一根洁净的铁钉放入稀硫酸中,下列叙述正确的是
①在铁钉表面产生气泡;②液体由无色变为蓝色;③铁钉逐渐变小;④产生的气体有刺激性气味
A.①③ B.②③④ C.①④ D.①②③
6.(本题2分)某同学将mgMg、A1、Zn、Fe 的混合物放入足量的稀盐酸中,充分反应后,将所得溶液小心蒸干,得到(m+7.1) g不含结晶水的固体,则m的取值范围是
A.2.4≤m≤6.5
B.2.4
D.1.8
A.化学反应前后元素的种类不变 B.原子重新组合成生成物分子
C.该反应是置换反应 D.生成的丙、丁分了个数比为1:1
8.(本题2分)在一定条件下,下列物质都能一步转化的是
A.Cu→CuO→Cu(OH)2 B.Mg→MgO→MgSO4
C.Fe→Fe2O3→FeSO4 D.S→SO2→Na2SO4
9.(本题2分)下列说法错误的是
选项 甲 乙
A 可燃气体 氢气、一氧化碳、天然气
B 常见合金 生铁、不锈钢、青铜
C 氧化物 水、过氧化氢、氢氧化钾
D 人体中常见微量元素 碘、锌、硒、铁等
A.A B.B C.C D.D
10.(本题2分)下列化学方程式书写正确的是
A.Cu + 2HCl =CuCl2 + H2↑ B.4Fe + 3O22Fe2O3
C.C + O2CO2 D.Al+FeSO4=Fe+AlSO4
二、判断题(共10分)
11.(本题2分)多数金属矿石中的金属元素主要以单质形式存在( )
12.(本题2分)置换反应中一定有元素化合价发生变化,则有元素化合价发生变化的反应一定是置换反应( )
13.(本题2分)锌与硫酸反应较为剧烈,产生大量气泡,溶液仍为无色。( )
14.(本题2分)铝合金属于合成材料( )
15.(本题2分)建高架桥用的钢筋属于金属材料( )
三、综合应用题(共30分)
16.(本题10分)地球上的金属广泛存在于地壳和海洋中,除少数很不活泼的金属如金、银等以单质形式存在外,其余都以化合物形式存在。某化学兴趣小组就金属资源的利用和组成开展研究性学习
研究一:金属的冶炼
(1)铝在地壳中主要以铝土矿形式存在,铝土矿的主要成分为A12O3(含有少量Fe2O3、SiO2等杂质)。铝土矿中的SiO2不溶于水,也不与盐酸反应。
①加入足量稀盐酸后,发生反应的化学方程式是 (任写一个)。
②Al2O3:通电后生成A1和一种气态单质,该反应的基本反应类型是 。
(2)较早工业上炼铁大多采用赤铁矿(Fe2O3)、磁铁矿(Fe3O4),而不采用黄铁矿(FeS2)、黄铜矿(CuFeS2),可能的原因是:
①英铁矿、黄铜矿含铁量相对低;
② 。
(3)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:
4CuFeS2+17O2+2H2SO44CuSO4+2Fe2(SO4)3+2H2O。
向上述反应后的溶液中加Fe粉,得到FeSO4溶液和Cu。
①发生的主要反应的化学方程式: ;Fe+2Fe2(SO4)3=3FeSO4。
②溶液经蒸发浓缩、降温结晶、过滤等操作得到FeSO4﹒7H2O晶体。
研究二:铁的氧化物组成的测定
取一定质量的Fe(OH)3固体按下图装置进行实验。
查阅资料:加热Fe(OH)3至550℃时完全分解为Fe2O3和H2O
温度提高到1400℃时,Fe2O3继续分解为复杂的铁的氧化物和O2。
(4)实验加热前先通一段时间N2的原因是 。
(5)将反应后产生的气体依次通过装置B、C(产生的气体均被完全吸收)。C中玻璃管内发生的反应的化学方程式是 。装置质量变化如下表。
装置B 装置C
质量增加/g 5.4 0.8
则所得复杂的铁的氧化物化学式为 (写出计算过程)。
17.(本题10分)小莉同学进行如图实验,充分反应后,将试管①②内的物质倒入同一烧杯中混合。等充分反应后再过滤,结果得到滤渣A和无色滤液B。
(1)试管①中反应的化学方程式为 ;试管②中观察到的现象是: 。
(2)无色滤液B中含有的溶质是 (填化学式)。
(3)设计实验探究滤渣A的成分
【提出问题】滤渣A的成分是什么?
【查阅资料】银、铜、铁、铝四种金属中,只有铝能跟氢氧化钠溶液反应,该反应的化学方程式为:。
【作出猜想】滤渣A的成分为:
猜想Ⅰ:银、铜;猜想Ⅱ:银、铜、铁;猜想Ⅲ: 。
【分析思考】猜想Ⅰ一定不正确,原因是 。
【进行实验】结合猜想Ⅱ和Ⅲ,只要证明物质 是否存在即可。
实验步骤 实验现象
取滤渣样品放入小烧杯中,加入足量 溶液
【作出判断】如果 ,则猜想Ⅱ成立。如果 ,则猜想Ⅲ成立。
18.(本题10分)化学材料的应用和发展,极大的方便了我们的生活,提高我们的生活品质。
(1)材料在交通工具上有着广泛的应用。
应用 自行车 大飞机C919 共享汽车
用到的材料 轮胎:橡胶 机翼:铝锂合金 车身:钢
①上述交通工具用到的材料属于金属材料的是 (填一种即可),属于有机合成材料的是 。
②汽车车身表面的烤漆不仅美观,还能起到防锈的作用,工业上常用稀盐酸来除铁锈,该反应的化学方程式是 。
(2)铬是一种重要的金属材料,它具有良好的金属光泽和抗腐蚀性。某同学把一片表面用砂纸打磨过的金属铬放入稀酸中,发现铬片表面缓慢产生气泡,由此可得出铬与硫酸铜溶液 (选填能“或“不能”)反应。
(3)2019年1月3日嫦娥四号探测器成功着陆在月球背面,并通过“鹊桥”中继星传回了近距离拍摄的月背影像图,揭开了月背的神秘面纱。“鹊桥”号上伞状通信天线是用表面镀金的钼丝编织而成的金属网。这种镀金钼丝纤维只有头发丝四分之一细,其性能稳定。“编”出来的金属网既强韧,受得住发射飞行外力“折腾”,又能在太空中收放自如,可以说是“刚柔并济”。
①钼能制成细丝,是利用了钼 性,钼丝表面镀金,原因之一是利用了金的化学性质 。
②我国的钼矿储量非常丰富,用辉钼矿(AMS)制备的过程如图:
过程Ⅱ分两个阶段:
已知第一阶段反应中反应物与生成物的化学计量数之比为1:1:1:1,请写出第一阶段的化学方程式 ,两个阶段中属于置换反应的阶段是 。
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
学校:___________姓名:___________班级:___________考号:___________
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A、铁能与硫酸铜反应生成硫酸亚铁和铜,说明铁比铜活泼,不符合题意;
B、单质铁中铁元素的化合价为0,硫酸亚铁中铁元素的化合价为+2价,故铁元素的化合价从0价升高到+2价,不符合题意;
C、硫酸铜中铜元素显+2价,单质铜中铜元素的化合价为0,故铜元素的化合价从+2价降低到0价,不符合题意;
D、该反应符合“一种单质和一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,符合题意。
故选D。
2.A
【详解】A、生活污水会污染水源,应处理达标后排放,符合题意;
B、废旧电池中的重金属会污染水源和土壤,属于有害垃圾,应分类回收处理,保护环境,不符合题意;
C、禁止露天焚烧秸秆,可减少可吸入颗粒物的含量,减少雾霾产生,保护环境,不符合题意;
D、合理地施用化肥和农药,可以减少污染,保护环境,不符合题意。
故选A。
3.D
【详解】A、向氢氧化钠溶液中滴加盐酸时,随着稀盐酸的加入,除了反应生成水,而且溶液中含有水,所以水的量应一直增大,错误;
B、加热高锰酸钾时,产生氧气,氧元素的质量是减少了,但固体的总质量也减少,但不可能减少到0,错误;
C、向硫酸铜溶液中加入铁粉,发生反应:,根据每56份的Fe,置换出64份的Cu,故溶液质量是减少的,但不可能变为0,错误;
D、过氧化氢溶液在催化剂二氧化锰作用下,生成氧气和水,随着反应的进行,过氧化氢逐渐减少直至消失,正确。
故选D。
4.D
【详解】A、油的密度比水小,加少量水后,油会漂浮于水面上,与氧气的接触面积更大,更容易燃烧,应用锅盖盖灭,选项错误;
B、人体内碘元素过量也会造成甲状腺肿大,因此应合理适量摄入,选项错误;
C、家中燃气泄漏应立即打开排风扇通风,遇电火花可能发生爆炸,选项错误;
D、铁粉与空气中的氧气和水蒸气反应生成铁锈,可以吸收食品包装中的氧气和水蒸气,使食物保持新鲜,选项正确。
故选D。
5.A
【分析】铁与硫酸发生置换反应放出氢气,同时得到硫酸亚铁的溶液,铁钉随反应的进行逐渐溶解至完全反应后消失。
【详解】①置换产生氢气,可观察到铁钉表面上产生气泡,故正确;
②反应后得到的硫酸亚铁溶液为浅绿色,可观察到溶液变为浅绿色,原叙述不正确;
③反应不断消耗铁钉,会观察到铁钉逐渐变小,故正确;
④反应只产生氢气且氢气无色无味,因此不会有刺激性气味的气体,原叙述不正确。
故选A。
6.D
【详解】将mgMg、A1、Zn、Fe 的混合物放入足量的稀盐酸中,充分反应后,将所得溶液小心蒸干,得到(m+7.1) g不含结晶水的固体,该不含结晶水的固体是由金属离子(Mg2+、A13+、Zn2+、Fe2+)和Cl-组成的。根据质量守恒定律可知:不含结晶水的固体中含有Cl-的质量为(m+7.1) g-mg=7.1g。则该反应消耗稀盐酸的质量为:7.1g÷=7.3g。
假设分别为四种金属单质与等量的稀盐酸反应,则
由计算可知,若为四种金属单质与等量的稀盐酸反应时,m最大值为6.5g,最小值为1.8g,而该物质为混合物,故m的最大值应小于6.5g,最小值应大于1.8g,故选D。
7.C
【详解】A、根据微观示意图,反应前有S、O、H元素,反应后有S、O、H元素,所以化学反应前后元素的种类不变,故A正确;
B、化学反应的本质过程是分子分解成原子,原子重新组合成新的分子,故B正确;
C、该反应是H2S和O2反应生成SO2和H2O,生成物是两种化合物,不是置换反应,故C错误;
D、化学方程式为:,生成的丙、丁分了个数比为2:2=1:1,故D正确。
故选C。
8.B
【详解】A、铜能与氧气在加热的条件下反应生成氧化铜,氧化铜不能一步转化为氢氧化铜,故A不符合题意;
B、镁燃烧生成氧化镁,氧化镁与稀硫酸反应生成硫酸镁和水,故B符合题意;
C、铁能与空气中的氧气和水反应生成氧化铁,氧化铁不能一步转化为硫酸亚铁,故C不符合题意;
D、硫燃烧能生成二氧化硫,二氧化硫不能一步转化为硫酸钠,故D不符合题意。
故选B。
9.C
【详解】A、氢气、一氧化碳、天然气都是可燃气体,正确;
B、生铁、不锈钢是铁和碳的合金,青铜是铜和锡或铅的合金,正确;
C、氢氧化钾是由氢、氧、钾三种元素组成的,不属于氧化物,错误;
D、碘、锌、硒、铁是人体中常见微量元素,正确;
故选C。
10.C
【详解】A、在金属活动性顺序表中,铜排在氢之后,不能和盐酸反应生成氢气,A错误;
B、铁在纯氧中点燃,发生燃烧生成Fe3O4,化学方程式为3Fe+2O2Fe3O4,B错误;
C、C和O2在点燃的条件下生成CO2,C正确;
D、在金属活动性顺序中,Al排在Fe之前,可以置换出FeSO4中的Fe,化学方程式为2Al+3FeSO4=3Fe+Al2(SO4)3,D错误。
故选C。
11.错误
【详解】多数金属矿石中的金属元素主要以化合物形式存在,说法错误。
故填:错误
12.错误
【详解】有元素化合价发生变化的反应不一定是置换反应,例如氢气燃烧生成水,反应前氢元素、氧元素化合价都是0,反应后氢元素化合价是+1,氧元素化合价是-2,故说法错误。
13.正确
【详解】锌与硫酸反应生成硫酸锌和氢气,该反应较为剧烈,产生大量气泡,溶液仍为无色,故正确。
14.错误
【详解】纯金属和合金属于金属材料,故填:错误。
15.正确
【详解】金属材料包括合金和纯金属,钢筋属于合金,建高架桥用的钢筋属于金属材料,说法正确。
16.(1) Fe2O3+6HCl=2FeCl3+3H2O / Al2O3+6HCl=2AlCl3+3H2O 分解反应
(2)冶炼过程中会产生SO2,污染环境
(3)Fe+CuSO4=FeSO4+Cu
(4)排尽装置中的空气
(5) 解:设生成的Fe2O3的质量为x,则
x=16g
则氧化铁中铁元素的质量为,根据元素守恒,则复杂的铁的氧化物中,铁元素的化合价为11.2g,装置C增加的质量即为氧气的质量,即氧气的质量为0.8g,则复杂的铁的氧化物中,Fe与O的原子个数比为:
则所得复杂的铁的氧化物化学式为Fe4O5
【详解】(1)①氧化铝能与盐酸反应生成氯化铝和水,反应的化学方程式为,氧化铁能与盐酸反应生成氯化铁和水,反应的化学方程式为。
②电解氧化铝生成铝和一种气体单质,根据元素守恒,可知单质为氧气,该反应为一种物质生成多种物质的反应,属于分解反应。
(2)黄铁矿(FeS2)、黄铜矿(CuFeS2)中,均含有硫元素,根据元素守恒,则反应过程中均会生成二氧化硫,二氧化硫会污染空气。
(3)铁能与硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为。
(4)若想测定铁的氧化物,则需要测量生成的水的质量,则实验开始时先通一段时间N2,目的是除去装置中的空气,防止影响实验结果。
(5)由于温度提高到1400℃时,Fe2O3继续分解为复杂的铁的氧化物和O2,而铜能与氧气反应生成氧化铜,则C中玻璃管内发生的反应的化学方程式是。
计算过程见答案。
17.(1) 有红色固体析出,溶液由蓝色变成无色
(2)Al(NO3)3
(3) 银、铜、铁、铝 滤液是无色的,说明硝酸亚铁中的铁被铝置换出来,滤渣中一定含有铁 铝 氢氧化钠 无气泡产生,固体不溶解 有气泡产生,固体部分溶解
【详解】(1)试管①中铁和硝酸银反应生成硝酸亚铁和银,反应的化学方程式为:;
试管②中铝和硝酸铜反应生成硝酸铝和铜,观察到的现象是:有红色固体析出,溶液由蓝色变成无色;
(2)无色滤液B中一定不含硝酸亚铁(浅绿色)、硝酸铜(蓝色),含有的溶质是反应生成的硝酸铝,其化学式为:Al(NO3)3;
(3)提出猜想:滤渣A的成分为:
猜想一:银、铜;
猜想二:银、铜、铁;
猜想三:银、铜、铁、铝;
分析思考:猜想一不合理,理由是:滤液是无色的,说明硝酸亚铁中的铁被铝置换出来,因此滤渣中一定含有铁,故填:否;滤渣中一定含有铁;
进行实验:结合猜想Ⅱ和Ⅲ,只要证明物质铝是否存在即可。
取滤渣样品放入小烧杯中,加入足量氢氧化钠溶液,铝和氢氧化钠和水反应生成偏铝酸钠和氢气;
作出判断:如果无气泡产生,固体不溶解,则猜想Ⅱ成立;如果有气泡产生,固体部分溶解,则猜想Ⅲ成立。
18.(1) 钢(或铝锂合金) 橡胶
(2)能
(3) 延展 不活泼
第二阶段
【详解】(1)①金属材料包含纯金属和合金,上述交通工具用到的材料属于金属材料的是钢(或铝锂合金);有机合成材料包括:塑料、合成橡胶,合成纤维,所以属于有机合成材料的是橡胶,故填:钢(或铝锂合金);橡胶。
②铁锈的主要成分是氧化铁,氧化铁与稀盐酸反应生成氯化铁和水,该反应的化学方程式是: ,故填: 。
(2)铬是一种重要的金属材料,某同学把一片表面用砂纸打磨过的金属铬放入稀酸中,发现铬片表面缓慢产生气泡,说明铬是氢前金属,而铜是氢后金属,所以铬的活动性强于铜,由此可得出铬将铜从硫酸铜溶液中置换出来,故填:能。
(3)①钼能制成细丝,是利用了钼延展性,钼丝表面镀金,原因之一是利用了金的化学性质不活泼,故填:延展;不活泼。
②将MoO3在 H2的作用下转化为 Mo,第一阶段中氧化物1为MoO3,单质1为H2,根据反应生成物为氧化物2、3,且化学计量数之比为1:1:1:1,结合氢气的还原性,可以判断出氧化物 2 为 MoO2,氧化物 3 为 H2O;故方程式为:;第二阶段氧化物2为MoO2,单质1为H2,生成的氧化物 3 为H2O,根据最终产物为 Mo,即单质2 为 Mo,该反应的化学方程式为:,一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应,故填: ;第二阶段。
答案第1页,共2页
答案第1页,共2页
