人教版 高中化学 必修二 5.3.1无机非金属材料(含解析)
文档属性
| 名称 | 人教版 高中化学 必修二 5.3.1无机非金属材料(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-14 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
人教版 高中化学 必修二 5.3.1无机非金属材料
一、单选题
1.硅及其化合物在现代信息技术、航天、医疗等领域有着广泛的应用。下列硅的单质或化合物中,广泛用作半导体材料的是( )
A.SiO2 B.Si C.Na2SiO3 D.SiC
2.化学与生产、生活密切相关,下列有关说法正确的是( )
A.水玻璃可用于生产黏合剂和防火剂
B.根据稳定性可将分散系分为溶液、胶体和浊液
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了其强氧化性
D.高纯度的硅单质可用于制作光导纤维
3.下列我国科研成果所涉材料中,主要成分为同主族元素组成的无机非金属材料的是( )
A.“玉兔二号”钛合金筛选网轮
B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线
D.4.03米大口径碳化硅反射镜
4.对下列事实的解释错误的是( )
A.二氧化硅常作为光导纤维,因为二氧化硅具有导电性
B.金属钠可用于钛、锆、铌等金属的冶炼,因为金属钠具有还原性
C.黑暗的电影院中,放映口发出的光会形成光柱,因为胶体具有丁达尔效应
D.不锈钢具有很强的抗腐蚀能力,因为加入合金元素后内部组织结构发生变化
5.下列材料中不含SiO2的是( )
A.光纤 B.玻璃 C.石英 D.芯片
6.2021年6月11日,国家航天局举行“天问一号”探测器着陆火星首批科学影像图揭幕仪式,公布了由“祝融号”火星车拍摄的“着巡合影”“中国印迹”等影像图。“祝融号”火星车使用的下列材料中,属于金属材料的是( )
A.隔热降噪材料三胺泡沫 B.SiC颗粒
C.新型镁锂合金 D.有机热控涂层
7.化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量SO2的目的是防止营养成分被
氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁,是新型絮凝剂,可用来杀灭水中病菌
8.下列材料中不属于硅酸盐材料的是( )
A.做窗户的普通玻璃 B.浇灌房顶的水泥
C.铺地板的陶瓷瓷砖 D.传输信号的光导纤维
9.中华文化源远流长、博大精深,云南省馆藏文物是中华文化的重要代表。下列文物主要是由硅酸盐材料制成的是( )
文物
战国牛虎铜案 溪山行旅图 西汉滇王编钟 新石器时代鸡形陶壶
选项 A B C D
A.A B.B C.C D.D
10.下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2) Mg(OH)2 MgCl2溶液 无水MgCl2
②铝土矿 AlO2- Al(OH)3 Al2O3
③NH3 NO NO2 HNO3
④NaCl溶液 Cl2 无水FeCl2
⑤S SO3 H2SO4
⑥SiO2 Na2SiO3溶液 H2SiO3
A.③⑥ B.③⑤⑥ C.①④⑤ D.①③⑥
11.熔化氢氧化钠时,应选用的坩埚是 ( )
A.铁坩埚
B.石英坩埚
C.刚玉坩埚
D.陶瓷坩埚
12.下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
⑤传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐
A.①③④ B.①②⑤ C.①⑤ D.①②④⑤
13.硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是( )
A B C D
玛瑙 光导纤维 太阳能电池板 水晶
A.A B.B C.C D.D
14.东莞制造走向世界。下列产品的主要材料属于新型无机非金属材料的是
A.Laeeb毛绒玩具 B.冰墩墩外壳 C.FIFA官方纪念品 D.松山湖清芯半导体SiC器件
A.A B.B C.C D.D
15.下列物质之间的转化都能一步实现的是( )
A.H2S→S→SO3→H2SO4 B.Si→SiO2→H2SiO3→Na2SiO3
C.FeS2→SO2→Na2SO3→Na2SO4 D.N2→NH3→NO2→HNO3→NO2
16.中国国家地理标志产品,福建省特产“建盏”,由黄泥、粘土、红土、釉石等多种原料烧制,主要特点是Fe2O3含量高。下列有关“建盏”说法正确的是( )
A.属于新型无机非金属材料产品
B.因含有较多Fe2O3,外表多呈棕黑色
C.产品耐腐蚀性强,可用于盛放各种酸碱
D.现代工艺使用天然气替代煤炭,有助于减少污染
17.“无色而具图画的灿烂,无声而有音乐的和谐”描述书法之美。书法之美尽在笔墨纸砚之间(如图所示钟繇的“宣示帖”)。下列说法不正确的是( )
A.墨汁是一种水溶液
B.宣纸主要成分是纤维素
C.砚石主要成分属于无机非金属材料
D.制笔的羊毫主要含有、、、元素
18.下列表述正确的是()
A.二氧化硅是将太阳能转化变为电能的常用材料
B.玻璃、水晶、玛瑙的主要成分都是硅酸盐
C.水玻璃可用于生产黏合剂和防火剂
D.二氧化硅既能跟HF反应,又能跟NaOH反应,因此二氧化硅是两性氧化物
二、实验探究题
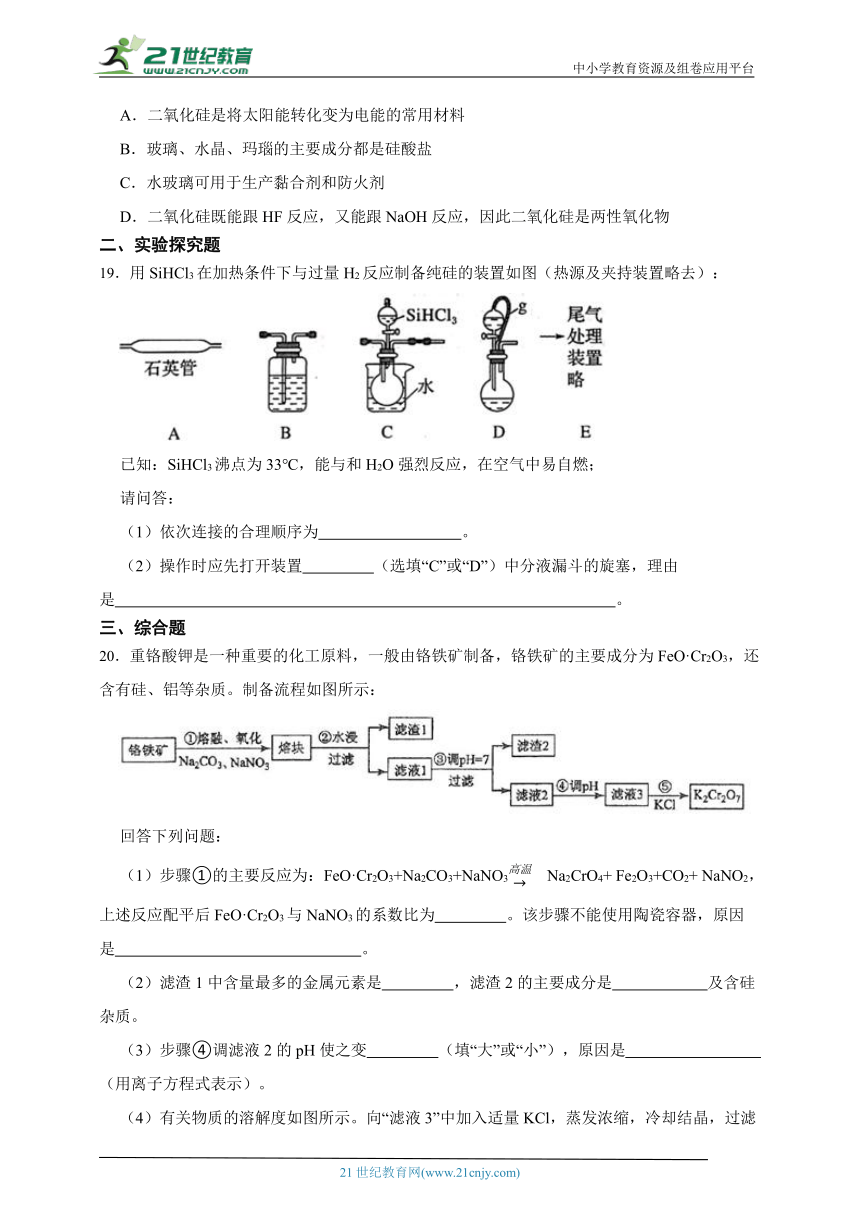
19.用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)依次连接的合理顺序为 。
(2)操作时应先打开装置 (选填“C”或“D”)中分液漏斗的旋塞,理由是 。
三、综合题
20.重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为 。该步骤不能使用陶瓷容器,原因是 。
(2)滤渣1中含量最多的金属元素是 ,滤渣2的主要成分是 及含硅杂质。
(3)步骤④调滤液2的pH使之变 (填“大”或“小”),原因是 (用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到 (填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 。
(5)某工厂用m1
kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为 。
21.实验室加热液体时,常加入沸石、其主要成分为,根据其组成元素完成下列填空:
(1)指出元素在周期表中的位置 。
(2)沸石中的元素可形成多种化合物;元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为 ;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是 (填化学式),化合物乙中存在的化学键类型为 。
(3)O元素和其同周期相邻的两种元素分别形成的简单氢化物中最稳定的是 (填化学式)。
(4)已知硅酸(H2SiO3)为白色胶状沉淀。
实验室中现有药品:①稀盐酸、②稀硫酸、③NaHCO3固体、④CaCO3固体、⑤Na2SiO3溶液,请选择合适药品利用上述装置设计实验验证C、Si的非金属性的变化规律;装置X、Y、Z处所盛装或放置的药品分别为 、 、 (填序号)。但有同学认为该实验所得现象无法充分证明C、Si的非金属性强弱,如何改进? 。
(5)Uue是暂时未合成的化学元素,与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则中A= 、Z= 。
22.硅在地壳中的含量较高,硅及其化合物的开发由来已久。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为 。
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_ 。
(3)有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_ ;
SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_ 。
物质 Si SiCl4 SiHCl3 SiH2Cl2 SiH3Cl HCl SiH4
熔点/℃ 1410 -70.4 -126.5 -122 -118 -114.2 -185
沸点/℃ 2355 57.6 31.8 8.2 -30.4 -84.9 -111.9
(4)还原炉中发生的化学反应为:
。.
(5)上述工艺生产中循环使用的物质除Si、SiHCl3外, 还有_ 。
23.以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
(1)用H2SO4溶解后过滤,得到的滤渣是 (填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是 。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是 。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式: 。
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是 。
24.置换反应的通式可表示为:单质甲+化合物A→单质乙+化合物B,请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程为 。
(2)若过量的单质甲 与化合物A发生反应的化学方程式为:
2Al+Fe2O3 Al2O3+2Fe。除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 。
(3)若甲为金属,其焰火为黄色,化合物B为一种常见的强碱,则该反应的化学方程式为
。
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为 。
(5)若化合物A可作光导纤维材料,乙为非金属半导体材料,则该反应的化学方程式为
。
答案解析部分
1.【答案】B
【解析】【解答】A.SiO2具有良好的光学效应,常用作光导纤维,故A不符合题意;
B.Si具有良好的导电功能,常用作半导体材料,故B符合题意;
C.Na2SiO3属于硅酸盐,其水溶液俗称水玻璃,常用作粘合剂,防火剂,故C不符合题意;
D.SiC又名人造金刚砂,属于耐高温、耐磨材料,故D不符合题意;
故答案为B。
【分析】半导体材料用的是单质硅。
2.【答案】A
【解析】【解答】A. 水玻璃是硅酸钠的水溶液,由于硅酸钠具有粘性、不易燃烧,所以水玻璃是生产硅胶、木材防火剂、粘合剂的原料,故A符合题意;
B. 根据分散质粒子直径的大小将分散系分为溶液、胶体和浊液,故B不符合题意;
C. 用高锰酸钾溶液、双氧水的强氧化性进行杀菌消毒,酒精能使病毒中蛋白质发生变性,但酒精不具有强氧化性,故C不符合题意;
D. 高纯度的硅单质广泛用于制作半导体,制光导纤维的材料为二氧化硅,故D不符合题意。
故答案为:A。
【分析】本题考查化学知识在生产,生活中的应用。根据分散质粒子直径的大小,可以将分散系分为溶液,胶体和浊液,二氧化硅可用于制作光导纤维。
3.【答案】D
【解析】【解答】A.钛合金为含有金属钛元素的合金,其属于金属材料,不属于无机非金属材料,故A不符合题意;
B.聚氨酯为有机高分子化合物,不属于无机非金属材料,故B不符合题意;
C.碳包覆银纳米材料属于复合材料,不属于无机非金属材料,且银不是主族元素,故C不符合题意;
D.碳化硅(SiC)是由碳元素和硅元素组成的无机非金属材料,且碳元素与硅元素均位于元素周期表第IVA族,故D符合题意;
故答案为:D。
【分析】无机非金属材料是指以某些元素的氧化物,碳化物、氮化物,卤素化合物、以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料。
4.【答案】A
【解析】【解答】A.二氧化硅具有良好的传输光信号的能力,常用作光导纤维,故A符合题意;
B.金属钠具有还原性可用金属钠与钛、锆、铌等金属的熔融盐反应制取相应金属,故B不符合题意;
C.空气中的粉尘颗粒可以形成气溶胶,当一束光照射时会产生丁达尔效应,故C不符合题意;
D.钢中掺杂其他金属原子后改变了金属内部的组织结构,使其具有很强的抗腐蚀能力,故D不符合题意;
故答案为:A。
【分析】依据物质的性质和用途判断,其中A项中二氧化硅具有良好的传输光信号的能力,常用作光导纤维。
5.【答案】D
【解析】【解答】光纤、玻璃、石英中均含有SiO2,芯片是由单质硅制成的,不含有SiO2,故答案为:D。
【分析】(1)含二氧化硅的材料:玻璃、石英玻璃、水玻璃、光导纤维、电子工业的重要部件和陶器等;
(2)硅可以做半导体材料,如芯片、太阳能电池板。
6.【答案】C
【解析】【解答】A.隔热降噪材料三胺泡沫属于有机物,不是金属材料,A不符合题意;
B.SiC颗粒属于无机材料,不是金属材料,B不符合题意
C.镁锂合金属于金属材料,C符合题意;
D.有机热控涂层属于有机物,不是金属材料,D不符合题意;
故答案为:C。
【分析】金属材料包括金属和合金,结合物质组成判断解答。
7.【答案】B
【解析】【解答】A、芯片的主要成分是硅,硅为新型无机非金属材料,A错误;
B、二氧化硫具有还原性,可以防止营养成分被氧化,B正确;
C、酒精具有还原性,84消毒液具有氧化性,两者可以发生氧化还原反应,C错误;
D、聚合硫酸铁可以水解生成氢氧化铁胶体,作为吸附剂,D错误;
故答案为:B
【分析】A、硅为新型非金属材料,不属于有机高分子材料;
B、二氧化硫具有还原性,可以防止营养成分被氧化;
C、酒精中的羟基具有还原性;
D、铁离子可以水解生成氢氧化铁胶体,胶体具有吸附性。
8.【答案】D
【解析】【解答】A.硅酸盐材料主要包括:玻璃、水泥、陶瓷,做窗户的普通玻璃属于硅酸盐材料,A不符合;
B.硅酸盐材料主要包括:玻璃、水泥、陶瓷,浇灌房顶的水泥属于硅酸盐材料,B不符合;
C.硅酸盐材料主要包括:玻璃、水泥、陶瓷,铺地板的陶瓷瓷砖属于硅酸盐材料,C不符合;
D. 传输信号的光导纤维的主要成分是SiO2, D符合;
故答案为:D。
【分析】普通玻璃、水泥、陶瓷等均属于硅酸盐材料,光导纤维的主要成分是SiO2。
9.【答案】D
【解析】【解答】A.铜案属于金属材料,A 不符合题意;
B.溪山行旅图为图画制品,不是硅酸盐材料,B不符合题意;
C.编钟属于金属材料,C不符合题意;
D.陶壶为陶制品,属于硅酸盐材料,D符合题意;
故答案为:D。
【分析】A.铜是金属材料;
B.纸张的成分为纤维素;
C.编钟材料为铜合金,属于金属材料。
10.【答案】A
【解析】【解答】①盐卤(含MgCl2)与石灰乳反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应生成氯化镁溶液,由于Mg2+水解Mg2++2H2O Mg(OH)2+2H+,加热蒸发时HCl挥发,平衡向右移动,所以得不到无水MgCl2,故①不符合题意;
②氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中加入足量的盐酸,生成氯化铝,得不到氢氧化铝,故②不符合题意;
③氨催化氧化生成一氧化氮和水,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,符合各步转化,故③符合题意;
④电解氯化钠溶液生成氢气、氢氧化钠和氯气,氯气与铁反应只能生成氯化铁,得不到氯化亚铁,故④不符合题意;
⑤硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,故⑤不符合题意;
⑥SiO2与氢氧化钠反应Na2SiO3,Na2SiO3中通二氧化碳发生反应生成H2SiO3,符合各步转化,故⑥符合题意;
故③⑥符合题意,
故答案为:A。
【分析】①加热氯化镁溶液,镁离子水解得到促进,得到的是氢氧化镁;
②偏铝酸根离子与足量盐酸反应生成氯化铝,而不是氢氧化铝沉淀;
③氨气催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸;
④氯气的氧化性很强,与铁反应生成高价铁;
⑤硫与氧气反应生成二氧化硫;
⑥二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与二氧化碳反应生成硅酸。
11.【答案】A
【解析】【解答】A.熔融状态下, NaOH与Fe不反应,故可用铁坩埚熔化NaOH,选项正确,A符合题意;
B.石英的主要成分为SiO2,熔融状态下,NaOH能与SiO2反应,故不可用石英坩埚熔化NaOH,选项错误,B不符合题意;
C.刚玉为Al2O3,熔融状态下,NaOH能与Al2O3反应,故不可用刚玉坩埚熔化NaOH,选项错误,C不符合题意;
D.陶瓷中含有SiO2,熔融状态下,NaOH能与SiO2反应,故不可用陶瓷坩埚熔化NaOH,选项错误,D不符合题意;
故答案为:A
【分析】熔化NaOH所用的坩埚应不能与NaOH反应,据此分析选项。
12.【答案】C
【解析】【解答】①浓硝酸见光或受热易分解,保存在棕色试剂瓶,①符合题意;
②HNO3有氧化性,将SO32-氧化为SO42-,加氯化钡产生白色沉淀,不能检验,②不符合题意;
③锌与稀硝酸发生氧化还原反应,不生成氢气,③不符合题意;
④浓硫酸滴到纸张上,纸脱水炭化变黑,说明浓硫酸有脱水性,④不符合题意;
⑤传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐,⑤符合题意;
故答案为:C
【分析】①浓硝酸见光或受热易分解;
②HNO3有氧化性;
③锌与稀硝酸发生氧化还原反应;
④浓硫酸有脱水性;
⑤陶瓷、水泥、玻璃的主要成分是硅酸盐。
13.【答案】C
【解析】【解答】玛瑙、光导纤维、水晶的主要成分是SiO2,而太阳能电池板的主要原料是晶体Si,
故答案为C。
【分析】太阳能电池板或者是芯片主要成分是硅单质
14.【答案】D
【解析】【解答】A.Laeeb毛绒玩具的生产材料为纤维素,属于有机高分子材料,A不符合题意;
B.冰墩墩外壳是一种塑料制品,属于有机高分子材料,B不符合题意;
C.FIFA官方纪念品,是一种金属材料,属于金属材料,C不符合题意;
D.松山湖清芯半导体SiC器件,是一种非金属化合物,属于新型无机非金属材料,D符合题意;
故答案为:D。
【分析】A.纤维素属于有机高分子材料;
B.塑料有机高分子材料;
C.金属及合金属于金属材料;
D.SiC是一种非金属化合物,属于新型无机非金属材料。
15.【答案】C
【解析】【解答】A.硫与氧气反应只能生成二氧化硫,不能一步反应生成三氧化硫,故A不符合题意;
B.二氧化硅不能一步生成硅酸,可由可溶性的硅酸盐与酸反应生成硅酸,故B不符合题意;
C.FeS2在高温条件下与氧气反应生成SO2,SO2与氢氧化钠溶液反应生成Na2SO3,Na2SO3被氧气氧化为Na2SO4,各物质之间的转化均能一步完成,故C符合题意;
D.氨气催化氧化得到一氧化氮,不能一步生成二氧化氮,故D不符合题意。
故答案为:C。
【分析】A.硫单质和氧气反应时,氧气的氧化性只能将硫氧化为二氧化硫,不能直接到三氧化硫
B.二氧化硅不能与水直接反应,并且不溶于水
C.符合反应流程,各步骤均可以一步到位
D.氨气与氧气的催化氧化时,氧气的氧化性不足将其氧化为二氧化氮
16.【答案】D
【解析】【解答】A.“建盏”为陶瓷,属于传统无机非金属材料,故A不符合题意;
B.Fe2O3为红色固体,所以因含有较多Fe2O3,外表多呈红色,故B不符合题意;
C.“建盏”为陶瓷,但含有较多Fe2O3,不能用于盛放各种酸,故C不符合题意;
D.现代工艺使用天然气替代煤炭,可以减少二氧化硫的排放,有助于减少污染,故D符合题意;
故答案为:D。
【分析】 福建省特产“建盏”,由黄泥、粘土、红土、釉石等多种原料烧制,主要特点是Fe2O3含量高。 因此就是传统的无机非金属材料,表面为红棕色,不能溶于酸,利用现代技术可以减少污染
17.【答案】A
【解析】【解答】A. 墨汁的主要成分是骨胶和炭黑,是固体小颗粒炭黑与水形成的一种胶体,墨汁不是水溶液,故A符合题意;
B. 宣纸主要成分是纤维素,故B不符合题意;
C. 硅酸钙(CaSiO3)是由金属阳离子——钙离子与酸根阴离子——硅酸根离子构成的化合物,砚石主要成分硅酸钙属于无机非金属材料,故C不符合题意;
D.制笔所用狼毫的主要成分是蛋白质, 制笔的羊毫主要含有、、、元素,故D不符合题意;
故答案为:A。
【分析】墨汁是一种胶体,不是水溶液。
18.【答案】C
【解析】【解答】A.硅是将太阳能转化变为电能的常用材料,A不符合题意;
B.水晶、玛瑙的主要成分都是二氧化硅,B不符合题意;
C.水玻璃是硅酸钠的水溶液,可用于生产黏合剂和防火剂,C符合题意;
D.二氧化硅既能跟HF反应,又能跟NaOH反应,但二氧化硅是酸性氧化物,D不符合题意,
故答案为:C。
【分析】本题主要考查的是无机非金属单质及其化合物的性质及应用。
19.【答案】(1)DBCAE或DBCABE
(2)D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气
【解析】【解答】⑴先是氢气发生装置,再是干燥装置,再是将汽化装置,再是反应装置,再是尾气处理装置,也可以先干燥后再处理尾气,因此依次连接的合理顺序为DBCAE或DBCABE;故答案为:DBCAE或DBCABE。⑵由于SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃,整个装置需要先排除装置内空气,因此操作时应先打开装置D中分液漏斗的旋塞,理由是SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气;故答案为:D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气。
【分析】A装置主要是SiHCl3与过量H2在加热条件下反应制备纯硅,B主要是干燥气体,C主要是将SiHCl3转变为气体在A中反应,D是氢气发生装置,E尾气处理装置。
20.【答案】(1)2∶7;陶瓷在高温下会与Na2CO3反应
(2)铁;Al(OH)3
(3)小;2 +2H+ +H2O
(4)d;复分解反应
(5) ×100%
【解析】【解答】铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质,制备重铬酸钾,由制备流程可知,步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2+7NaNO2,该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,滤液1中含NaAlO2、Na2CrO4,调节pH过滤分离出Al(OH)3、含Si物质,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+ Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,溶解度小的析出。(1)步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2+7NaNO2,则FeO·Cr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;(2)滤渣1中含量最多的金属元素是 Fe,滤渣2的主要成分是 Al(OH)3及含硅杂质。(3)步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72-,2CrO42-+2H+ Cr2O72-+H2O;(4)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到40℃,选d,K2Cr2O7固体的溶解度在四种物质中较小、且溶解度较大,过滤分离产品最多,10℃时最合适;步骤⑤发生Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,反应类型是复分解反应。(5)用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为=实际产量/理论产量,由Cr原子守恒可知,则产率为190m2/147m1×100%。
【分析】(1)FeO·Cr2O3是还原剂。完全氧化为铬酸钠和三氧化铁,每1mol反应转移7mol电子,根据电荷守恒及物质的系数比可以算出;在高温条件下,碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳;
(2)熔块中的氧化铁不溶于水,过滤后,进入滤渣1,调节ph过滤后会得到滤渣2为氢氧化铝;
(3)步骤 ④ 调节滤液二的pH,目的是提高溶液酸性,增大溶液中的氢离子,使平衡正向移动,提高重铬酸根离子的浓度。
(4)由图可知,在10摄氏度左右时得到的重铬酸钾固体最多;
(5)先算出三氧化二钴的物质的量,然后根据原子守恒,得到产率。
21.【答案】(1)第三周期ⅢA族
(2);Na2O2;离子键和非极性共价键
(3)HF
(4)①;④;⑤;在Y、Z之间加装饱和NaHCO3的洗气瓶
(5)299;119
【解析】【解答】(1)铝的原子序数为13,位于元素周期表第三周期第ⅢA族。
(2)原子半径最小的元素为H,Na与H组成的化合物为NaH,其电子式为,化合物乙可作为呼吸面具或潜艇氧气的来源,乙是Na2O2,Na2O2为离子化合物,含离子键和氧氧非极性共价键。
(3)O元素和其同周期相邻的两种元素分别形成的简单氢化物为NH3、H2O、HF,而F的非金属性比O、N强,因此HF的稳定性最强。
(4)为验证C、Si的非金属性的变化规律,左边装置用于制取二氧化碳,右边装置中盛放硅酸钠溶液,因此X、Y、Z处所盛装或放置的药品分别为稀盐酸、CaCO3固体、Na2SiO3溶液,但稀盐酸有挥发性,制得的二氧化碳中会混有HCl,HCl也能和硅酸钠溶液反应生成硅酸沉淀,无法证明是二氧化碳和硅酸钠溶液反应生成硅酸,因此应在Y、Z之间加装饱和NaHCO3的洗气瓶,用于除去氯化氢,防止干扰实验。
(5)钠位于第IA族,Uue与Na同主族,位于第八周期,原子序数为119,即质子数为119,其一种可能存在的核素原子核中有180个中子,质量数为119+180=299,因此中A=299,Z=119。
【分析】(1)依据电子分层排布规律确定在元素周期表的位置。
(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小;依据物质的组成判断;
(3)非金属性越强气态氢化物越稳定;
(4)依据强酸制弱酸的原理,但注意稀盐酸有挥发性,防止干扰实验。
(5)依据原子表示时左上角表示质量数、左下角表示质子数,质量数=质子数+中子数。
22.【答案】(1)SiO2+ 2C Si + 2CO↑
(2)Si + 3HCl SiHCl3+ H2 (或加热)
(3)蒸馏;H4SiO4 (或H2SiO3). H2、HCl
(4)SiHCl3+ H2 Si+ 3HCl
(5)H2、HCl
【解析】【解答】(1)化学方程式为 SiO2+ 2C Si + 2CO↑
(2)由反应物和生成物可推方程式为 Si + 3HCl SiHCl3+ H2 (或加热)
(3)根据熔沸点可知,操作流程依次为沉降、冷凝、和蒸馏
可燃性气体为氢气, 能生成氢气则说明硅元素的化合价要升高,则产物为硅酸,剩下来的氯就形成HCl
(4)还原炉中是得到纯硅的反应,根据反应物和生成物可推化学方程式为 SiHCl3+ H2 Si+ 3HCl
(5)根据示意图可知,水解过程中产生的氢气和氯化氢也能循环使用
【分析】(1)注意:该条件下C只能变成CO,不能到二氧化碳
(3)可根据熔沸点来选择提纯方法
(5)可根据示意图来找出循环物质。
23.【答案】(1)SiO2;提高钴元素的利用率(或其他合理答案)
(2)6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O
(3)取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化
(4)6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑
(5)防止因温度降低,CoCl2晶体析出
【解析】【解答】(1)含钴废催化剂中含有的Fe、Co均可溶于硫酸,而SiO2不溶,所以滤渣的是SiO2 ,洗涤滤渣的洗涤液中含有钴的化合物,为了提高钴元素的利用率,将洗液与滤液合并;本题答案为:SiO2 ,提高钴元素的利用率;(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是:6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O;
本题答案为:6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O;(3)依据所给信息,Fe2+和[Fe(CN)6]3 反应,生成蓝色Fe3[Fe(CN)6]2沉淀,故确定Fe2+是否氧化完全的方法是:取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化;本题答案为:取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化;(4)氧化后的溶液中,含有Fe3+,加入Na2CO3后,生成[Na2Fe6(SO4)4(OH)12]沉淀和CO2气体,离子方程式为:6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑;
本题答案为:6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑;(5)由CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出;
本题答案为:防止因温度降低,CoCl2晶体析出。
【分析】(1)含钴废催化剂中含有的Fe、Co均可溶于硫酸,而SiO2不溶,洗涤滤渣的洗涤液中含有钴的化合物;(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,ClO3-被还原为Cl-;(3)欲判断Fe2+是否氧化完全,需要验证溶液中有无Fe2+即可;(4)氧化后的溶液中,含有Fe3+,加入Na2CO3后,生成[Na2Fe6(SO4)4(OH)12]沉淀和CO2气体;(5)由CoCl2的溶解度曲线可以知道,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出;
24.【答案】(1)2I-+Cl2=I2+2Cl-
(2)NaOH溶液
(3)2Na+2H2O=2NaOH+H2↑
(4)2Mg+CO2 2MgO+C
(5)SiO2+2C Si+2CO↑
【解析】【解答】(1)黄绿色气体为Cl2,能使淀粉溶液变蓝色的为I2,该反应的离子方程式为Cl2+2I-=I2+2Cl-;
(2)Al、Al2O3具有两性,能与强酸溶液和强碱溶液发生反应,Fe为活泼金属,能与强酸溶液反应,因此除去Fe、Al、Al2O3混合物中的Al、Al2O3时,可加入NaOH溶液,充分反应后,过滤,即可得到Fe;
(3)焰色反应显黄色,则甲为Na,因此化合物B为NaOH,则该反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(4)单质乙是黑色非金属固体单质,则乙是C,化合物B是优质耐高温材料,则为MgO或Al2O3,结合反应生成C可知,化合物B为MgO,该反应的化学方程式为2Mg+CO22MgO+C;
(5)化合物A可用作光导纤维,则A为SiO2,乙为半导体材料,则乙为Si,该反应的化学方程式为SiO2+2CSi+2CO↑;
【分析】(1)黄绿色气体为Cl2,能使淀粉溶液变蓝色的为I2,据此写出反应的离子方程式;
(2)结合Al、Al2O3的两性进行分析;
(3)焰色反应显黄色,则甲为Na,因此化合物B为NaOH,据此写出反应的化学方程式;
(4)单质乙是黑色非金属固体单质,则乙是C,化合物B是优质耐高温材料,则为MgO或Al2O3,结合反应生成C可知,化合物B为MgO,据此写出反应的化学方程式;
(5)化合物A可用作光导纤维,则A为SiO2,乙为半导体材料,则乙为Si,据此写出反应的化学方程式;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
人教版 高中化学 必修二 5.3.1无机非金属材料
一、单选题
1.硅及其化合物在现代信息技术、航天、医疗等领域有着广泛的应用。下列硅的单质或化合物中,广泛用作半导体材料的是( )
A.SiO2 B.Si C.Na2SiO3 D.SiC
2.化学与生产、生活密切相关,下列有关说法正确的是( )
A.水玻璃可用于生产黏合剂和防火剂
B.根据稳定性可将分散系分为溶液、胶体和浊液
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了其强氧化性
D.高纯度的硅单质可用于制作光导纤维
3.下列我国科研成果所涉材料中,主要成分为同主族元素组成的无机非金属材料的是( )
A.“玉兔二号”钛合金筛选网轮
B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线
D.4.03米大口径碳化硅反射镜
4.对下列事实的解释错误的是( )
A.二氧化硅常作为光导纤维,因为二氧化硅具有导电性
B.金属钠可用于钛、锆、铌等金属的冶炼,因为金属钠具有还原性
C.黑暗的电影院中,放映口发出的光会形成光柱,因为胶体具有丁达尔效应
D.不锈钢具有很强的抗腐蚀能力,因为加入合金元素后内部组织结构发生变化
5.下列材料中不含SiO2的是( )
A.光纤 B.玻璃 C.石英 D.芯片
6.2021年6月11日,国家航天局举行“天问一号”探测器着陆火星首批科学影像图揭幕仪式,公布了由“祝融号”火星车拍摄的“着巡合影”“中国印迹”等影像图。“祝融号”火星车使用的下列材料中,属于金属材料的是( )
A.隔热降噪材料三胺泡沫 B.SiC颗粒
C.新型镁锂合金 D.有机热控涂层
7.化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量SO2的目的是防止营养成分被
氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁,是新型絮凝剂,可用来杀灭水中病菌
8.下列材料中不属于硅酸盐材料的是( )
A.做窗户的普通玻璃 B.浇灌房顶的水泥
C.铺地板的陶瓷瓷砖 D.传输信号的光导纤维
9.中华文化源远流长、博大精深,云南省馆藏文物是中华文化的重要代表。下列文物主要是由硅酸盐材料制成的是( )
文物
战国牛虎铜案 溪山行旅图 西汉滇王编钟 新石器时代鸡形陶壶
选项 A B C D
A.A B.B C.C D.D
10.下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2) Mg(OH)2 MgCl2溶液 无水MgCl2
②铝土矿 AlO2- Al(OH)3 Al2O3
③NH3 NO NO2 HNO3
④NaCl溶液 Cl2 无水FeCl2
⑤S SO3 H2SO4
⑥SiO2 Na2SiO3溶液 H2SiO3
A.③⑥ B.③⑤⑥ C.①④⑤ D.①③⑥
11.熔化氢氧化钠时,应选用的坩埚是 ( )
A.铁坩埚
B.石英坩埚
C.刚玉坩埚
D.陶瓷坩埚
12.下列表述正确的是
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
⑤传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐
A.①③④ B.①②⑤ C.①⑤ D.①②④⑤
13.硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是( )
A B C D
玛瑙 光导纤维 太阳能电池板 水晶
A.A B.B C.C D.D
14.东莞制造走向世界。下列产品的主要材料属于新型无机非金属材料的是
A.Laeeb毛绒玩具 B.冰墩墩外壳 C.FIFA官方纪念品 D.松山湖清芯半导体SiC器件
A.A B.B C.C D.D
15.下列物质之间的转化都能一步实现的是( )
A.H2S→S→SO3→H2SO4 B.Si→SiO2→H2SiO3→Na2SiO3
C.FeS2→SO2→Na2SO3→Na2SO4 D.N2→NH3→NO2→HNO3→NO2
16.中国国家地理标志产品,福建省特产“建盏”,由黄泥、粘土、红土、釉石等多种原料烧制,主要特点是Fe2O3含量高。下列有关“建盏”说法正确的是( )
A.属于新型无机非金属材料产品
B.因含有较多Fe2O3,外表多呈棕黑色
C.产品耐腐蚀性强,可用于盛放各种酸碱
D.现代工艺使用天然气替代煤炭,有助于减少污染
17.“无色而具图画的灿烂,无声而有音乐的和谐”描述书法之美。书法之美尽在笔墨纸砚之间(如图所示钟繇的“宣示帖”)。下列说法不正确的是( )
A.墨汁是一种水溶液
B.宣纸主要成分是纤维素
C.砚石主要成分属于无机非金属材料
D.制笔的羊毫主要含有、、、元素
18.下列表述正确的是()
A.二氧化硅是将太阳能转化变为电能的常用材料
B.玻璃、水晶、玛瑙的主要成分都是硅酸盐
C.水玻璃可用于生产黏合剂和防火剂
D.二氧化硅既能跟HF反应,又能跟NaOH反应,因此二氧化硅是两性氧化物
二、实验探究题
19.用SiHCl3在加热条件下与过量H2反应制备纯硅的装置如图(热源及夹持装置略去):
已知:SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃;
请问答:
(1)依次连接的合理顺序为 。
(2)操作时应先打开装置 (选填“C”或“D”)中分液漏斗的旋塞,理由是 。
三、综合题
20.重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为 。该步骤不能使用陶瓷容器,原因是 。
(2)滤渣1中含量最多的金属元素是 ,滤渣2的主要成分是 及含硅杂质。
(3)步骤④调滤液2的pH使之变 (填“大”或“小”),原因是 (用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到 (填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 。
(5)某工厂用m1
kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为 。
21.实验室加热液体时,常加入沸石、其主要成分为,根据其组成元素完成下列填空:
(1)指出元素在周期表中的位置 。
(2)沸石中的元素可形成多种化合物;元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为 ;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是 (填化学式),化合物乙中存在的化学键类型为 。
(3)O元素和其同周期相邻的两种元素分别形成的简单氢化物中最稳定的是 (填化学式)。
(4)已知硅酸(H2SiO3)为白色胶状沉淀。
实验室中现有药品:①稀盐酸、②稀硫酸、③NaHCO3固体、④CaCO3固体、⑤Na2SiO3溶液,请选择合适药品利用上述装置设计实验验证C、Si的非金属性的变化规律;装置X、Y、Z处所盛装或放置的药品分别为 、 、 (填序号)。但有同学认为该实验所得现象无法充分证明C、Si的非金属性强弱,如何改进? 。
(5)Uue是暂时未合成的化学元素,与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则中A= 、Z= 。
22.硅在地壳中的含量较高,硅及其化合物的开发由来已久。高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
(1)工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃生成粗硅的化学方程式为 。
(2)在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl 等,粗硅生成SiHCl3的化学反应方程式_ 。
(3)有关物质的熔沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_ ;
SiHCl3极易水解且生成某种可燃性气体,其完全水解的产物为_ 。
物质 Si SiCl4 SiHCl3 SiH2Cl2 SiH3Cl HCl SiH4
熔点/℃ 1410 -70.4 -126.5 -122 -118 -114.2 -185
沸点/℃ 2355 57.6 31.8 8.2 -30.4 -84.9 -111.9
(4)还原炉中发生的化学反应为:
。.
(5)上述工艺生产中循环使用的物质除Si、SiHCl3外, 还有_ 。
23.以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
(1)用H2SO4溶解后过滤,得到的滤渣是 (填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是 。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是 。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式: 。
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是 。
24.置换反应的通式可表示为:单质甲+化合物A→单质乙+化合物B,请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程为 。
(2)若过量的单质甲 与化合物A发生反应的化学方程式为:
2Al+Fe2O3 Al2O3+2Fe。除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 。
(3)若甲为金属,其焰火为黄色,化合物B为一种常见的强碱,则该反应的化学方程式为
。
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为 。
(5)若化合物A可作光导纤维材料,乙为非金属半导体材料,则该反应的化学方程式为
。
答案解析部分
1.【答案】B
【解析】【解答】A.SiO2具有良好的光学效应,常用作光导纤维,故A不符合题意;
B.Si具有良好的导电功能,常用作半导体材料,故B符合题意;
C.Na2SiO3属于硅酸盐,其水溶液俗称水玻璃,常用作粘合剂,防火剂,故C不符合题意;
D.SiC又名人造金刚砂,属于耐高温、耐磨材料,故D不符合题意;
故答案为B。
【分析】半导体材料用的是单质硅。
2.【答案】A
【解析】【解答】A. 水玻璃是硅酸钠的水溶液,由于硅酸钠具有粘性、不易燃烧,所以水玻璃是生产硅胶、木材防火剂、粘合剂的原料,故A符合题意;
B. 根据分散质粒子直径的大小将分散系分为溶液、胶体和浊液,故B不符合题意;
C. 用高锰酸钾溶液、双氧水的强氧化性进行杀菌消毒,酒精能使病毒中蛋白质发生变性,但酒精不具有强氧化性,故C不符合题意;
D. 高纯度的硅单质广泛用于制作半导体,制光导纤维的材料为二氧化硅,故D不符合题意。
故答案为:A。
【分析】本题考查化学知识在生产,生活中的应用。根据分散质粒子直径的大小,可以将分散系分为溶液,胶体和浊液,二氧化硅可用于制作光导纤维。
3.【答案】D
【解析】【解答】A.钛合金为含有金属钛元素的合金,其属于金属材料,不属于无机非金属材料,故A不符合题意;
B.聚氨酯为有机高分子化合物,不属于无机非金属材料,故B不符合题意;
C.碳包覆银纳米材料属于复合材料,不属于无机非金属材料,且银不是主族元素,故C不符合题意;
D.碳化硅(SiC)是由碳元素和硅元素组成的无机非金属材料,且碳元素与硅元素均位于元素周期表第IVA族,故D符合题意;
故答案为:D。
【分析】无机非金属材料是指以某些元素的氧化物,碳化物、氮化物,卤素化合物、以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料。
4.【答案】A
【解析】【解答】A.二氧化硅具有良好的传输光信号的能力,常用作光导纤维,故A符合题意;
B.金属钠具有还原性可用金属钠与钛、锆、铌等金属的熔融盐反应制取相应金属,故B不符合题意;
C.空气中的粉尘颗粒可以形成气溶胶,当一束光照射时会产生丁达尔效应,故C不符合题意;
D.钢中掺杂其他金属原子后改变了金属内部的组织结构,使其具有很强的抗腐蚀能力,故D不符合题意;
故答案为:A。
【分析】依据物质的性质和用途判断,其中A项中二氧化硅具有良好的传输光信号的能力,常用作光导纤维。
5.【答案】D
【解析】【解答】光纤、玻璃、石英中均含有SiO2,芯片是由单质硅制成的,不含有SiO2,故答案为:D。
【分析】(1)含二氧化硅的材料:玻璃、石英玻璃、水玻璃、光导纤维、电子工业的重要部件和陶器等;
(2)硅可以做半导体材料,如芯片、太阳能电池板。
6.【答案】C
【解析】【解答】A.隔热降噪材料三胺泡沫属于有机物,不是金属材料,A不符合题意;
B.SiC颗粒属于无机材料,不是金属材料,B不符合题意
C.镁锂合金属于金属材料,C符合题意;
D.有机热控涂层属于有机物,不是金属材料,D不符合题意;
故答案为:C。
【分析】金属材料包括金属和合金,结合物质组成判断解答。
7.【答案】B
【解析】【解答】A、芯片的主要成分是硅,硅为新型无机非金属材料,A错误;
B、二氧化硫具有还原性,可以防止营养成分被氧化,B正确;
C、酒精具有还原性,84消毒液具有氧化性,两者可以发生氧化还原反应,C错误;
D、聚合硫酸铁可以水解生成氢氧化铁胶体,作为吸附剂,D错误;
故答案为:B
【分析】A、硅为新型非金属材料,不属于有机高分子材料;
B、二氧化硫具有还原性,可以防止营养成分被氧化;
C、酒精中的羟基具有还原性;
D、铁离子可以水解生成氢氧化铁胶体,胶体具有吸附性。
8.【答案】D
【解析】【解答】A.硅酸盐材料主要包括:玻璃、水泥、陶瓷,做窗户的普通玻璃属于硅酸盐材料,A不符合;
B.硅酸盐材料主要包括:玻璃、水泥、陶瓷,浇灌房顶的水泥属于硅酸盐材料,B不符合;
C.硅酸盐材料主要包括:玻璃、水泥、陶瓷,铺地板的陶瓷瓷砖属于硅酸盐材料,C不符合;
D. 传输信号的光导纤维的主要成分是SiO2, D符合;
故答案为:D。
【分析】普通玻璃、水泥、陶瓷等均属于硅酸盐材料,光导纤维的主要成分是SiO2。
9.【答案】D
【解析】【解答】A.铜案属于金属材料,A 不符合题意;
B.溪山行旅图为图画制品,不是硅酸盐材料,B不符合题意;
C.编钟属于金属材料,C不符合题意;
D.陶壶为陶制品,属于硅酸盐材料,D符合题意;
故答案为:D。
【分析】A.铜是金属材料;
B.纸张的成分为纤维素;
C.编钟材料为铜合金,属于金属材料。
10.【答案】A
【解析】【解答】①盐卤(含MgCl2)与石灰乳反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应生成氯化镁溶液,由于Mg2+水解Mg2++2H2O Mg(OH)2+2H+,加热蒸发时HCl挥发,平衡向右移动,所以得不到无水MgCl2,故①不符合题意;
②氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中加入足量的盐酸,生成氯化铝,得不到氢氧化铝,故②不符合题意;
③氨催化氧化生成一氧化氮和水,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,符合各步转化,故③符合题意;
④电解氯化钠溶液生成氢气、氢氧化钠和氯气,氯气与铁反应只能生成氯化铁,得不到氯化亚铁,故④不符合题意;
⑤硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,故⑤不符合题意;
⑥SiO2与氢氧化钠反应Na2SiO3,Na2SiO3中通二氧化碳发生反应生成H2SiO3,符合各步转化,故⑥符合题意;
故③⑥符合题意,
故答案为:A。
【分析】①加热氯化镁溶液,镁离子水解得到促进,得到的是氢氧化镁;
②偏铝酸根离子与足量盐酸反应生成氯化铝,而不是氢氧化铝沉淀;
③氨气催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮溶于水生成硝酸;
④氯气的氧化性很强,与铁反应生成高价铁;
⑤硫与氧气反应生成二氧化硫;
⑥二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与二氧化碳反应生成硅酸。
11.【答案】A
【解析】【解答】A.熔融状态下, NaOH与Fe不反应,故可用铁坩埚熔化NaOH,选项正确,A符合题意;
B.石英的主要成分为SiO2,熔融状态下,NaOH能与SiO2反应,故不可用石英坩埚熔化NaOH,选项错误,B不符合题意;
C.刚玉为Al2O3,熔融状态下,NaOH能与Al2O3反应,故不可用刚玉坩埚熔化NaOH,选项错误,C不符合题意;
D.陶瓷中含有SiO2,熔融状态下,NaOH能与SiO2反应,故不可用陶瓷坩埚熔化NaOH,选项错误,D不符合题意;
故答案为:A
【分析】熔化NaOH所用的坩埚应不能与NaOH反应,据此分析选项。
12.【答案】C
【解析】【解答】①浓硝酸见光或受热易分解,保存在棕色试剂瓶,①符合题意;
②HNO3有氧化性,将SO32-氧化为SO42-,加氯化钡产生白色沉淀,不能检验,②不符合题意;
③锌与稀硝酸发生氧化还原反应,不生成氢气,③不符合题意;
④浓硫酸滴到纸张上,纸脱水炭化变黑,说明浓硫酸有脱水性,④不符合题意;
⑤传统无机非金属材料陶瓷、水泥、玻璃的主要成分是硅酸盐,⑤符合题意;
故答案为:C
【分析】①浓硝酸见光或受热易分解;
②HNO3有氧化性;
③锌与稀硝酸发生氧化还原反应;
④浓硫酸有脱水性;
⑤陶瓷、水泥、玻璃的主要成分是硅酸盐。
13.【答案】C
【解析】【解答】玛瑙、光导纤维、水晶的主要成分是SiO2,而太阳能电池板的主要原料是晶体Si,
故答案为C。
【分析】太阳能电池板或者是芯片主要成分是硅单质
14.【答案】D
【解析】【解答】A.Laeeb毛绒玩具的生产材料为纤维素,属于有机高分子材料,A不符合题意;
B.冰墩墩外壳是一种塑料制品,属于有机高分子材料,B不符合题意;
C.FIFA官方纪念品,是一种金属材料,属于金属材料,C不符合题意;
D.松山湖清芯半导体SiC器件,是一种非金属化合物,属于新型无机非金属材料,D符合题意;
故答案为:D。
【分析】A.纤维素属于有机高分子材料;
B.塑料有机高分子材料;
C.金属及合金属于金属材料;
D.SiC是一种非金属化合物,属于新型无机非金属材料。
15.【答案】C
【解析】【解答】A.硫与氧气反应只能生成二氧化硫,不能一步反应生成三氧化硫,故A不符合题意;
B.二氧化硅不能一步生成硅酸,可由可溶性的硅酸盐与酸反应生成硅酸,故B不符合题意;
C.FeS2在高温条件下与氧气反应生成SO2,SO2与氢氧化钠溶液反应生成Na2SO3,Na2SO3被氧气氧化为Na2SO4,各物质之间的转化均能一步完成,故C符合题意;
D.氨气催化氧化得到一氧化氮,不能一步生成二氧化氮,故D不符合题意。
故答案为:C。
【分析】A.硫单质和氧气反应时,氧气的氧化性只能将硫氧化为二氧化硫,不能直接到三氧化硫
B.二氧化硅不能与水直接反应,并且不溶于水
C.符合反应流程,各步骤均可以一步到位
D.氨气与氧气的催化氧化时,氧气的氧化性不足将其氧化为二氧化氮
16.【答案】D
【解析】【解答】A.“建盏”为陶瓷,属于传统无机非金属材料,故A不符合题意;
B.Fe2O3为红色固体,所以因含有较多Fe2O3,外表多呈红色,故B不符合题意;
C.“建盏”为陶瓷,但含有较多Fe2O3,不能用于盛放各种酸,故C不符合题意;
D.现代工艺使用天然气替代煤炭,可以减少二氧化硫的排放,有助于减少污染,故D符合题意;
故答案为:D。
【分析】 福建省特产“建盏”,由黄泥、粘土、红土、釉石等多种原料烧制,主要特点是Fe2O3含量高。 因此就是传统的无机非金属材料,表面为红棕色,不能溶于酸,利用现代技术可以减少污染
17.【答案】A
【解析】【解答】A. 墨汁的主要成分是骨胶和炭黑,是固体小颗粒炭黑与水形成的一种胶体,墨汁不是水溶液,故A符合题意;
B. 宣纸主要成分是纤维素,故B不符合题意;
C. 硅酸钙(CaSiO3)是由金属阳离子——钙离子与酸根阴离子——硅酸根离子构成的化合物,砚石主要成分硅酸钙属于无机非金属材料,故C不符合题意;
D.制笔所用狼毫的主要成分是蛋白质, 制笔的羊毫主要含有、、、元素,故D不符合题意;
故答案为:A。
【分析】墨汁是一种胶体,不是水溶液。
18.【答案】C
【解析】【解答】A.硅是将太阳能转化变为电能的常用材料,A不符合题意;
B.水晶、玛瑙的主要成分都是二氧化硅,B不符合题意;
C.水玻璃是硅酸钠的水溶液,可用于生产黏合剂和防火剂,C符合题意;
D.二氧化硅既能跟HF反应,又能跟NaOH反应,但二氧化硅是酸性氧化物,D不符合题意,
故答案为:C。
【分析】本题主要考查的是无机非金属单质及其化合物的性质及应用。
19.【答案】(1)DBCAE或DBCABE
(2)D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气
【解析】【解答】⑴先是氢气发生装置,再是干燥装置,再是将汽化装置,再是反应装置,再是尾气处理装置,也可以先干燥后再处理尾气,因此依次连接的合理顺序为DBCAE或DBCABE;故答案为:DBCAE或DBCABE。⑵由于SiHCl3沸点为33℃,能与和H2O强烈反应,在空气中易自燃,整个装置需要先排除装置内空气,因此操作时应先打开装置D中分液漏斗的旋塞,理由是SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气;故答案为:D;SiHCl3在空气中易自燃,实验时先通一段时间氢气排除装置内空气。
【分析】A装置主要是SiHCl3与过量H2在加热条件下反应制备纯硅,B主要是干燥气体,C主要是将SiHCl3转变为气体在A中反应,D是氢气发生装置,E尾气处理装置。
20.【答案】(1)2∶7;陶瓷在高温下会与Na2CO3反应
(2)铁;Al(OH)3
(3)小;2 +2H+ +H2O
(4)d;复分解反应
(5) ×100%
【解析】【解答】铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质,制备重铬酸钾,由制备流程可知,步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2+7NaNO2,该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,滤液1中含NaAlO2、Na2CrO4,调节pH过滤分离出Al(OH)3、含Si物质,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+ Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7,溶解度小的析出。(1)步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2+7NaNO2,则FeO·Cr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;(2)滤渣1中含量最多的金属元素是 Fe,滤渣2的主要成分是 Al(OH)3及含硅杂质。(3)步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72-,2CrO42-+2H+ Cr2O72-+H2O;(4)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到40℃,选d,K2Cr2O7固体的溶解度在四种物质中较小、且溶解度较大,过滤分离产品最多,10℃时最合适;步骤⑤发生Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,反应类型是复分解反应。(5)用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为=实际产量/理论产量,由Cr原子守恒可知,则产率为190m2/147m1×100%。
【分析】(1)FeO·Cr2O3是还原剂。完全氧化为铬酸钠和三氧化铁,每1mol反应转移7mol电子,根据电荷守恒及物质的系数比可以算出;在高温条件下,碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳;
(2)熔块中的氧化铁不溶于水,过滤后,进入滤渣1,调节ph过滤后会得到滤渣2为氢氧化铝;
(3)步骤 ④ 调节滤液二的pH,目的是提高溶液酸性,增大溶液中的氢离子,使平衡正向移动,提高重铬酸根离子的浓度。
(4)由图可知,在10摄氏度左右时得到的重铬酸钾固体最多;
(5)先算出三氧化二钴的物质的量,然后根据原子守恒,得到产率。
21.【答案】(1)第三周期ⅢA族
(2);Na2O2;离子键和非极性共价键
(3)HF
(4)①;④;⑤;在Y、Z之间加装饱和NaHCO3的洗气瓶
(5)299;119
【解析】【解答】(1)铝的原子序数为13,位于元素周期表第三周期第ⅢA族。
(2)原子半径最小的元素为H,Na与H组成的化合物为NaH,其电子式为,化合物乙可作为呼吸面具或潜艇氧气的来源,乙是Na2O2,Na2O2为离子化合物,含离子键和氧氧非极性共价键。
(3)O元素和其同周期相邻的两种元素分别形成的简单氢化物为NH3、H2O、HF,而F的非金属性比O、N强,因此HF的稳定性最强。
(4)为验证C、Si的非金属性的变化规律,左边装置用于制取二氧化碳,右边装置中盛放硅酸钠溶液,因此X、Y、Z处所盛装或放置的药品分别为稀盐酸、CaCO3固体、Na2SiO3溶液,但稀盐酸有挥发性,制得的二氧化碳中会混有HCl,HCl也能和硅酸钠溶液反应生成硅酸沉淀,无法证明是二氧化碳和硅酸钠溶液反应生成硅酸,因此应在Y、Z之间加装饱和NaHCO3的洗气瓶,用于除去氯化氢,防止干扰实验。
(5)钠位于第IA族,Uue与Na同主族,位于第八周期,原子序数为119,即质子数为119,其一种可能存在的核素原子核中有180个中子,质量数为119+180=299,因此中A=299,Z=119。
【分析】(1)依据电子分层排布规律确定在元素周期表的位置。
(2)电子层数越多半径越大,电子层数相同,质子数越多半径越小;依据物质的组成判断;
(3)非金属性越强气态氢化物越稳定;
(4)依据强酸制弱酸的原理,但注意稀盐酸有挥发性,防止干扰实验。
(5)依据原子表示时左上角表示质量数、左下角表示质子数,质量数=质子数+中子数。
22.【答案】(1)SiO2+ 2C Si + 2CO↑
(2)Si + 3HCl SiHCl3+ H2 (或加热)
(3)蒸馏;H4SiO4 (或H2SiO3). H2、HCl
(4)SiHCl3+ H2 Si+ 3HCl
(5)H2、HCl
【解析】【解答】(1)化学方程式为 SiO2+ 2C Si + 2CO↑
(2)由反应物和生成物可推方程式为 Si + 3HCl SiHCl3+ H2 (或加热)
(3)根据熔沸点可知,操作流程依次为沉降、冷凝、和蒸馏
可燃性气体为氢气, 能生成氢气则说明硅元素的化合价要升高,则产物为硅酸,剩下来的氯就形成HCl
(4)还原炉中是得到纯硅的反应,根据反应物和生成物可推化学方程式为 SiHCl3+ H2 Si+ 3HCl
(5)根据示意图可知,水解过程中产生的氢气和氯化氢也能循环使用
【分析】(1)注意:该条件下C只能变成CO,不能到二氧化碳
(3)可根据熔沸点来选择提纯方法
(5)可根据示意图来找出循环物质。
23.【答案】(1)SiO2;提高钴元素的利用率(或其他合理答案)
(2)6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O
(3)取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化
(4)6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑
(5)防止因温度降低,CoCl2晶体析出
【解析】【解答】(1)含钴废催化剂中含有的Fe、Co均可溶于硫酸,而SiO2不溶,所以滤渣的是SiO2 ,洗涤滤渣的洗涤液中含有钴的化合物,为了提高钴元素的利用率,将洗液与滤液合并;本题答案为:SiO2 ,提高钴元素的利用率;(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是:6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O;
本题答案为:6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O;(3)依据所给信息,Fe2+和[Fe(CN)6]3 反应,生成蓝色Fe3[Fe(CN)6]2沉淀,故确定Fe2+是否氧化完全的方法是:取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化;本题答案为:取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化;(4)氧化后的溶液中,含有Fe3+,加入Na2CO3后,生成[Na2Fe6(SO4)4(OH)12]沉淀和CO2气体,离子方程式为:6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑;
本题答案为:6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑;(5)由CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出;
本题答案为:防止因温度降低,CoCl2晶体析出。
【分析】(1)含钴废催化剂中含有的Fe、Co均可溶于硫酸,而SiO2不溶,洗涤滤渣的洗涤液中含有钴的化合物;(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,ClO3-被还原为Cl-;(3)欲判断Fe2+是否氧化完全,需要验证溶液中有无Fe2+即可;(4)氧化后的溶液中,含有Fe3+,加入Na2CO3后,生成[Na2Fe6(SO4)4(OH)12]沉淀和CO2气体;(5)由CoCl2的溶解度曲线可以知道,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出;
24.【答案】(1)2I-+Cl2=I2+2Cl-
(2)NaOH溶液
(3)2Na+2H2O=2NaOH+H2↑
(4)2Mg+CO2 2MgO+C
(5)SiO2+2C Si+2CO↑
【解析】【解答】(1)黄绿色气体为Cl2,能使淀粉溶液变蓝色的为I2,该反应的离子方程式为Cl2+2I-=I2+2Cl-;
(2)Al、Al2O3具有两性,能与强酸溶液和强碱溶液发生反应,Fe为活泼金属,能与强酸溶液反应,因此除去Fe、Al、Al2O3混合物中的Al、Al2O3时,可加入NaOH溶液,充分反应后,过滤,即可得到Fe;
(3)焰色反应显黄色,则甲为Na,因此化合物B为NaOH,则该反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(4)单质乙是黑色非金属固体单质,则乙是C,化合物B是优质耐高温材料,则为MgO或Al2O3,结合反应生成C可知,化合物B为MgO,该反应的化学方程式为2Mg+CO22MgO+C;
(5)化合物A可用作光导纤维,则A为SiO2,乙为半导体材料,则乙为Si,该反应的化学方程式为SiO2+2CSi+2CO↑;
【分析】(1)黄绿色气体为Cl2,能使淀粉溶液变蓝色的为I2,据此写出反应的离子方程式;
(2)结合Al、Al2O3的两性进行分析;
(3)焰色反应显黄色,则甲为Na,因此化合物B为NaOH,据此写出反应的化学方程式;
(4)单质乙是黑色非金属固体单质,则乙是C,化合物B是优质耐高温材料,则为MgO或Al2O3,结合反应生成C可知,化合物B为MgO,据此写出反应的化学方程式;
(5)化合物A可用作光导纤维,则A为SiO2,乙为半导体材料,则乙为Si,据此写出反应的化学方程式;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
