2.1共价键2023~2024学年高二下学期化学同步练习(人教版2019)(含解析)
文档属性
| 名称 | 2.1共价键2023~2024学年高二下学期化学同步练习(人教版2019)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 521.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-14 12:35:39 | ||
图片预览




文档简介
2.1共价键 2023~2024学年高二下学期化学同步练习(人教版2019)
一、单选题,共15小题
1.(21-22高二·全国·课时练习)下列有机化合物中σ键与π键个数比为3∶2的是
A.CH3CH3 B.CH2=CH2
C.CH≡CH D.CH4
2.(22-23高三上·江苏苏州·期末)实验室可由与反应制备。下列说法正确的是
A.半径大小: B.电负性大小
C.电离能大小: D.键角大小:
3.(20-21高二·全国·课后作业)下列关于键和键的说法中,错误的是
A.键的电子云图形是轴对称的,键的电子云图形是镜面对称的
B.键是原子轨道“头碰头”式重叠,键是原子轨道“肩并肩”式重叠
C.两个p轨道不能形成键,只能形成键
D.H只能形成键,O可以形成键和键
4.(23-24高二上·辽宁沈阳·阶段练习)下列化学用语或图示表达错误的是
A.砷原子的简化电子排布式为:
B.的电子式为
C.铝原子最高能级的电子云轮廓图:
D.HCl的键电子云图:
5.(22-23高二上·重庆北碚·阶段练习)通常把原子总数和价电子总数相同的分子或离子称为等电子体,人们发现等电子体的空间结构相同。下列说法,认识错误的有几个
①s-s键与p-p键的电子云对称性不同
②1个N原子最多只能与3个H原子结合形成分子,是由共价键的饱和性决定的
③、、中碳原子间成键键长相同
④两个非金属原子之间形成的化学键都是共价键
⑤1个分子中含有11个键
⑥与互为等电子体,空间结构均为V形
A.1个 B.2个 C.3个 D.4个
6.(21-22高二上·吉林长春·期末)氰气的化学式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似。下列说法正确的是
A.不和氢氧化钠溶液发生反应
B.分子中N≡C的键长大于C-C的键长
C.分子中含有两个σ键和四个π键
D.分子中既有极性键又有非极性键
7.(23-24高三上·江苏·阶段练习)前四周期主族元素X、Y、Z、Q的原子序数依次增大,基态X原子核外电子占据两种形状不同的原子轨道,且两种轨道中电子总数相等,Q与X处于同一主族。Y的周期序数与族序数相等,Z的第二电离能远小于第三电离能。下列说法正确的是
A.电负性: B.最高价氧化物对应水化物的碱性:Y<Z
C.Z的氯化物是工业漂白粉的有效成分 D.X形成的氢化物中只有极性共价键
8.(20-21高二下·江苏南通·期中)法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法正确的是
A.该分子中N、O、F的第一电离能大小顺序为F>N>O
B.该分子中C—N键的键能大于C—F键的键能
C.该分子中σ键与π键数目之比为7:2
D.该分子中存在手性碳原子
9.(23-24高二上·浙江湖州·期末)下列结论正确,且能用键能解释的是
化学键
键能 411 318 799 358 346 222
A.键角: B.键长:
C.稳定性: D.电负性:
10.(22-23高二下·新疆巴音郭楞·期末)共价键参数:键能,键长,键角。其中,决定共价键强弱的重要参数是
A.键长和键角 B.键能和键角 C.键能和键长 D.键能、键长和键角
11.(23-24高二上·黑龙江大庆·期末)关于σ键和π键的说法中正确的是
A.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
B.所有σ键的强度都比π键的强度大
C.HCl和Cl2中的共价键类型均为s-sσ键
D.杂化轨道只用于形成σ键
12.(23-24高二上·重庆·期末)含有极性键且分子中各原子都满足8电子稳定结构的化合物是
A.CH4 B.CH2=CH2 C.CS2 D.N2
13.(23-24高二上·浙江绍兴·期末)下列说法不正确的是
A.H只能形成键,O可以形成键和键
B.氧原子可以形成、,也可以形成
C.共价键的成键原子可以是非金属原子也可以是金属原子
D.键和键的电子云形状的对称性相同
14.(23-24高二上·陕西西安·期中)下列表述正确的是
A.共价键的成键原子只能是非金属原子
B.所有σ键都比π键强度大
C.所有分子中均存在共价键
D.键长是构成化学键两个原子的核间距
15.(23-24高二上·云南昆明·阶段练习)下列关于共价键的叙述,正确的是
A.键键能一定比键键能大,且键与键电子云均为镜面对称
B.键的键长比键长,键的键能是键的两倍
C.分子中有键不一定有键,有键则一定有键
D.含有键的数目为
二、非选择题,共4小题
16.(21-22高二上·海南儋州·期末)按要求回答问题
(1)1 mol HCHO分子中含有σ键的数目为 NA。
(2)CS2分子中,共价键的类型有 。
(3)下列物质中:①MgCl2;②Na2O2; ③CS2 ;④NaOH; ⑤H2,只存在极性键的是 (填序号,下同),只存在非极性键的是 ,只存在离子键的是 ,既存在离子键又存在极性共价键的是 ,既存在离子键又存在非极性共价键的是 。
17.(21-22高二下·宁夏银川·阶段练习)下表是一些常见共价键的键能,其中键百位数被污渍遮住了,请回答下列问题:
共价键
键能/ 436 391 67 565 498
(1)键键能为 ,根据表中数据计算,电解水,需要吸收 kJ能量。
(2)键极性比键极性 (强/弱),键键长比键键长 (长/短)。
(3)中的键键角比中的 (大/小),原因是 。
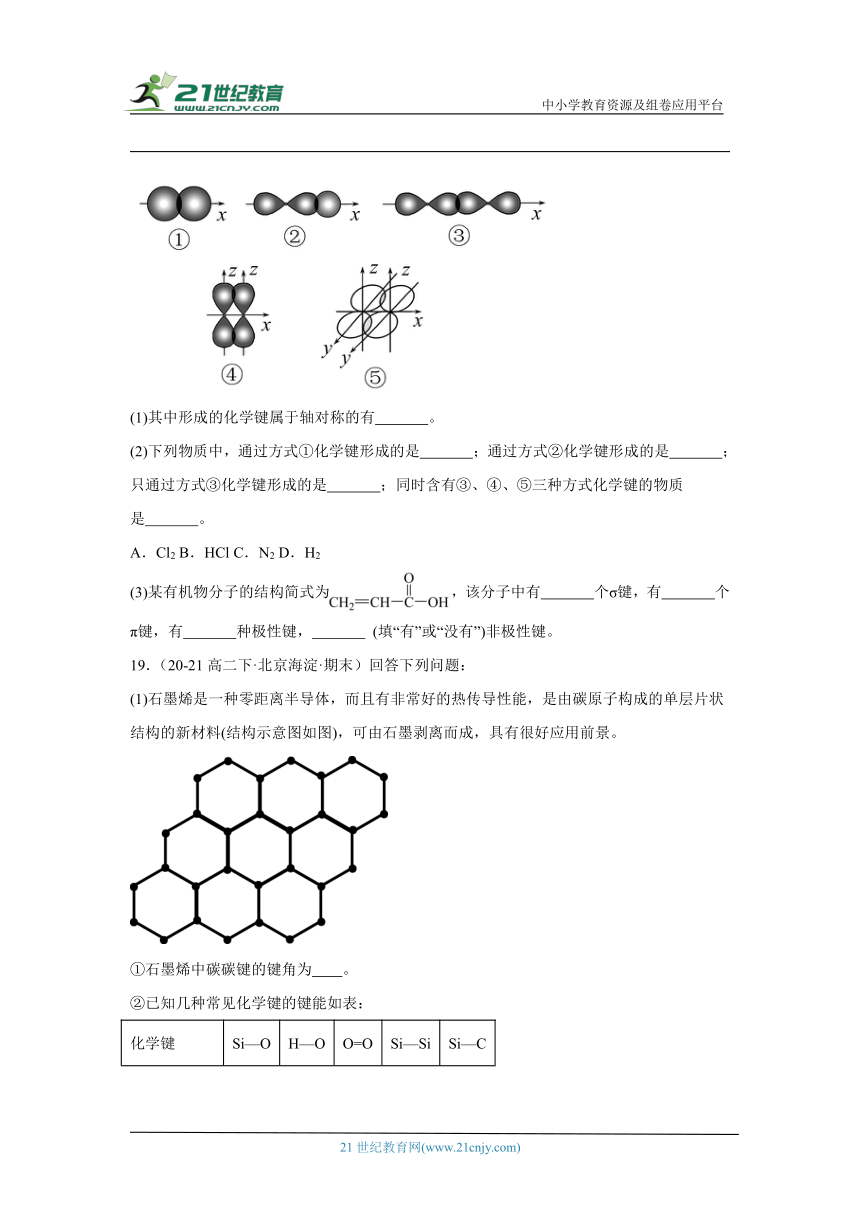
18.(21-22高二·全国·课时练习)如图表示不同类型共价键形成时电子云重叠情况:
(1)其中形成的化学键属于轴对称的有 。
(2)下列物质中,通过方式①化学键形成的是 ;通过方式②化学键形成的是 ;只通过方式③化学键形成的是 ;同时含有③、④、⑤三种方式化学键的物质是 。
A.Cl2 B.HCl C.N2 D.H2
(3)某有机物分子的结构简式为,该分子中有 个σ键,有 个π键,有 种极性键, (填“有”或“没有”)非极性键。
19.(20-21高二下·北京海淀·期末)回答下列问题:
(1)石墨烯是一种零距离半导体,而且有非常好的热传导性能,是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有很好应用前景。
①石墨烯中碳碳键的键角为 。
②已知几种常见化学键的键能如表:
化学键 Si—O H—O O=O Si—Si Si—C
键能/kJ·mol-1 368 467 498 226 x
i.比较Si—Si键与Si—C键的键能大小:x (填“>”“<”或“=”)226kJ·mol-1。
ii.H2被誉为21世纪人类最理想的燃料,而更有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。已知1mol单质硅含有2molSi—Si键,1molSiO2含4molSi—O键,试计算:1molSi完全燃烧放出的热量约为 。
(2)立体异构是有机化合物和无机化合物中都存在的同分异构现象。N2F2存在顺式和反式两种同分异构体,据此事实,判断N2F2分子中两个氮原子之间的键型组成为 。
A.仅有一个σ键 B.仅有一个π键 C.一个σ键,一个π键 D.两个σ键
写出N2F2分子的顺式异构体的结构式 。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A.CH3CH3中有7个σ键,没有π键,故A不符合题意;
B.CH2=CH2中有5个σ键,1个π键,故B不符合题意;
C.CH≡CH中有3个σ键,2个π键,故C符合题意;
D.CH4中有4个σ键,没有π键,故D不符合题意。
综上所述,答案为C。
2.A
【详解】A.电子层结构相同的离子,核电荷数越大,离子半径越小,则氯离子的离子半径大于钙离子,故A正确;
B.元素的非金属性越强,电负性越大,氧元素的非金属性强于氢元素,电负性大于氢元素,故B错误;
C.同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则氮元素的第一电离能大于氧元素,故C错误;
D.孤对电子对数越多,对成键电子对的斥力越大,键角越小,铵根离子和氨分子的孤对电子对数分别为0和1,则铵根离子的键角大于氨分子,故D错误;
故选A。
3.C
【详解】A.σ键的电子云图形以形成共价键的两原子核的连线为轴作旋转操作,共价键的电子云图形不变,为轴对称,π键电子云由两块组成,分别位于由原子核构成平面的两侧,为镜面对称,A正确;
B.σ键电子云重叠程度较大,以头碰头方式重叠,π键电子云重叠程度较小,以肩并肩方式重叠,B正确;
C.两个p轨道可以以头碰头方式形成σ键,也可以以肩并肩方式形成π键,C错误;
D.H原子只有1个电子,位于1s轨道上,电子云形状为球形,和其他原子形成共价键时,只能以头碰头方式重叠,即只能形成σ键,O原子p轨道上的价电子,可以以头碰头方式形成σ键,也可以以肩并肩方式形成π键,D正确;
故答案选C。
4.A
【详解】A.漏写3d能级上的电子,砷原子的简化电子排布式为:[Ar]3d104s24p3,故A错误;
B.CaO2由Ca2+、通过离子键构成,过氧根离子内氧原子与氧原子共用一对电子,则电子式为,故B正确;
C.Al原子最高能级为3p能级,3p能级上的电子云呈哑铃形,铝原子最高能级的电子云轮廓图:,故C正确;
D.s轨道为球形,p轨道为哑铃形,HCl的键的电子云图为,故D正确;
故选:A。
5.C
【详解】①键的特征是轴对称,s-s键与p-p键的电子云图形均是轴对称,①错误;
②共价键具有饱和性,1个N原子最多只能与3个H原子结合形成分子,是由共价键的饱和性决定的,②正确;
③化学键的键长与键能相关,键能越大,键长越小,C-C、C=C、C≡C的键能不同,键长也不同,③错误;
④非金属原子都不易失去电子,非金属原子间形成化学键时,均会通过共用电子对结合,形成共价键,④正确;
⑤共价单键是键,共价双键、共价三键中均有一个键是键,故1个该分子中含有21个键,⑤错误;
⑥与原子总数均是3,价电子总数均是18,互为等电子体,二者空间结构相似,均是V形,⑥正确;
上述认识中错误的有①③⑤三个,故选C。
6.D
【详解】A.氰气性质与卤素相似,能和氢氧化钠溶液发生反应,故A错误;
B.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长,碳原子半径大于氮原子,所以氰分子中键长小于键长,故B错误;
C.单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;该分子的结构式为,该分子中含有3个键4个键,故C错误;
D.同种原子间形成非极性键,不同原子形成极性键,该分子的结构式为,分子中既有极性键,又有非极性键,故D正确;
故选D。
7.B
【分析】前四周期主族元素X、Y、Z、Q的原子序数依次增大,基态X原子核外电子占据两种形状不同的原子轨道,且两种轨道中电子总数相等,则X的电子排布式为1s22s22p4,X为O元素;Q与X处于同一主族,则Q为Se元素;Y的周期序数与族序数相等,则Y为Al元素;Z的第二电离能远小于第三电离能,则Z的价电子数为2,其为Ca元素。从而确定X、Y、Z、Q分别为O、Al、Ca、Se。
【详解】A.X、Q分别为O、Se,二者属于同主族元素,非金属性O>Se,非金属性越强,电负性越大,则电负性:,A不正确;
B.Y、Z分别为Al、Ca,金属性Al<Ca,则最高价氧化物对应水化物的碱性:Al(OH)3<Ca(OH)2,B正确;
C.Z的氯化物为CaCl2,工业漂白粉的有效成分为Ca(ClO)2,C不正确;
D.X形成的氢化物H2O2中,既含极性共价键又含非极性共价键,D不正确;
故选B。
8.A
【详解】A.同周期元素的第一电离能从左到右有增大的趋势,但ⅡA族和ⅤA族的元素达到全满或半满状态,所以N、O、F的第一电离能由大到小的顺序为F>N>O,A正确;
B.分子中C-H键的键能与C-F键的键能比较,可以根据键长的大小来判断,具体来说就是根据相结合的两个原子的半径来比较,半径越小键能越大,两个化学键都含有C原子,F原子的半径大于H原子的,所以C-H键的键能大于C-F键的键能,B正确;
C.该分子中键与键数目之比为15:4,C错误;
D.手性碳原子一定是饱和碳原子,所连接的四个基团要是不同的,该有机物中没有饱和的碳原子,故D错误;
故选A。
9.C
【详解】A.是正四面体形,键角为109°28′,是直线形,键角为108°,与键能无关,故A不选;
B.键能越大,键长越短,键能大于,所以键长:,故B不选;
C.键能越大越稳定,C-H键能大于Si-H,所以稳定性:,故C选;
D.电负性与键能无关,故D不选;
故选C。
10.C
【详解】键能指气态基态原子形成1mol化学键释放的最低能量,键能越大,意味着化学键越稳定,越不容易被破坏。键长是形成共价键的两个原子之间的核间距,键长越短,往往键能越大,共价键越稳定。键能和键长是决定共价键强弱的重要参数。当物质分子内有多个化学键时,化学键之间的夹角叫键角,它反映了分子内原子的空间分布情况,因此键角是描述分子空间结构的重要参数,故答案为C。
11.A
【详解】A.σ键为轴对称,π键为镜面对称,所以σ键可以绕键轴旋转,π键一定不能绕键轴旋转,A正确;
B.σ键不一定比π键强度大,如氮气中σ键的强度比π键强度小,B错误;
C.H-Cl是氢原子1s轨道与氯原子3p轨道“头碰头”形成的,是s-pσ键,C错误;
D.杂化轨道可用于形成σ键或用于容纳未参与成键的孤电子,D错误;
答案选A。
12.C
【详解】A.CH4分子中存在C-H极性键;CH4中C元素化合价为-4,C原子最外层电子数为4,所以|-4|+4=8,分子中C原子满足8电子结构;H原子不满足8电子结构,不符合题意,故A不选;
B.CH2=CH2分子中C-H为极性键;CH2=CH2分子中H原子不满足8电子结构,不符合题意,故B不选;
C.CS2的结构式为S=C=S,符合4+4=8,则分子中所有原子均满足8电子稳定结构,且只含C、S之间的极性键,符合题意,故C选;
D.N2分子中存在N≡N非极性键;N原子满足8电子稳定结构,但是N2是单质,不是化合物,且只含非极性键,不符合题意,故D不选;
故选:C。
13.B
【详解】A.氢原子只有一个s轨道,只能形成键,O有s轨道和p轨道,可以形成键和键,故A正确;
B.氧原子可以形成H2O、H2O2,也可以形成H3O+,但不能形成H3O,故B错误;
C.共价键的成键原子可以是非金属原子也可以是金属原子,如AlCl3中Al原子与Cl原子之间形成的是共价键,故C正确;
D.σ键有方向性,两个成键原子必须沿着对称轴方向接近才能达到最大重叠,故s-sσ键与s-pσ键的电子云形状对称性相同,故D正确;
故答案为:B。
14.D
【详解】A.共价键的成键原子可以是金属原子,如AlCl3中Al原子和Cl原子之间是共价键,A错误;
B.在N2中,σ键的强度比π键的小,B错误;
C.分子晶体中不一定都存在共价键,如稀有气体为单原子分子,分子中不存在共价键,所以形成的晶体中不存在共价键,C错误;
D.键长是构成化学键两个原子的核间距,D正确;
故答案为:D。
15.C
【详解】A.键为“头碰头”方式重叠形成的,为轴对称,键为“肩并肩”方式重叠形成的,为镜面对称,A错误;
B.键的键长比键长,键的键能大于键的键能且小于其两倍,B错误;
C.键能单独存在,而键不能单独存在;分子中有键不一定有键,有键则一定有键,C正确;
D.氮氮三键中含有1个键和2个键,含有键的数目为,D错误;
故选C。
16.(1)3NA
(2)极性键
(3) ③ ⑤ ① ④ ②
【详解】(1)HCHO结构式是,共价单键都是σ键,共价双键中一个是σ键,一个是π键,可见1个HCHO分子中含有3个σ键,则在1 mol HCHO分子中含有σ键的数目为3NA;
(2)CS2是由分子构成,在1个CS2分子中C原子与2个S原子形成4个共价键,结构式是S=C=S,C=S键是两种不同的非金属元素的原子形成的共价键,因此属于极性键;
(3)①MgCl2是离子化合物,Mg2+与2个Cl-之间以离子键结合,存在离子键;
②Na2O2是离子化合物,2个Na+与以离子键结合,在中2个O原子之间以非极性共价键结合,故Na2O2中存在离子键、非极性共价键;
③CS2是由CS2分子构成的共价化合物,其结构式是S=C=S,分子中存在极性共价键;
④NaOH是离子化合物,Na+与OH-之间以离子键结合,在OH-中H、O原子之间以极性键结合,故NaOH中含有离子键、极性共价键;
⑤H2是由分子构成的非金属单质,在H2中2个H原子之间以非极性键H-H键结合,故其中只含非极性键。
综上所述可知:只存在极性键的物质序号是③;只存在非极性键的物质序号是⑤;只存在离子键的物质序号是①;既存在离子键又存在极性共价键的物质序号是④;既存在离子键又存在非极性共价键的是②。
17.(1) 467 249
(2) 弱 长
(3) 小 H2O分子中孤对电子对成键电子对的排斥作用大于H3O+中孤对电子对成键电子对的排斥作用
【详解】(1)原子半径:N>O>F,原子半径越小,键长越短,键能越大,所以O-H键的键能应介于N-H键和F-H键之间,N-H键键能为391kJ/mol,F-H键的键能为565kJ/mol,因此O-H键的键能为467kJ/mol;电解水的化学方程式为:2H2O2H2↑+O2↑,根据表中数据计算,电解1molH2O,需要吸收的能量为:(4672-463-0.5498)kJ=249kJ。
(2)氧的电负性小于氟,所以O-H键极性比F-H键极性弱;氧的原子半径比氟大,原子半径越小,键长越短,则O-H键的键长比F-H键的键长长。
(3)H2O中氧原子的价电子对数为2+(6-21)=4,有2对孤对电子,H3O+中氧原子的价电子对数为3+(6-1-31)=4,有1对孤对电子,H2O分子中孤对电子对成键电子对的排斥作用大于H3O+中孤对电子对成键电子对的排斥作用,所以H2O中H-O-H键的键角比H3O+中的小。
18.(1)①②③
(2) D B A C
(3) 8 2 4 有
【详解】(1)形成的化学键属于轴对称的有:两个s轨道以头碰头方式发生重叠形成稳定的σ键,s轨道与p轨道以头碰头方式发生重叠形成稳定的σ键,两个p轨道以头碰头方式发生重叠形成稳定的σ键;故选①②③。
(2)方式①两个s轨道以头碰头方式发生重叠形成稳定的σ键,故为氢气,选D;
方式②s轨道与p轨道以头碰头方式发生重叠形成稳定的σ键,,故为氯化氢,选B;
方式③两个p轨道以头碰头方式发生重叠形成稳定的σ键,故为氯气,选A;
同时含有③、④、⑤三种方式化学键的物质是氮气,两个氮原子通过2p轨道形成σ键,同时两外p轨道以肩并肩的方式形成2个π键,选C。
(3)中存在碳氢键、碳碳双键、碳碳键、碳氧双键、碳氧键、氢氧键,在一个该分子中有8个σ键,碳碳双键、碳氧双键中有2个π键,碳氢键、碳氧双键、碳氧键、氢氧键中有4种极性键,碳碳单键中有非极性键。
19.(1) 120° > 522kJ
(2) C
【详解】(1)①石墨烯是由碳原子构成的单层片状结构的新材料,可由石墨剥离而成,其中碳原子采取sp2杂化,形成平面六元并环结构,其中碳碳键的键角为120°;答案为:120°。
②i.由于C原子半径小于Si原子半径,则键长:Si—Si键大于Si—C键,键能:Si—Si键小于Si—C键,故x>226kJ/mol;答案为:>。
ii.Si燃烧反应的化学方程式为Si+O2SiO2,根据 H=反应物的键能总和-生成物的键能总和,则该反应的 H=2E(Si—Si)+E(O=O)-4E(Si—O)=2×226kJ/mol+498kJ/mol-4×368kJ/mol=-522kJ/mol,即1molSi完全燃烧放出的热量约为522kJ;答案为:522kJ。
(2)基态N原子的核外电子排布式为1s22s22p3,基态F原子的核外电子排布式为1s22s22p5;由于N2F2存在顺式和反式两种同分异构体,故两个N原子间形成氮氮双键,N2F2的结构式可表示为F—N=N—F,双键中含一个σ键、一个π键,即两个氮原子之间的键型组成为一个σ键、一个π键,选C;顺式结构中两个F原子在双键的同一侧,顺式异构体的结构式为;答案为:C,。
答案第1页,共2页
答案第1页,共2页
一、单选题,共15小题
1.(21-22高二·全国·课时练习)下列有机化合物中σ键与π键个数比为3∶2的是
A.CH3CH3 B.CH2=CH2
C.CH≡CH D.CH4
2.(22-23高三上·江苏苏州·期末)实验室可由与反应制备。下列说法正确的是
A.半径大小: B.电负性大小
C.电离能大小: D.键角大小:
3.(20-21高二·全国·课后作业)下列关于键和键的说法中,错误的是
A.键的电子云图形是轴对称的,键的电子云图形是镜面对称的
B.键是原子轨道“头碰头”式重叠,键是原子轨道“肩并肩”式重叠
C.两个p轨道不能形成键,只能形成键
D.H只能形成键,O可以形成键和键
4.(23-24高二上·辽宁沈阳·阶段练习)下列化学用语或图示表达错误的是
A.砷原子的简化电子排布式为:
B.的电子式为
C.铝原子最高能级的电子云轮廓图:
D.HCl的键电子云图:
5.(22-23高二上·重庆北碚·阶段练习)通常把原子总数和价电子总数相同的分子或离子称为等电子体,人们发现等电子体的空间结构相同。下列说法,认识错误的有几个
①s-s键与p-p键的电子云对称性不同
②1个N原子最多只能与3个H原子结合形成分子,是由共价键的饱和性决定的
③、、中碳原子间成键键长相同
④两个非金属原子之间形成的化学键都是共价键
⑤1个分子中含有11个键
⑥与互为等电子体,空间结构均为V形
A.1个 B.2个 C.3个 D.4个
6.(21-22高二上·吉林长春·期末)氰气的化学式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似。下列说法正确的是
A.不和氢氧化钠溶液发生反应
B.分子中N≡C的键长大于C-C的键长
C.分子中含有两个σ键和四个π键
D.分子中既有极性键又有非极性键
7.(23-24高三上·江苏·阶段练习)前四周期主族元素X、Y、Z、Q的原子序数依次增大,基态X原子核外电子占据两种形状不同的原子轨道,且两种轨道中电子总数相等,Q与X处于同一主族。Y的周期序数与族序数相等,Z的第二电离能远小于第三电离能。下列说法正确的是
A.电负性: B.最高价氧化物对应水化物的碱性:Y<Z
C.Z的氯化物是工业漂白粉的有效成分 D.X形成的氢化物中只有极性共价键
8.(20-21高二下·江苏南通·期中)法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法正确的是
A.该分子中N、O、F的第一电离能大小顺序为F>N>O
B.该分子中C—N键的键能大于C—F键的键能
C.该分子中σ键与π键数目之比为7:2
D.该分子中存在手性碳原子
9.(23-24高二上·浙江湖州·期末)下列结论正确,且能用键能解释的是
化学键
键能 411 318 799 358 346 222
A.键角: B.键长:
C.稳定性: D.电负性:
10.(22-23高二下·新疆巴音郭楞·期末)共价键参数:键能,键长,键角。其中,决定共价键强弱的重要参数是
A.键长和键角 B.键能和键角 C.键能和键长 D.键能、键长和键角
11.(23-24高二上·黑龙江大庆·期末)关于σ键和π键的说法中正确的是
A.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
B.所有σ键的强度都比π键的强度大
C.HCl和Cl2中的共价键类型均为s-sσ键
D.杂化轨道只用于形成σ键
12.(23-24高二上·重庆·期末)含有极性键且分子中各原子都满足8电子稳定结构的化合物是
A.CH4 B.CH2=CH2 C.CS2 D.N2
13.(23-24高二上·浙江绍兴·期末)下列说法不正确的是
A.H只能形成键,O可以形成键和键
B.氧原子可以形成、,也可以形成
C.共价键的成键原子可以是非金属原子也可以是金属原子
D.键和键的电子云形状的对称性相同
14.(23-24高二上·陕西西安·期中)下列表述正确的是
A.共价键的成键原子只能是非金属原子
B.所有σ键都比π键强度大
C.所有分子中均存在共价键
D.键长是构成化学键两个原子的核间距
15.(23-24高二上·云南昆明·阶段练习)下列关于共价键的叙述,正确的是
A.键键能一定比键键能大,且键与键电子云均为镜面对称
B.键的键长比键长,键的键能是键的两倍
C.分子中有键不一定有键,有键则一定有键
D.含有键的数目为
二、非选择题,共4小题
16.(21-22高二上·海南儋州·期末)按要求回答问题
(1)1 mol HCHO分子中含有σ键的数目为 NA。
(2)CS2分子中,共价键的类型有 。
(3)下列物质中:①MgCl2;②Na2O2; ③CS2 ;④NaOH; ⑤H2,只存在极性键的是 (填序号,下同),只存在非极性键的是 ,只存在离子键的是 ,既存在离子键又存在极性共价键的是 ,既存在离子键又存在非极性共价键的是 。
17.(21-22高二下·宁夏银川·阶段练习)下表是一些常见共价键的键能,其中键百位数被污渍遮住了,请回答下列问题:
共价键
键能/ 436 391 67 565 498
(1)键键能为 ,根据表中数据计算,电解水,需要吸收 kJ能量。
(2)键极性比键极性 (强/弱),键键长比键键长 (长/短)。
(3)中的键键角比中的 (大/小),原因是 。
18.(21-22高二·全国·课时练习)如图表示不同类型共价键形成时电子云重叠情况:
(1)其中形成的化学键属于轴对称的有 。
(2)下列物质中,通过方式①化学键形成的是 ;通过方式②化学键形成的是 ;只通过方式③化学键形成的是 ;同时含有③、④、⑤三种方式化学键的物质是 。
A.Cl2 B.HCl C.N2 D.H2
(3)某有机物分子的结构简式为,该分子中有 个σ键,有 个π键,有 种极性键, (填“有”或“没有”)非极性键。
19.(20-21高二下·北京海淀·期末)回答下列问题:
(1)石墨烯是一种零距离半导体,而且有非常好的热传导性能,是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有很好应用前景。
①石墨烯中碳碳键的键角为 。
②已知几种常见化学键的键能如表:
化学键 Si—O H—O O=O Si—Si Si—C
键能/kJ·mol-1 368 467 498 226 x
i.比较Si—Si键与Si—C键的键能大小:x (填“>”“<”或“=”)226kJ·mol-1。
ii.H2被誉为21世纪人类最理想的燃料,而更有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。已知1mol单质硅含有2molSi—Si键,1molSiO2含4molSi—O键,试计算:1molSi完全燃烧放出的热量约为 。
(2)立体异构是有机化合物和无机化合物中都存在的同分异构现象。N2F2存在顺式和反式两种同分异构体,据此事实,判断N2F2分子中两个氮原子之间的键型组成为 。
A.仅有一个σ键 B.仅有一个π键 C.一个σ键,一个π键 D.两个σ键
写出N2F2分子的顺式异构体的结构式 。
中小学教育资源及组卷应用平台
试卷第1页,共3页
21世纪教育网(www.21cnjy.com)
参考答案:
1.C
【详解】A.CH3CH3中有7个σ键,没有π键,故A不符合题意;
B.CH2=CH2中有5个σ键,1个π键,故B不符合题意;
C.CH≡CH中有3个σ键,2个π键,故C符合题意;
D.CH4中有4个σ键,没有π键,故D不符合题意。
综上所述,答案为C。
2.A
【详解】A.电子层结构相同的离子,核电荷数越大,离子半径越小,则氯离子的离子半径大于钙离子,故A正确;
B.元素的非金属性越强,电负性越大,氧元素的非金属性强于氢元素,电负性大于氢元素,故B错误;
C.同周期元素,从左到右第一电离能呈增大趋势,氮原子的2p轨道为稳定的半充满结构,元素的第一电离能大于相邻元素,则氮元素的第一电离能大于氧元素,故C错误;
D.孤对电子对数越多,对成键电子对的斥力越大,键角越小,铵根离子和氨分子的孤对电子对数分别为0和1,则铵根离子的键角大于氨分子,故D错误;
故选A。
3.C
【详解】A.σ键的电子云图形以形成共价键的两原子核的连线为轴作旋转操作,共价键的电子云图形不变,为轴对称,π键电子云由两块组成,分别位于由原子核构成平面的两侧,为镜面对称,A正确;
B.σ键电子云重叠程度较大,以头碰头方式重叠,π键电子云重叠程度较小,以肩并肩方式重叠,B正确;
C.两个p轨道可以以头碰头方式形成σ键,也可以以肩并肩方式形成π键,C错误;
D.H原子只有1个电子,位于1s轨道上,电子云形状为球形,和其他原子形成共价键时,只能以头碰头方式重叠,即只能形成σ键,O原子p轨道上的价电子,可以以头碰头方式形成σ键,也可以以肩并肩方式形成π键,D正确;
故答案选C。
4.A
【详解】A.漏写3d能级上的电子,砷原子的简化电子排布式为:[Ar]3d104s24p3,故A错误;
B.CaO2由Ca2+、通过离子键构成,过氧根离子内氧原子与氧原子共用一对电子,则电子式为,故B正确;
C.Al原子最高能级为3p能级,3p能级上的电子云呈哑铃形,铝原子最高能级的电子云轮廓图:,故C正确;
D.s轨道为球形,p轨道为哑铃形,HCl的键的电子云图为,故D正确;
故选:A。
5.C
【详解】①键的特征是轴对称,s-s键与p-p键的电子云图形均是轴对称,①错误;
②共价键具有饱和性,1个N原子最多只能与3个H原子结合形成分子,是由共价键的饱和性决定的,②正确;
③化学键的键长与键能相关,键能越大,键长越小,C-C、C=C、C≡C的键能不同,键长也不同,③错误;
④非金属原子都不易失去电子,非金属原子间形成化学键时,均会通过共用电子对结合,形成共价键,④正确;
⑤共价单键是键,共价双键、共价三键中均有一个键是键,故1个该分子中含有21个键,⑤错误;
⑥与原子总数均是3,价电子总数均是18,互为等电子体,二者空间结构相似,均是V形,⑥正确;
上述认识中错误的有①③⑤三个,故选C。
6.D
【详解】A.氰气性质与卤素相似,能和氢氧化钠溶液发生反应,故A错误;
B.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其键长越长,碳原子半径大于氮原子,所以氰分子中键长小于键长,故B错误;
C.单键均为σ键,双键中含有1个σ键1个π键,叁键含有1个σ键2个π键;该分子的结构式为,该分子中含有3个键4个键,故C错误;
D.同种原子间形成非极性键,不同原子形成极性键,该分子的结构式为,分子中既有极性键,又有非极性键,故D正确;
故选D。
7.B
【分析】前四周期主族元素X、Y、Z、Q的原子序数依次增大,基态X原子核外电子占据两种形状不同的原子轨道,且两种轨道中电子总数相等,则X的电子排布式为1s22s22p4,X为O元素;Q与X处于同一主族,则Q为Se元素;Y的周期序数与族序数相等,则Y为Al元素;Z的第二电离能远小于第三电离能,则Z的价电子数为2,其为Ca元素。从而确定X、Y、Z、Q分别为O、Al、Ca、Se。
【详解】A.X、Q分别为O、Se,二者属于同主族元素,非金属性O>Se,非金属性越强,电负性越大,则电负性:,A不正确;
B.Y、Z分别为Al、Ca,金属性Al<Ca,则最高价氧化物对应水化物的碱性:Al(OH)3<Ca(OH)2,B正确;
C.Z的氯化物为CaCl2,工业漂白粉的有效成分为Ca(ClO)2,C不正确;
D.X形成的氢化物H2O2中,既含极性共价键又含非极性共价键,D不正确;
故选B。
8.A
【详解】A.同周期元素的第一电离能从左到右有增大的趋势,但ⅡA族和ⅤA族的元素达到全满或半满状态,所以N、O、F的第一电离能由大到小的顺序为F>N>O,A正确;
B.分子中C-H键的键能与C-F键的键能比较,可以根据键长的大小来判断,具体来说就是根据相结合的两个原子的半径来比较,半径越小键能越大,两个化学键都含有C原子,F原子的半径大于H原子的,所以C-H键的键能大于C-F键的键能,B正确;
C.该分子中键与键数目之比为15:4,C错误;
D.手性碳原子一定是饱和碳原子,所连接的四个基团要是不同的,该有机物中没有饱和的碳原子,故D错误;
故选A。
9.C
【详解】A.是正四面体形,键角为109°28′,是直线形,键角为108°,与键能无关,故A不选;
B.键能越大,键长越短,键能大于,所以键长:,故B不选;
C.键能越大越稳定,C-H键能大于Si-H,所以稳定性:,故C选;
D.电负性与键能无关,故D不选;
故选C。
10.C
【详解】键能指气态基态原子形成1mol化学键释放的最低能量,键能越大,意味着化学键越稳定,越不容易被破坏。键长是形成共价键的两个原子之间的核间距,键长越短,往往键能越大,共价键越稳定。键能和键长是决定共价键强弱的重要参数。当物质分子内有多个化学键时,化学键之间的夹角叫键角,它反映了分子内原子的空间分布情况,因此键角是描述分子空间结构的重要参数,故答案为C。
11.A
【详解】A.σ键为轴对称,π键为镜面对称,所以σ键可以绕键轴旋转,π键一定不能绕键轴旋转,A正确;
B.σ键不一定比π键强度大,如氮气中σ键的强度比π键强度小,B错误;
C.H-Cl是氢原子1s轨道与氯原子3p轨道“头碰头”形成的,是s-pσ键,C错误;
D.杂化轨道可用于形成σ键或用于容纳未参与成键的孤电子,D错误;
答案选A。
12.C
【详解】A.CH4分子中存在C-H极性键;CH4中C元素化合价为-4,C原子最外层电子数为4,所以|-4|+4=8,分子中C原子满足8电子结构;H原子不满足8电子结构,不符合题意,故A不选;
B.CH2=CH2分子中C-H为极性键;CH2=CH2分子中H原子不满足8电子结构,不符合题意,故B不选;
C.CS2的结构式为S=C=S,符合4+4=8,则分子中所有原子均满足8电子稳定结构,且只含C、S之间的极性键,符合题意,故C选;
D.N2分子中存在N≡N非极性键;N原子满足8电子稳定结构,但是N2是单质,不是化合物,且只含非极性键,不符合题意,故D不选;
故选:C。
13.B
【详解】A.氢原子只有一个s轨道,只能形成键,O有s轨道和p轨道,可以形成键和键,故A正确;
B.氧原子可以形成H2O、H2O2,也可以形成H3O+,但不能形成H3O,故B错误;
C.共价键的成键原子可以是非金属原子也可以是金属原子,如AlCl3中Al原子与Cl原子之间形成的是共价键,故C正确;
D.σ键有方向性,两个成键原子必须沿着对称轴方向接近才能达到最大重叠,故s-sσ键与s-pσ键的电子云形状对称性相同,故D正确;
故答案为:B。
14.D
【详解】A.共价键的成键原子可以是金属原子,如AlCl3中Al原子和Cl原子之间是共价键,A错误;
B.在N2中,σ键的强度比π键的小,B错误;
C.分子晶体中不一定都存在共价键,如稀有气体为单原子分子,分子中不存在共价键,所以形成的晶体中不存在共价键,C错误;
D.键长是构成化学键两个原子的核间距,D正确;
故答案为:D。
15.C
【详解】A.键为“头碰头”方式重叠形成的,为轴对称,键为“肩并肩”方式重叠形成的,为镜面对称,A错误;
B.键的键长比键长,键的键能大于键的键能且小于其两倍,B错误;
C.键能单独存在,而键不能单独存在;分子中有键不一定有键,有键则一定有键,C正确;
D.氮氮三键中含有1个键和2个键,含有键的数目为,D错误;
故选C。
16.(1)3NA
(2)极性键
(3) ③ ⑤ ① ④ ②
【详解】(1)HCHO结构式是,共价单键都是σ键,共价双键中一个是σ键,一个是π键,可见1个HCHO分子中含有3个σ键,则在1 mol HCHO分子中含有σ键的数目为3NA;
(2)CS2是由分子构成,在1个CS2分子中C原子与2个S原子形成4个共价键,结构式是S=C=S,C=S键是两种不同的非金属元素的原子形成的共价键,因此属于极性键;
(3)①MgCl2是离子化合物,Mg2+与2个Cl-之间以离子键结合,存在离子键;
②Na2O2是离子化合物,2个Na+与以离子键结合,在中2个O原子之间以非极性共价键结合,故Na2O2中存在离子键、非极性共价键;
③CS2是由CS2分子构成的共价化合物,其结构式是S=C=S,分子中存在极性共价键;
④NaOH是离子化合物,Na+与OH-之间以离子键结合,在OH-中H、O原子之间以极性键结合,故NaOH中含有离子键、极性共价键;
⑤H2是由分子构成的非金属单质,在H2中2个H原子之间以非极性键H-H键结合,故其中只含非极性键。
综上所述可知:只存在极性键的物质序号是③;只存在非极性键的物质序号是⑤;只存在离子键的物质序号是①;既存在离子键又存在极性共价键的物质序号是④;既存在离子键又存在非极性共价键的是②。
17.(1) 467 249
(2) 弱 长
(3) 小 H2O分子中孤对电子对成键电子对的排斥作用大于H3O+中孤对电子对成键电子对的排斥作用
【详解】(1)原子半径:N>O>F,原子半径越小,键长越短,键能越大,所以O-H键的键能应介于N-H键和F-H键之间,N-H键键能为391kJ/mol,F-H键的键能为565kJ/mol,因此O-H键的键能为467kJ/mol;电解水的化学方程式为:2H2O2H2↑+O2↑,根据表中数据计算,电解1molH2O,需要吸收的能量为:(4672-463-0.5498)kJ=249kJ。
(2)氧的电负性小于氟,所以O-H键极性比F-H键极性弱;氧的原子半径比氟大,原子半径越小,键长越短,则O-H键的键长比F-H键的键长长。
(3)H2O中氧原子的价电子对数为2+(6-21)=4,有2对孤对电子,H3O+中氧原子的价电子对数为3+(6-1-31)=4,有1对孤对电子,H2O分子中孤对电子对成键电子对的排斥作用大于H3O+中孤对电子对成键电子对的排斥作用,所以H2O中H-O-H键的键角比H3O+中的小。
18.(1)①②③
(2) D B A C
(3) 8 2 4 有
【详解】(1)形成的化学键属于轴对称的有:两个s轨道以头碰头方式发生重叠形成稳定的σ键,s轨道与p轨道以头碰头方式发生重叠形成稳定的σ键,两个p轨道以头碰头方式发生重叠形成稳定的σ键;故选①②③。
(2)方式①两个s轨道以头碰头方式发生重叠形成稳定的σ键,故为氢气,选D;
方式②s轨道与p轨道以头碰头方式发生重叠形成稳定的σ键,,故为氯化氢,选B;
方式③两个p轨道以头碰头方式发生重叠形成稳定的σ键,故为氯气,选A;
同时含有③、④、⑤三种方式化学键的物质是氮气,两个氮原子通过2p轨道形成σ键,同时两外p轨道以肩并肩的方式形成2个π键,选C。
(3)中存在碳氢键、碳碳双键、碳碳键、碳氧双键、碳氧键、氢氧键,在一个该分子中有8个σ键,碳碳双键、碳氧双键中有2个π键,碳氢键、碳氧双键、碳氧键、氢氧键中有4种极性键,碳碳单键中有非极性键。
19.(1) 120° > 522kJ
(2) C
【详解】(1)①石墨烯是由碳原子构成的单层片状结构的新材料,可由石墨剥离而成,其中碳原子采取sp2杂化,形成平面六元并环结构,其中碳碳键的键角为120°;答案为:120°。
②i.由于C原子半径小于Si原子半径,则键长:Si—Si键大于Si—C键,键能:Si—Si键小于Si—C键,故x>226kJ/mol;答案为:>。
ii.Si燃烧反应的化学方程式为Si+O2SiO2,根据 H=反应物的键能总和-生成物的键能总和,则该反应的 H=2E(Si—Si)+E(O=O)-4E(Si—O)=2×226kJ/mol+498kJ/mol-4×368kJ/mol=-522kJ/mol,即1molSi完全燃烧放出的热量约为522kJ;答案为:522kJ。
(2)基态N原子的核外电子排布式为1s22s22p3,基态F原子的核外电子排布式为1s22s22p5;由于N2F2存在顺式和反式两种同分异构体,故两个N原子间形成氮氮双键,N2F2的结构式可表示为F—N=N—F,双键中含一个σ键、一个π键,即两个氮原子之间的键型组成为一个σ键、一个π键,选C;顺式结构中两个F原子在双键的同一侧,顺式异构体的结构式为;答案为:C,。
答案第1页,共2页
答案第1页,共2页
