4.3氧气(2课时)学案(无答案) 初中化学 鲁教版 九年级上册
文档属性
| 名称 | 4.3氧气(2课时)学案(无答案) 初中化学 鲁教版 九年级上册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-15 09:30:29 | ||
图片预览


文档简介
第三节 氧气
第一课时 氧气的实验室制法
【学习目标】
1.学会制取氧气的方法,学习巩固装置气密性的检查、药品的取用、气体的收集方法等实验基本操作。
2.了解催化剂概念,培养人为改变化学反应速率、改造自然的意识。
3.通过催化剂的探究学习,体会一切现成的方法都是通过尝试和探究得到的。
【教学重点】
氧气的实验室制法。
【教学难点】
实验方案的选择。
【学习过程】
【探究点1】实验室制取气体物质的思路分析
【知识回顾】工业上制备大量的氧气一般采用分离__ __的方法,其原理是利用液态氮和液态氧的__ _不同将它们分离。属于__ _变化;电解水也可以得到氧气,反应的文字表达式是 ___,但是反应需要消耗大量的电能,且反应很慢。
我会自学:阅读教材P87,探究实验室制取氧气的思路。
一、反应原理
1.药品的选择
你认为下列哪些物质不能作为实验室制取氧气的反应物 ;依据是什么:_ _。
①水(H2O) ②二氧化碳(CO2) ③氯化钠(NaCl) ④高锰酸钾(KMnO4) ⑤过氧化氢(H2O2) ⑥甲烷(CH4)
2.反应表达式
二、用过氧化氢制取氧气装置的选择
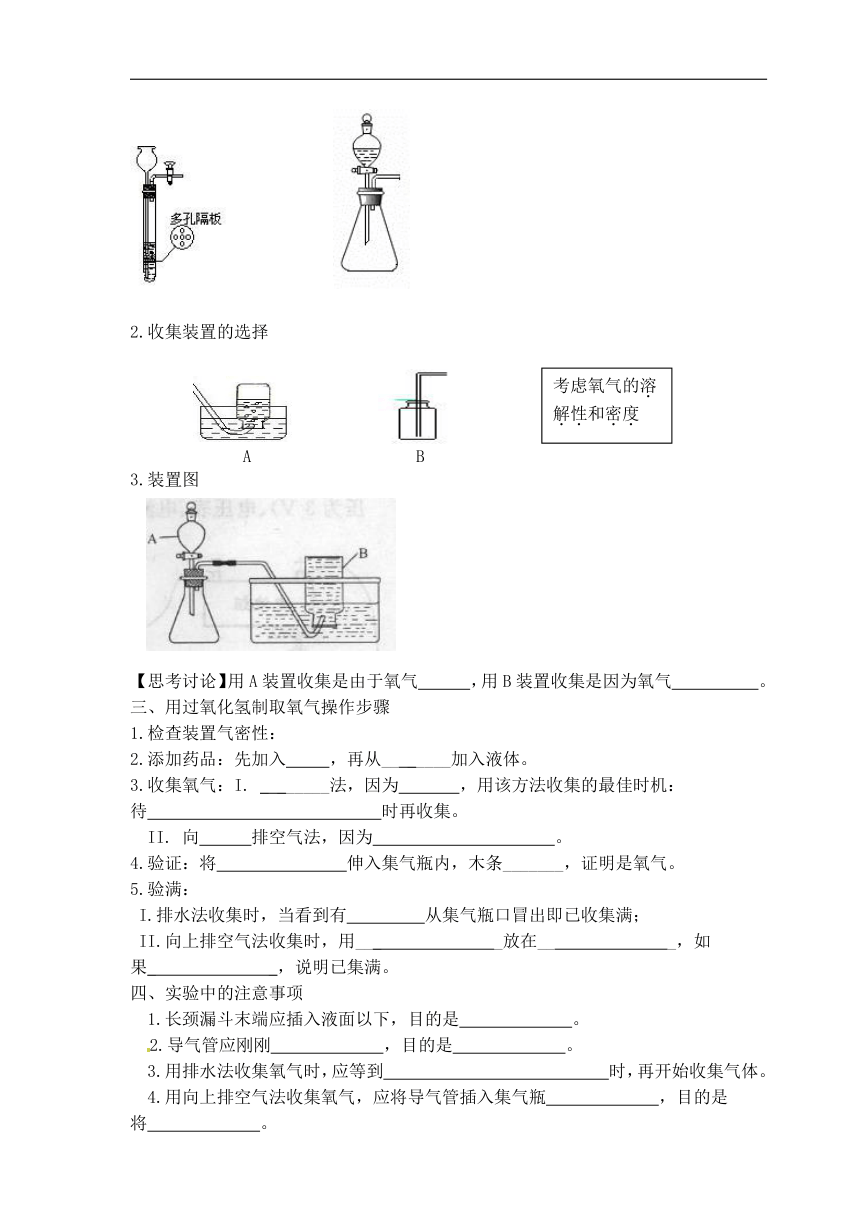
1.发生装置的选择
发生装置:如图所示 填写仪器名称①__ _②___ _
2.收集装置的选择
21教育网
A B
3.装置图
【思考讨论】用A装置收集是由于氧气 ,用B装置收集是因为氧气 。
三、用过氧化氢制取氧气操作步骤
1.检查装置气密性:
2.添加药品:先加入 ,再从__ _____加入液体。
3.收集氧气:I. _ ______法,因为 ,用该方法收集的最佳时机:
待 时再收集。
II. 向 排空气法,因为 。
4.验证:将 伸入集气瓶内,木条_______,证明是氧气。
5.验满:
I.排水法收集时,当看到有 从集气瓶口冒出即已收集满;
II.向上排空气法收集时,用___ _放在__ _,如
果_ _,说明已集满。
四、实验中的注意事项
1.长颈漏斗末端应插入液面以下,目的是 。
2.导气管应刚刚 ,目的是 。
3.用排水法收集氧气时,应等到 时,再开始收集气体。
4.用向上排空气法收集氧气,应将导气管插入集气瓶 ,目的是将 。
5.收集满氧气的集气瓶应 在桌上,因为氧气的密度比空气大。
【探究点2】:催化剂
取A、B、C、三支试管,分别加入3ml~5ml的15%过氧化氢溶液
加入物质 操作 现象
产生气体速率 能否使带火星的木条复燃
A 5%的过氧化氢 将带火星的木条伸入试管口 慢
B 加热5%的过氧化氢 将带火星的木条伸入试管口 慢
C 5%的过氧化氢中加入少量二氧化锰 将带火星的木条伸入试管口
通过实验总结
你认为最适合于在实验室制取氧气的做法是 。
小资料:1.将反应后的二氧化锰过滤、干燥、称量,发现二氧化锰的质量不发生改变 。2.将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。该资料说明 。
小结:能 其他物质的化学反应速率,本身的 和 在反应前后不变的物质叫做催化剂。
【课堂小结】通过本节课的学习,你收获了什么?
【练习反馈】
1.下列物质中含有氧气的是( )
A.过氧化氢 B.空气 C.高锰酸钾 D.二氧化锰
2.下列关于催化剂的说法正确的是( )
A.在化学反应中质量减少
B.催化剂一定能加快化学反应的速率
C.过氧化氢中加入少量二氧化锰能增加产生氧气的总量
D.催化剂在化学反应中化学性质没有发生变化
3. 一氧化氮是汽车尾气中的一种大气污染物,它是无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的二氧化氮,在实验室制取一氧化氮时,应采用的收集方法是( )
A.向上排空气法 B.排水集气法
C.向下排空气法 D.排水集气法或向上排空气法
4.如图是实验室制取气体的几种发生装置和收集装置。请回答下列问题:
(1)写出标号①的仪器名称_ ________。
(2)实验室用双氧水和二氧化锰制取氧气时,应选用的发生装置是___ __(填字母),写出该反应的符号表达式为_。二氧化锰的质量在反应前后__ ___(填“变大” “变小”或“不变”)。
(3)连接好仪器,加入药品开始反应前,需要__ __。
(4)用C装置收集氧气时,验满的方法为__ __ __ __ 。
(5)将右侧E和F装置连接,可以测量收集氧气的体积,氧气应从____(填“a”或“b”)口通入。
5.如图是实验室制取气体的常用装置。请回答下列问题:
(1)指出图中标有数字的仪器名称:① ______;②______。
(2)实验室用双氧水和二氧化锰制取氧气时应选用_______(填字母标号,下同)发生装置,写出该反应的符号表达式:___________________________。
第三节 氧气
第二课时 氧气的实验室制法
【素养目标】
1.能结合实例说明氧气的主要性质,知道氧气能跟许多物质发生氧化反应。并能从元素组成上认识氧化物。
2.了解自然界中的氧循环和碳循环,感悟氧循环对人类的重要意义。
3.会观察并描述实验现象,分析实验现象获得结论;在探究中获得研究气体性质 的一般思路和方法。
【教学重点】
初步掌握氧气的化学性质及对实验现象的准确描述。
【教学难点】
认识氧气与常见物质的氧化反应。
【学习过程】
【探究点1】认识氧气的物理性质:观察一瓶氧气,归纳氧气的物理性质,填写教材89页表格。
颜色 气味 状态 密度 溶解性
______ ______ ______ ______ ______
【探究点2】探究氧气的化学性质
1.物质与氧气的反应
反应物 实验操作 现象 反应文字表达式
木炭 用坩埚钳夹一块木炭,在酒精灯上加热至燃烧;然后将木炭插入盛氧气的集气瓶;等燃烧停止后,向集气瓶中加入少量澄清的石灰水并振荡。观察现象。 木炭是________色___________体,在空气中燃烧发出_______光。在氧气中燃烧,发出_________,用手摸瓶壁_______。注入澄清石灰水,澄清的石灰水___________。 __________________
铁丝 铁丝绕成螺旋状,在酒精灯上加热,观察现象。把红热的铁丝插入有氧气的集气瓶中(瓶中预先加少量水或细沙),观察现象。 铁丝在酒精灯上加热观察到的现象是_________。 铁丝在氧气中________燃烧,_________,放出大量的_________生成___ _色固体。注:瓶底部预先加少量水或铺一层细沙,目的是________ __________________
蜡烛 点燃一根蜡烛,观察并记录蜡烛在空气中和氧气中燃烧的现象 蜡烛在氧气中燃烧比在空气中燃烧_________,发出_______,集气瓶内壁有______出现,用手摸瓶壁______ ______
【小结】氧气的化学性质:氧气是一种化学性质_______的气体,许多物质都可以跟氧气发生化学反应。木碳、铁丝、蜡烛等物质在氧气中燃烧比在空气中燃烧更剧烈,说明物质跟氧气发生化学反应时,单位体积的空间里氧分子数目越多,反应就 ______。
2.氧化物和氧化反应
(1)氧化反应:物质跟_____________发生的化学反应,属于氧化反应。由__________物质生成________物质的化学反应,称为化合反应。氧化反应一定是化合反应吗?_________。化合反应一定是氧化反应吗?______。
注意:氧化反应不是基本反应类型!
(2)氧化物 由__________元素组成的__________,其中一种元素是________。 例如:二氧化碳(CO2)、水(H2O)、四氧化三铁(Fe3O4)。 相对分子质量最小的氧化物的化学式为 。
【探究点3】氧循环和缓慢氧化
[活动天地] 观察下图,看看氧元素在自然界里是怎样循环的?
思考:
1.自然界中氧气产生与消耗的途径主要有哪些?
2.氧气是性质活泼的气体,自然界中很多物质在常温下就能与氧气发生化学反应,缓慢氧化:进行得非常缓慢的 _ 。
例如:钢铁生锈,动植物体腐烂、塑料的老化、酿酒、动植物呼吸等。
为什么大气中氧气的含量没有越来越低呢?
【课堂小结】通过本节课的学习,你收获了什么?
【练习反馈】
1.(2022 青岛)空气是人类赖以生存的物质基础。下列生活现象与空气中的氧气无关的是( )
A.水果腐烂 B.酥脆饼干久置变软
C.木炭燃烧 D.动植物呼吸
2.(2022 娄底)下列有关实验现象的描述,正确的是( )
A.硫在氧气中燃烧,产生淡蓝色火焰,生成无色无味的气体
B.镁在空气中燃烧,产生苍白色火焰,生成白色烟雾
C.红磷在空气中燃烧,发出红色的火焰,产生大量白色烟雾
D.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
3.下列有关实验现象的描述,正确的是( )
A.镁带在空气中燃烧,生成氧化镁
B.红磷在氧气中燃烧,产生大量白雾
C.硫在氧气中燃烧,发出微弱的淡蓝色火焰
D.将燃着的木条伸入盛满呼出气体的集气瓶中,木条熄灭
4. 以下关于燃烧现象的描述,正确的是( )
A.铁丝在空气中燃烧火星四射
B.蜡烛在氧气中燃烧发出红光
C.镁带在空气中燃烧发出耀眼的白光
D.红磷在氧气中燃烧产生大量白雾
5.某同学做物质在氧气中燃烧的实验方法如下图所示,其中不合理的是( )
A.木炭在氧气中燃烧 B.铁丝在氧气中燃烧
C.硫在氧气中燃烧 D.蜡烛在氧气中燃烧
6.关于氧气用途的说法不正确的是( )
A.氧气可用来炼钢
B.氧气可供给动植物呼吸
C.氧气可用于登山或飞行
D.氧气可用来灭火
7.下列变化中,不属于缓慢氧化的是( )
A.光合作用 B.粮食酿酒 C.钢铁生锈 D.木炭燃烧
8.下列物质中,属于氧化物的是( )
A.MnO2 B.NaCl C.NaOH D.H2SO4
第一课时 氧气的实验室制法
【学习目标】
1.学会制取氧气的方法,学习巩固装置气密性的检查、药品的取用、气体的收集方法等实验基本操作。
2.了解催化剂概念,培养人为改变化学反应速率、改造自然的意识。
3.通过催化剂的探究学习,体会一切现成的方法都是通过尝试和探究得到的。
【教学重点】
氧气的实验室制法。
【教学难点】
实验方案的选择。
【学习过程】
【探究点1】实验室制取气体物质的思路分析
【知识回顾】工业上制备大量的氧气一般采用分离__ __的方法,其原理是利用液态氮和液态氧的__ _不同将它们分离。属于__ _变化;电解水也可以得到氧气,反应的文字表达式是 ___,但是反应需要消耗大量的电能,且反应很慢。
我会自学:阅读教材P87,探究实验室制取氧气的思路。
一、反应原理
1.药品的选择
你认为下列哪些物质不能作为实验室制取氧气的反应物 ;依据是什么:_ _。
①水(H2O) ②二氧化碳(CO2) ③氯化钠(NaCl) ④高锰酸钾(KMnO4) ⑤过氧化氢(H2O2) ⑥甲烷(CH4)
2.反应表达式
二、用过氧化氢制取氧气装置的选择
1.发生装置的选择
发生装置:如图所示 填写仪器名称①__ _②___ _
2.收集装置的选择
21教育网
A B
3.装置图
【思考讨论】用A装置收集是由于氧气 ,用B装置收集是因为氧气 。
三、用过氧化氢制取氧气操作步骤
1.检查装置气密性:
2.添加药品:先加入 ,再从__ _____加入液体。
3.收集氧气:I. _ ______法,因为 ,用该方法收集的最佳时机:
待 时再收集。
II. 向 排空气法,因为 。
4.验证:将 伸入集气瓶内,木条_______,证明是氧气。
5.验满:
I.排水法收集时,当看到有 从集气瓶口冒出即已收集满;
II.向上排空气法收集时,用___ _放在__ _,如
果_ _,说明已集满。
四、实验中的注意事项
1.长颈漏斗末端应插入液面以下,目的是 。
2.导气管应刚刚 ,目的是 。
3.用排水法收集氧气时,应等到 时,再开始收集气体。
4.用向上排空气法收集氧气,应将导气管插入集气瓶 ,目的是将 。
5.收集满氧气的集气瓶应 在桌上,因为氧气的密度比空气大。
【探究点2】:催化剂
取A、B、C、三支试管,分别加入3ml~5ml的15%过氧化氢溶液
加入物质 操作 现象
产生气体速率 能否使带火星的木条复燃
A 5%的过氧化氢 将带火星的木条伸入试管口 慢
B 加热5%的过氧化氢 将带火星的木条伸入试管口 慢
C 5%的过氧化氢中加入少量二氧化锰 将带火星的木条伸入试管口
通过实验总结
你认为最适合于在实验室制取氧气的做法是 。
小资料:1.将反应后的二氧化锰过滤、干燥、称量,发现二氧化锰的质量不发生改变 。2.将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。该资料说明 。
小结:能 其他物质的化学反应速率,本身的 和 在反应前后不变的物质叫做催化剂。
【课堂小结】通过本节课的学习,你收获了什么?
【练习反馈】
1.下列物质中含有氧气的是( )
A.过氧化氢 B.空气 C.高锰酸钾 D.二氧化锰
2.下列关于催化剂的说法正确的是( )
A.在化学反应中质量减少
B.催化剂一定能加快化学反应的速率
C.过氧化氢中加入少量二氧化锰能增加产生氧气的总量
D.催化剂在化学反应中化学性质没有发生变化
3. 一氧化氮是汽车尾气中的一种大气污染物,它是无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的二氧化氮,在实验室制取一氧化氮时,应采用的收集方法是( )
A.向上排空气法 B.排水集气法
C.向下排空气法 D.排水集气法或向上排空气法
4.如图是实验室制取气体的几种发生装置和收集装置。请回答下列问题:
(1)写出标号①的仪器名称_ ________。
(2)实验室用双氧水和二氧化锰制取氧气时,应选用的发生装置是___ __(填字母),写出该反应的符号表达式为_。二氧化锰的质量在反应前后__ ___(填“变大” “变小”或“不变”)。
(3)连接好仪器,加入药品开始反应前,需要__ __。
(4)用C装置收集氧气时,验满的方法为__ __ __ __ 。
(5)将右侧E和F装置连接,可以测量收集氧气的体积,氧气应从____(填“a”或“b”)口通入。
5.如图是实验室制取气体的常用装置。请回答下列问题:
(1)指出图中标有数字的仪器名称:① ______;②______。
(2)实验室用双氧水和二氧化锰制取氧气时应选用_______(填字母标号,下同)发生装置,写出该反应的符号表达式:___________________________。
第三节 氧气
第二课时 氧气的实验室制法
【素养目标】
1.能结合实例说明氧气的主要性质,知道氧气能跟许多物质发生氧化反应。并能从元素组成上认识氧化物。
2.了解自然界中的氧循环和碳循环,感悟氧循环对人类的重要意义。
3.会观察并描述实验现象,分析实验现象获得结论;在探究中获得研究气体性质 的一般思路和方法。
【教学重点】
初步掌握氧气的化学性质及对实验现象的准确描述。
【教学难点】
认识氧气与常见物质的氧化反应。
【学习过程】
【探究点1】认识氧气的物理性质:观察一瓶氧气,归纳氧气的物理性质,填写教材89页表格。
颜色 气味 状态 密度 溶解性
______ ______ ______ ______ ______
【探究点2】探究氧气的化学性质
1.物质与氧气的反应
反应物 实验操作 现象 反应文字表达式
木炭 用坩埚钳夹一块木炭,在酒精灯上加热至燃烧;然后将木炭插入盛氧气的集气瓶;等燃烧停止后,向集气瓶中加入少量澄清的石灰水并振荡。观察现象。 木炭是________色___________体,在空气中燃烧发出_______光。在氧气中燃烧,发出_________,用手摸瓶壁_______。注入澄清石灰水,澄清的石灰水___________。 __________________
铁丝 铁丝绕成螺旋状,在酒精灯上加热,观察现象。把红热的铁丝插入有氧气的集气瓶中(瓶中预先加少量水或细沙),观察现象。 铁丝在酒精灯上加热观察到的现象是_________。 铁丝在氧气中________燃烧,_________,放出大量的_________生成___ _色固体。注:瓶底部预先加少量水或铺一层细沙,目的是________ __________________
蜡烛 点燃一根蜡烛,观察并记录蜡烛在空气中和氧气中燃烧的现象 蜡烛在氧气中燃烧比在空气中燃烧_________,发出_______,集气瓶内壁有______出现,用手摸瓶壁______ ______
【小结】氧气的化学性质:氧气是一种化学性质_______的气体,许多物质都可以跟氧气发生化学反应。木碳、铁丝、蜡烛等物质在氧气中燃烧比在空气中燃烧更剧烈,说明物质跟氧气发生化学反应时,单位体积的空间里氧分子数目越多,反应就 ______。
2.氧化物和氧化反应
(1)氧化反应:物质跟_____________发生的化学反应,属于氧化反应。由__________物质生成________物质的化学反应,称为化合反应。氧化反应一定是化合反应吗?_________。化合反应一定是氧化反应吗?______。
注意:氧化反应不是基本反应类型!
(2)氧化物 由__________元素组成的__________,其中一种元素是________。 例如:二氧化碳(CO2)、水(H2O)、四氧化三铁(Fe3O4)。 相对分子质量最小的氧化物的化学式为 。
【探究点3】氧循环和缓慢氧化
[活动天地] 观察下图,看看氧元素在自然界里是怎样循环的?
思考:
1.自然界中氧气产生与消耗的途径主要有哪些?
2.氧气是性质活泼的气体,自然界中很多物质在常温下就能与氧气发生化学反应,缓慢氧化:进行得非常缓慢的 _ 。
例如:钢铁生锈,动植物体腐烂、塑料的老化、酿酒、动植物呼吸等。
为什么大气中氧气的含量没有越来越低呢?
【课堂小结】通过本节课的学习,你收获了什么?
【练习反馈】
1.(2022 青岛)空气是人类赖以生存的物质基础。下列生活现象与空气中的氧气无关的是( )
A.水果腐烂 B.酥脆饼干久置变软
C.木炭燃烧 D.动植物呼吸
2.(2022 娄底)下列有关实验现象的描述,正确的是( )
A.硫在氧气中燃烧,产生淡蓝色火焰,生成无色无味的气体
B.镁在空气中燃烧,产生苍白色火焰,生成白色烟雾
C.红磷在空气中燃烧,发出红色的火焰,产生大量白色烟雾
D.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
3.下列有关实验现象的描述,正确的是( )
A.镁带在空气中燃烧,生成氧化镁
B.红磷在氧气中燃烧,产生大量白雾
C.硫在氧气中燃烧,发出微弱的淡蓝色火焰
D.将燃着的木条伸入盛满呼出气体的集气瓶中,木条熄灭
4. 以下关于燃烧现象的描述,正确的是( )
A.铁丝在空气中燃烧火星四射
B.蜡烛在氧气中燃烧发出红光
C.镁带在空气中燃烧发出耀眼的白光
D.红磷在氧气中燃烧产生大量白雾
5.某同学做物质在氧气中燃烧的实验方法如下图所示,其中不合理的是( )
A.木炭在氧气中燃烧 B.铁丝在氧气中燃烧
C.硫在氧气中燃烧 D.蜡烛在氧气中燃烧
6.关于氧气用途的说法不正确的是( )
A.氧气可用来炼钢
B.氧气可供给动植物呼吸
C.氧气可用于登山或飞行
D.氧气可用来灭火
7.下列变化中,不属于缓慢氧化的是( )
A.光合作用 B.粮食酿酒 C.钢铁生锈 D.木炭燃烧
8.下列物质中,属于氧化物的是( )
A.MnO2 B.NaCl C.NaOH D.H2SO4
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
