中考化学二轮强化提升:流程图(含答案)
图片预览



文档简介
中考化学二轮强化提升:流程图
学校:___________姓名:___________班级:___________考号:___________
一、填空与简答
1.Fe3O4颗粒在磁记录材料、磁流体等领域广泛应用。制备Fe3O4方法如图:
已知:
①“沉淀”时的反应为:2FeCl3+FeCl2+8NH3 H2OFe3O4↓+8NH4Cl+4H2O;
②+2价的铁元素容易被空气中的氧气氧化。
(1)为了加快“溶解”速率,可采取的措施是 ;
(2)若向盐酸酸化的FeCl2溶液中通入O2可生成FeCl3和H2O,该反应的化学方程式为 。
(3)“沉淀”时反应温度不宜过高,需要控制温度为50℃,原因是 。
(4)“溶解”时,实际投放的远大于理论值,原因是 。
2.2024年4月24日是第九个“中国航天日”,今年的主题是“极目楚天,共襄星汉”。近年来,我国航天事业蓬勃发展。钛()被称为航空金属,如图是以钛铁矿【主要成分为钛酸亚铁()】为主要原料冶炼金属钛的生产工艺流程,请回答下列问题。
【查阅资料】在高温条件下,易与空气中的发生反应。
(1)反应①中为了提高酸浸时的反应速率,通常可采取的措施是 。(写出一条即可)
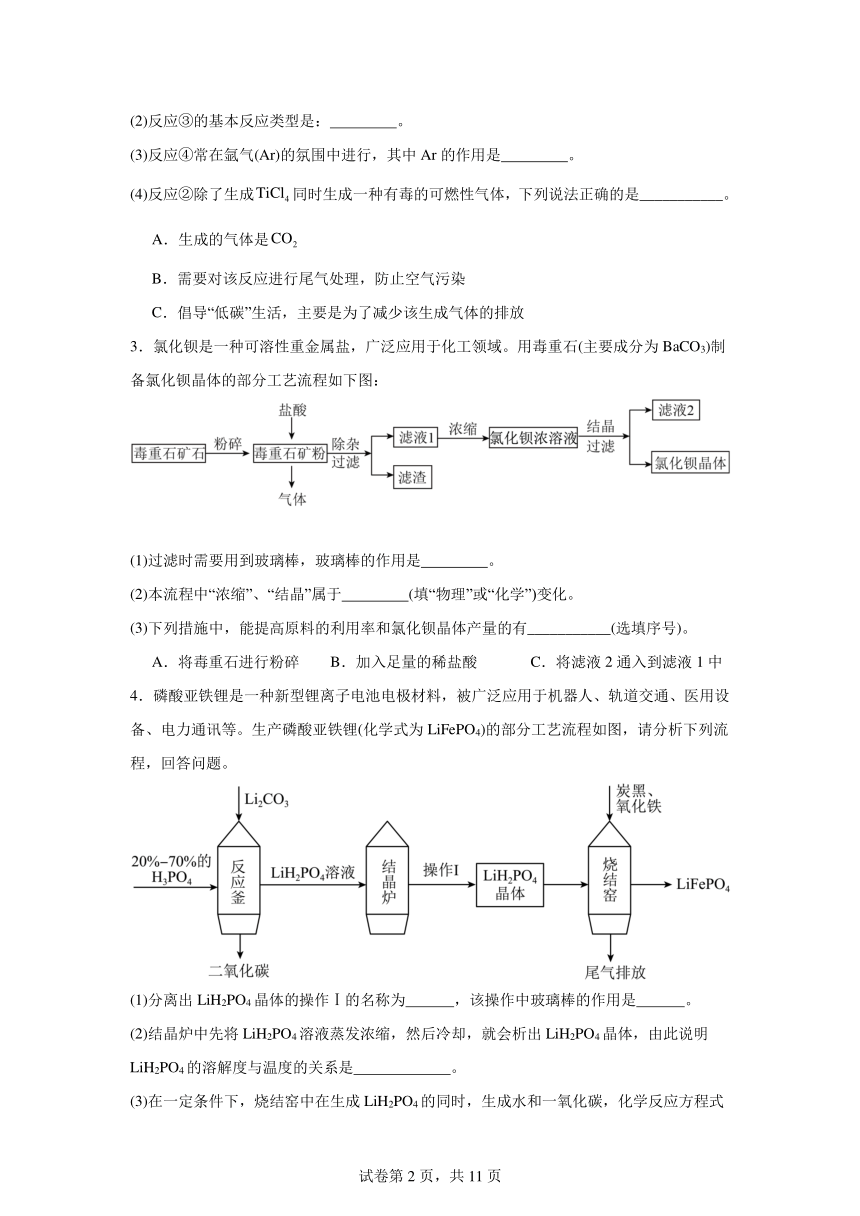
(2)反应③的基本反应类型是: 。
(3)反应④常在氩气(Ar)的氛围中进行,其中Ar的作用是 。
(4)反应②除了生成同时生成一种有毒的可燃性气体,下列说法正确的是___________。
A.生成的气体是
B.需要对该反应进行尾气处理,防止空气污染
C.倡导“低碳”生活,主要是为了减少该生成气体的排放
3.氯化钡是一种可溶性重金属盐,广泛应用于化工领域。用毒重石(主要成分为BaCO3)制备氯化钡晶体的部分工艺流程如下图:
(1)过滤时需要用到玻璃棒,玻璃棒的作用是 。
(2)本流程中“浓缩”、“结晶”属于 (填“物理”或“化学”)变化。
(3)下列措施中,能提高原料的利用率和氯化钡晶体产量的有___________(选填序号)。
A.将毒重石进行粉碎 B.加入足量的稀盐酸 C.将滤液2通入到滤液1中
4.磷酸亚铁锂是一种新型锂离子电池电极材料,被广泛应用于机器人、轨道交通、医用设备、电力通讯等。生产磷酸亚铁锂(化学式为LiFePO4)的部分工艺流程如图,请分析下列流程,回答问题。
(1)分离出LiH2PO4晶体的操作Ⅰ的名称为 ,该操作中玻璃棒的作用是 。
(2)结晶炉中先将LiH2PO4溶液蒸发浓缩,然后冷却,就会析出LiH2PO4晶体,由此说明LiH2PO4的溶解度与温度的关系是 。
(3)在一定条件下,烧结窑中在生成LiH2PO4的同时,生成水和一氧化碳,化学反应方程式为 。从绿色环保的角度分析,该流程的不足之处是 。
5.电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该新方法的示意图如图所示。
(1)传统方法:CaCO3在900℃以上完全分解生成 CaO 和 (填化学式)。
(2)新方法:
i.电解水属于 反应(填基本反应类型),反应前后氢元素的化合价 (填“升高”“降低”或“不变”)。
ii.反应器 1:一定的H2环境及较低温度下CaCO3可与H2反应生成CaO、CO 和H2O。CO与H2O的分子个数比为 。
CaCO3还可以直接分解。反应器 1中 CO、CO2的含量随反应温度的变化如下图所示。 ℃时,抑制 CO2生成的效果最好。
iii.反应器 2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为 。
(3)与传统方法相比,新方法的优点有 (写两条)。
6.制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如下:
(1)“除杂1”应依次加入的两种试剂是 、 ,“除杂2”应加入的试剂是 。(除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2)
(2)将“溶液A”在80℃蒸发浓缩,至有少量固体析出。
①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: 。
②该小组停止蒸发浓缩,经 、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是 。
(3)设计由硫磺(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: 。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
7.(Li2CO3)是制备新能源汽车电池的重要原料。下图是一种模拟提纯碳酸锂的工艺,根据要求回答问题。
【查阅资料】
I.锂辉矿主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3(化学性质Na2CO3类似】为无色晶体,微溶于水,在冷水中的溶解度比热水中大。
(1)X是一种酸。其溶质化学式为 ,常用 (填试剂名称)检验气体Y。
(2)②中发生中和反应的化学方程式为 。
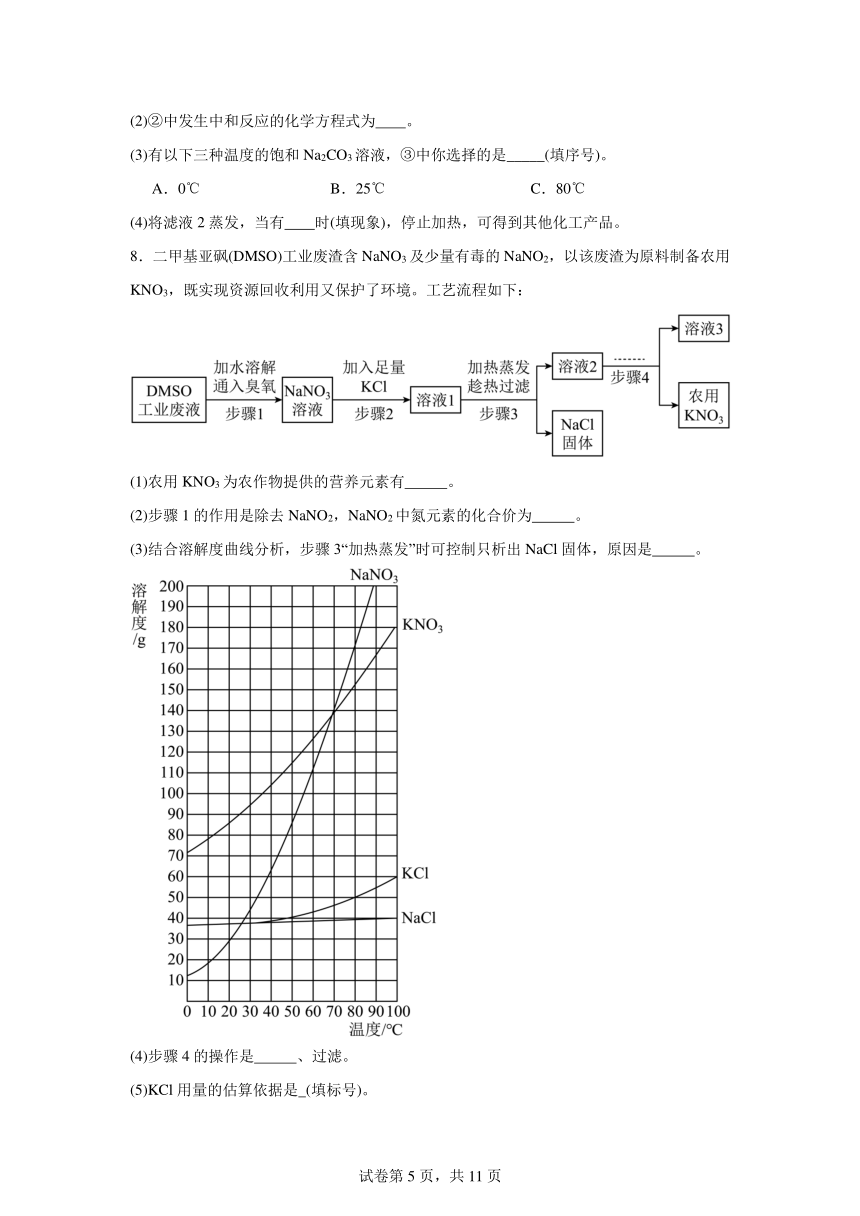
(3)有以下三种温度的饱和Na2CO3溶液,③中你选择的是_____(填序号)。
A.0℃ B.25℃ C.80℃
(4)将滤液2蒸发,当有 时(填现象),停止加热,可得到其他化工产品。
8.二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有 。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为 。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是 。
(4)步骤4的操作是 、过滤。
(5)KCl用量的估算依据是 (填标号)。
A.KCl与NaNO3的粒子个数比为1:1
B.KCl与NaNO3的质量比为1:1
C.KCl与NaNO3在溶液中的质量分数之比为1:1
(6)该工艺所得农用KNO3混有一定量NaCl。取25g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质为14.35g,则样品中杂质NaCl的质量是 g,样品含KNO3 %(质量分数)。
(相对分子质量:KNO3-101 NaCl-58.5 AgNO3-170 AgCl-143.5)
9.柠檬酸亚铁(FeC6H6O7)是一种易被吸收的补血剂。利用硫酸厂的废渣(主要含Fe2O3、Fe3O4,还有少量SiO2)制备柠檬酸亚铁,该工艺流程如图所示,回答下列问题:
资料1:;
资料2:SiO2不溶于水,也不与稀硫酸反应。
(1)柠檬酸亚铁进入人体肠道后以 (填阳离子符号)的形式被吸收,达到补血效果。
(2)固体C的成分是 。
(3)步骤①②③④中涉及置换反应的是 (填数字序号)。
(4)步骤③中发生反应的化学方程式是 。
(5)“一系列操作”中,将柠檬酸亚铁晶体与溶液分离的操作是 。
10.氢气是重要的化工原料。下图是通过热化学循环用硫化氢气体(H2S)制备氢气的模拟工艺流程。
(1)吸收室中生成的S可进一步燃烧为反应室提供SO2,写出该反应的化学方程式 。
(2)HI进入产品室中发生的反应属于 (填基本反应类型)。
(3)写出一种上述流程中可以循环利用的物质 。
(4)硫化氢气体制备氢气时生成两种单质,写出化学方程式 。
11.为了实现碳减排目标,许多国家都在研究二氧化碳的减排措施,其中“碳捕捉和封存”技术是实现这一目标的重要途径之一。工业流程如图所示:
请回答以下有关问题:
(1)捕集——人工固碳:将二氧化碳和水混合注入地下玄武岩中最终形成石头(碳酸盐),此转化方式属于 (填“物理”或“化学)变化。
(2)“捕捉室”中发生反应的化学方程式为 。
(3)进入“反应分离器”中物质A是 (填化学式)。
(4)整个过程中,可以循环使用的物质是 。
二、综合应用题
12.能源、环境、材料、健康已成为人类日益关注的问题,根据所学知识回答下列问题。
(1)水是生态之基、生产之要、生命之源。
①水是一种常用的溶剂,生理盐水(0.9%的氯化钠溶液)可用于医疗注射。生理盐水中主要含有的阴离子是 (用化学用语表示);
②目前很多场所选择使用直饮水,某品牌直饮机工作流程如图所示:
利用炭罐中活性炭颗粒的 性除去自来水中的色素和异味等;直饮机使用方便,只要将其与自来水管对接,截留清除水中的有害物质(如细菌,微生物等)便能得到直饮水,直饮水属于 (填“纯净物”或“混合物”)。
(2)2023年5月28日,我国自行研制的“C919”大型客机成功完成首次商业载客飞行。
①“C919”机身采用了第三代铝锂合金,铝锂合金属于 (填“金属材料”或“合成材料”)。
②为了身体健康,我们必须均衡膳食。本次航班为旅客提供了一款名为“五福临门”的餐食,其中有腊味煲仔饭、三色水果拼盘、牛奶,在上述列举的餐食中,旅客可从 中摄入更多蛋白质。
(3)2023年9月23日晚,杭州亚运会开幕式隆重举行。“绿色、智能、节俭、文明”是杭州亚运会的办会理念。
①点火仪式诠释了“绿色亚运”理念,主火炬塔首次使用了废碳再生的绿色燃料——甲醇(CH3OH)。甲醇是利用工业尾气中排放的废弃二氧化碳以及焦炉气中的氢气合成。合成甲醇的化学反应微观示意图如下,下列说法正确的是 (填字母):
A.甲醇中碳元素的质量分数为40%
B.参加反应的甲和乙的分子个数比为1:1
C.该反应实现了二氧化碳的再生利用
D.该反应的基本反应类型是复分解反应
②在生活中,我们也应秉持杭州亚运会的办会理念。请你写出一个在生活中贯彻“低碳生活”理念的具体做法 (答案合理即可)。
(4)2024年5月1日8时许,我国第三艘航空母舰福建舰从上海江南造船厂码头解缆起航,赴相关海域开展首次航行试验。建造航母需大量钢材,在工业上用一氧化碳还原氧化铁来炼铁,其反应的化学方程式为 ;航母外壳用涂料覆盖可有效防止钢铁锈蚀,其原理是 。
13.羰基铁粉在国防军工领域有重要应用,我国是少数几个掌握其生产技术的国家之一。制备羰基铁粉的过程如图所示。
(1)Fe(CO)5中碳、氧元素的质量比为 。
(2)反应1的化学方程式为 。用100 kg含铁96%的海绵铁,理论上可制备Fe(CO)5的质量是多少 (写出计算过程)
(3)反应2的化学方程式为 。196kgFe(CO)5分解生成基铁粉的质量随时间的变化如下图所示。在t1时,剩余 kg Fe(CO)5未分解;在 时Fe(CO)5恰好完全分解。
(4)制备羰基铁粉过程中循环利用的物质是 。
14.铜制品长期露置在潮湿的空气中会因锈蚀生成“铜绿”【化学式为Cu2(OH)2CO3】而使其表面变成绿色。
(1)小花同学根据铜绿成分做出猜想:金属铜锈蚀的条件除了有氧气和水外,还必须有二氧化碳,为了证明“必须有二氧化碳”,需要进行下列实验中的 (选填实验编号)。
(2)小花和同学们利用废旧品中锈蚀严重的废铜屑为原料(假设不含其他杂质)设计了两个方案回收铜。
【查阅资料】a.;
b.。
【分析评价】
①X为碳的氧化物时,步骤Ⅱ中发生反应的化学方程式为 。
②步骤V过程中观察到的实验现象为 。
③以上两个方案中,你认为哪一个方案更优越并说明理由 (理由写一点)。
【拓展探究】
(3)氢气也能将氧化铜还原为铜。小红和小强各取12.0g氧化铜用氢气还原,反应一段时间后,两份固体均全部变红。小红和小强所得红色固体质量分别为9.8g和10.4g。
提出问题:红色固体中含有哪些物质?
查阅资料:c.氢气还原氧化铜时也可产生氧化亚铜(Cu2O)。
d.氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。
分析推断:小红得到的红色固体中含有的物质为 (填化学式)。
实验检验:请设计简单实验检验小强得到的红色固体的成分 。
15.对于金属材料,我们应该从多角度了解。
Ⅰ金属冶炼
(1)《天工开物》中记载了炼锡的场景:“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
①鼓入足量空气的目的是 ,从而提高炉温。
②“点铅勾锡”是炼锡的关键步骤,加铅能使锡较易熔化流出,其原因是 。
Ⅱ金属的活动性
(2)为探究锌、铁、铜三种金属的活动性及它们和氢元素的位置关系,小明设计了如下实验:
①试管C中发生反应的化学方程式为 ,该反应属于 (填基本反应类型)。
②小莉认为省略上述实验中的 (填字母),也能达到实验目的。
Ⅲ金属的锈蚀与防护
(3)对钢铁制品进行“发蓝”处理,使其表面生成一层致密的氧化膜,能有效防止钢铁锈蚀。
①“发蓝”过程属于 (填“物理”或“化学”)变化。
②“发蓝”能防止钢铁锈蚀的原因是 。
Ⅳ金属的回收再利用
(4)某学习小组同学欲从废旧电脑的某些零部件中回收金属银,设计流程如图所示。
①步骤Ⅰ中加入足量稀硫酸后发生反应的化学方程式为 。
②溶液X中只含有一种溶质,该溶质为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)用玻璃棒搅拌
(2)
(3)减少的挥发
(4)“溶解”时,FeCl2在盐酸存在下,与空气中的氧气反应生成FeCl3
2.(1)增大酸的浓度/粉碎矿石/升高温度/搅拌
(2)分解反应
(3)作保护气,防止钛被氧化
(4)B
3.(1)引流
(2)物理
(3)ABC
4.(1) 过滤 引流
(2)LiH2PO4的溶解度随温度的升高而增大
(3) 没有对尾气进行处理,生成的一氧化碳对环境造成污染
5.(1)CO2
(2) 分解 降低 1:1 750
(3)①减少二氧化碳排放,缓解温室效应;②节约能源
6.(1) 氢氧化钙/Ca(OH)2 碳酸钠/Na2CO3 HCl
(2) 溶液中硫酸钠的含量比氯化钠高,硫酸钠先达到饱和析出 降温结晶
加热蒸发溶剂至有较多晶体析出,趁热过滤,洗涤,干燥
(3)、SO2+2NaOH=Na2SO3+H2O、2Na2SO3+O2=2Na2SO4
7.(1) H2SO4 澄清石灰水/氢氧化钙溶液
(2)2NaOH+H2SO4=Na2SO4+2H2O
(3)C
(4)较多固体出现
8.(1)钾元素和氮元素
(2)+3
(3)硝酸钾溶解度受温度影响比较大,氯化钠受温度影响比较小
(4)降温结晶
(5)A
(6) 5.85 76.6
9.(1)Fe2+
(2)SiO2 、Fe
(3)②
(4)
(5)过滤
10.(1)
(2)分解反应
(3)H2SO4/I2
(4)
11.(1)化学
(2)
(3)CaO
(4)氧化钙、氢氧化钠
12.(1) Cl- 吸附 混合物
(2) 金属材料 牛奶
(3) C 绿色出行
(4) 使铁与氧气和水隔绝
13.(1)3:4
(2)设理论上可制备Fe(CO)5的质量为x
答:理论上可制备Fe(CO)5的质量是336kg。
(3) 98 t3
(4)CO/一氧化碳
14.(1)bd
(2) 固体部分溶解,有气泡产生,溶液由无色变为浅绿色 方案二,操作简单(合理即可)
(3) Cu、Cu2O 取样于试管中,加入氨水振荡,红色固体部分溶解,得到蓝色溶液
15.(1) 使木炭充分反应,放出热量
合金的熔点低
(2)
置换反应 C
(3) 化学 隔绝氧气和水
(4)
硝酸铜
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、填空与简答
1.Fe3O4颗粒在磁记录材料、磁流体等领域广泛应用。制备Fe3O4方法如图:
已知:
①“沉淀”时的反应为:2FeCl3+FeCl2+8NH3 H2OFe3O4↓+8NH4Cl+4H2O;
②+2价的铁元素容易被空气中的氧气氧化。
(1)为了加快“溶解”速率,可采取的措施是 ;
(2)若向盐酸酸化的FeCl2溶液中通入O2可生成FeCl3和H2O,该反应的化学方程式为 。
(3)“沉淀”时反应温度不宜过高,需要控制温度为50℃,原因是 。
(4)“溶解”时,实际投放的远大于理论值,原因是 。
2.2024年4月24日是第九个“中国航天日”,今年的主题是“极目楚天,共襄星汉”。近年来,我国航天事业蓬勃发展。钛()被称为航空金属,如图是以钛铁矿【主要成分为钛酸亚铁()】为主要原料冶炼金属钛的生产工艺流程,请回答下列问题。
【查阅资料】在高温条件下,易与空气中的发生反应。
(1)反应①中为了提高酸浸时的反应速率,通常可采取的措施是 。(写出一条即可)
(2)反应③的基本反应类型是: 。
(3)反应④常在氩气(Ar)的氛围中进行,其中Ar的作用是 。
(4)反应②除了生成同时生成一种有毒的可燃性气体,下列说法正确的是___________。
A.生成的气体是
B.需要对该反应进行尾气处理,防止空气污染
C.倡导“低碳”生活,主要是为了减少该生成气体的排放
3.氯化钡是一种可溶性重金属盐,广泛应用于化工领域。用毒重石(主要成分为BaCO3)制备氯化钡晶体的部分工艺流程如下图:
(1)过滤时需要用到玻璃棒,玻璃棒的作用是 。
(2)本流程中“浓缩”、“结晶”属于 (填“物理”或“化学”)变化。
(3)下列措施中,能提高原料的利用率和氯化钡晶体产量的有___________(选填序号)。
A.将毒重石进行粉碎 B.加入足量的稀盐酸 C.将滤液2通入到滤液1中
4.磷酸亚铁锂是一种新型锂离子电池电极材料,被广泛应用于机器人、轨道交通、医用设备、电力通讯等。生产磷酸亚铁锂(化学式为LiFePO4)的部分工艺流程如图,请分析下列流程,回答问题。
(1)分离出LiH2PO4晶体的操作Ⅰ的名称为 ,该操作中玻璃棒的作用是 。
(2)结晶炉中先将LiH2PO4溶液蒸发浓缩,然后冷却,就会析出LiH2PO4晶体,由此说明LiH2PO4的溶解度与温度的关系是 。
(3)在一定条件下,烧结窑中在生成LiH2PO4的同时,生成水和一氧化碳,化学反应方程式为 。从绿色环保的角度分析,该流程的不足之处是 。
5.电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该新方法的示意图如图所示。
(1)传统方法:CaCO3在900℃以上完全分解生成 CaO 和 (填化学式)。
(2)新方法:
i.电解水属于 反应(填基本反应类型),反应前后氢元素的化合价 (填“升高”“降低”或“不变”)。
ii.反应器 1:一定的H2环境及较低温度下CaCO3可与H2反应生成CaO、CO 和H2O。CO与H2O的分子个数比为 。
CaCO3还可以直接分解。反应器 1中 CO、CO2的含量随反应温度的变化如下图所示。 ℃时,抑制 CO2生成的效果最好。
iii.反应器 2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为 。
(3)与传统方法相比,新方法的优点有 (写两条)。
6.制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如下:
(1)“除杂1”应依次加入的两种试剂是 、 ,“除杂2”应加入的试剂是 。(除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2)
(2)将“溶液A”在80℃蒸发浓缩,至有少量固体析出。
①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: 。
②该小组停止蒸发浓缩,经 、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是 。
(3)设计由硫磺(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: 。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
7.(Li2CO3)是制备新能源汽车电池的重要原料。下图是一种模拟提纯碳酸锂的工艺,根据要求回答问题。
【查阅资料】
I.锂辉矿主要成分为Li2CO3,含泥沙等杂质。
Ⅱ.Li2CO3(化学性质Na2CO3类似】为无色晶体,微溶于水,在冷水中的溶解度比热水中大。
(1)X是一种酸。其溶质化学式为 ,常用 (填试剂名称)检验气体Y。
(2)②中发生中和反应的化学方程式为 。
(3)有以下三种温度的饱和Na2CO3溶液,③中你选择的是_____(填序号)。
A.0℃ B.25℃ C.80℃
(4)将滤液2蒸发,当有 时(填现象),停止加热,可得到其他化工产品。
8.二甲基亚砜(DMSO)工业废渣含NaNO3及少量有毒的NaNO2,以该废渣为原料制备农用KNO3,既实现资源回收利用又保护了环境。工艺流程如下:
(1)农用KNO3为农作物提供的营养元素有 。
(2)步骤1的作用是除去NaNO2,NaNO2中氮元素的化合价为 。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出NaCl固体,原因是 。
(4)步骤4的操作是 、过滤。
(5)KCl用量的估算依据是 (填标号)。
A.KCl与NaNO3的粒子个数比为1:1
B.KCl与NaNO3的质量比为1:1
C.KCl与NaNO3在溶液中的质量分数之比为1:1
(6)该工艺所得农用KNO3混有一定量NaCl。取25g样品加足量水溶解,向溶液中加入足量的AgNO3溶液,生成沉淀的质为14.35g,则样品中杂质NaCl的质量是 g,样品含KNO3 %(质量分数)。
(相对分子质量:KNO3-101 NaCl-58.5 AgNO3-170 AgCl-143.5)
9.柠檬酸亚铁(FeC6H6O7)是一种易被吸收的补血剂。利用硫酸厂的废渣(主要含Fe2O3、Fe3O4,还有少量SiO2)制备柠檬酸亚铁,该工艺流程如图所示,回答下列问题:
资料1:;
资料2:SiO2不溶于水,也不与稀硫酸反应。
(1)柠檬酸亚铁进入人体肠道后以 (填阳离子符号)的形式被吸收,达到补血效果。
(2)固体C的成分是 。
(3)步骤①②③④中涉及置换反应的是 (填数字序号)。
(4)步骤③中发生反应的化学方程式是 。
(5)“一系列操作”中,将柠檬酸亚铁晶体与溶液分离的操作是 。
10.氢气是重要的化工原料。下图是通过热化学循环用硫化氢气体(H2S)制备氢气的模拟工艺流程。
(1)吸收室中生成的S可进一步燃烧为反应室提供SO2,写出该反应的化学方程式 。
(2)HI进入产品室中发生的反应属于 (填基本反应类型)。
(3)写出一种上述流程中可以循环利用的物质 。
(4)硫化氢气体制备氢气时生成两种单质,写出化学方程式 。
11.为了实现碳减排目标,许多国家都在研究二氧化碳的减排措施,其中“碳捕捉和封存”技术是实现这一目标的重要途径之一。工业流程如图所示:
请回答以下有关问题:
(1)捕集——人工固碳:将二氧化碳和水混合注入地下玄武岩中最终形成石头(碳酸盐),此转化方式属于 (填“物理”或“化学)变化。
(2)“捕捉室”中发生反应的化学方程式为 。
(3)进入“反应分离器”中物质A是 (填化学式)。
(4)整个过程中,可以循环使用的物质是 。
二、综合应用题
12.能源、环境、材料、健康已成为人类日益关注的问题,根据所学知识回答下列问题。
(1)水是生态之基、生产之要、生命之源。
①水是一种常用的溶剂,生理盐水(0.9%的氯化钠溶液)可用于医疗注射。生理盐水中主要含有的阴离子是 (用化学用语表示);
②目前很多场所选择使用直饮水,某品牌直饮机工作流程如图所示:
利用炭罐中活性炭颗粒的 性除去自来水中的色素和异味等;直饮机使用方便,只要将其与自来水管对接,截留清除水中的有害物质(如细菌,微生物等)便能得到直饮水,直饮水属于 (填“纯净物”或“混合物”)。
(2)2023年5月28日,我国自行研制的“C919”大型客机成功完成首次商业载客飞行。
①“C919”机身采用了第三代铝锂合金,铝锂合金属于 (填“金属材料”或“合成材料”)。
②为了身体健康,我们必须均衡膳食。本次航班为旅客提供了一款名为“五福临门”的餐食,其中有腊味煲仔饭、三色水果拼盘、牛奶,在上述列举的餐食中,旅客可从 中摄入更多蛋白质。
(3)2023年9月23日晚,杭州亚运会开幕式隆重举行。“绿色、智能、节俭、文明”是杭州亚运会的办会理念。
①点火仪式诠释了“绿色亚运”理念,主火炬塔首次使用了废碳再生的绿色燃料——甲醇(CH3OH)。甲醇是利用工业尾气中排放的废弃二氧化碳以及焦炉气中的氢气合成。合成甲醇的化学反应微观示意图如下,下列说法正确的是 (填字母):
A.甲醇中碳元素的质量分数为40%
B.参加反应的甲和乙的分子个数比为1:1
C.该反应实现了二氧化碳的再生利用
D.该反应的基本反应类型是复分解反应
②在生活中,我们也应秉持杭州亚运会的办会理念。请你写出一个在生活中贯彻“低碳生活”理念的具体做法 (答案合理即可)。
(4)2024年5月1日8时许,我国第三艘航空母舰福建舰从上海江南造船厂码头解缆起航,赴相关海域开展首次航行试验。建造航母需大量钢材,在工业上用一氧化碳还原氧化铁来炼铁,其反应的化学方程式为 ;航母外壳用涂料覆盖可有效防止钢铁锈蚀,其原理是 。
13.羰基铁粉在国防军工领域有重要应用,我国是少数几个掌握其生产技术的国家之一。制备羰基铁粉的过程如图所示。
(1)Fe(CO)5中碳、氧元素的质量比为 。
(2)反应1的化学方程式为 。用100 kg含铁96%的海绵铁,理论上可制备Fe(CO)5的质量是多少 (写出计算过程)
(3)反应2的化学方程式为 。196kgFe(CO)5分解生成基铁粉的质量随时间的变化如下图所示。在t1时,剩余 kg Fe(CO)5未分解;在 时Fe(CO)5恰好完全分解。
(4)制备羰基铁粉过程中循环利用的物质是 。
14.铜制品长期露置在潮湿的空气中会因锈蚀生成“铜绿”【化学式为Cu2(OH)2CO3】而使其表面变成绿色。
(1)小花同学根据铜绿成分做出猜想:金属铜锈蚀的条件除了有氧气和水外,还必须有二氧化碳,为了证明“必须有二氧化碳”,需要进行下列实验中的 (选填实验编号)。
(2)小花和同学们利用废旧品中锈蚀严重的废铜屑为原料(假设不含其他杂质)设计了两个方案回收铜。
【查阅资料】a.;
b.。
【分析评价】
①X为碳的氧化物时,步骤Ⅱ中发生反应的化学方程式为 。
②步骤V过程中观察到的实验现象为 。
③以上两个方案中,你认为哪一个方案更优越并说明理由 (理由写一点)。
【拓展探究】
(3)氢气也能将氧化铜还原为铜。小红和小强各取12.0g氧化铜用氢气还原,反应一段时间后,两份固体均全部变红。小红和小强所得红色固体质量分别为9.8g和10.4g。
提出问题:红色固体中含有哪些物质?
查阅资料:c.氢气还原氧化铜时也可产生氧化亚铜(Cu2O)。
d.氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。
分析推断:小红得到的红色固体中含有的物质为 (填化学式)。
实验检验:请设计简单实验检验小强得到的红色固体的成分 。
15.对于金属材料,我们应该从多角度了解。
Ⅰ金属冶炼
(1)《天工开物》中记载了炼锡的场景:“凡煎炼亦用洪炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
①鼓入足量空气的目的是 ,从而提高炉温。
②“点铅勾锡”是炼锡的关键步骤,加铅能使锡较易熔化流出,其原因是 。
Ⅱ金属的活动性
(2)为探究锌、铁、铜三种金属的活动性及它们和氢元素的位置关系,小明设计了如下实验:
①试管C中发生反应的化学方程式为 ,该反应属于 (填基本反应类型)。
②小莉认为省略上述实验中的 (填字母),也能达到实验目的。
Ⅲ金属的锈蚀与防护
(3)对钢铁制品进行“发蓝”处理,使其表面生成一层致密的氧化膜,能有效防止钢铁锈蚀。
①“发蓝”过程属于 (填“物理”或“化学”)变化。
②“发蓝”能防止钢铁锈蚀的原因是 。
Ⅳ金属的回收再利用
(4)某学习小组同学欲从废旧电脑的某些零部件中回收金属银,设计流程如图所示。
①步骤Ⅰ中加入足量稀硫酸后发生反应的化学方程式为 。
②溶液X中只含有一种溶质,该溶质为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.(1)用玻璃棒搅拌
(2)
(3)减少的挥发
(4)“溶解”时,FeCl2在盐酸存在下,与空气中的氧气反应生成FeCl3
2.(1)增大酸的浓度/粉碎矿石/升高温度/搅拌
(2)分解反应
(3)作保护气,防止钛被氧化
(4)B
3.(1)引流
(2)物理
(3)ABC
4.(1) 过滤 引流
(2)LiH2PO4的溶解度随温度的升高而增大
(3) 没有对尾气进行处理,生成的一氧化碳对环境造成污染
5.(1)CO2
(2) 分解 降低 1:1 750
(3)①减少二氧化碳排放,缓解温室效应;②节约能源
6.(1) 氢氧化钙/Ca(OH)2 碳酸钠/Na2CO3 HCl
(2) 溶液中硫酸钠的含量比氯化钠高,硫酸钠先达到饱和析出 降温结晶
加热蒸发溶剂至有较多晶体析出,趁热过滤,洗涤,干燥
(3)、SO2+2NaOH=Na2SO3+H2O、2Na2SO3+O2=2Na2SO4
7.(1) H2SO4 澄清石灰水/氢氧化钙溶液
(2)2NaOH+H2SO4=Na2SO4+2H2O
(3)C
(4)较多固体出现
8.(1)钾元素和氮元素
(2)+3
(3)硝酸钾溶解度受温度影响比较大,氯化钠受温度影响比较小
(4)降温结晶
(5)A
(6) 5.85 76.6
9.(1)Fe2+
(2)SiO2 、Fe
(3)②
(4)
(5)过滤
10.(1)
(2)分解反应
(3)H2SO4/I2
(4)
11.(1)化学
(2)
(3)CaO
(4)氧化钙、氢氧化钠
12.(1) Cl- 吸附 混合物
(2) 金属材料 牛奶
(3) C 绿色出行
(4) 使铁与氧气和水隔绝
13.(1)3:4
(2)设理论上可制备Fe(CO)5的质量为x
答:理论上可制备Fe(CO)5的质量是336kg。
(3) 98 t3
(4)CO/一氧化碳
14.(1)bd
(2) 固体部分溶解,有气泡产生,溶液由无色变为浅绿色 方案二,操作简单(合理即可)
(3) Cu、Cu2O 取样于试管中,加入氨水振荡,红色固体部分溶解,得到蓝色溶液
15.(1) 使木炭充分反应,放出热量
合金的熔点低
(2)
置换反应 C
(3) 化学 隔绝氧气和水
(4)
硝酸铜
答案第1页,共2页
答案第1页,共2页
同课章节目录
