第九单元 实验活动5 一定溶质质量分数的氯化钠溶液的配制 课件(共27张PPT)初中化学人教版九年级下册
文档属性
| 名称 | 第九单元 实验活动5 一定溶质质量分数的氯化钠溶液的配制 课件(共27张PPT)初中化学人教版九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-16 22:19:34 | ||
图片预览








文档简介
(共27张PPT)
实验活动5一定溶质质量分数的氯化钠溶液的配制
单击此处添加副标题
【资料卡片】
通过盐水洗鼻可以把鼻腔内的致病菌、分泌物冲出来,能明显清洁鼻腔,保持鼻腔湿润,减少炎性因子,减轻黏膜水肿,有利于提高黏膜纤毛功能。用氯化钠和水可配制出浓度为0.9%的洗鼻液,市场上常规的洗鼻剂则是通过用高级精盐和适当提纯过的小苏打等进行配比。
任务1:回顾旧知
【问题】这种盐水是由什么组成?
任务1:回顾旧知
溶液由溶质和溶剂两个部分组成
m(溶液)=m(溶质)+m(溶剂)
任务1:回顾旧知
【问题】(1)这样形成的两份溶液一样吗?
(2)有什么方法可以区分?
取10gNaCl固体溶于50mL水中和1g固体完全溶解于50mL水中。
=
溶液质量
溶质质量
溶质的质量分数
×100%
任务1:回顾旧知
请同学们根据公式写出盐水的溶质质量分数通式:
=
m(NaCl)+m(H2O)
m(NaCl)
盐水的溶质质量分数
×100%
【问题】
怎样用NaCl和水配制50g质量分数为3.6%的氯化钠溶液?有哪些难关要克服?
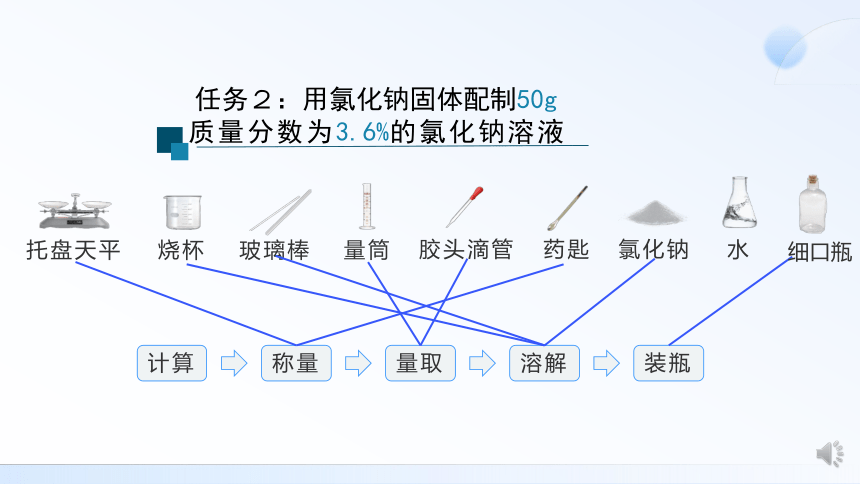
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
(1)计算:
NaCl的质量:50g×3.6%=1.8g;
水的质量:50g-1.8g=48.2g;
水的体积:48.2g÷1g/mL=48.2mL。
(2)称量:用托盘天平称量氯化钠的质量。
(3)量取:用50mL量筒量取水的体积。
(4)溶解:将称好的NaCl和量好的水倒入烧杯中,用玻璃棒搅拌使之完全溶解。
(5)装瓶,贴标签.
任务2:用氯化钠固体配制50g质量分数
为3.6%的氯化钠溶液
计算
称量
量取
溶解
装瓶
托盘天平
烧杯
玻璃棒
量筒
胶头滴管
药匙
氯化钠
水
细口瓶
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
配制50g质量分数为3.6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl: ;H2O: 。
NaCl的质量
=NaCl溶液的质量
×NaCl的质量分数
=50g
×3.6%
=1.8g
H2O的质量
=NaCl溶液的质量
-NaCl的质量
=50g
-1.8g
=48.2g
1.8g
48.2g
计算
称量
量取
溶解
装瓶
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
使用规范:左物右码
计算
称量
量取
溶解
装瓶
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
视线与凹液面最低处保持水平
倾倒至接近刻度线改用胶头滴管滴加
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
计算
称量
量取
溶解
装瓶
玻璃棒作用:搅拌,使其加速溶解
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
计算
称量
量取
溶解
装瓶
将配制好的溶液装入试剂瓶中,贴上标签,标签上应包括药品的名称、化学式、溶质的质量分数
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
【动手实验】利用提供的氯化钠和水配制溶质质量分数为3.6%的氯化钠溶液50g。
【仪器及药品】氯化钠固体、蒸馏水、托盘天平、药匙、20mL量筒、50mL量筒、胶头滴管、烧杯、玻璃棒、试剂瓶。
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
①天平使用时注意:游码归零,调平,两边都要垫上相同的称量纸,左物右码;
②取用砝码和移动游码都应该用镊子;
③量筒量取液体时应平视读数,不可俯视或仰视;
④搅拌时,不可将溶液溅出;
⑤注意贴上标签。
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液倒放左物右码沿杯壁缓慢注入不碰壁和底溶解需在烧杯中进行
【资料】0.9%的氯化钠溶液是最适合鼻纤毛摆动的(鼻纤毛摆动正常是鼻腔功能正常的一个重要标志)。浓度太高反而会对鼻纤毛摆动造成危害。从舒适程度上来说,0.9%的盐水因为和人体鼻腔的体液是等渗的,在使用时非常舒适,不会出现灼痛感;而高浓度盐水在使用时会有灼痛感。
任务3:浓溶液的稀释
【问题】如何用3.6%的浓溶液配制60g0.9%的稀溶液?
(1)计算:
设浓溶液的质量为x,则
60g×0.9%=x×3.6%,解得x=15g
(由于溶液密度近似为1g/mL,体积也近似算成15mL)
需要加水:60g-15g=45g,体积为45mL。
(2)量取:量取浓溶液和水的体积,倒入烧杯中。
(3)混匀:搅拌,使溶液混合均匀。
(4)装瓶,贴标签:把配制好的溶液装入试剂瓶中,盖好瓶塞,贴上标签。
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
3.6%NaCl溶液
0.9%NaCl溶液
任务3:浓溶液的稀释
由浓溶液配制稀溶液时,计算的依据是什么?
溶液稀释前后,溶质的质量不变
稀释前
稀释后
Ag×a%=Bg×b%
任务3:浓溶液的稀释
用已配好的质量分数为3.6%的氯化钠溶液(密度约为1g/cm3),配制60g质量分数为0.9%的氯化钠溶液所需3.6%氯化钠溶液和水的质量分别为: NaCl溶液: (体积为) ; H2O: 。
计算
量取
混匀
装瓶
所需3.6%NaCl溶液的质量=(60g×0.9%)÷3.6%=15g
所需3.6%NaCl溶液的体积=15g÷1g/cm3≈15mL
H2O的质量
=60g-15g
=45g
45g
15g
15mL
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
量取15mL3.6%NaCl溶液
量取45mLH2O
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
将配制好的溶液装入试剂瓶中,贴上标签,标签上应包括药品的名称、化学式、溶质的质量分数
任务3:浓溶液的稀释
【实验2】用3.6%的氯化钠溶液配制0.9%的氯化钠溶液60g。
有哪些因素会影响最终溶液的质量分数的准确性?
任务3:浓溶液的稀释
【问题】下列各种情况下,所配得的溶液溶质质量分数如何变化?
任务4:误差分析,体验成果
(1)所用NaCl不纯: 。..
(2)用天平称量时指针指在分度盘的左边: 。,
(3)用量筒量取水时俯视刻度线: 。.
(4)将量筒内的水倒入烧杯时有少量水溅出: 。.
(5)配制溶液的烧杯不干燥,内壁有水珠: 。
(6)溶解后,溶液有少量溅出: 。.
偏小
偏大
偏大
偏大
偏小
无影响
小结
(1)溶质、溶剂、溶液和溶质质量分数之间的关系;
(2)固体物质配制步骤:计算→称量→量取→溶解→装瓶;浓溶液稀释步骤:计算→量取→混匀→装瓶;
(3)导致实验误差的因素分析。
实验活动5一定溶质质量分数的氯化钠溶液的配制
单击此处添加副标题
【资料卡片】
通过盐水洗鼻可以把鼻腔内的致病菌、分泌物冲出来,能明显清洁鼻腔,保持鼻腔湿润,减少炎性因子,减轻黏膜水肿,有利于提高黏膜纤毛功能。用氯化钠和水可配制出浓度为0.9%的洗鼻液,市场上常规的洗鼻剂则是通过用高级精盐和适当提纯过的小苏打等进行配比。
任务1:回顾旧知
【问题】这种盐水是由什么组成?
任务1:回顾旧知
溶液由溶质和溶剂两个部分组成
m(溶液)=m(溶质)+m(溶剂)
任务1:回顾旧知
【问题】(1)这样形成的两份溶液一样吗?
(2)有什么方法可以区分?
取10gNaCl固体溶于50mL水中和1g固体完全溶解于50mL水中。
=
溶液质量
溶质质量
溶质的质量分数
×100%
任务1:回顾旧知
请同学们根据公式写出盐水的溶质质量分数通式:
=
m(NaCl)+m(H2O)
m(NaCl)
盐水的溶质质量分数
×100%
【问题】
怎样用NaCl和水配制50g质量分数为3.6%的氯化钠溶液?有哪些难关要克服?
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
(1)计算:
NaCl的质量:50g×3.6%=1.8g;
水的质量:50g-1.8g=48.2g;
水的体积:48.2g÷1g/mL=48.2mL。
(2)称量:用托盘天平称量氯化钠的质量。
(3)量取:用50mL量筒量取水的体积。
(4)溶解:将称好的NaCl和量好的水倒入烧杯中,用玻璃棒搅拌使之完全溶解。
(5)装瓶,贴标签.
任务2:用氯化钠固体配制50g质量分数
为3.6%的氯化钠溶液
计算
称量
量取
溶解
装瓶
托盘天平
烧杯
玻璃棒
量筒
胶头滴管
药匙
氯化钠
水
细口瓶
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
配制50g质量分数为3.6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl: ;H2O: 。
NaCl的质量
=NaCl溶液的质量
×NaCl的质量分数
=50g
×3.6%
=1.8g
H2O的质量
=NaCl溶液的质量
-NaCl的质量
=50g
-1.8g
=48.2g
1.8g
48.2g
计算
称量
量取
溶解
装瓶
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
使用规范:左物右码
计算
称量
量取
溶解
装瓶
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
视线与凹液面最低处保持水平
倾倒至接近刻度线改用胶头滴管滴加
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
计算
称量
量取
溶解
装瓶
玻璃棒作用:搅拌,使其加速溶解
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
计算
称量
量取
溶解
装瓶
将配制好的溶液装入试剂瓶中,贴上标签,标签上应包括药品的名称、化学式、溶质的质量分数
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
【动手实验】利用提供的氯化钠和水配制溶质质量分数为3.6%的氯化钠溶液50g。
【仪器及药品】氯化钠固体、蒸馏水、托盘天平、药匙、20mL量筒、50mL量筒、胶头滴管、烧杯、玻璃棒、试剂瓶。
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
①天平使用时注意:游码归零,调平,两边都要垫上相同的称量纸,左物右码;
②取用砝码和移动游码都应该用镊子;
③量筒量取液体时应平视读数,不可俯视或仰视;
④搅拌时,不可将溶液溅出;
⑤注意贴上标签。
任务2:用氯化钠固体配制50g质量分数为3.6%的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液倒放左物右码沿杯壁缓慢注入不碰壁和底溶解需在烧杯中进行
【资料】0.9%的氯化钠溶液是最适合鼻纤毛摆动的(鼻纤毛摆动正常是鼻腔功能正常的一个重要标志)。浓度太高反而会对鼻纤毛摆动造成危害。从舒适程度上来说,0.9%的盐水因为和人体鼻腔的体液是等渗的,在使用时非常舒适,不会出现灼痛感;而高浓度盐水在使用时会有灼痛感。
任务3:浓溶液的稀释
【问题】如何用3.6%的浓溶液配制60g0.9%的稀溶液?
(1)计算:
设浓溶液的质量为x,则
60g×0.9%=x×3.6%,解得x=15g
(由于溶液密度近似为1g/mL,体积也近似算成15mL)
需要加水:60g-15g=45g,体积为45mL。
(2)量取:量取浓溶液和水的体积,倒入烧杯中。
(3)混匀:搅拌,使溶液混合均匀。
(4)装瓶,贴标签:把配制好的溶液装入试剂瓶中,盖好瓶塞,贴上标签。
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
3.6%NaCl溶液
0.9%NaCl溶液
任务3:浓溶液的稀释
由浓溶液配制稀溶液时,计算的依据是什么?
溶液稀释前后,溶质的质量不变
稀释前
稀释后
Ag×a%=Bg×b%
任务3:浓溶液的稀释
用已配好的质量分数为3.6%的氯化钠溶液(密度约为1g/cm3),配制60g质量分数为0.9%的氯化钠溶液所需3.6%氯化钠溶液和水的质量分别为: NaCl溶液: (体积为) ; H2O: 。
计算
量取
混匀
装瓶
所需3.6%NaCl溶液的质量=(60g×0.9%)÷3.6%=15g
所需3.6%NaCl溶液的体积=15g÷1g/cm3≈15mL
H2O的质量
=60g-15g
=45g
45g
15g
15mL
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
量取15mL3.6%NaCl溶液
量取45mLH2O
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
任务3:浓溶液的稀释
计算
量取
混匀
装瓶
将配制好的溶液装入试剂瓶中,贴上标签,标签上应包括药品的名称、化学式、溶质的质量分数
任务3:浓溶液的稀释
【实验2】用3.6%的氯化钠溶液配制0.9%的氯化钠溶液60g。
有哪些因素会影响最终溶液的质量分数的准确性?
任务3:浓溶液的稀释
【问题】下列各种情况下,所配得的溶液溶质质量分数如何变化?
任务4:误差分析,体验成果
(1)所用NaCl不纯: 。..
(2)用天平称量时指针指在分度盘的左边: 。,
(3)用量筒量取水时俯视刻度线: 。.
(4)将量筒内的水倒入烧杯时有少量水溅出: 。.
(5)配制溶液的烧杯不干燥,内壁有水珠: 。
(6)溶解后,溶液有少量溅出: 。.
偏小
偏大
偏大
偏大
偏小
无影响
小结
(1)溶质、溶剂、溶液和溶质质量分数之间的关系;
(2)固体物质配制步骤:计算→称量→量取→溶解→装瓶;浓溶液稀释步骤:计算→量取→混匀→装瓶;
(3)导致实验误差的因素分析。
同课章节目录
