1.1.2热化学方程式和燃烧热课件(共25张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.2热化学方程式和燃烧热课件(共25张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-06-17 10:45:05 | ||
图片预览







文档简介
(共25张PPT)
热化学方程式 燃烧热
第一节 反应热
化学反应的热效应
化学反应一般都有反应热,
如何测量一个化学反应的反应热呢?
量热器示意图
通过实验测量真实的反应热
如何估算一个化学反应的反应热呢?
通过键能测量反应的反应热
如何规范表示一个化学反应的反应热呢?
热化学反应方程式
表明反应所放出或吸收的_______的化学方程式
热量
不仅表明了化学反应中的____________,
也表明了化学反应中的______________。
H2(g) + Cl2(g) = 2HCl(g)
物质变化
能量变化
物质变化
能量变化
ΔH =﹣184.6 kJ/mol
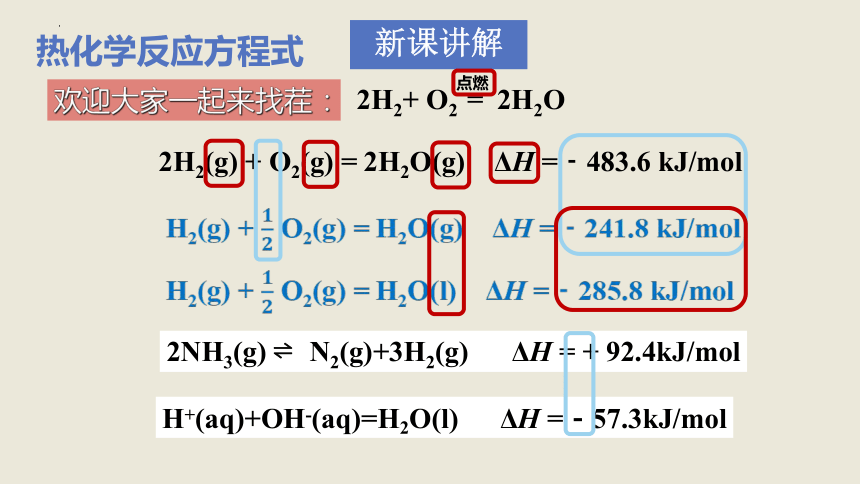
2H2(g) + O2(g) = 2H2O(g) ΔH =﹣483.6 kJ/mol
2H2+ O2 = 2H2O
点燃
H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3kJ/mol
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
欢迎大家一起来找茬:
H2(g) + O2(g) = H2O(l) ΔH =﹣285.8 kJ/mol
2NH3(g) N2(g)+3H2(g) ΔH = + 92.4kJ/mol
热化学反应方程式
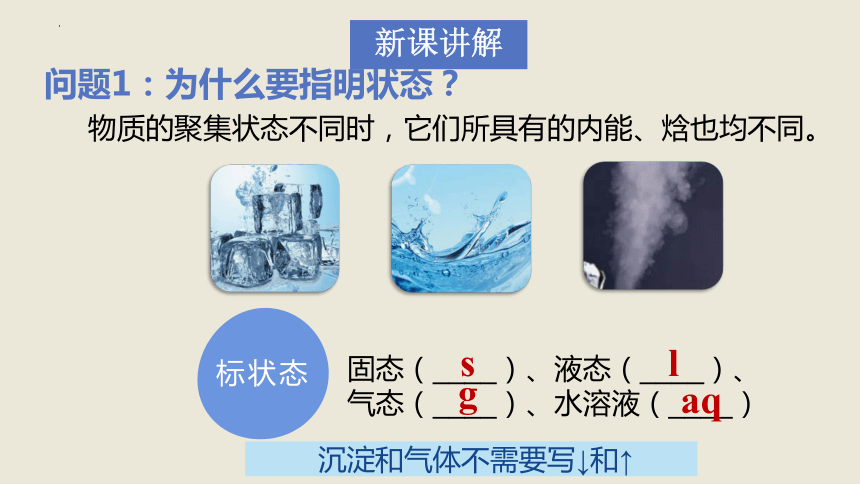
问题1:为什么要指明状态?
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
H2(g) + O2(g) = H2O(l) ΔH =﹣285.8 kJ/mol
思考:1mol气态水液化放出/吸收多少能量?
放出44kJ能量
标状态
固态(____)、液态(____)、
气态(____)、水溶液(____)
g
l
s
aq
物质的聚集状态不同时,它们所具有的内能、焓也均不同。
问题1:为什么要指明状态?
沉淀和气体不需要写↓和↑
常温常压不标注(25℃,101KPa)
其他反应条件可省略
(如点燃、加热、催化剂、高温等)
H2(g)+ I2 (g) = 2HI(g) ΔH =﹣14.9 kJ/mol
100℃
H2(g) + I2(g) = 2HI(g) ΔH =﹣9.48kJ/mol
标温度、压强
问题2:为什么要指明温度和压强?
101KPa
25℃
101KPa
不同压强和温度,反应热也不同(内能受外界T、P影响)
2H2+ O2 = 2H2O
点燃
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
问题3:为什么化学计量数可以是分数?
系数既可以表示微粒个数,又表示物质的量
系数只表示物质的量,不表示微粒个数,所以可以是分数、整数
2H2(g) + O2(g) = 2H2O(g) ΔH =﹣483.6 kJ/mol
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
问题4:为什么反应物相同,但反应热却不同?
如何对这两个热化学方程式进行文字描述?
仔细阅读课本P9,谈谈ΔH单位中的“mol-1”的含义
ΔH 的单位中“mol-1”的含义——
指的是“每摩尔反应”吸收或放出的热量
而非每摩尔反应物
问题4:为什么反应物相同,但反应热却不同?
焓变跟着系数变,单位永远都不变
化学计量数可为整数或分数
看系数
ΔH 必须与方程式一一对应
N2(g)+3H2(g) 2NH3(g) ΔH = - 92.4kJ/mol
思考:1mol氮气和3mol氢气发生反应,其焓变计算为92.4KJ,请书写其热化学方程式。
思考:1mol氮气和3mol氢气发生反应,能否放出92.4kJ能量,理由?
92.4kJ指1mol氮气完全消耗才放出的,但该反应为可逆反应,不能完全反应
N2(g)+3H2(g) 2NH3(g) ΔH = - 92.4kJ/mol
思考:假如该反应的氮气的转化率为30%,求实际放出热量?
Q=30%*92.4kJ=27.72kJ
N2(g)+3H2(g) 2NH3(g) ΔH = - 92.4kJ/mol
思考:下列反应的焓变为多少?
2NH3(g) = N2(g)+3H2(g)
ΔH = + 92.4kJ/mol
ΔH 必须与方程式一一对应:
当反应逆向进行时,其反应热与正反应的反应热数值________,符号________
相等
相反
注明 ΔH 的:“+”与“-”
不论化学反应是否可逆,热化学方程式中的反应热ΔH 都表示反应进行到底时的能量变化。
可逆反应的ΔH 和 实际吸收或放出热量 的区别:
2NH3(g) N2(g)+3H2(g) ΔH = + 92.4kJ/mol
1.在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.52 kJ·mol-1
B
观察以下反应,思考哪一反应不适合做火箭推进剂?
计算热值!
需要关注物质燃烧放出的热量——燃烧热
在101 kPa 时,_______纯物质______燃烧生成___________时所放出的热量。
1 mol
完全
指定产物
指定产物:
C → ;
H → ;
S → ;
N →_______。
CO2(g)
H2O(l)
SO2(g)
N2(g)
测定某物质的燃烧热,所用测量装置为
弹式量热计
ΔH = - 285.8kJ/mol
4. 在25 ℃、101 kPa时,H2在1.0 mol O2中完全燃烧生成2.0 mol H2O(l)放出571.6 kJ的热量。
该条件下,H2的燃烧热ΔH为________________。
-285.8 kJ·mol-1
或,该条件下氢气的燃烧热为285.8 kJ·mol-1
5.1mol S 的燃烧热和2mol S 的燃烧热,哪个数值更大?
燃烧热相等 总热量为1:2
6.热化学方程式与普通化学方程式不同,下列有关热化学方程式
CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1的说法错误的是( )
A.既表示化学反应中的物质变化,又表示化学反应中的能量变化
B.表示1 molCO(g)与 mol O2(g)完全反应生成1 molCO2(g)放出283.0 kJ热量
C.一氧化碳的燃烧热为283.0 kJ·mol-1
D.CO与O2反应生成CO2只能实现化学能向热能的转化
D
热化学方程式 燃烧热
第一节 反应热
化学反应的热效应
化学反应一般都有反应热,
如何测量一个化学反应的反应热呢?
量热器示意图
通过实验测量真实的反应热
如何估算一个化学反应的反应热呢?
通过键能测量反应的反应热
如何规范表示一个化学反应的反应热呢?
热化学反应方程式
表明反应所放出或吸收的_______的化学方程式
热量
不仅表明了化学反应中的____________,
也表明了化学反应中的______________。
H2(g) + Cl2(g) = 2HCl(g)
物质变化
能量变化
物质变化
能量变化
ΔH =﹣184.6 kJ/mol
2H2(g) + O2(g) = 2H2O(g) ΔH =﹣483.6 kJ/mol
2H2+ O2 = 2H2O
点燃
H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3kJ/mol
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
欢迎大家一起来找茬:
H2(g) + O2(g) = H2O(l) ΔH =﹣285.8 kJ/mol
2NH3(g) N2(g)+3H2(g) ΔH = + 92.4kJ/mol
热化学反应方程式
问题1:为什么要指明状态?
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
H2(g) + O2(g) = H2O(l) ΔH =﹣285.8 kJ/mol
思考:1mol气态水液化放出/吸收多少能量?
放出44kJ能量
标状态
固态(____)、液态(____)、
气态(____)、水溶液(____)
g
l
s
aq
物质的聚集状态不同时,它们所具有的内能、焓也均不同。
问题1:为什么要指明状态?
沉淀和气体不需要写↓和↑
常温常压不标注(25℃,101KPa)
其他反应条件可省略
(如点燃、加热、催化剂、高温等)
H2(g)+ I2 (g) = 2HI(g) ΔH =﹣14.9 kJ/mol
100℃
H2(g) + I2(g) = 2HI(g) ΔH =﹣9.48kJ/mol
标温度、压强
问题2:为什么要指明温度和压强?
101KPa
25℃
101KPa
不同压强和温度,反应热也不同(内能受外界T、P影响)
2H2+ O2 = 2H2O
点燃
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
问题3:为什么化学计量数可以是分数?
系数既可以表示微粒个数,又表示物质的量
系数只表示物质的量,不表示微粒个数,所以可以是分数、整数
2H2(g) + O2(g) = 2H2O(g) ΔH =﹣483.6 kJ/mol
H2(g) + O2(g) = H2O(g) ΔH =﹣241.8 kJ/mol
问题4:为什么反应物相同,但反应热却不同?
如何对这两个热化学方程式进行文字描述?
仔细阅读课本P9,谈谈ΔH单位中的“mol-1”的含义
ΔH 的单位中“mol-1”的含义——
指的是“每摩尔反应”吸收或放出的热量
而非每摩尔反应物
问题4:为什么反应物相同,但反应热却不同?
焓变跟着系数变,单位永远都不变
化学计量数可为整数或分数
看系数
ΔH 必须与方程式一一对应
N2(g)+3H2(g) 2NH3(g) ΔH = - 92.4kJ/mol
思考:1mol氮气和3mol氢气发生反应,其焓变计算为92.4KJ,请书写其热化学方程式。
思考:1mol氮气和3mol氢气发生反应,能否放出92.4kJ能量,理由?
92.4kJ指1mol氮气完全消耗才放出的,但该反应为可逆反应,不能完全反应
N2(g)+3H2(g) 2NH3(g) ΔH = - 92.4kJ/mol
思考:假如该反应的氮气的转化率为30%,求实际放出热量?
Q=30%*92.4kJ=27.72kJ
N2(g)+3H2(g) 2NH3(g) ΔH = - 92.4kJ/mol
思考:下列反应的焓变为多少?
2NH3(g) = N2(g)+3H2(g)
ΔH = + 92.4kJ/mol
ΔH 必须与方程式一一对应:
当反应逆向进行时,其反应热与正反应的反应热数值________,符号________
相等
相反
注明 ΔH 的:“+”与“-”
不论化学反应是否可逆,热化学方程式中的反应热ΔH 都表示反应进行到底时的能量变化。
可逆反应的ΔH 和 实际吸收或放出热量 的区别:
2NH3(g) N2(g)+3H2(g) ΔH = + 92.4kJ/mol
1.在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.52 kJ·mol-1
B
观察以下反应,思考哪一反应不适合做火箭推进剂?
计算热值!
需要关注物质燃烧放出的热量——燃烧热
在101 kPa 时,_______纯物质______燃烧生成___________时所放出的热量。
1 mol
完全
指定产物
指定产物:
C → ;
H → ;
S → ;
N →_______。
CO2(g)
H2O(l)
SO2(g)
N2(g)
测定某物质的燃烧热,所用测量装置为
弹式量热计
ΔH = - 285.8kJ/mol
4. 在25 ℃、101 kPa时,H2在1.0 mol O2中完全燃烧生成2.0 mol H2O(l)放出571.6 kJ的热量。
该条件下,H2的燃烧热ΔH为________________。
-285.8 kJ·mol-1
或,该条件下氢气的燃烧热为285.8 kJ·mol-1
5.1mol S 的燃烧热和2mol S 的燃烧热,哪个数值更大?
燃烧热相等 总热量为1:2
6.热化学方程式与普通化学方程式不同,下列有关热化学方程式
CO(g)+O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1的说法错误的是( )
A.既表示化学反应中的物质变化,又表示化学反应中的能量变化
B.表示1 molCO(g)与 mol O2(g)完全反应生成1 molCO2(g)放出283.0 kJ热量
C.一氧化碳的燃烧热为283.0 kJ·mol-1
D.CO与O2反应生成CO2只能实现化学能向热能的转化
D
